Уравнение взаимодействия воды с хлором
Задача 812.
Составить схему цепной реакции хлора с водородом. Какую роль в ней играет освещение? Имеет ли значение частота света?
Решение:
Синтез HCl из Н 2 и Cl 2 протекает на свету:
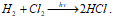
Эта реакция относится к неразветвлённым цепным реакциям. Поглощение кванта света или другой лучистой энергии (hv) молекулой Cl2 приводит к её возбуждению – к появлению в ней энергичных колебаний атомов. И, как только энергия колебаний атомов превышает энергию связи между атомами, то молекула распадается. Формирование цепи начинается с образования радикалов:
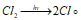
Образующиеся атомы хлора легко реагируют с молекулой водорода с образованием молекулы хлороводорода и атома водорода:
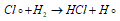
Атом водорода, в свою очередь, легко реагирует с молекулой хлора с образованием молекулы хлороводорода и атома хлора:
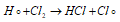
Эта последовательность процесса продолжается дальше, в рассматриваемом случае число звеньев может достигать 100000. При данной фотохимической реакции частота света играет существенную роль, поскольку количество энергии кванта света определяется произведением постоянной Планка (h) и частотой света (v), получим: (hv). От численного значения частоты света зависит величина количества энергии кванта. Для распада молекулы Cl2 на 2 необходима частота света чуть больше 550 ммк. Под действием получаемого при данной частоте кванта света разрушается связь Cl — Cl, а не Н — Н, так как Е(Cl — Cl) = 243 кДж/моль, а Е(Н — Н) = 436 кДж/моль.
Таким образом, под действием света энергии кванта света (Е = hv) достаточно только для разрыва связей Cl — Cl в молекуле Cl2, а не для разрыва связей Н — Н в молекуле Н2. Именно свет является фактором, который определяет начало цепной реакции - образование свободных атомов хлора.
Задача 813.
Написать уравнения реакций взаимодействия галогенов с водой и растворами щелочей (холодными и горячими).
Решение:
а) Уравнения реакций взаимодействия галогенов с водой:
б) Уравнения реакций взаимодействия галогенов с холодным раствором щёлочи:
Cl2 + 2OH- ↔ Cl - + OCl - + H2O.
в) Уравнения реакции взаимодействия галогена с горячим раствором щёлочи:
3Cl2 + 6OH - ↔ 5Cl - + OCl3 - + 3H2O.
Таким образом, при растворении галогенов в холодной воде и в холодных растворах щелочей происходит восстановление хлора до степени окисления его атома +1 и окисление галогена до степени окисления -1. В горячих растворах щелочей галоген самоокисляется и самовосстанавливается соответственно до степени окисления -1 и до степени окисления +5.
Задача 814.
Привести примеры возможных реакций галогенов друг с другом. Указать степени окисленности галогенов в продуктах реакций.
Решение:
Известны соединения галогенов друг с другом (галоиды), например: BrCl, ICl3, BrF5, IF7, ClF, ClF5 IBr и другие. Все соединения галоидов могут быть получены прямым синтезом, например:
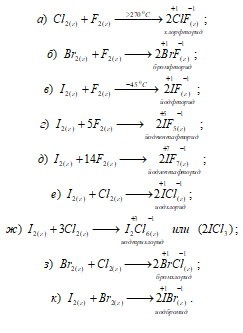
Некоторые из галоидов могут существовать в обычных условиях и не разлагаться, например ClF (газ), BrF (жидкость), IF5 (жидкость), IF7 (газ).
Задача 815.
При 300°С степень термической диссоциации НI составляет 20%. Каковы при этой температуре равновесные концентрации Н2 и I2 в системе
Н2 +12 ↔ 2НI, если равновесная концентрация НI равна 0,96 моль/л?
Решение:
Обозначим начальную концентрацию HI через х (моль/л). Если к моменту наступления равновесия из каждых х молей йодоводорода диссоциировано х молей,
то при этом, согласно уравнению реакции, образовалось 0,5х; моля Н2 и 0,5х моля I2.
Находим начальную концентрацию HI (х) с учетом того, что термическая диссоциация ее составляет 20% (0,2), составив соотношение:
0,96 = х - (0,96 . 0,2);
х = 0,96 + 0,192 = 1,152 моля.
Тогда равновесные концентрации Н2 и I2 с учётом того, что степень термической диссоциации НI составляет 20%, получим:
[H2] =[I2] = 0,5x . 0,2 = 0,5 . 1,152 . 0,2 = 0,1152 моля.
При растворении газообразного хлора в воде при обычной температуре до 50% растворенного хлора гидролизуется с образованием сильной хлороводородной и слабой хлорноватистой кислоты НСЮ:

При электролизе (без мембраны) раствора хлорида натрия получается хлор, реагирующий с водой по этому уравнению. Этот раствор называют хлорной водой. Хлорноватстая кислота НСЮ разлагается при действии света на кислород и хлороводородную кислоту:

Слабая хлорноватистая кислота НСЮ — сильный окислитель и применяется для обеззараживания воды и отбелки тканей. Соли хлорноватистой кислоты, гипохлориты, в водных растворах ведут себя как очень сильные окислители. При добавлении к раствору хлора в воде гидроксида натрия NaOH образуется раствор гипохлорита натрия NaCIO (и хлорида натрия), который используется для беления бумаги тканей.
Гипохлорит натрия NaCIO получают также электролизом раствора хлорида натрия. Кристаллический NaCIO-5Н20 реагирует с органическими веществами взрывоподобно, и его используют как дезинфицирующее средство. Подобным образом ведет себя гипохлорит калия. Гипохлориты получаются также при пропускании хлора через растворы карбонатов натрия или калия. Если используется гидроксид кальция, образуется хлорная известь, соль хлороводородной и хлорноватистой кислот:

Иногда хлорную известь считают смесью Са(ОС1)2, СаС12 и Са(ОН)2. Можно встретить и такую формулу: Са(СЮ)2СаС12*2НС1.
Хлорная известь — распространенное дезинфецирующее средство. У свежеприготовленной хлорной извести содержание активного хлора (в группе -ОС1) достигает 38%. На свету и во влажном состоянии она постепенно разлагается, выделяя хлор. Влажная хлорная известь за год теряет около 10% активного хлора.
Дезинфицирующее действие хлорной извести иногда объясняют тем, что на воздухе она в реакции с углекислым газом выделяет оксид хлора С120:

Хлорноватистая кислота в водном растворе неустойчива. Ее разложение может идти по нескольким параллельным реакциям, в которых образуются кислород, оксид хлора С120 и хлорноватая кислота НСЮ3: 
Скорости этих реакций неодинаковы и зависят от условий их проведения. При освещении преобладает первая реакция. Образующийся атомный кислород действует как сильный окислитель или превращается в молекульный кислород 02.
При введении в раствор водоотнимающих средств, т.е. при увеличении концентрации хлорноватистой кислоты, образуется оксид хлора С120, который при обычных условиях представляет собой газ, распадающийся на простые вещества. С120 — сильный окислитель. При соприкосновении его с органическими веществами может произойти взрыв. В реакции с водой оксид хлора образует хлорноватистую кислоту НСЮ.
При нагревании раствора НСЮ образуется раствор сильных хлорноватой НСЮ3 и хлороводородной кислот:

Хлорноватая кислота в свободном состоянии не получена, является сильной кислотой и сильным окислителем в водном растворе. Ее соли, хлораты, в растворе не проявляют окислительные свойства.
При действии на раствор бертолетовой соли диоксидом серы S02 или другими восстановителями образуется диоксид хлора С102.
При нагревании хлората калия КСЮ3 возможно прохождение двух параллельных реакций. В присутствии катализатора диоксида марганца Мп02 образуется кислород:

Без катализатора протекает реакция с образованием перхлората калия, соли хлорной кислоты НСЮ4: 
При действии на КСЮ4 концентрированной серной кислотой образуется хлорная кислота НСЮ4 — очень сильный окислитель и самая сильная кислота в водном растворе. Безводная хлорная кислота неустойчива и взрывоопасна, но в разбавленных растворах устойчива. Водные растворы ее солей, перхлоратов, устойчивы.
Перхлорат-ион СЮ4 — крайне слабый лиганд, поэтому хлорная кислота используется при изучении водных растворов катионов, когда важно иметь в растворе гидратированные катионы, а не комплексные катионы с лигандами-анионами.
Хлорноватистая кислота НСЮ, хотя и слабый окислитель, тем не менее отличается быстротой окислительного действия. Хотя хлорная кислота НСЮ4 — самый сильный из неорганических окислителей, ее действие в водном растворе протекает довольно медленно (но если в склянку с концентрированной хлорной кислотой попадет пылинка органического вещества, последует сильнейший взрыв).
Столь сильная разница в кинетическом поведении двух кислот объясняется тем, что в хлорноватистой кислоте НСЮ доступ восстановителя к атому хлора почти свободен, а в хлорной кислоте НС104 атом хлора в семивалентном состоянии закрыт четырьмя атомами кислорода, что препятствует сближению его с частицей восстановителя (энтропия активации).
Отметим еще одну малоустойчивую кислородную кислоту хлора — хлористую НСЮ2, соли которой называются хлоритами.
Окислительные и кислотные свойства кислородсодержащих кислот хлора сопоставлены ниже:

Распространенным методом обеззараживания воды является ее хлорирование. С этой целью применяют свободный хлор, соли хлорноватистой кислоты (гипохлориты), диоксид хлора СЮ2 и другие вещества. Обеззараживание воды хлором основано на его способности угнетать ферментные системы микробов (доза хлора — 20—30 мг/л).
При хлорировании сточных вод, содержащих фенол СвН-ОН (оксибензол, карболовая кислота), образуется янтарная кислота (инсектицид, лекарственное средство), существенно менее опасная для здоровья человека:

При обеззараживании воды в плавательных бассейнах иногда одновременно вводят хлор С1.;, сульфат меди CuSO^ и дополнительно соли серебра. (В-6-3. Зачем?)
Хлор применяется также для удаления из воды различных ионов и солей, например сульфата железа(И), и растворенных газов, например аммиака, диоксида серы или сульфит-ионов:

При передозировке хлора проводят дехлорирование воды, для чего можно использовать те же вещества, которые удаляются хлором, или пользоваться тиосульфатом натрия (гипосульфитом) Na.,S203:

Хлор уничтожает бактерии намного лучше, чем озон, но при хлорировании образуются опасные для человека вещества типа канцерогенных диоксимов, молекула которых состоит из двух бензольных колец, связанных друг с другом двумя атомами кислорода.
Один из часто используемых диоксимов с названием диоксин (тетрахлордибензодиоксин) имеет формулу

Диоксин — бесцветные кристаллы без запаха, плавится при
320°С и устойчив до 750°С. Одна из реакций получения диоксина — действие гидроксида натрия на трихлорфенол:

(В-6-4. Это окислительно-восстановительная реакция?) Диоксин обнаружен как побочный продукт при получения гербицидов, в целлюлозной промышленности, металлургии, в выхлопных газах двигателей внутреннего сгорания при их неисправности и плохом бензине. Диоксин образуется при сжигании полимерных материалов, в частности пласмассовых бутылок.
Диоксин — высокотоксичное с разносторонним действием вещество: раздражает кожу, поражает печень, обладает тератогенным (повреждение эмбрионов), мутагенным и канцерогенным действием. Способен накапливаться в организме, медленно ослабляя его до летального исхода. Использовался авиацией США (1965—1968 гг.) для уничтожения зарослей растительности во Вьетнаме. Некоторые летчики, распылявшие диоксин, через десятилетие погибли. Обезвреживание диоксина проводят дехлорированием.
Диоксин вызывает раковые опухоли, разрушает кроветворную и иммунную системы человека и вызывает различные мутации, часто приводящие к аномалиям и уродствам человека, животных и растений. Диоксин химически инертен, накапливается в организме и почти не выводится. Период полуразложения в почве достигает одного года.
Иногда для более сильного бактерицидного действия хлора в воду добавляют соли аммония или пропускают одновременно хлор и аммиак: 
Образующийся хлорамин в воде медленно гидролизуется:

Хлорамин — хлорпроизводное аммиака, соединение, в котором один или два атома водорода в аммиаке (или аминогруппе —NH2) замещены атомами хлора. Хлорамин получают действием хлора или НСЮ на аммиак.
Хлорамин NH.;C1 — сильный окислитель, его 1%-ный водный раствор — дезинфицирующее средство, используемое для хлорирования воды. Даже при небольшой концентрации хлорамин убивает возбудителей многих болезней, среди которых холера, чума и сибирская язва. Иногда хлорамин применяют для отбеливания и стерилизации больничного белья.
Диоксид хлора СЮ2 — другой окислитель, действующий сильнее и быстрее хлора. Это зеленовато-желтый газ (?кип = 11°С), растворим в воде. Получают восстановлением NaCl03 хлороводоро- дом или диоксидом серы, а также окислением NaCl02 хлором или хлороводородом. (В-6-5. Напишите уравнения реакций.) Хотя диоксид хлора неустойчив и может взрываться, его водные растворы, и особенно кислотные, устойчивы.
Для очистки воды применяют газовую смесь хлора и диоксида хлора. При использовании этой смеси бактерии, вирусы, споры и мельчайшие водоросли уничтожаются в несколько раз быстрее, чем при действии хлора. При этом не образуются токсичные хло- рорганические вещества. Диоксид хлора иродливает обеззараживающее действие до 10 дней, улучшает вкус воды и устраняет запах хлора. Доксид хлора и его смесь с хлором применяются для отбеливания тканей и обезвреживания сточных вод, что удобно при содержании в них фенола (разрушается бензольное кольцо).
Кроме хлора, для очистки воды используются и другие окислители: озон, пероксид водорода и перманганат калия. Озон обладает более сильным бактерицидным действием, чем хлор, но при озонировании погибают не все бактерии, а оставшиеся в живых быстро размножаются, поглощая остатки уничтоженных, через некоторое время очищенная вода становится снова загрязненной бактериями и эффект озонирования пропадает. Поэтому озонирование совмещают с ультрафиолетовым облучением воды и другими методами очистки.
Озонирование может проводиться непосредственно в месте забора и использования воды при наличии электроэнергии (и озонатора). Для хлорирования необходимы баллоны с жидким хлором, что создает трудности их доставки и хранения. Пероксид водорода дорог, хотя его применение расширяется. Перманганат калия не относится к экологически чистым окислителям, так как при его использовании образуется диоксид марганца Мп02.
Задача 812.
Составить схему цепной реакции хлора с водородом. Какую роль в ней играет освещение? Имеет ли значение частота света?
Решение:
Синтез HCl из Н 2 и Cl 2 протекает на свету:
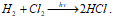
Эта реакция относится к неразветвлённым цепным реакциям. Поглощение кванта света или другой лучистой энергии (hv) молекулой Cl2 приводит к её возбуждению – к появлению в ней энергичных колебаний атомов. И, как только энергия колебаний атомов превышает энергию связи между атомами, то молекула распадается. Формирование цепи начинается с образования радикалов:
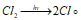
Образующиеся атомы хлора легко реагируют с молекулой водорода с образованием молекулы хлороводорода и атома водорода:
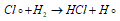
Атом водорода, в свою очередь, легко реагирует с молекулой хлора с образованием молекулы хлороводорода и атома хлора:
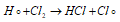
Эта последовательность процесса продолжается дальше, в рассматриваемом случае число звеньев может достигать 100000. При данной фотохимической реакции частота света играет существенную роль, поскольку количество энергии кванта света определяется произведением постоянной Планка (h) и частотой света (v), получим: (hv). От численного значения частоты света зависит величина количества энергии кванта. Для распада молекулы Cl2 на 2 необходима частота света чуть больше 550 ммк. Под действием получаемого при данной частоте кванта света разрушается связь Cl — Cl, а не Н — Н, так как Е(Cl — Cl) = 243 кДж/моль, а Е(Н — Н) = 436 кДж/моль.
Таким образом, под действием света энергии кванта света (Е = hv) достаточно только для разрыва связей Cl — Cl в молекуле Cl2, а не для разрыва связей Н — Н в молекуле Н2. Именно свет является фактором, который определяет начало цепной реакции - образование свободных атомов хлора.
Задача 813.
Написать уравнения реакций взаимодействия галогенов с водой и растворами щелочей (холодными и горячими).
Решение:
а) Уравнения реакций взаимодействия галогенов с водой:
б) Уравнения реакций взаимодействия галогенов с холодным раствором щёлочи:
Cl2 + 2OH- ↔ Cl - + OCl - + H2O.
в) Уравнения реакции взаимодействия галогена с горячим раствором щёлочи:
3Cl2 + 6OH - ↔ 5Cl - + OCl3 - + 3H2O.
Таким образом, при растворении галогенов в холодной воде и в холодных растворах щелочей происходит восстановление хлора до степени окисления его атома +1 и окисление галогена до степени окисления -1. В горячих растворах щелочей галоген самоокисляется и самовосстанавливается соответственно до степени окисления -1 и до степени окисления +5.
Задача 814.
Привести примеры возможных реакций галогенов друг с другом. Указать степени окисленности галогенов в продуктах реакций.
Решение:
Известны соединения галогенов друг с другом (галоиды), например: BrCl, ICl3, BrF5, IF7, ClF, ClF5 IBr и другие. Все соединения галоидов могут быть получены прямым синтезом, например:
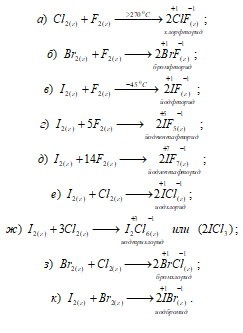
Некоторые из галоидов могут существовать в обычных условиях и не разлагаться, например ClF (газ), BrF (жидкость), IF5 (жидкость), IF7 (газ).
Задача 815.
При 300°С степень термической диссоциации НI составляет 20%. Каковы при этой температуре равновесные концентрации Н2 и I2 в системе
Н2 +12 ↔ 2НI, если равновесная концентрация НI равна 0,96 моль/л?
Решение:
Обозначим начальную концентрацию HI через х (моль/л). Если к моменту наступления равновесия из каждых х молей йодоводорода диссоциировано х молей,
то при этом, согласно уравнению реакции, образовалось 0,5х; моля Н2 и 0,5х моля I2.
Находим начальную концентрацию HI (х) с учетом того, что термическая диссоциация ее составляет 20% (0,2), составив соотношение:
0,96 = х - (0,96 . 0,2);
х = 0,96 + 0,192 = 1,152 моля.
Тогда равновесные концентрации Н2 и I2 с учётом того, что степень термической диссоциации НI составляет 20%, получим:
[H2] =[I2] = 0,5x . 0,2 = 0,5 . 1,152 . 0,2 = 0,1152 моля.
Cl2 при об. Т - газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха - в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Основаны на процессе окисления анионов Cl -
2Cl - - 2e - = Cl2 0
Электролиз водных растворов хлоридов, чаще - NaCl:
Окисление конц. HCI различными окислителями:
Хлор - очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl - :
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl - , а другие в положительной степени окисления входят в состав анионов ClO - или ClO3 - .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 - гипохлориты; КClO3 - хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
HCl - хлорид водорода. При об. Т - бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl - окисляется до свободного галогена:
2Cl - - 2e - = Cl2 0
Уравнения реакция см. "Получение хлора". Особое значение имеет ОВР между соляной и азотной кислотами:

а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)

Кислородсодержащие соединения хлора - чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Взаимодействие хлора с аммиаком и азотсодержащими веществами было рассмотрено в предыдущей статье.
Свободный хлор способен окислять марганец, но скорость окисления при рН S+HCl+H2O
При взаимодействии хлора с органическими веществами возможны реакции окисления (гуминовых веществ, спиртов и др.) и замещения (хлорирование фенолов и др.).
В реакциях окисления основную роль играет окислительно-восстановительный потенциал окислителя, определяющий возможность протекания окислительно-восстановительной реакции между веществами, а при наличии нескольких окислителей в растворе можно определить приоритет их взаимодействия. Окислительно-восстановительный (ОВ) потенциал сильно зависит от рН среды, уменьшаясь с увеличением рН. Приводим для ориентировки стандартные ОВ потенциалы основных окислителей:
Озон - + 2,07 В (кислая среда)
СlO2 - + 1,5 В (рН 1)
НСlO - + 1,2 В (рН 4)
NaСlO - + 0.84 В (рН 8)
Кислород - + 0.84 В (рН 7)
Дихлорамин - + 0,75 В
Монохлорамин - + 0,7 В
В реакциях замещения хлорирующие агенты располагаются в следующий ряд: Сl2 > НСlO > СlO-. Однако, кинетика (скорость) процесса осветления не всегда определяется величиной ОВ потенциала окислителя, а зависит от образования различных активных форм окисляющегося вещества, промежуточных продуктов реакции и их химических свойств.
Сложность состава природных вод и наличие в них широкого спектра органических и неорганических веществ, реагирующих с хлором, являются причиной того, что до настоящего времени эти сложные процессы комплексно оцениваются лишь суммарной характеристикой - величиной хлоропоглощаемости.
Анализ химизма взаимодействия хлора с окрашенными органическими кислотами почвенного гумуса показал, что основной реакцией при всех значениях рН является окисление, сопровождающееся обесцвечиванием. Обесцвечивание хлором водного гумуса зависит от его фракционного состава. Так, при хлорировании креновых кислот снижение цветности на 1 градус достигается 3,5 мг/л, а апокреновых - 0,2 мг/л хлора. Максимальное обесцвечивание наблюдается при рН 7-8. однако, хлорирование гумусовых веществ не является деструктивным процессом и не может обеспечить такую же глубину обесцвечивания воды, как озонирование.
Обесцвечивание воды хлорированием применялось на московских и киевских водопроводах. Так, на Днепровском водопроводе г. Киева введение 10-15 мг/л хлора при контакте 6 часов обеспечивало удаление цветности на 40-70%. Удельный расход хлора составлял 0,15-0,5 мг/град, в то же время, как удельный расход сернокислого алюминия был на уровне - 1-4,5 мг/град. Замена значительной части коагулянта меньшим количеством хлора (в 6-9 раз) давала значительный экономический эффект. Однако, такая практика должна быть прекращена в связи с указаниями на образование высокотоксичных тригалоидметанов при хлорировании гумуса (в концентрациях прямо пропорциональных дозах хлора). Эта сторона проблемы подробно освещена в разделе 3 данной лекции.
В Институте Коллоидной химии и химии воды (ИКХХВ) АН УССР проведен ряд важных работ по хлорированию и озонированию многих органических примесей воды (фенолов, нефтепродуктов, пестицидов и др.). Эти исследования показали, что хлорирование может быть применено для окисления фенолов (удельный расход хлора от 2,4 мг/мг для гидрохинона до 6-8 мг/мг для фенола). Для удаления нефтепродуктов и изученных пестицидов (хлорофоса, дихлофоса, метафоса, гептахлора) хлорирование непригодно. В отдельных случаях образуются еще более токсичные хлопроизводные, например, при хлорировании гептахлора, хлорофоса, дихлофоса и метафоса. Удовлетворительно обеззараживается хлором лишь фосфамид (расход хлора 25 М на 1 М пестицида).
Показано, что все изученные пестициды достаточно хорошо обеззараживаются озонированием.
Читайте также:

