Ученые открывшие раковую клетку

5 декабря стало известно, что специалисты австралийской биотехнологической компании Имуген модернизировали вирус коровьей оспы, создав новый искусственный вирус. Эта смертоносная для рака конструкция получила название CF33.
Были проведены лабораторные исследования, во время которых вирус убил раковые клетки 60 различных видов. затем провели испытания на мышах. Учёных вновь ждал успех. В ближайшее время онколог из США Юман Фон намерен проверить убойную силу вируса в Австралии. Вирусом заразят пациентов с раком груди, желудка, лёгких, мочевого пузыря и раком кожи. Вирусы будут впрыскивать непосредственно в опухоли. Затем проведут исследования на пациентах, которые страдают от нескольких видов рака одновременно. Если испытания закончатся успешно, то человечество получит долгожданное лекарство от рака.
Правда скептики сомневаются и предполагают, что этот вирус может убить иммунная система человека. Но, как говорится, надежда умирает последней.
Американский онколог Юман Фонг объявил о начале испытаний на людях нового потенциального средства против рака, разработанного австралийской биотехнологической компанией Imugene, сообщает издание naked-science.ru.
Ранее врачи заявили, что в ближайшее время число больных раком увеличится на 30 процентов. Об этом сообщил главный внештатный онколог Минздрава, академик РАН Андрей Каприн. По данным Всемирной организации здравоохранения, ежегодно в мире выявляется более 18 миллионов случаев заболеваемости раком, половина пациентов умирает.
Отметим, в России продолжает расти число умерших от рака людей. Только за первое полугодие 2019 года смертность от рака увеличилась на 1,5% по сравнению с аналогичным периодом 2018 года и составила 149 384 человека.
Онкология в Смоленской области занимает второе место по причинам смертности. Напомним, каждый седьмой смолянин умирает от рака. За шесть месяцев 2019 года, по данным ведомства, в Смоленской области умерло 7283 человек. От новообразований в нашем регионе погибли 1 005 человек, что больше на 11 пациентов, чем за аналогичный период прошлого года. Из них от злокачественных образований погибли 996 смолян.
Ранее мы рассказывали, что россиянам стала доступна иммунотерапия при лечении онкологии. Иммунотерапия отличается тем, что не воздействует на клетки злокачественной опухоли напрямую, позволяя иммунной системе самостоятельно обнаруживать и уничтожать опухолевые клетки. Поскольку применение иммунотерапии активирует собственную иммунную систему организма, эффективность лечения может быть значительно выше по сравнению с другими видами лекарственной терапии. Иммуноонкологические препараты входят в перечни ЖНВЛП и ОНЛС, поэтому многие пациенты с онкологическими заболеваниями имеют право на их получение.
Ранее медики назвали 5 признаков рака, которые люди часто не воспринимают всерьёз. Так, например, увеличение лимфатических узлов, которые не болят, говорят о развитии рака лимфатических узлов. Именно с этого началось заболевание у Кирилла Малышева. Смоленск сравнительно небольшой городок, где все друг друга знают. Весть о его болезни сразу же разлетелась не только по всем редакциям, в силу специфики его работы, но и по всему городу. Пожалуй, это первый в Смоленске человек, который не только спокойно, но ещё и с юмором может рассказывать о страшном заболевании – раке. Причём не о чужом, а о своём. О раке из первых уст.
Smolnarod решил выяснить причины смертности от онкологических заболеваний в Смоленской области. За комментариями мы обратились к главному врачу Смоленского областного онкологического диспансера Александру Эфрону. О самых распространённых в нашем регионе видах рака, причинах заболеваемости и способах выявления читайте в нашем материале.

Открытие новых Т-клеток заставило говорить о создании универсального лечения рака.
Фото Global Look Press.
Международная группа исследователей открыла новый тип клеток иммунной системы, способных преследовать и уничтожать большинство видов раковых клеток. Открытие может совершить настоящую революцию в области иммунотерапии и привести к появлению универсального метода лечения рака, считают специалисты.
Развитие технологии CAR-T (сhimeric antigen receptor, что можно перевести как химерный рецептор антигена Т-клетки) стало одним из самых новаторских достижений в терапии рака за последние годы. Речь идёт о персонализированном лечении, при котором Т-клетки пациента собирают и перепрограммируют на "преследование" особых белков, обнаруженных на раковых клетках пациента.
В 2017 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило первое подобное лечение для молодых пациентов с редким видом рака крови и костного мозга. Но такая терапия является весьма дорогостоящей и чревата серьёзными побочными эффектами. Более того, CAR-T не показала должных результатов в лечении солидных (твёрдых) опухолей, которые встречаются в большинстве всех случаев заболевания.
Ещё одна проблема этого вида терапии заключается в том, что не существует универсального Т-клеточного рецептора (ТКР), который может справляться с самыми разными видами рака у всех пациентов. Но недавнее открытие учёных из Кардиффского университета показывает, что это неверная точка зрения.
Исследователи обнаружили Т-клетки иммунной системы, которые имеют неизвестный ранее рецептор. Последний, как предполагают специалисты, способен преследовать и уничтожать большинство раковых клеток человека. Что самое важное, "новичок" не вредит здоровым клеткам.
Считается, что недавно обнаруженная Т-клетка способна отличать раковые клетки от здоровых, поскольку она фокусируется на молекуле MR1, которая находится на поверхности большего количества раковых клеток. Что интересно, такая молекула имеется почти у всех клеток организма человека. Но, как предполагают учёные, у раковых клеток она несколько отличается, что позволяет "универсальному" ТКР эффективно нацеливаться на широкий спектр опухолей. Иными словами, новый ТКР способен отличать здоровые клетки от раковых, уничтожая только последние.
Специалисты провели исследования в лаборатории и выяснили, что Т-клетки, обладающие новым ТКР, уничтожают раковые клетки лёгких, кожи, крови, толстой кишки, молочной железы, костей, простаты, яичников, почек и шейки матки. При этом они, как было указано выше, игнорировали здоровые клетки.
Исследователи уже провели испытание на больных раком мышах, введя им Т-клетки, способные распознавать MR1. В результате они смогли "очистить" организм животных от раковых клеток. Результат можно сравнить с одобренной терапией CAR-T, которая была испытана на той же модели мышей.
"Современную терапию на основе ТКР можно применять лишь к небольшому количеству пациентов, и она подходит не ко всем онкологическим заболеваниям", – объясняет автор работы профессор Эндрю Сьюэлл (Andrew Sewell).
По его словам, новая таргетная терапия рака открывает новые горизонты, и, возможно, она приведёт к появлению "универсального" лечения этого заболевания.
"Найден единственный тип Т-клеток, который способен уничтожить множество различных типов рака. Ранее никто не верил, что такое возможно", – добавляет Сьюэлл.
На сегодняшний день учёные проводят эксперименты по определению точного молекулярного механизма, с помощью которого раннее неизвестный ТКР отличает здоровые клетки от раковых.
Профессор Сьюэлл считает, что испытания на людях могут начаться в ближайшие несколько лет, если дальнейшие проверки новой терапии на безопасность окажутся успешными.
Научная статья по итогам исследования опубликована в издании Nature Immunotherapy.
Комбинация ингибитора каспаз эмрикасана и антител против белка программируемой клеточной гибели может стать эффективным средством для повышения эффективности лучевой терапии.
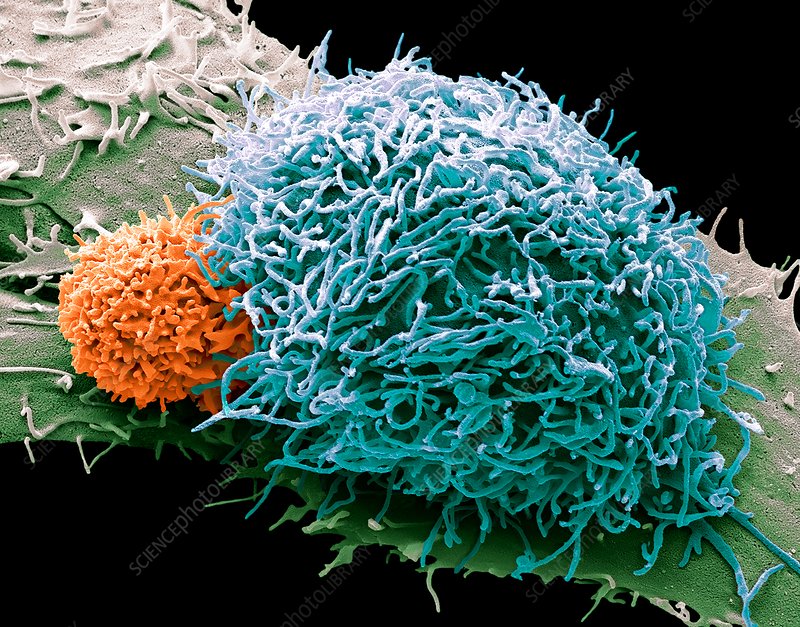
Клетки опухолей способны избежать атаки со стороны иммунной системы после облучения, используя те же сигнальные пути, с помощью которых запуска иммунного ответа избегают погибающие клетки. Статья об этом опубликована в издании Nature Immunology.
Лучевая терапия — основа большинства протоколов лечения самых разных видов рака. Высокоэнергетическое излучение убивает опухолевые клетки, из ядер которых высвобождается ДНК: она, в свою очередь, становится триггером интерферон-опосредованного иммунного ответа. Хотя мутировавшие раковые клетки составляют большую часть опухолей, сами они выделяют очень мало интерферона. Это натолкнуло ученых на мысль, что существует определенный механизм, позволяющий опухоли избегать иммунного ответа.
Исследователи из Северо-западного медицинского центра Техаса попробовали идентифицировать этот механизм. Они протестировали 42 препарата, одобренных FDA, которые блокируют различные сигнальные пути в культуре клеток рака кишечника мышей. Ученые пытались найти среди этих лекарств то, которое могло бы побудить клетки синтезировать большие количества интерферона.
Таким препаратом оказался эмрикасан, разработанный для лечения хронической печеночной недостаточности. По своему механизму действия эмрикасан является ингибитором каспаз — ферментов, которые играют важную роль в процессах запрограммированной клеточной гибели и в то же время подавляют реакцию иммунной системы на гибнущие клетки.
Дальнейшие эксперименты показали, что один фермент из этого семейства, каспаза 9, служит ключевым веществом для подавления синтеза интерферонов. Генетические манипуляции, направленные на выключение гена СASP9, кодирующего эту каспазу, приводили к тому, что после радиационного воздействия синтез интерферонов клетками опухоли повышался в тысячи раз по сравнению с клетками дикого типа (с рабочим геном СASP9).
Когда исследователи пересаживали мышам раковые клетки с выключенными генами CASP9, их опухоли практически полностью регрессировали после сеанса облучения. Дополнительные эксперименты показали, что в процессе ликвидации клеток опухоли была задействована специфическая популяция иммунных клеток, так называемые CD8+ T-лимфоциты. Они были рекрутированы для борьбы с раковыми клетками именно посредством интерферона.
Однако вопрос о том, как именно работает защитный механизм раковых клеток, оставался открытым. Дело в том, что ядерная ДНК высвобождается уже после смерти клетки: следовательно, есть некий молекулярный триггер, который стимулирует активацию каспаз, когда клетка еще не погибла. Таким триггером оказалась митохондриальная ДНК, которая выделяется в цитоплазму клеток раньше ядерной. Когда авторы исследования удалили из опухолевых клеток всю митохондриальную ДНК, это привело к отсутствию синтеза интерферонов в ответ на облучение.
Хотя блокирование гена синтеза каспаз выглядит как многообещающий способ борьбы с онкологическими заболеваниями, этот метод имеет существенный недостаток. При потере синтеза каспазы 9 опухолевые клетки выработали новый метод ухода от иммунного ответа — посредством белка программируемой клеточной гибели PD (L)1.

Учёные из Университета Кардиффа обнаружили новый тип Т-киллеров, которые дают нам надежду на универсальную противораковую терапию.
Т-клеточная терапия — извлечение иммунных клеток, их изменение и возвращение в кровь пациента в целях поиска и уничтожения раковых клеток — новейшая парадигма в лечении рака.
Наиболее широко используемая терапия, известная как CAR-T, персонализирована для каждого пациента, но нацелена лишь на несколько типов рака и не показала успех в лечении опухолей, которые составляют большинство раковых заболеваний.
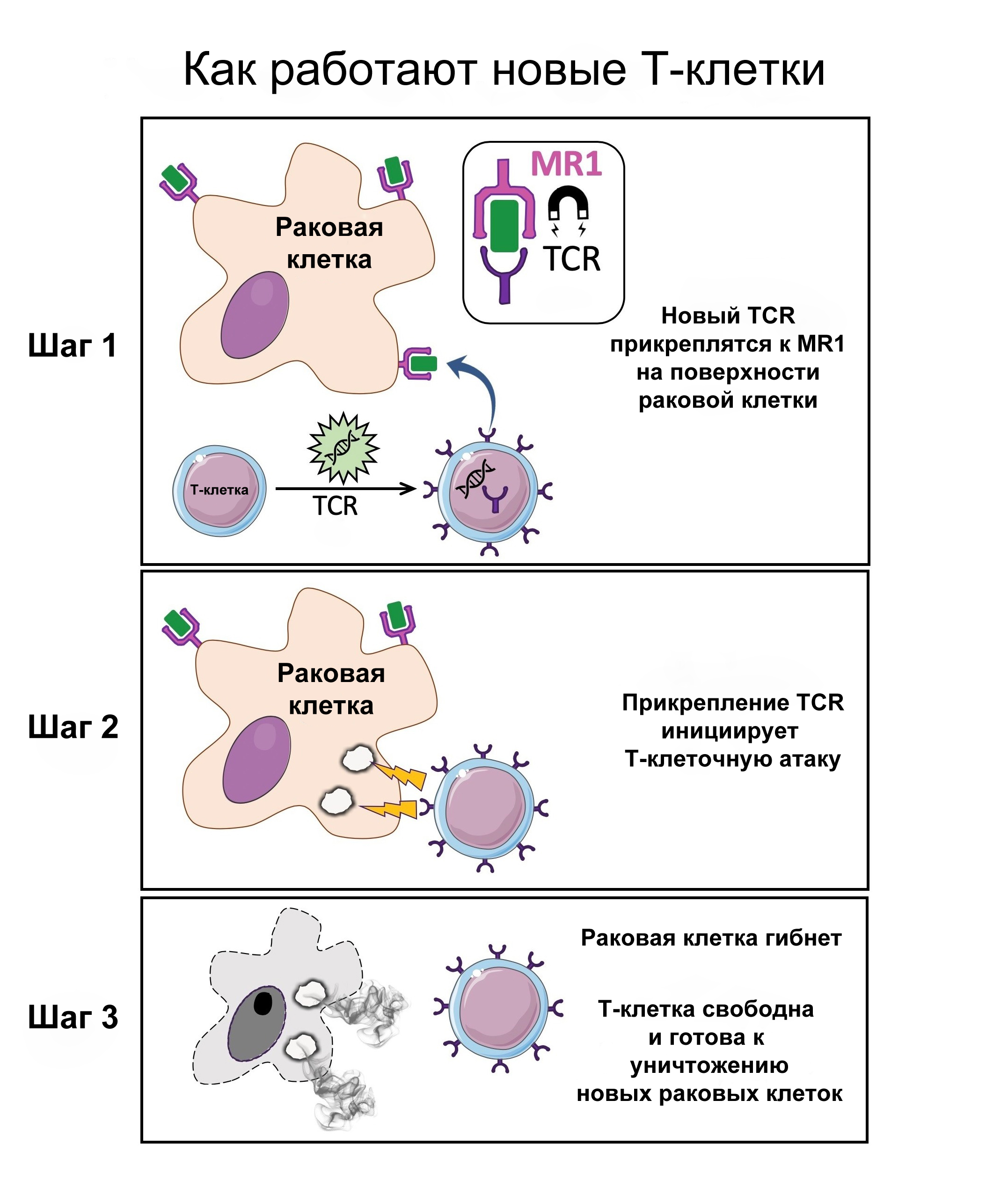
Учёные из Кардиффа обнаружили Т-клетки, оснащённые новым типом Т-клеточных рецепторов (TCR), которые распознают и убивают большинство типов рака у человека, игнорируя при этом здоровые клетки.
Этот TCR распознает молекулу, присутствующую на поверхности широкого спектра раковых клеток, а также во многих нормальных клетках организма, но, что удивительно, способен различать здоровые и раковые клетки, убивая лишь больные.
Как работает этот новый TCR?
Сканирующая система распознает небольшие части клеточных белков, которые связаны с молекулами клеточной поверхности, называемыми антигеном лейкоцитов человека (HLA), позволяя Т-киллерам узнавать, что происходит внутри клеток, сканируя их поверхность.
HLA сильно различается у разных людей, что ранее мешало учёным создать универсальную терапию на основе Т-клеток, нацеленную на большинство типов рака у всех людей.
Но работа в Кардиффе, опубликованная в журнале Nature Immunology, описывает уникальный TCR, который может распознавать многие типы рака через одну HLA-подобную молекулу, называемую MR1.
В отличие от HLA, MR1 не изменяется в популяции людей — это означает, что она чрезвычайно привлекательная новая цель в иммунотерапии.
Что показали учёные?
В работе было показано, что Т-клетки, оснащённые новым TCR, убивают клетки рака лёгких, кожи, крови, толстой кишки, молочной железы, предстательной железы, яичников, почек и шейки матки, игнорируя при этом здоровые клетки.
Чтобы проверить терапевтический потенциал этих клеток in vivo, учёные вводили Т-клетки, способные распознавать MR1, у мышей с раком человека и иммунной системой человека.
Это показало великолепные результаты лечения рака, которые, по словам учёных, были сопоставимы с используемой в настоящее время в клинике терапией CAR-T в аналогичной модели у животных.
Группа из Кардиффа также смогла показать, что Т-клетки пациентов с меланомой, изменённые в целях экспрессии этого нового TCR, могут разрушать не только собственные раковые клетки пациента, но и раковые клетки иных пациентов в лаборатории, независимо от типа HLA пациента.
«Современные методы лечения, основанные на TCR, могут использоваться лишь у малого числа пациентов и специфическими раковыми заболеваниями.
И какие у них планы?
Проводятся эксперименты по определению точного молекулярного механизма, с помощью которого новый TCR различает рак и здоровые клетки.
Учёные полагают, что он может работать, ощущая изменения в клеточном метаболизме, которые вызывают различные метаболические промежуточные продукты, оказывающиеся на поверхности раковых клеток с помощью MR1.
Научная группа надеется опробовать эту новую терапию на пациентах к концу этого года после испытаний на безопасность.
Профессор Сьюэлл сказал, что жизненно важным аспектом постоянного тестирования безопасности является обеспечение того, чтобы Т-киллеры, изменённые новым TCR, распознавали лишь раковые клетки.
Работа финансировалась исследовательскими центрами Wellcome Trust, Health and Care Wales и Tenovus.

НОВОСИБИРСК, 1 июля. /ТАСС/. Специалисты Федерального исследовательского центра Институт цитологии и генетики СО РАН (ФИЦ ИЦиГ СО РАН) открыли универсальный маркер стволовых раковых клеток. Кроме того, ученым удалось разработать способ их уничтожения, что позволило вылечить лабораторных мышей от двух форм злокачественных опухолей, сообщает в пятницу официальное издание СО РАН "Наука в Сибири".
"Как выяснила старший научный сотрудник лаборатории индуцированных клеточных процессов кандидат биологических наук Евгения Долгова, если к стволовым инициирующим раковым клеткам добавить фрагменты ДНК, они их захватят. На этом принципе строится идея универсального маркера, полученного в ФИЦ ИЦиГ СО РАН. Ученые вводят специфический флуорохромный краситель в ДНК-зонд, и принявшие его клетки в определенном спектре начинают светиться красным", - говорится в сообщении. Ученые полагают, что это открытие может стать настоящим прорывом в изучении малочисленной популяции клеток, являющихся первопричиной развития рака.
Ученые решили проверить, можно ли с помощью ДНК в комплекте с другими средствами приостановить рост опухоли. Как установили специалисты, фрагменты ДНК, попавшие в стволовую раковую клетку после воздействия химиотерапевтического препарата циклофосфана, прерывают ее восстановление и впоследствии погибают.
Старший научный сотрудник лаборатории кандидат биологических наук Екатерина Алямкина разработала методику, позволяющую привести к одной фазе и уничтожить все стволовые раковые клетки асцитной (когда образуется полость с жидкостью) опухоли Кребс-2. В ходе эксперимента удалось полностью вылечить 50% лабораторных мышей, которые затем дали здоровое потомство. С помощью этой методики удалось успешно воздействовать и на на так называемую "солидную" форму этой опухоли (когда она перевивается в мышцу и растет как твердое новообразование).
"Стволовую раковую клетку, являющуюся причиной развития болезни, нужно попытаться убить в момент восстановления после воздействия специфических химиопрепаратов. В такой период она наиболее чуствительна. Если новообразование лишится такого организующего "центра", иммунная система организма устранит остаточные опухолевые очаги и произойдет полное излечение", - приводит издание слова заведующего лабораторией индуцированных клеточных процессов доктора биологических наук Сергея Богачева.
Сейчас в ФИЦ ИЦиГ СО РАН планируют применить обнаруженный принцип уничтожения стволовых канцерогенных клеток и дальнейшей терапии на другие типы злокачественных новообразований. Также ученые прорабатывают диагностическую методику мониторинга эффективности лечения рака яичника и желудка с использованием универсального маркера. Оценка количества стволовых клеток до начала лечения и после его завершения позволит максимально точно сказать: устранен ли недуг полностью или возможен рецидив.


Боль - под контроль
Всего в портфеле Научно-образовательного центра КФУ, созданного в рамках ФЦП "Фарма-2020" в 2011 году, девять уникальных разработок. Шесть из них с успехом прошли доклинические исследования, то есть доказали свою эффективность и безопасность на животных. Предполагается, что в 2020 году их начнут испытывать на добровольцах.


Несмотря на то, что клиническая фаза исследований препаратов еще впереди, некоторые из них уже имеют солидную репутацию. К примеру, полгода назад противовоспалительный препарат KFU-01 завоевал золотую медаль на 47-й Международной выставке изобретений. Лекарство может стать настоящим спасением для тех, кто страдает такими тяжелыми воспалительными заболеваниями опорно-двигательного аппарата, как артроз и артрит.
- Считается, что избавиться от этих недугов полностью нельзя, можно лишь на некоторое время снять боль и острое воспаление, - рассказывает ведущий научный сотрудник НОЦ фармацевтики КФУ Константин Балакин. - Наша разработка претендует на то, что эти болезни станут излечимыми. Исследования на животных показали, что KFU-01 способен полностью подавлять хроническое воспаление, моделирующее ревматоидный артрит, тогда как один из самых эффективных и безопасных в мире нестероидных противовоспалительных препаратов даже в большей дозе справляется с этой задачей лишь на 50 процентов. Это важно, потому что, если воспаление приглушить, но не снять полностью, оно через какое-то время вернется.
К тому же, по его словам, за счет особого дизайна препарат обладает очень высоким уровнем безопасности. В течение полугода ученые ежедневно вводили кроликам и крысам до 500 миллиграммов субстанции KFU-01 на килограмм их веса. Это сопоставимо с двумя-тремя упаковками лекарства для человека. В итоге не то что летальных случаев, а даже существенного изменения биохимических параметров у животных зафиксировано не было.
А еще KFU-01 эффективно снимает боль и в отличие от других противовоспалительных препаратов не вреден для желудка. Да и применять его достаточно один раз в день.
Покорить "Эверест"
Большие надежды внушают и другие разработки НОЦ фармацевтики КФУ. Взять хотя бы противоэпилептический препарат KFU-06. Доклинические исследования показали, что он эффективен даже в самых жестких моделях заболевания. А ведь в соответствии с клиническими данными, сейчас примерно 30 процентов тяжелых случаев эпилепсии практически не поддаются лечению.


Другой препарат, KFU-08, совместное изобретение казанских и волгоградских ученых, может качественно изменить жизнь больных сахарным диабетом (если не только доклинические, но и клинические исследования пройдут успешно). Он предназначен для лечения осложнений этого коварного заболевания.
В разработке - противогрибковый, противотуберкулезный, антибактериальный и противоопухолевый препараты. Имеются совершенно уникальные молекулы. Например, противоопухолевое соединение KFU-07, по словам директора НОЦ фармацевтики КФУ Юрия Штырлина, является для коллектива разработчиков своеобразным творческим "Эверестом".
- Утверждать, что это готовое лекарство, пока рано, - говорит Константин Балакин. - KFU-07 еще не до конца прошел испытания даже на животных. В отличие от большинства современных средств фармакотерапии рака, наш препарат не убивает раковую клетку, а перепрограммирует ее, постепенно превращая в незлокачественную. До сих пор считалось, что это невозможно.
По его словам, исследования на грызунах это подтверждают. Ученые поделили мышей с привитой злокачественной опухолью молочной железы на две группы. Одна группа не получала никакого лечения. А грызунам другой группы в течение 40 дней вводили малые дозы KFU-07. Потом около месяца следили за их состоянием.


В итоге к концу эксперимента половина мышей, не получавших лечение, погибли. В то время как грызуны, испытывавшие препарат, выжили все. И не просто выжили, а, по сути, избавились от рака. Гистологическое исследование опухолевых клеток показало, что новообразование не злокачественное. А такая опухоль, как известно, не дает метастазов, ее можно удалить.
- Этим проектом мы занимаемся уже около восьми лет, - рассказывает Константин Балакин. - Эксперты Минобрнауки РФ очень позитивно восприняли его. Предполагалось, что государство выделит деньги на доклинические исследования. Средства действительно были предусмотрены в федеральном бюджете еще два года назад. Но до нас так и не дошли. В 2018 году весь миллиард рублей, предназначенный для доклинических исследований инновационных лекарственных кандидатов, был возвращен в казну. В 2019-м ситуация повторилась: около 300 миллионов рублей опять ушли в бюджет и не попали к разработчикам. Без объяснения причин. Подобная непоследовательность не только замедляет процесс создания инновационных препаратов, но и ставит такие коллективы, как НОЦ фармацевтики КФУ, на грань краха, потому что университетская наука, в отличие, например, от образовательных подразделений, не имеет базового финансирования. Так, в предыдущие годы центр работал исключительно за счет госконтрактов. В результате фактической их отмены ряды сотрудников НОЦ заметно поредели. От прежнего состава разработчиков осталась почти треть.
Инновации: за или против?
Есть еще одна серьезная проблема. В современной российской науке главным критерием эффективности работы ученых, как это ни парадоксально, являются не инновационные разработки, а количество научных публикаций. Из-за этого, считает Константин Балакин (а он, к слову, один из самых цитируемых российских медицинских химиков), большинство публикаций, мягко говоря, не дотягивает до уровня полноценного научного труда.


- Даже гранты выдают на основании персонального рейтинга цитируемости, - говорит он. - Но, если бы мы публиковали все полученные в ходе исследований данные, наши разработки никогда бы не стали лекарствами. Если до определенного момента не соблюдать режим строгой секретности, патента не получишь. А без него бизнес не будет вкладывать деньги в разработку.
Впрочем, с бизнесом и так не все просто. Формально фармацевтические компании обеими руками за инновации, на деле же все иначе. Активно позиционировать свои разработки казанские ученые начали еще два года назад.
- Мы разослали официальное приглашение к сотрудничеству вместе с кратким описанием проектов 60 крупным российским компаниям. Думаете, фарминдустрия как-то на это отреагировала? В ответ было получено всего три робких письма с просьбой прислать дополнительные материалы. Выслали. И опять молчок! Современному отечественному бизнесу это неинтересно. Большинство фармкомпаний даже оценить по достоинству разработку не могут, поскольку не имеют квалифицированных экспертов.
Но открыто об этом, разумеется, не говорят. В лучшем случае мотивируют отказ ранней стадией разработки. А чаще ссылаются на отсутствие средств.
Между тем
Ученые утверждают: разговоры о том, что внедрение разработок требует многомиллиардных затрат, не более чем миф. По словам Константина Балакина, если идея правильная, то и заключительные клинические исследования перед выведением инновационного препарата, например на российский рынок, обходятся в среднем в 150 миллионов рублей.
Американские ученые нашли способ трансформации раковых клеток в нормальные клетки с помощью процесса, связанного с выработкой микроРНК (miRNA). Исследователи из клиники Майо говорят, что их разработка открывает перспективы новой стратегии борьбы с раком, основанной на возвращении канцерных клеток обратно в нормальное состояние. Исследование было опубликовано в журнале Nature Cell Biology.

Малые некодирующие молекулы РНК (микроРНК) регулируют экспрессию группы генов. Когда нормальные клетки контактируют друг с другом, подгруппа микроРНК подавляет гены, стимулирующие рост клеток.
В раковых клетках адгезия нарушается, микроРНК начинают работать неправильно, а клеточный рост становится неконтролируемым. После того, как ученые восстановили нормальный уровень микроРНК в раковых клетках, процесс неконтролируемого роста был обращен вспять.
По адгезивным белкам, которые нужны для развития нормальной эпителиальной ткани, имеются противоречивые данные. Одни исследования выставляют E-кадгерин и катенин р120 в качестве подавителей опухолей, другие – стимуляторов.
Это привело нас к мысли, что эти молекулы имеют два лица – хорошее, обеспечивающее нормальное поведение клеток, и плохое, которое провоцирует онкогенез, — говорят ученые.
Как оказалось, поведение клеток регулируется белком PLEKHA7. При его отсутствии работа микроРНК нарушается и клетки становятся раковыми. Ученые сравнивают PLEKHA7 с педалью тормоза в ускоряющемся автомобиле.
Первые эксперименты с некоторыми агрессивными видами рака показали перспективность этого подхода.

На сегодняшний день антидепрессанты для многих являются единственным способом борьбы с волнениями и стрессом. Несмотря на то, что разработка этих препаратов началась еще в 50-х годах прошлого века, ученые до сих пор точно не знают, как работают некоторые антидепрессанты. Но тот факт, что для многих людей они являются эффективными, не вызывает сомнений, иначе данные препараты […]

Как думаете, сахар – это наркотик? Этот вопрос обсуждается уже не первое десятилетие. Сахар щекочет наши дофаминовые рецепторы точно так же, как алкоголь, никотин и другие наркотики, вдохновляя систему вознаграждения нашего мозга. Ученым известно, что избыток сахара является виновником целого ряда опасных для жизни заболеваний. Но даже с учетом этого потребление сладкого во всем мире […]

Мы склонны думать, что только негативные изменения причиняют боль. Мы связываем боль с потерями, отказами и неудачами. Тем не менее, в нашей жизни случаются позитивные изменения, которые тоже приходят с долей страданий, что может показаться несколько неожиданным. Часто речь идет о выбранных изменениях, которые, вероятно, сделают нас лучше в долгосрочной перспективе, но они не лишены […]
Читайте также:

