Трофобластическая природа раковых клеток
Заболевание представляет собой группу редких доброкачественных и злокачественных опухолей, в основе которых лежит аномальный рост и развитие трофобласта.
Что это такое
Трофобластическая болезнь — уникальная группа опухолей женского организма, возникновение которых всегда ассоциировано с беременностью. Они могут возникнуть как во время беременности, так и после её завершения независимо от срока окончания беременности и её исхода. Это может быть благополучно протекавшая беременность, завершившаяся родами, самопроизвольный выкидыш или прерывание на любом сроке беременности. При этом сроки развития заболевания могут составлять от нескольких дней до нескольких лет.
Источником трофобластических опухолей являются трофобласты – клетки, которые окружают эмбрион и участвуют в процессе его прикрепления к стенке матки, а затем – в образовании плаценты во время беременности. При чрезмерном размножении трофобластов возникает опухоль.
Частота развития данной патологии составляет не более 1 % случаев среди всех злокачественных заболеваний женских половых органов. Наиболее склонны к заболеванию женщины, у которых беременность наступила до 21 года или после 35 лет.
Уникальной особенностью этих неоплазий является высокая частота излечения даже при наличии отдаленных метастазов, при этом у большинства пациенток после завершения лечения сохраняется репродуктивная функция.
Классификация
Трофобластическая болезнь – собирательное понятие доброкачественных и злокачественных опухолей. В число первых входит морфологическое изменение, из-за которого возникает:
- частичный пузырный занос. Образуется при оплодотворении яйцеклетки сразу двумя сперматозоидами. Такой эмбрион содержит дополнительный набор хромосом, и, к сожалению, является нежизнеспособным;
- полный пузырный занос. Образуется при оплодотворении яйцеклетки с отсутствием хромосом. При дальнейшем делении клеток отцовские хромосомы удваиваются и становятся заменой материнских, однако эмбрион не образуется.
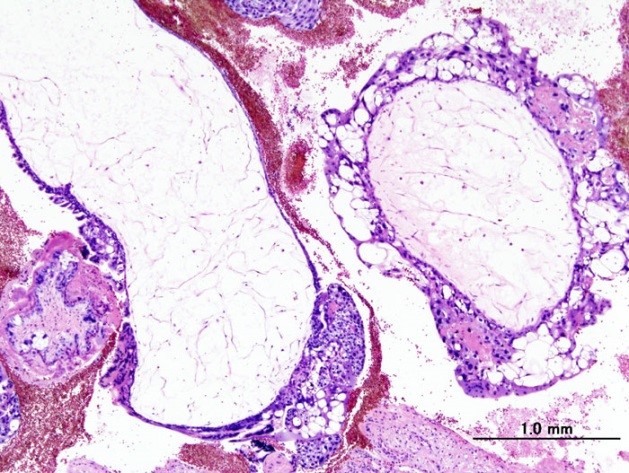
Полный пузырный занос
Эти доброкачественные опухоли диагностируются у 70 % больных, при этом как при полном, так и неполном пузырном заносе наблюдается только разрастание трофобластической ткани и превращение ворсинок хориона в пузырьки. Однако в 20 % случаев трофобласты приобретают способность к малигнизации и метастазированию. По мере распространения злокачественных клеток в окружающие ткани различают инвазивный пузырный занос, диссеминированный пузырный занос, хорионкарционому, трофобластическую опухоль плацентарного ложа и эпителиоидную трофобластическую опухоль.
Трофобластическая опухоль
плацентарного ложа
Симптомы
Женщину должны насторожить следующие признаки:
- безболезненные выделения из влагалища с примесью крови разной интенсивности и выраженности;
- увеличение размера матки, несоответствующее сроку беременности при полном пузырном заносе;
- уменьшенный размер матки, несоответствующий сроку беременности при частичном пузырном заносе;
- токсикоз на поздних сроках беременности.
При злокачественной трофобластической болезни изменяется характер выделений во время менструаций. Ежемесячные кровотечения или вовсе отсутствуют, или идут дольше обычного срока и обильно. Вместе с этим появляются жалобы на изменение вкусовых пристрастий, тошноту и головокружение – симптомы, позволяющие предположить наступление беременности. Нередко возникает тупая боль в нижней части живота, связанная со сдавливанием опухолью стенок матки.
Течение заболевания зависит от провоцирующего фактора. Так, после нормальной беременности, закончившейся родами или абортом, болезнь развивается стремительно, нарушая восстановление женского организма. Если опухоль образовалась после внематочной беременности или трансформировалась из пузырного заноса, то течение болезни более благоприятное.
Клиническая картина может существенно варьировать в зависимости от локализации метастатических очагов:
- при метастазах в лёгких возникают кровохарканье, постоянный кашель, одышка, боли в грудной клетке;
- при метастазах во влагалище пальпируется уплотнение через переднюю стенку живота;
- при метастазах в печени появляется боль в правом подреберье;
- при метастазах в головном мозге беспокоят постоянные головные боли, тошнота, возможны судороги и потеря сознания.
Диагностика
После гинекологического осмотра, сбора анамнеза и фиксирования жалоб пациентка направляется на обследование:
Стадии
В зависимости от степени распространения процесса различают 4 стадии заболевания:
- 1 стадия – опухоль ограничена полостью матки;
- 2 стадия – опухоль распространяется на придатки, шейку матки и влагалище;
- 3 стадия – появляются метастазы в легких;
- 4 стадия – метастазы в других органах.

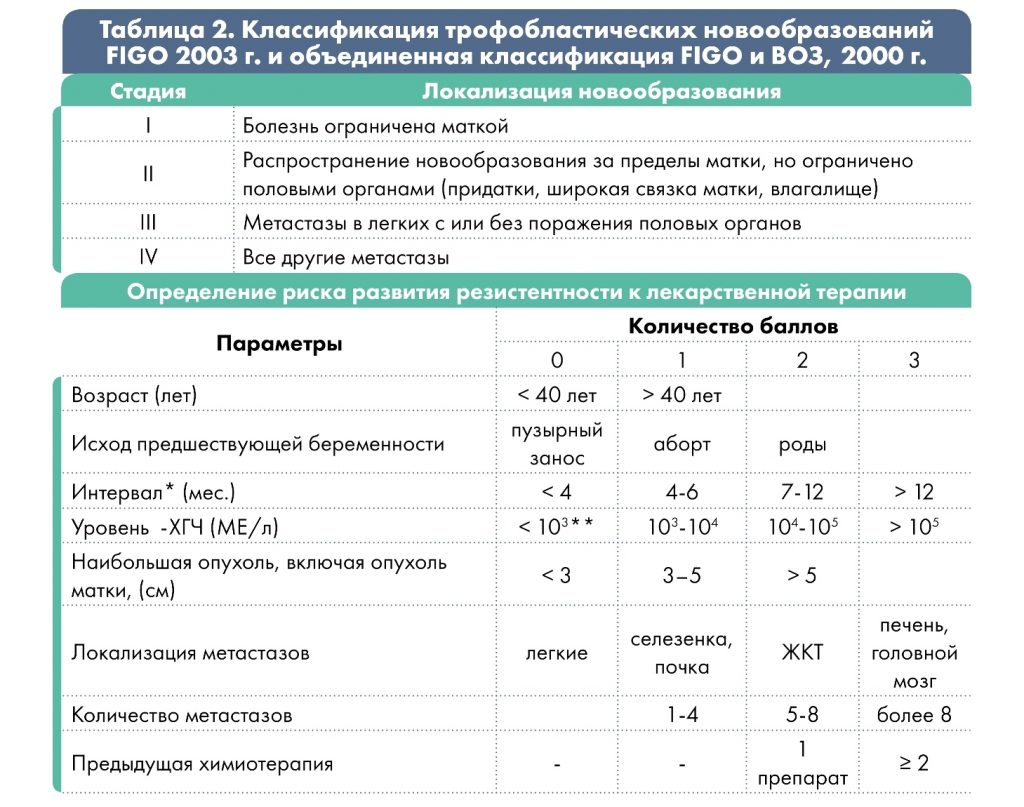
* интервал между окончанием предыдущей беременности и началом химиотерапии;
** низкий уровень β-ХГЧ может быть при трофобластической опухоли на месте плаценты.
При сумме баллов ≤ 6 – низкий риск развития резистентности опухоли; ≥ 7 баллов – высокий.
Лечение
Лечение доброкачественной опухоли невозможно без прерывания беременности. Выполняется аборт, а далее патологические ткани удаляются вакуумным аспиратором. После процедуры на протяжении месяца контролируется уровень β-ХГЧ. Женщина еженедельно сдает анализ крови, пока не получит отрицательный результат три раза подряд. Далее контрольные анализы проводятся ежемесячно в течение года. Важно после эвакуации пузырного заноса выполнить рентгенографию органов грудной клетки и УЗИ органов малого таза.
Если анализ β-ХГЧ остаётся положительным или обнаруживается злокачественная опухоль, то пациентка нуждается в продолжении лечения. Больную следует направить в специализированный центр, имеющий опыт работы и знающий данную патологию, что крайне важно для определения прогноза и эффективности терапии.
Ведущий метод лечения – химиотерапия, которая должна быть начата в кратчайшие сроки. Основные показания для ее проведения:
- стабильный или растущий уровень β-ХГЧ после сдачи трех анализов крови с интервалом в семь дней;
- повышенный уровень β-ХГЧ через полгода после процедуры;
- выявление хориокарциномы, опухоли плацентарного ложа или эпителиоидной трофобластической опухоли;
- обнаружение метастазов.
Врач выбирает рекомендованную схему терапии, основываясь на особенности анамнеза и характеристики опухолевого процесса, т.е. в зависимости от группы риска резистентности опухоли к химиотерапии. Группа риска определяется по шкале FIGO (2000 г.) с учётом результатов обследования: менее 6 баллов соответствует низкому риску, 7 и более баллов – высокому риску.
Если риски рецидива заболевания минимальны, то назначается монотерапия препаратом метотрексат. При высоких рисках рецидива опухоли используется комбинация препаратов, включающих этопозид, дактиномицин, метотрексат, винкристин и циклофосафамид.
Количество циклов химиотерапии определяется индивидуально и зависит от степени снижения уровня β-ХГЧ после каждого цикла. При нормализации уровня специфического маркера дополнительно проводится 2-4 цикла химиотерапии в том же режиме для консолидации полученного эффекта.
Если опухоль приобретает резистентность и нет нормализации уровня маркера, то требуется переход к противоопухолевым препаратам второй линии, например, такие комбинации как дактиномицин, этопозид + дактиномицин + метотрексат + цисплатин или цисплатин + паклитаксел + этопозид.
В некоторых случаях прибегают к хирургическому лечению с последующим проведением адъювантной химиотерапии. Основные показания к оперативному вмешательству являются:
- перфорация опухолью стенки матки;
- кровотечение, не поддающееся консервативной терапии и угрожающее жизни пациентки;
- резистентность опухоли к стандартной химиотерапии при отсутствии отдаленных метастазов;
- резистентность одиночных метастазов при отсутствии первичной опухоли.
Лучевая терапия используется только при метастазах в головном мозге.
Прогноз
Правильное и своевременное выявление заболевания, а также адекватное лечение в настоящее время позволяют достичь 100 % ремиссии на протяжении пяти лет при простом пузырном заносе и более 90 % – при хорионкарциноме без наличия метастазов.
Повторное развитие опухоли возможно в течение первых 36 месяцев до 10 % случаев. Частота излечение рецидива составляет около 75 %.
Фертильность
После завершения лечения у большинства женщин сохраняется репродуктивная функция. Планировать повторную беременность для пациенток с I-II стадией разрешается через год после последнего цикла химиотерапии, а для больных с III-IV стадией – через полтора-два года. Такие сроки установлены с целью правильной интерпретации наступления беременности или рецидива заболевания, а также для профилактики развития аномалий плода.
Профилактика
После удаления пузырного заноса необходимо следить за уровнем β-ХГЧ, а также выполнить рентгенографию органов грудной клетки и УЗИ органов малого таза. После завершения лечения уровень β-ХГЧ определяется каждые две недели на протяжении первых трех месяцев, затем ежемесячно в течение года. В дальнейшем контрольный анализ крови проводится раз в два месяца, а еще через год – один раз в четыре месяца.
Обязательна контрацепция в течение первого года после нормализации уровня β-ХГЧ. Специалисты рекомендуют в качестве метода контрацепции выбирать комбинированные оральные контрацептивы.






— Откуда появляются онкологические заболевания?
— Рак — болезнь генома. Это значит, что его вызывают определенные изменения в генах, которые контролируют работу наших клеток, особенно то, как они растут и делятся. Определенные генные изменения приводят к тому, что клетки ускользают от контроля роста и деления, начинают усиленно и ненормально делиться, расти и становятся раком.
Раковые клетки имеют больше генетических изменений, чем нормальные. При этом онкология каждого человека имеет уникальную комбинацию генетических изменений.
Поскольку опухоль растет, происходят дополнительные вторичные изменения. Даже внутри одной и той же опухоли раковые клетки могут иметь разные генетические изменения. Это явление называется гетерогенностью опухоли.
— Как в целом происходят поломки в генах и можно ли их починить в масштабе человечества?
— Ген представляет собой участок ДНК. Соответственно, поломка гена — поломка структуры ДНК. Есть много разных видов изменений ДНК: некоторые из них затрагивают только одну единицу ДНК, называемую нуклеотидом. Один нуклеотид может быть заменен другим или полностью отсутствовать.
Другие изменения включают в себя большие отрезки ДНК и могут подразумевать перестановки, потери или удвоение длинных участков молекулы.
Иногда изменения затрагивают не последовательность самой ДНК, а добавление или удаление химических меток, называемых эпигенетическими модификациями.
Починить поломки гена в масштабах человечества — задача привлекательная, но крайне сложная и, к сожалению, в настоящее время практически нереализуемая. Развитие инструментов для исправления мутации в гене сильно отстает от методов диагностики.
А с учетом того, что у каждого онкологического пациента свой индивидуальный набор генетических изменений в опухоли, задача становится еще более сложной. Проводятся различные исследования и разработки, но ни один из изучаемых методов пока не нашел практического применения.
— Каковы механизмы наследования онкологических заболеваний?
— Генетические изменения, которые способствуют развитию рака, могут быть унаследованы от наших родителей, если эти изменения присутствуют в половых клетках (яйцеклетки и сперматозоиды).
Такие изменения, называемые изменениями зародышевой линии (герминогенные), обнаруживаются в каждой клетке потомства.
Унаследованные генетические мутации играют основную роль примерно в 5-10% всех случаев рака. Исследователи связывают генетические мутации в генах более чем с 50 наследственными синдромами, которые могут предрасполагать к развитию определенных видов рака.
При этом даже если в семье присутствует мутация, предрасполагающая к раку, не у всего потомства он обязательно развивается.
Вот несколько примеров генов, которые могут играть роль в наследственных раковых синдромах — наследственные мутации в генах BRCA1 и BRCA2 приводят к синдрому рака молочной железы и яичников, онкологии поджелудочной и предстательной желез; TP53 продуцирует белок, подавляющий рост опухолей, который приводит к более высокому риску развития некоторых видов рака; мутации в гене PTEN связаны с синдромом Коудена, наследственным заболеванием, которое увеличивает риск рака молочной и щитовидной желез, эндометрии и других типов рака.
Генетические тесты могут определить, есть ли у человека с признаками ракового синдрома наследственная мутация. Эти тесты также могут показать, унаследовали ли члены семьи ту же мутацию.
Иногда кажется, что рак, не связанный с наследственными мутациями, возникает и в семьях. Действительно, общая среда или образ жизни (например, употребление алкоголя, курение) могут вызывать развитие подобных видов рака среди членов одной семьи.
— Возможна ли профилактика? Каковы ее перспективы: можно ли предупредить развитие рака?
— Обычно невозможно точно узнать, почему у одного человека развивается онкология, а у другого — нет. Исследования показали, что определенные факторы риска, такие как воздействие химических или других веществ, а также определенные типы поведения могут увеличить шансы развития рака. Они также включают неконтролируемые факторы, такие как возраст и историю семьи.
Профилактика — это комплекс мер, направленных на минимизацию факторов риска и усиление факторов защиты. Разберем основные факторы и возможные меры профилактики.
Доказано, например, что употребление алкоголя может увеличить риск развития онкологии рта, горла, пищевода, гортани, печени и молочной железы. Риск заболеть намного выше среди тех, кто пьет алкоголь и курит.
Курение, кстати, является главной причиной смерти от рака, вызывающее множество его типов, включая рак поджелудочной железы, толстой и прямой кишки и другие. Нет никакого безопасного способа использования табака.
А вот у людей, бросивших курить, независимо от их возраста, есть существенная прибавка в ожидаемой продолжительности жизни. Кроме того, прекращение курения на момент постановки диагноза рака также снижает риск смерти.
Одним из потенциальных источников воздействия ионизирующего излучения является медицинское (рентген, КТ и т. п.), а еще природный газ радон в подвалах домов. Важными стратегиями профилактики является ограничение ненужных КТ и других диагностических исследований, а также снижение доз облучения.
Эстрогены, женские половые гормоны, — известные канцерогены. Хотя эти гормоны играют важную физиологическую роль как у женщин, так и у мужчин, они также связаны с повышенным риском некоторых видов онкологии (молочной железы, эндометрии).
Поэтому женщина, которая думает о менопаузальной гормональной терапии, должна обсудить возможные риски и преимущества со своим врачом.
Исследования также показали, что риск развития рака молочной железы у женщины может быть связан с ранними менструациями, поздним наступлением менопаузы, поздней первой беременностью или решением никогда не рожать, что также связано с экспозицией половых гормонов. Роды же, напротив, являются в этом смысле защитным фактором.
Определенные возбудители инфекции также могут вызвать рак или увеличить его риск. Например, вирус папилломы человека ассоциирован с раком шейки матки, вирус гепатита С — с раком печени.
Этот факт явился основанием для разработки и внедрения вакцинопрофилактики. В частности, вакцина против вируса папилломы человека уже продемонстрировала превосходные результаты по снижению смертности от рака шейки матки.
Ученые изучили много продуктов питания на предмет увеличения или уменьшения риска рака. За редким исключением эти исследования не показали каких-либо окончательных результатов, способствует ли употребление в пищу того или иного продукта риску развития онкологии или, напротив, предотвращает этот риск.

При этом избыточное питание в целом может оказать негативное влияние. Так, у людей с ожирением повышается риск развития онкологии молочной железы, толстой и прямой кишки, матки, пищевода, почки, поджелудочной железы и желчного пузыря.
— Как обнаружить заболевание на ранней стадии, какие регулярные обследования надо проходить?
— Обнаружить рак на ранней стадии, до появления симптомов, помогают скрининговые тесты. Но важно помнить, что когда ваш врач предлагает провести скрининг, это не всегда означает, будто он думает, что у вас онкология.
Существуют разные виды скрининговых тестов. Например, осмотр пациента на предмет общих признаков и симптомов, необычных образований или проявлений, изучение истории его здоровья, перенесенных заболеваний и методов лечения.
Скрининговыми тестами также можно считать лабораторные анализы образцов тканей, крови, мочи или других веществ в организме, процедуры визуализации внутренних органов (рентгенография, УЗИ, КТ и т. д.) и генетические тесты на предмет определенных генных мутаций.
Каждый скрининг-тест имеет как преимущества, так и недостатки. Также возможны ложноположительные или ложноотрицательные результаты скрининга.
Важно, чтобы пациенты понимали преимущества и недостатки скрининговых тестов и делали осознанный выбор. Перед проведением какого-либо обследования важно обсудить это со своим врачом и вместе принять решение.
— Какие существуют новые возможности в терапии и как меняется статистика смертности?
— Новые возможности лечения далеко не единственный фактор, который влияет на статистику смертности. Недавно были опубликованы результаты наблюдения показателей и тенденций развития рака в США за период с 1991 по 2016 год.
В течение 25 лет смертность от рака снизилась на 27% с неуклонным ежегодным показателем падения примерно в 1,5% после своего пика в 1991 году (215,1 случая смерти на 100 тысяч).
Снижение смертности от рака за последние десятилетия в США явилась в первую очередь результатом неуклонного сокращения курения, популяризации здорового образа жизни, а также успехов в раннем выявлении и лечении.
Социально-экономическая обстановка также имеет колоссальное влияние. Так, в США жители малообеспеченных округов испытывают существенные проблемы с наиболее предотвратимыми раковыми заболеваниями.
Например, смертность от рака шейки матки среди женщин в бедных округах в США вдвое выше, чем среди женщин в обеспеченных. Похожая статистика у мужчин: смертность от рака легких и печени более чем на 40% выше среди мужчин, живущих в бедных округах, по сравнению с сильным полом в обеспеченных округах.
В России же в 2017 году от рака умерли 26 506 больных (в два раза больше чем в 2005 году), не состоявших на учете в онкологических учреждениях. Доля больных, умерших в течение первого года после установления диагноза, составила 22,5%, при этом при снижении среднероссийского показателя в ряде регионах динамика отрицательная.
Все это говорит о неудовлетворительном состоянии прежде всего диагностики, включая ранней, и по-прежнему, свидетельствует о необходимости разработки и внедрения эффективной национальной онкологической программы.
— Что такое таргетная терапия, как она работает? Почему лечение убивает опухоль, а не здоровые клетки?
— Таргетная терапия в онкологии зарекомендовала себя весьма эффективным и перспективным методом лечения. Основа такого подхода —целенаправленное воздействие на определенные мишени, которыми наделены именно клетки опухоли.
В отличие от химиотерапии таргетная действует сугубо на ткань новообразования, практически не оказывает влияния на другие органы, поэтому и вероятность побочных и токсических эффектов сведена к минимуму, а эффективность при этом сопоставимая и даже превосходящая.
— Может ли возникнуть у новообразований устойчивость к препаратам?
— Может. Происходит это потому, что раковые клетки способны продолжать мутировать, становясь все более и более ненормальными. При этом некоторые мутации делают клетки устойчивыми к лекарственному лечению.
Если это происходит, врач назначает другую схему терапии. К сожалению, иногда опухоль развивает устойчивость ко многим препаратам одновременно. Врачи называют это множественной лекарственной устойчивостью.
— В каких случаях и почему рак возвращается?
— Спустя какое-то время после терапии онкология может вернуться, чему есть много причин. Одна из них заключается в том, что первоначальное лечение не избавило от всех раковых клеток и оставшиеся превратились в новую опухоль.
Некоторые раковые клетки могли остаться после операции, а некоторые уже оторвались от первичной опухоли, но были слишком маленькими, чтобы их можно было увидеть (микрометастазы).
Хирурги делают все возможное, чтобы удалить весь рак во время операции. Но всегда есть риск, что клетки останутся. Поэтому может быть рекомендована дополнительная терапия, направленная на предотвращение рецидива и контроля микрометастазов.
Если пациент остается в полной ремиссии в течение пяти лет или больше, некоторые врачи могут сказать, что он вылечен. Для большинства раковых образований рецидивы происходят в течение первых пяти лет после лечения.
Однако некоторые раковые клетки могут остаться в теле много лет после лечения. И существует риск, что рак вернется позже. Поэтому рекомендуется многолетнее наблюдение у врача.
— Возможно ли полное восстановление организма после лечения?
— Возможно. Каждый пациент с нетерпением ожидает того дня, когда доктор скажет, что лечение, наконец, завершено. В этот момент начинается новый важный этап.

С тех пор как Ричард Никсон официально объявил войну с раком посредством подписания Американского противоракового закона, более ста миллиардов долларов из средств налогоплательщиков было потрачено на исследования и разработку лекарств в попытке уничтожить болезнь, триллионами больше потратили сами больные, но результаты остаются неутешительными.
Может, это грандиозное поражение отражает тот факт, что природа рака была истолкована в корне неверно, а вместе с тем ошибочны и наши попытки предотвратить или вылечить его?
Итак, вопрос, на который заново должен быть дан ответ: что такое рак?
Тогда действительно ли в основе превращения здоровой клетки в раковую лежит случайность и хаос? Опухолевые клетки, в конце концов, проявляют высоко организованное поведение, поэтому кажется невозможным тот факт, что их стимулируют такие совершенно случайные силы, как мутация…
Раковые клетки (опухоли или новообразования), например, способны построить собственную систему кровоснабжения (ангиогенез), способны защитить себя сайленсингом подавляющих рак генов и активацией генов-инициаторов опухолей, выделением ферментов агрессии, чтобы свободно перемещаться по всему организму, они способны изменять свой метаболизм, чтобы жить в среде с низким содержанием кислорода, высоким содержанием сахара и повышенной кислотностью, а также знают, как удалить свои собственные поверхностные рецепторы, чтобы избежать обнаружения лейкоцитами.
Случайные мутации, несомненно, играют важную роль в инициации и стимулировании рака, но только их одних не достаточно для полноценного объяснения.
Рак как древняя программа выживания
Выдающаяся теория, представленная учёным из государственного университета Аризоны Полом Дэвисом и учёным из Австралийского национального университета Чарльзом Линевивером, поможет пролить столь необходимый свет на истинную природу рака.
Без высокодифференцированных клеток и специализированных органов высших многоклеточных (многоклеточные 2.0), клетки с генетикой многоклеточных 1.0 обладали бы полезными свойствами, которые позволили бы им выжить при прямом контакте с тем, что представляло бы совершенно иную, более жёсткую (для нас) окружающую среду.
Например, миллиард лет назад уровень кислорода в атмосфере был чрезвычайно низким, так как ещё не сформировался фотосинтез, чтобы производить его обильный запас. Это означает, что клеточной жизни в то время пришлось бы учиться развиваться в окружающей среде с низким содержанием кислорода или вообще в бескислородной среде – именно это и делают раковые клетки, используя аэробный гликолиз для выработки энергии вместо окислительного фосфорилирования.
Дэвис и Линевивер кратко изложили своё мнение следующим образом:
Не забывайте, эта древняя совокупность клеток не имела такой дифференциации клеточного типа и специализации тканей, как у высших животных (т.е. кожи, волос, ногтей и др.), для защиты от пагубного воздействия окружающей среды.
В рамках этого нового способа мышления рак больше не может рассматриваться как некоторый предопределённый ген-бомба замедленного действия, заложенный в нас, или просто как побочный продукт кумулятивного воздействия на генотоксичные вещества.
Cкорее всего, рак – это древняя реакция выживания во всё более токсичной среде, с ненатуральным питанием и ослабленным иммунитетом. Эти клетки научились выживать при постоянных чрезмерных нагрузках, осуществляя постоянное самовосстановление (репликацию) и следуя принципу: всё, что не убивает, делает тебя сильнее.
Рак больше не может рассматриваться как что-то плохое, происходящее внутри здорового организма. Рак является тем, что организм активно предпринимает в ответ на нездоровую клеточную, физическую и планетарную среду. Вместо выражения физического отклонения от нормы, он может быть выражением физического интеллекта и способности наших клеток к выживанию в условиях, которые угрожают разрушить их до такой критической отметки, за которой выживание невозможно.
Это также проливает свет на разрушительный характер химио- и лучевой терапии. Опухоли содержат широкий спектр клеток, многие из которых, по сути, являются доброкачественными (никогда не причинят вред организму), а некоторые из них ещё и сдерживают более вредоносные клетки.
Инвазивные клетки более исконны в своей генетической конфигурации (многоклеточные 1.0) ввиду того, сколько повреждений им приходится переносить в течение их жизненного цикла. Именно эти клетки, которые наиболее устойчивы к химиотерапии, реже умирают при воздействии на них. Следовательно, химиотерапия и лучевая терапия убивают клетки, которые на самом деле не представляют угрозы.
Рак – симптом, а не болезнь
По сути, мы должны переключить наше мышление с той точки зрения, что рак является чем-то неестественным, что происходит с нами, на ту, где мы видим, что рак является вполне естественной реакцией нашего организма, чтобы выжить в неестественных условиях. Измените эти условия к лучшему, и от этого вы получите гораздо больше пользы, чем от борьбы с раком, как с врагом.
Они либо забыли, как пройти запрограммированную смерть (апоптоз), или были вынуждены из-за травмы (генетического нарушения) или экологической нагрузки (эпигенетического изменения) подавить гены, которые позволили бы им умереть.
Раковые клетки, по сути, скопированы с древнего генетического инструментария, который их предшественники более миллиарда лет назад использовали, чтобы выжить в очень суровых условиях, и где репликация была гораздо более предпочтительным свойством, чем смерть.
| Текущее время: 20-07, 02:52 |
Часовой пояс: UTC + 3 часа
Трофобластическая теория рака
Трофобластическая теория рака
Альтернативные методы лечения
[AD]
Доказательства, приводимые доктором Кребсом в поддержку своего мнения, впечатляют. Несколько веков назад мы употребляли в пищу богатый витамином В17 просяной хлеб, но сейчас мы предпочитаем белый хлеб, который его не содержит. Когда-то наши бабушки старательно толкли в ступе семена слив, изюма, зеленого винограда, вишен, яблок, абрикосов и другие семена и добавляли толченый порошок в свои варенья и консервирования. Бабушка не знала, зачем она делает это, но семена этих фруктов являются самым мощным источником витамина В17 в мире. В тропиках большие количества витамина находятся в кассаве, известной еще как маннок. Когда мы ели эту еду в последний раз?
Независимые исследования также показали, что некое племя на Гималаях, по имени Хунза, никогда не встречалось с раком до тех пор, пока их родная диета была особенно богата просом и абрикосами. Однако, как только они столкнулись с западной диетой, они стали такими же уязвимыми, как и мы.
Лаэтрил Доктора Кребса был получен из абрикосовых косточек и затем синтезирован в форму кристалла на основе своих собственных уникальных процессов. Но внезапно FDA засыпала прессу историей о несчастной паре из Сан-Франциско, который отравились, поедая сырые абрикосовые косточки. По всей Америке эта история была на первых полосах. Несколько журналистов, занимавшихся этим вопросом, так и не смогли идентифицировать несчастную парочку. Но дело было сделано. С тех пор употребление Витамина В17 или абрикосовых косточек прочно стало ассоциироваться с самоубийством.
Еще в 50-х Кребс доказал, что В17 совершенно безвреден для людей.
Проверив витамин на животных, он наполнил свой шприц мегадозой и ввел себе в вену. После этого ещё много лет он пребывал в добром здравии.
Следовательно, цианид освобождается только в раковых участках тела с поразительными результатами, губительными для раковых клеток, потому что бензальдегид тоже освобождается в то же самое время. Это смертельный яд по своим свойствам, но в сочетании с цианидом он становится еще в 100 раз смертельнее. Производимый ими эффект на раковые клетки можно предоставить воображению.
Вы спросите — а есть ли опасность для остальных, здоровых клеток тела?
Другой энзим, роданез, всегда присутствующий в здоровых клетках в больших количествах, чем энзим-ключ бета-глюкозидазы, имеет способность преобразовывать и цианид, и бета-глюкозидазу в полезные продукты для тела. Вероятнее всего, что раковые клетки вообще не содержат роданеза и оставлены на произвол действия цианида и бензальдегида.
«В своей речи на банкете в Сан-Франциско 19 ноября 1967 Доктор Эрнст Т. Кребс дал краткое обозрение шести подобных случаев. Затем он добавил: И теперь существует преимущество не подвергаться предшествующему облучению, поскольку если вы не подвергались облучению, которое прошло безуспешно, вы и не сможете насладиться воображаемой выгодой от задержанных эффектов этого облучения. Поэтому этот парень попадает в категорию „спонтанная регрессия“.
Всего лишь несколько месяцев назад австралийское телевидение сообщило информацию, что двое из троих австралийцев в своей жизни, по крайней мере, раз будут страдать от рака кожи. Веские доказательства, предоставленные доктором Кребсом и Гриффиным, могут свести количество больных к мизерному проценту, если австралийцам предоставят свободу выбора относительно Лаэтрила. Для австралийцев настало время сделать свой выбор в этом жизненно важном вопросе.
Данные положения и определения не прошли официальные утверждения FDA (Управление по контролю над продуктами и лекарствами США), либо других государственных медицинских структур и организаций. Информация предоставлена здесь только для рассмотрения и не может быть использована для диагностирования, лечения или предотвращения болезни. Информация, предоставленная здесь, не может официально заменить профессиональное медицинское обслуживание, консультации и лечение.
Читайте также:

