Трансплантация гемопоэтических стволовых клеток острый лейкоз
Лейкемия и трансплантация стволовых клеток. Трансплантация стволовых клеток излечивает лейкоз!
Терапии рака (химиотерапия, лучевая терапия и т.д.) могут повредить или уничтожить нормальные клетки крови и костного мозга. Цель химиотерапии - уничтожение раковых клеток, но многие химиотерапевтические препараты нанесят вред быстро делящимся клеткам, особенно такие как кроветворные стволовые клетки костного мозга. Однако большие дозы химиопрепаратов, необходимых для лечения лейкемии, эффективно убивают раковые клетки в крови. Так что же можно сделать для того, чтобы победить рак и сохранить жизнь пациента?
Врачи начали решать эту проблему путем проведения трансплантации стволовых клеток (SCT) более 20 лет назад. Стволовые клетки кроветворных клеток костного мозга непрерывно делятся, для формирования новых клеток крови, которые поступают в артерии и вены. Процедура пересадки стволовых клеток позволяет врачам дать химиотерапию и лучевую терапию в дозах, которые достаточно сильны, чтобы ликвидировать лейкозные клетки но и дать возможность пациенту быстро восстановить собственный иммунитет. Поврежденный костный мозг затем пополняется за счет пересадки стволовых клеток, которые могут изготовить необходимые новые клетки крови.
Стволовые клетки для трансплантации могут быть собраны из различных источников:
* Аспирация стволовых клеток костной жидкости непосредственно из костного мозга в задней части бедра;
* Лейкаферез (также известно как аферез), выделение лейкоцитов в крови из кровотока и их активирование
* Клетки пуповинной крови (стволовые клетки, полученные из пуповинной крови).
В клинике Топ Ихилов с участием отделения СТС - центра клеточной иммунотерапии терапии рака под управлением профессора Славина, практикуется трансплантация стволовых клеток, взятых у родственного донора (родители, братья, дети после 18 лет), у неродственного донора (из Израильской базы или Европейской базы данных), а также трансплантация собственных активированных лейкоцитов крови и стволовых клеток, взятых у пациента до проведения курсов химиотерапии и облучения, очищенных от раковых клеток и размноженных для трансплантации.
Стоит заметить, что подобная процедура практикуется в рамках инновационного лечения иммунотерапии рака только в нашем центре в Израиле и показывает высокие результаты не только в лечении рака, но и ряда других иммунных заболеваний.
Виды трансплантаций
Трансплантации стволовых клеток классифицируются как аутогенные или аллогенные, основанные на характеристиках доноров.
Основной ролью аутологичной трансплантации костного мозга является восстановление кроветворения после химиотерапии, что позволяет многократно увеличивать разовые дозы некоторых противоопухолевых препаратов. Это дает возможность усиливать противоопухолевый эффект и достигать более высокой безрецидивной выживаемости в сравнении с результатами стандартной химиотерапии.
- Autologous SCT - Аутологичная трансплантация костного мозга ( autologous bone marrow transplant - autoBMT) - это процедура, в которой собственные гемопоэтические стволовые клетки пациента (незрелые клетки, из которых образуются все клетки крови) выделяются из костного мозга. Этот вид трансплантации не часто используется, потому что очень трудно гарантировать, что нормальные стволовые клетки были отделены от лейкозных клеток, даже после очистки .
- Другая форма аутологичной трансплантации костного мозга является трансплантация стволовых клетокиз периферической крови , или лейкаферез. Кровь пациента проходит через машину, которая отделяет стволовые клетки, а затем возвращает их в кровь пациента. Эта процедура обычно занимает от 3 до 4 часов. Стволовые клетки хранятся до окончания химиотерапии и облучения, затем возвращаются обратно в организм пациента. Лейкаферез могут быть выполнен как самостоятельная процедура, так и с autoBMT, хотя большинство врачей предпочитают использовать лейкафереза сам по себе.Процедура довольно проста и недорога.
- Аллогенная трансплантация стволовых клеток, также известный как аллогенная трансплантация костного мозга (alloBMT), является одной из форм пересадки стволовых клеток, при которой стволовые клетки получают от донора, у которого тип ткани близко соответствует типу ткани пациента (HLA) . Таким донором обычно становится родственники (брат, сестра, ребенок) или, иногда, неродственные доноры. Аллогенная трансплантация обычно применяется для лиц, моложе 55 и которые имеют совместимого донора в семье - то есть, доноров с совместимыми лейкоцитарным антигеном (HLA) - белка, обнаруженного на поверхности некоторых клеток, таких как лейкоциты). Аллогенные клетки донора на самом деле могут помочь в борьбе лейкозных клеток, поскольку они инициируют ответ, известный как " реакция трансплантат против хозяина" .
Трансплантация стволовых клеток производится пациентам в изолированных палатах больницы, пока их общая белых кровяных клеток (WBC) кол выше 500. В течение этого времени, пациенты получает поддерживающую терапию, такие как внутривенное питание, лечение с антибактериальными и противогрибковыми препаратами, и переливания эритроцитов и тромбоцитов. В течение 2 до 3 недель, стволовые клетки приживаются в организме пациента и после этого периода начинают творить белые клетки крови (лейкоциты). Далее, начинается выработка тромбоцитов, а затем через несколько недель - производство красных кровяных телец (эритроцитов).
Как только количество лейкоцитов подходит к 1000, пациент в целом может быть выписан из больницы. Ежедневные амбулаторные осмотры могут быть назначены в течение нескольких недель, а затем регулярные встречи в течение 6-месячного периода. Онколог, как правило, пригласит на полное обследование через 1 год после лечения, раннее исследование производится только тогда, когда симптомы возвращения.
Осложнения после трансплантации стволовых клеток.
Побочные эффекты, связанные с аллогенной трансплантацией стволовых клеток, могут произойти вскоре после лечения, или же они могут развиваться значительно позже. Стоит заметить что при аутогенной трансплантации многие отрицательные эффекты отсутствуют, в частности, реакция "трансплантант против лейкоза". Ранние осложнения обычно связаны с вредом, причиненным высокими дозами химиотерапии и лучевой терапии (например, временная потеря волос, анемия, лейкопения, тромбоцитопения, желудочно-кишечные симптомы, такие как тошнота, рвота и диарея).
Долгосрочные или хронические осложнения могут включать в себя :
* Хроническая реакция "трансплантат против хозяина" или РТПХ, которая может развиться после 100 дней. Это аутоиммунное заболевание развивается, когда стволовые клетки донора производят иммунные клетки, которые атакуют ткани кожи пациента, кишки, полости рта, половых органов и других органов. Типичные особенности включают сухость во рту и глазах, изменения кожи, такие как утолщение волос, выпадение волос, сухость и сыпи; усталость, мышечные боли и слабость, инфекции.
* Необратимое бесплодие у мужчин и женщин, которые получили общее облучение тела (TBI) или высокие дозы бусульфан химиотерапии. Женщины будут испытывать радиационно-индуцированную менопаузы и потребуется гинекологическое наблюдение после первых 100 дней. Заместительная гормональная терапия необходима будет в пременопаузе.
* Эндокринные (гормональные) сбои в работе системы, особенно щитовидной железы. Гипотиреоз (низкая активность щитовидной железы) часто происходит, поэтому регулярное обследование щитовидной железы необходимо после любого лечения рака.
* Токсичность к остного мозга (яды или токсины), особенно, когда проявляется как asceptic некроз - гибель клеток костного мозга без инфекции. Тяжелые поражения кости и / или повреждения суставов могут потребовать хирургической замены.
* Респираторные симптомы и нарушения (например, затрудненное дыхание) из-за повреждения легких, связанных с радиацией.
* Катаракта, аномалия хрусталика глаза, которое блокирует свет и ухудшает зрение.
* Тромботических микроангиопатии (TM), свертывания крови в мелких кровеносных сосудах, условие, которое включает гемолитический уремический синдром (ГУС, кровавая моча) и тромбоцитопеническая пурпура (ТТП; пурпурно обесцвечивание кожи, вызванное внутренним кровоизлиянием, связанные с низким количеством тромбоцитов ). ТМ имеет несколько причин и, к сожалению, часто не реагируют на терапию.
* Возникновение второй злокачественной опухоли. У больных после ТГСК увеличен риск возникновения второй опухоли (лимфома, лейкоз, опухоль головного мозга, меланома, рак печени, остеогенная саркома, рак щитовидной железы), что связано с применением химиотерапии, облучения и иммунодепрессантов.
Вероятность развития второй опухоли больше у пациентов, возраст которых был менее 30 лет на момент ТГСК и увеличивается параллельно длительности жизни после ТГСК (трансплантации гомопоэтических стволовых клеток).
Трансплантация стволовых клеток считается методом выбора в случае прогностически неблагоприятных острых лейкозов в первой ремиссии, во второй и всех последующих ремиссиях острых гемобластозов и при неполных ремиссиях, когда бластоз в костном мозге составляет не более 20%.
Решение о проведении трансплантации стволовых клеток принимает либо пациент лично, либо его близкие.
Стволовые клетки - это невызревшие клетки-предшественницы гемопоэза, впоследствии развивающиеся в лейкоциты, эритроциты и тромбоциты.
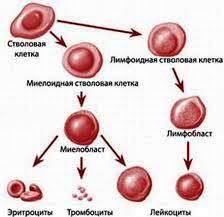
До относительно недавнего времени пересадка гемопоэтических стволовых клеток рассматривалась сугубо в контексте трансплантации костного мозга, так как он долго был единственным источником этих элементов. Сейчас их по-прежнему получают из костного мозга, но также из пуповинной или периферической крови.
Существует два вида трансплантации гемопоэтических стволовых клеток:
Аутологичная пересадка, включает в себя предварительный этап забора материала самого пациента, хранение полученной массы в замороженном виде, её специальную обработку и вливание больному уже после проведения высокодозной химиотерапии или облучения.
Стволовые клетки забираются обычно в период полной клинико-гематологической ремиссии, когда имеет место нормализация объективной клинической картины продолжительностью не менее одного месяца, а в миелограмме обнаруживается не более чем 5% бластов и до 30% лимфоцитов. В этом случае вполне можно рассчитывать на восстановление гемопоэза.
Недостатком такой аутологичной трансплантации является более высокая вероятность рецидива бластоза, по сравнению со вторым вариантом – аллогенной пересадкой.
Аллогенная трансплантация - требует наличия родственного или неродственного донора, гистосовместимого (тканесовместимого) с пациентом по HLA-системе.
В качестве родственного донора в основном выступают родные братья или сёстры, а иногда родители или другие кровные родственники (тёти, дяди, кузены). Как бы то ни было, поиск донора начинают с ближайших родственников, а уже затем осуществляют (кстати, не так и редко) типирование и более дальних родственников пациента. Если подходящего донора таким образом найти не удаётся, поднимается вопрос о штудировании базы данных.
Вне зависимости от того, взят материал от родственного или неродственного донора, сама процедура трансплантации, по сути, одна и та же. Сначала производится забор кроветворных стволовых клеток донора, которые затем, в основном без этапа заморозки, в течение одних суток после изъятия внутривенно вводятся пациенту онкогематологического отделения.
Восстановительный период длится намного дольше, чем госпитализация, для проведения трансплантации. В течение нескольких месяцев пациент должен оставаться под постоянным пристальным наблюдением медицинского персонала. Он также продолжает получать достаточно интенсивное лечение, например, препараты для профилактики отторжения и переливания крови.
Необходимо регулярно (несколько раз в неделю) посещать медицинский центр, в котором была произведена трансплантация, выполнять профилактические обследования.
По-прежнему необходимы меры предосторожности, направленные на профилактику инфекций. При малейших признаках развития инфекционного заболевания необходимо незамедлительно прибыть в медицинский центр.
Костный мозг человека обладает уникальными свойствами, формирующими иммунитет. В нем создаются эритроциты, осуществляется гемопоэз. Орган представлен жидким состоянием, располагается внутри тазовых костей, в грудной клетке, черепе и трубчатых костях. Состоит из стромы.
В костном мозге содержатся стволовые клетки, которые отвечали за формирование органов в период зарождения эмбриона. Они не способны делиться в теле взрослого человека, но в случае поражения органов и систем устраняют патологические процессы, атакуя болезнетворные и чужеродные организмы. Пересадка стволовых клеток актуальна для людей с отсутствием иммунитета при лейкозах или иммунодефицитах.
Лейкоз – онкологический процесс, вызванный бластными незрелыми клетками, которые заменяют здоровую кровь. При нём развивается воспаление внутренних органов, метастазы распространяются по телу. Человек отмечает высокую температуру, снижение массы тела, слабость и сонливость. Патологический процесс приводит к необратимым последствиям в работе организма.

Миелобластный вид заболевания поражает следующие органы:
- Ткань лёгких. Пациент отмечает затяжной кашель на фоне высокой температуры.
- Головной мозг. Развивается менингит с характерными болями, ломотой в теле и эпилептическими припадками.
- При поражении почек возникает частичная либо полная задержка мочи.
- Кожа покрывается розовой или коричневой сыпью.
- Печень выпирает над уровнем брюшной полости. Становится плотной и болезненной.
- Метастазы в кишечнике провоцируют диарею, метеоризм и острые боли.
Для лимфобластного лейкоза характерны:
- Воспаление лимфоузлов и селезёнки.
- Развитие кашля, одышки, боли в органах желудочно-кишечного тракта.
Трансплантация костного мозга восстанавливает необходимый кроветворный процесс для нормальной жизни человека.
Практика применима для лечения ВИЧ-позитивных больных. Находится на экспериментальной стадии, но уже показала отличные результаты.
Зачем нужна процедура по пересадке костного мозга
При развитии тяжёлых онкологических патологий, когда организм человека перестает самостоятельно бороться с раковыми процессами, к примеру, при остром лейкозе, данная процедура рекомендована к проведению. Такая практика широко распространена в онкогематологии.
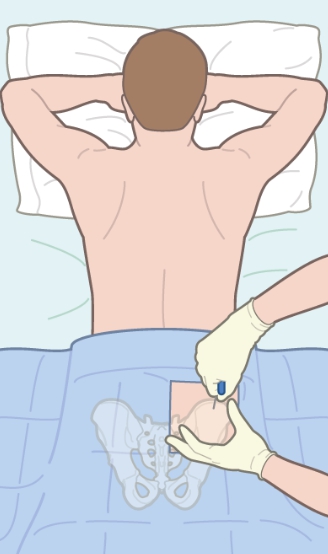
Метод применяется к следующим заболеваниям:
- Хронический лейкоз.
- Нарушения в плазме крови.
- Лимфомы.
- Лейкемия ювенильная.
- Апластическая анемия.
Пересадка костного мозга при лейкозе выполняется в качестве полной его замены или частичной. В последнем случае кроветворные элементы вводят в кровь пациента после лучевых и химиотерапий, когда собственный костный мозг не перестаёт функционировать.
Трансплантация происходит тремя способами:
- В период ремиссии у больного проводят забор собственных клеток, которые замораживаются и хранятся до необходимого момента. Метод, при котором вводятся родные элементы, называется аутологическим.
- При аллогенной методике пациент получает клетки кровных родственников или постороннего донора. Осложнения для проведения заключаются в отсутствии подходящего материала. Поиски донора могут отнимать много времени.
- Если забор стволовой клетки проводили у близнеца, способ называют сингенный. Метод эффективен, поскольку костный мозг близнецов состоит из идентичного генетического материала.
Для проведения процедуры назван ряд показаний и противопоказаний. Лечение с помощью пересадки гемопоэтических клеток актуально при анемиях, лимфобластном лейкозе, иммунодефицитах и заболеваниях, нарушающих естественный кроветворный процесс.
Метод не применяют при процессе разрушения тромбоцитов, при выраженных недостаточностях печени, почек и сердечно-сосудистой системы. Игнорируется острый период инфекционных заболеваний (туберкулёз) и если атипичная клетка не реагирует на лечение химиотерапией.
Трансплантацию стволовых клеток делают при лечении основной проблемы крови или после влияния на организм ионизирующего излучения и химиопрепаратов.
Переливание эффективно при первой ремиссии миелобластного лейкоза или при второй и третьей ремиссии лимфобластного острого лейкоза.
Особенности проведения процедуры в детском возрасте
У детей трансплантацию костного мозга проводят исходя из тех же диагнозов, что у старшего поколения. Рак крови в детском возрасте встречается в 3 раза реже, чем у взрослых. Ребёнку предоставляют должный сестринский уход в до- и послеоперационный период. Лечением занимаются онкогематолог и эрготерапевт. Действия второго направлены на помощь в адаптации пациента к нормальной жизни.
Прогноз на жизнь зависит от возраста пациента, патологических процессов в организме, работоспособности внутренних органов и по степени схожести генетического материала донора с больным человеком.
Наилучшие результаты отмечаются, если донор – родственник. Для роли спасителя хорошо подходит однояйцевый близнец. Биологический материал родителей редко используется для пересадки.
Заболевание поддаётся полному излечению при острой и хронической форме лейкоза. Может потребоваться систематическое введение донорского костного мозга на протяжении всей жизни.
Диагностические исследования до пересадки
Операция наносит удар по всем системам организма. Человек должен быть подготовлен и обследован до начала проведения процедуры. Врачи назначают ряд инструментальных и лабораторных диагностик:

- Биохимический и общий анализ крови показывают наличие воспалительных процессов и работоспособность внутренних органов.
- Иммунологические тесты.
- Гистология костного мозга.
- Ультразвуковая диагностика органов брюшной полости.
- Магнитно-резонансная, компьютерная и позитронно-эмиссионная томографии позволяют оценить состояние всех органов и систем, обнаружить метастазы.
- Рентген грудной клетки.
Как подбирается донор
Вначале проверяют на совместимость всех кровных родственников. Обычно донор находится среди них. Родители подходят в редких случаях. Если возможность использовать родственный костный мозг не представлена, пациент прибегает к услугам постороннего человека, имеющего не меньше 35% сходства с HLA-типом больного.
Критерии отбора донора:
- Возрастная категория от 18 до 50 лет.
- Отсутствие шизофрении, умственной отсталости, аутизма и других психических патологий.
- У донора не должно быть глютеновой болезни, ревматоидного артрита и прочих аутоиммунных заболеваний.
- Противопоказан забор материала у людей с вирусными гепатитами, туберкулезом, ВИЧ и СПИД.
Пуповинная кровь, взятая при рождении ребёнка, содержит необходимые стволовые клетки для борьбы с раком крови. В нашей стране создаются банки пуповинной крови, метод только набирает популярность. Проблемы при пересадке таких клеток возникают в случае недостаточного количества биоматериала.
Подготовка к пересадке и техника проведения
На первом этапе врачи провоцируют полное уничтожение раковых клеток с помощью максимально допустимого объёма химиопрепаратов. При этом значительно страдает иммунитет человека. В течение времени, пока новые кроветворные клетки не будут введены и не приживутся, человек лишается защитных функций организма. Возможно независимое вмешательство патогенных организмов. Могут развиться опасные последствия в виде инфекционных заболеваний, поэтому для содержания больного используют стерильные условия.
Для введения стволовых клеток используется система для переливания крови. Гемоцитобласты самостоятельно добираются до нужного места, приживаются и начинают продуцировать здоровые эритроциты. Биоматериал вводят в шейную артерию с помощью катетера Хикмана.
Вмешательство не требует особых навыков и условий. Обезболивается место введения катетера. Процедура занимает не больше часа.
Процесс приживления проходит в течение следующего месяца. Регулярно проводятся анализы крови для обнаружения новых кровяных телец.
Всегда остаётся риска развития осложнений. Статистика показывает, что чаще развиваются следующие явления:
- Трансплантируемый материал воспринимает клетки организма как атипичные. Такое явление окончательно уничтожает раковые клетки. Пациент может умереть, однако созданы специальные препараты для предотвращения проблемы.
- Организм не распознаёт новый костный мозг и отторгает его.
- Во время отсутствия иммунитета больной получает внутривенное питание. Может развиться сильнейшее воспаление слизистой оболочки кишечника.
- Аллергическая реакция на чужеродный материал.
- Летальный исход отмечается в половине случаев пересадки донорского мозга.
Прогноз на жизнь после приживления трансплантируемых клеток составляет 98%. Через год кроветворная система возвращается к нормальному режиму и формирует собственный иммунитет.
Человек, победивший лейкоз, должен систематически сдавать анализы крови и проходить осмотры онкогематолога. Необходимо улучшить качество жизни с помощью отказа от алкоголя, никотина и вредных пищевых привычек.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Общая стратегия лечения острого миелобластного лейкоза
В современной гематологии терапию лейкозов, в том числе и острого миелобластного, необходимо проводить в специализированных стационарах по строгим программам. Программа (протокол) включает перечень необходимых для диагностики исследований и жёсткий график их проведения. После завершения диагностического этапа пациент получает лечение, предусмотренное этим протоколом, с жёстким соблюдением сроков и порядка элементов терапии. В настоящее время в мире существуют несколько ведущих исследовательских групп, анализирующих диагностику и лечение острого миелобластного лейкоза у детей в мультицентровых исследованиях. Это американские исследовательские группы CCG (Children's Cancer Group) и POG (Pediatric Oncology Group), английская группа MRC (Medical Research Council), немецкая группа BFM (Berlin-Frankfurt-Miinster), японская CCLG (Children's Cancer and Leukemia Study Group), французская LAME (Leucamie Aique Mycloi'de Enfant), итальянская AIEOP (Associazione Italiana Ematologia ed Oncologia Pediatric) и др. Результаты их исследований - основные источники современных знаний о диагностике, прогнозе и лечении острого миелобластного лейкоза у детей.
Основная цель лечения - эрадикация лейкемического клона с последующим восстановлением нормального гемопоэза.
Первый этап - индукция ремиссии. Для прогноза важна оценка чувствительности к терапии после проведения индукционного курса. Окончательную оценку, согласно большинству протоколов, проводят после двух курсов лечения.
Постремиссионная терапия должна состоять не менее чем из трёх блоков. Это может быть только химиотерапия или химиотерапия с последующей аутологичной или аллогенной трансплантацией гемопоэтических стволовых клеток. Некоторые терапевтические режимы включают поддерживающую терапию. Важный элемент - профилактика и лечение поражений ЦНС путём интратекального введения цитостатических препаратов, системной высокодознои терапии, а иногда и краниального облучения. Основной препарат для интратекальной терапии при остром миелобластном лейкозе - цитозин-арабинозид, в некоторых протоколах дополнительно используют преднизолон и метотрексат.
Современная терапия острою миелобластного лейкоза должна быть дифференцированной, т.е. различной по интенсивности (а значит, и по токсичности) в зависимости от группы риска. Кроме того, лечение должно быть настолько специфичным, насколько это возможно.
Терапия индукции
Цитотоксическая терапия острого миелобластного лейкоза вызывает транзиторную, но тяжёлую миелосупрессию с высоким риском инфекций и геморрагических осложнений. Спектр цитостатических препаратов, эффективных в отношении острого миелобластного лейкоза, достаточно невелик. Базовые препараты - цитозин-арабинозид, антрациклины (даунорубицин, митоксантрон, идарубицин), этопозид, тиогуанин.
В 1989-1993 годах группа CCG провела исследование 589 детей с острым миелобластным лейкозом. Исследование показало преимущество индукции в режиме интенсивного тайминга. Суть этого режима в том, что больные получают индукционную терапию, состоящую из двух одинаковых 4-дневных курсов с интервалом 6 дней. Каждый курс лечения включает цитозин-арабинозид, даунорубицин, этопозид и тиогуанин. Необходимость повторения курса лечения строго через фиксированный интервал, независимо от показателей гемопоэза, обусловлена тем, что леикемические клетки, которые находились во время первого курса вне митотической фазы, войдут в неё ко времени начала второго курса и подвергнутся цитотоксическому воздействию химиопрепаратов. Преимущество интенсивного тайминга в достоверном увеличении EFSc 27% у больных, получавших ту же терапию в стандартном режиме, до 42%. В настоящее время группа CCG опубликовала данные о пилотном исследовании индукции интенсивного тайминга с использованием идарубицина, показаны преимущества этого препарата в терапии индукции у детей.
Группа MRC в исследовании AML-9 (1986 год) показала преимущества продлённой терапии индукции (5-дневную индукцию с применением даунорубицина, цитозин-арабинозида и тиогуанина сравнивали с 10-дневной). Несмотря на более высокий уровень смертности от токсичности (21 против 16%), уровень достижения ремиссии был выше в группе продлённой терапии. Следующее исследование этой группы - AML-10 - включало 341 ребёнка. Индукционная терапия в AML-10 была основана на стандартных дозах цитозин-арабинозида и даунорубицина с добавлением трегьего препарата - этопозида или тиогуанина, в зависимости от группы рандомизации. Индукция в AML-12 (в исследование включены 529 детей) состояла из схемы ADE (цитозин-арабинозид + даунорубицин + этопозид), в другой группе рандомизации - из схемы АМЕ (цитозин-арабинозид + митоксантрон + этопозид). Ремиссия в обоих исследованиях составила 92%, смерть в индукции и резистентные острые миелобластные лейкозы - по 4%. Уровень ремиссии в обеих ветвях протокола AML-12 (ADE и АМЕ) был практически одинаковым - 90 и 92%. В начале 1990-х годов DFS при остром миелобластном лейкозе увеличилась с 30 до 50%; с 1995 года (протокол AML-12) значение данного показателя составляет 66%.
Индукция по протоколу исследовательской группы LAME состоит из стандартных доз цитозин-арабинозида и митоксантрона (суммарная доза 60 мг/м 2 ), ремиссия достигнута у 90% больных.
В России наиболее хорошо известны протоколы группы BFM. До 1993 года индукционная терапия состояла из курса ADE (цитозин-арабинозид + даунорубицин + этопозид). Согласно протоколу AML-BFM-93 (исследование включает 471 ребёнка), индукционная терапия в одной группе рандомизации была прежней - ADE, в другой группе - состояла из цитозин-арабинозида, этопозида и идарубицина. Уровень достижения ремиссии среди всех пациентов составил 82,2%. Показано, что введение идарубицина достоверно увеличило редукцию бластов у пациентов к 15-му дню от начала индукционной терапии, однако это не повлияло на частоту досгижения ремиссии и DFS, которая в этих группах была сходной.
Постиндукционная терапия
Большинство протоколов в качестве постремиссионной терапии предполагает два или более курса цитостатиков. Как правило, не менее одного курса полихимиотерапии основано на высоких дозах цитозин-арабинозида (1-3 г/м 2 в одно введение). Дополнительные препараты - этопозид и/или антрациклины (идарубицин или митоксантрон).
Наиболее успешны протоколы, предусматривающие три постремиссионных блока химиотерапии, часть которых проводят в режиме интенсивного тайминга и/или с использованием высоких доз цитозин-арабинозида.
Трансплантация гемопоэтических стволовых клеток
Современная терапия острого миелобластного лейкоза предусматривает для определённых категорий пациентов трансплантацию гемопоэтических стволовых клеток (ТГСК). Существуют два принципиально различных вида трансплантации - аллогенная и аутологичная.
По сравнению с аллогенной, роль аутологичной трансплантации в профилактике рецидива не столь очевидна.
Терапия острого промиелоцитарного лейкоза
Вариант М, по ЕАВ - особый вид острого миелолейкоза. Его регистрируют во всех регионах мира, но в некоторых он существенно преобладает. Среди всех случаев острого миелобластного лейкоза в США и Европе на острый промиелоцитарный лейкоз приходится 10-15%, в то время как в Китае - около трети, а среди латиноамериканской популяции - до 46%. Основное звено патогенеза и диагностический признак острого промиелоцитарного лейкоза - транслокация t(15;17)(q22;ql2) с образованием химерного гена PML-RARa. В клинической картине лидирует коагулопатия (в равной степени вероятны ДВС и гиперфибринолиз), которая может усугубляться на фоне химиотерапии, формируя высокий уровень смертности от геморрагического синдрома в начале лечения (20%). Неблагоприятные в отношении прогноза факторы - инициальный лейкоцитоз (количество лейкоцитов превышает 10х10 9 /л) и экспрессия CD56 на лейкемических промиелоцитах.
Большинству пациентов для достижения ремиссии достаточно применения ATRA в качестве монотерапии, однако без дополнительной терапии заболевание практически всегда рецидивирует в течение первого полугодия. Наилучшая стратегия - комбинирование ATRA с индукционной химиотерапией. Показано, что индукция с использованием all-трансретиноевой кислоты в комбинации с антрациклинами, несколько курсов основанной на антрациклинах консолидации и поддерживающая низкодозная терапия с или без ATRA обеспечивает 75-85% EFS в течение 5 лет у взрослых. Применение ATRA в индукции одновременно с химиотерапией даёт более высокую безрецидивную выживаемость, чем последовательное использование препаратов. Применение поддерживающей терапии также уменьшает вероятность рецидива, а увеличение дозы антрациклинов в индукционной терапии и ATRA в консолидации может улучшить результаты лечения больных группы риска.
Результаты исследований эффективности лечения острого промиелоцитарного лейкоза у детей до настоящего времени не опубликованы, однако природа заболевания и принципы терапии одинаковы во всех возрастных группах.
Какой прогноз имеет острый миелобластный лейкоз?
Читайте также:

