Типы кровоснабжения злокачественных опухолей

Нераспознанное иммунной системой новообразование растет, вскоре начинает метастазировать в другие органы и ткани, замещая злокачественными клетками здоровые клетки ткани или органа. Для подтверждения злокачественности процесса проводится гистологическое исследование.
Один из факторов, влияющих на развитие злокачественной опухоли – генетическая предрасположенность. Есть определенные виды опухолей, которые чаще встречаются у женщин, есть виды опухолей, которые более часто поражают мужчин. Мужчины чаще болеют раком пищевода, губ, женщины – раком молочных желез, шейки матки, толстой кишки. Одинаково часто мужчины и женщины болеют злокачественными заболеваниями легкого, желудка, кожи. Некоторые виды злокачественных опухолей поражают преимущественно детей. Факторами риска развития злокачественной опухоли считают негативное воздействие окружающей среды, вредные привычки и рацион питания. Так, употребление большого количества жиров способствует развитию рака молочной железы, рака толстой и прямой кишки. Курение способствует развитию опухоли языка, гортани, легких. Также способствуют развитию этих злокачественных заболеваний продукты сгорания при приготовлении пищи.
Анатомия злокачественной опухоли
Принято, что опухоли, развивающиеся из эпителиальных клеток, называются раком или карциномой, а развивающиеся из соединительной ткани - называются саркомой. Развитие злокачественной опухоли может произойти в любом органе или ткани организма. Определенные негативные факторы создают для появления опухоли благоприятные условия, и она получает своё развитие. Оно начинается с определенного участка ткани или органа, по мере деления клеток опухоль прорастает в соседние ткани и органы, через кровеносное русло злокачественные клетки распространяются по организму – начинается метастазирование. В отличие от доброкачественных, злокачественная опухоль характеризуется агрессивным ростом, способна проникать в лимфатические и кровеносные сосуды, давать метастазы, которые ведут к развитию новых злокачественных образований в тканях и органах. Метастазирование – это определенное взаимодействие организма и опухоли, которое состоит из нескольких этапов: отделение злокачественных клеток от материнской опухоли, проникновение в кровеносное русло или лимфатические сосуды, передвижение клеток по сосудам, приживление злокачественных клеток в отдаленных лимфоузлах или органах. Злокачественные опухоли с быстрым ростом часто подвергаются некрозу – ткани опухоли размягчаются, образуются полости, начинается гнойное воспаление тканей. В результате такого процесса происходит прободение органа (чаще всего полостного) пораженного опухолью.
Злокачественная опухоль состоит из специфической и неспецифической ткани – паренхимы и ткани с сосудами, нервами, соединительнотканной стромой. Опухоль, состоящая только из опухолевых клеток, называется гистоидной опухолью, опухоль с выраженной стромой – органоидной опухолью.
Опухоли бывают зрелые (гомологичные и гомотипичные) и незрелые (гетерологичные и гетеротипичные). Строма является поддерживающей основой опухоли (скелетом), состоит из соединительной ткани, пронизанной кровеносными сосудами, которые питают опухоль. По своему внешнему виду опухоли подразделяются на:
Узловые, круглой формы.
Сосочковые, ворсинчатые опухоли.
Диффузные, отличающиеся от нормальной ткани окраской и консистенцией.
Образовавшие подобие шляпки гриба злокачественные опухоли.
Один из признаков злокачественного процесса – это инфильтрующий рост. Злокачественная опухоль разрушает соседнюю ткань, создавая неподвижное образование с размытыми границами. Злокачественная опухоль, состоящая из паренхимы, растет быстро, зрелые и опухоли со стромой растут медленно. Рост злокачественной опухоли зависит от ряда факторов – на быстрый рост может повлиять травма, воспалительный процесс, беременность, период полового созревания.
Классификация злокачественных опухолей
Классификация по стадиям развития учитывает определенные критерии: размер новообразования, степень поражения соседних тканей, распространение опухоли в соседние анатомические отделы, органы и ткани, наличие метастазов или их отсутствие. Классификация злокачественных опухолей включает 4 стадии развития, которые обозначаются римскими цифрами (классическая).
Стадии злокачественной опухоли
Первая стадия – начало изменения нормального процесса развития и роста клетки.
Вторая стадия – рост злокачественных клеток.
Третья стадия – прогрессивный рост опухоли.
Четвертая стадия – метастазы обнаруживаются в отдаленных лимфоузлах, органах и тканях.
Классификация TNM злокачественных опухолей
Также используется классификация злокачественных опухолей по международной системе, где:
T – величина опухоли
N – метастазы в регионарных узлах (местных)
M – отдаленные метастазы
К значению Т добавляют цифры от 0 до 4:
То – отсутствуют признаки первичной опухоли.
Тis (in situ) – обозначает внутриэпителиальную опухоль.
Т1 – незначительное распространение опухоли.
Т2 – опухоль поразила около половины тканей органа.
Т3 – опухоль распространилась на 2/3 части органа.
Т4 – полностью поражен орган, опухоль вышла за пределы органа.
К значению N добавляют цифры от 0 до 3, значения N0-N3 – показывают поражение метастазами регионарных лимфатических узлов, степень поражения. Значение Х говорит о том, что нет данных о метастазах в регионарных лимфоузлах, нет возможности оценить опухоль, ее размеры и распространение.
Nх – данных о метастазах нет.
N0 – метастазов в регионарных лимфоузлах нет.
N1 – метастазы в регионарных лимфоузлах.
N2 – поражены метастазами отдалённые лимфоузлы.
N3 – полное удаление злокачественной опухоли невозможно, поражены парааортальные лимфоузлы.
Значения М0 –М1 – наличие или отсутствие отдаленных метастазов.
М0 – нет отдаленных метастазов.
М1 – значение указывается при обнаружении даже одного отдаленного метастаза.
Добавление к данным символам буквы G указывает степень злокачественности опухоли:
G1 – высокодифференцированные клетки опухоли, низкая степень злокачественности.
G2 – низкодифференцированные клетки опухоли, злокачественность средней степени.
G3 – недифференцированные клетки опухоли, высокая степень злокачественности.
Символ Р обозначает в классификации опухолей – проникновение. Добавление этого символа обозначает степень прорастания опухолью стенок полых органов. Применяется в классификации только полых органов:
Р1 – опухоль находится в пределах слизистой.
Р2 – опухоль проросла в подслизистый слой.
Р3 – опухоль проросла в мышечный слой.
Р4 – проросла серозную оболочку, распространилась за пределы органа.
Типы злокачественных опухолей
Рак эпителиальных тканей
Аденокарцинома (слизистая, тубулярная, ацинозная, сосочковая, коллоидная), трабекулярный рак, медуллярный рак, фиброзный рак, эпидермоидный рак, недифференцированный рак - базалиома.
Рак покровного эпителия – это рак кожи, бронхов, губ, пищевода, мочевого пузыря и влагалищной части шейки матки. Рак железистого эпителия – это рак молочной железы, печени, матки, бронхов, поджелудочной железы, кишечника, слюнных желез.
Эпителиальные опухоли занимают первое место среди опухолей органов полости рта. Около 95% составляет плоскоклеточный рак, чаще всего встречается ороговевший плоскоклеточный рак. Развитию рака органов полости рта способствуют вредные привычки – курение, жевание табака, плохой уход за полостью рта, кариоз, протезы зубов, вызывающие частые травмы полости рта – щек, языка, слизистой оболочки дёсен, предраковые заболевания – лейкокератоз, не излеченные язвы полости рта, лейкоплакия (вызывается гормональными сбоями в организме, анемией). Основной причиной эпителиальной опухоли щеки являются протезы, которые травмируют слизистую щёк в течение длительного времени.
К эпителиальным опухолям матки относится карцинома in situ (не выходящая за пределы органа), которая определяется как внутрипротоковая карцинома, неинвазивная карцинома. Различные предраковые заболевания способствуют развитию рака матки при их недостаточном лечении или позднем обнаружении.
Около 90% опухолей яичников составляют эпителиальные опухоли. Диагностика злокачественных опухолей яичников очень сложна, поэтому большей частью они обнаруживаются на поздних стадиях.
Злокачественные опухоли эпителиального происхождения преимущественно метастазируют лимфогенным и лимфогематогенным путем, в отличие от других видов опухолей, которые преимущественно метастазируют гематогенным путем.
Типы злокачественных опухолей лимфатических и кровеносных сосудов
К злокачественным опухолям тканей кровеносных, лимфатических сосудов относится ангиосаркома, лимфангиоэндотелиома, гемангиоэндотелиома.
Ангиосаркома – злокачественная опухоль, легко метастазирующая. Происходит из перителия и эндотелия сосудов. Встречается редко, частота заболевания у мужчин и женщин одинаковая.
Лимфангиоэндотелиома – происходит из эндотелия лимфатических и кровеносных сосудов. Опухоль имеет тенденцию к быстрому росту и метастазированию. Метастазы опухоли поражают в первую очередь лимфатические узлы шеи, затем легкие и печень. Первичная ангиосаркома поражает пожилых людей, вторичная возникает при хроническом лимфатическом отеке.
Пораженный злокачественной опухолью лимфатический узел может спровоцировать распространение злокачественных клеток через лимфатическую и кровеносную системы в другие органы, где клетка может начать делиться и дать начало новой опухоли. Опухоль лимфатических узлов может спровоцировать злокачественные процессы в печени, костях, легких. Наиболее часто злокачественная опухоль лимфатических узлов развивается в области шеи.
Злокачественная опухоль соединительной ткани
К ним относятся: генерализованный ретикулез, ретикулосаркома, гемацитобластоз, лимфогранулематоз, миелоз, лимфаденоз, а также новообразования из неоформленной соединительной ткани: цитобластома (круглоклеточная саркома), полиморфно- и эпителиоидноклеточная, веретенноклеточная саркома, фибросаркома, липосаркома. Злокачественные образования оформленной соединительной ткани: остеосаркома, хондросаркома, злокачественная хордома.
Фибросаркома – злокачественная опухоль, которая начинает свое развитие из надкостницы, тканей сухожилия, из соединительных оболочек (фасций). Наиболее часто болеют молодые люди и люди зрелого возраста, поражает фибросаркома чаще всего конечности.
Злокачественная опухоль мышечной ткани
К злокачественным опухолям мышечной ткани относятся: миосаркомы (рабдомиосаркома, лейомисаркома, миобластома зернистоклеточная злокачественная.).
Злокачественные опухоли мышечной ткани развиваются из мышц, поднимающих волос, мышц потовых желез (кожные лейосаркомы), гладких мышц артериол и подкожных вен (подкожные лейосаркомы).
Рабдомиобластома происходит из поперечнополосатой (скелетной) мышцы, часто развивается у детей. Растет опухоль быстро, не происходит нарушения функций, нет боли. Часто прорастает кожу, образует узлы, которые кровоточат.
Злокачественные опухоли нервной системы
Опухоли, поражающие нервную систему: эпендимобластома, астробластома, злокачественная невринома, неврофибросаркома, симпатогониома, злокачественная параганглиома, медуллобластома, менингеальная саркома, глиобластома, спонкиобластома.
Злокачественные опухоли нервной системы развиваются в различных отделах головного мозга. Злокачественная патология встречается в любом возрасте, начиная от раннего детского возраста и заканчивая старческим возрастом. Некоторые виды опухолей поражают преимущественно детей.
Злокачественное заболевание кожи – меланома, бывает пигментной и беспигментной. Развивается злокачественная опухоль из меланоцитов. Проявляется в виде образований небольших размеров на коже. Пигментная меланома встречается чаще, чем беспигментная меланома. Беспигментная меланома – опасный вид раковой опухоли, растет быстро, агрессивно, метастазирует на ранних стадиях своего развития.
Важнейшая задача клинической диагностики – это диагностирование злокачественной опухоли на ранних стадиях ее развития. Совершенствование методов диагностики значительно подняло процент обнаружения рака на ранних этапах, что позволяет не применять радикального лечения.

Доктор медицинских наук В. ПРОЗОРОВСКИЙ.
В 1628 году английский врач Уильям Гарвей открыл кровообращение, а спустя некоторое время, в 1661 году, итальянский медик Марчелло Мальпиги — мельчайшие сосудики, капилляры, соединяющие артерии и вены у животных и человека. Сегодня наука о сердечно-сосудистой системе, ее функциях, заболеваниях — одна из ключевых в медицине, однако лишь недавно, в конце ХХ века, ученым пришло в голову, что кровеносные сосуды играют важную роль и в опухолевом росте. Теперь уже никто из медиков не сомневается, что раковая опухоль не может расти без постоянно образующихся вокруг нее новых сосудов.
Хотя post factum многое представляется само собой разумеющимся, но прошло немало лет, прежде чем медики догадались, что для интенсивного размножения опухолевых клеток нужны кислород и питательные вещества, поэтому быстрорастущая злокачественная опухоль требует крови больше, чем, скажем, липома, доброкачественная опухоль из жировой ткани. А значит, по мере развития раковая опухоль должна прорастать новыми кровеносными сосудами.
В 1971 году появилась статья американского хирурга Джуды Фолкмана, в которой впервые было высказано предположение, что рост опухолей, превышающих в диаметре несколько миллиметров, возможен только в случае формирования и прорастания в них мелких капилляров. В 1982 году американские ученые Ваупель, Каллиновски и Окуниефф показали, что во всех злокачественных опухолях действительно идет интенсивное новообразование сосудов. Верно и обратное — если образование новых сосудов прекращается, то дальнейший рост опухоли становится невозможен.
Открытие Фолкмана послужило началом целой череды научных достижений, в результате которых на свет явилась стройная теория ангиогенеза. Согласно ей образование сосудов в раковой опухоли, так же как и в любой поврежденной ткани, протекает в несколько стадий. Что же побуждает организм образовывать новые капилляры?
АКТИВАТОРЫ РОСТА НОВЫХ СОСУДОВ
Факторы роста совершенно необходимы здоровому организму для восстановления кровотока при различных повреждениях, но их избыток может стать роковым для онкологического больного. Повышение синтеза ФРЭС стимулирует метастазирование опухолей — под воздействием этого вещества раковые клетки выходят в кровяное русло и распространяются по всему организму. С другой стороны, ФРЭС играет и положительную роль — прорастающие в опухоли сосуды формируют в ней своеобразный мягкий скелет, который удерживает клетки на месте, не давая им метастазировать.
Кстати, при недостатке кислорода выработка ФРЭС и других факторов роста усиливается — ведь организму нужно скомпенсировать гипоксию увеличением кровотока. Отсюда можно сделать вывод об увеличении риска онкологических заболеваний при снижении концентрации кислорода в воздухе из-за уничтожения зеленых насаждений, загрязнения окружающей среды и т.д. Также доказано, что молекулы, вырабатывающиеся в организме человека при стрессе, одновременно стимулируют синтез ФРЭС. Этот факт наводит на мысли о пагубной роли нер-вного напряжения в возникновении раковых опухолей.
ВЕЩЕСТВА, ПРЕПЯТСТВУЮЩИЕ РОСТУ НОВЫХ СОСУДОВ
По счастью, помимо молекул, способствующих прорастанию опухоли сосудами, в организме синтезируются и собственные факторы, препятствующие росту сосудов (ингибиторы). В здоровом организме существует баланс между активаторами и ингибиторами роста новых кровеносных сосудов. При многих серьезных заболеваниях организм как бы теряет контроль над поддержанием этого равновесия. Смещение равновесия в сторону избыточного формирования новых сосудов происходит при онкологических заболеваниях, диабете, ревматоидном артрите и т.д. При таких опасных недугах, как заболевания коронарных артерий, инсульт, напротив, скорость роста новых сосудов явно ниже нормы.
Первым известным природным веществом, тормозящим рост новых сосудов, стал гликопротеин тромбоспондин, вырабатываемый различными клетками, в том числе и клетками стенок кровеносных сосудов. Тромбоспондин тормозит размножение и прикрепляемость эндотелиальных клеток, сдерживая таким путем рост капилляров.
В 1997 году тот же О’Рейли при исследовании культуры клеток злокачественной опухоли гемангиоэндотелиомы выделил еще один мощный блокатор формирования кровеносных сосудов — эндостатин. Это вещество является частью молекулы полипептида коллагена. Эндостатин активирует программируемую гибель эндотелиальных клеток и, вероятно, тормозит процесс их активации, размножения и миграции.
Помимо тромбоспондина, ангиостатина и эндостатина в органах и тканях животных исследователи обнаружили множество веществ, которые подавляют рост капилляров. К таким веществам относятся некоторые гормоны, фрагменты гепарина и др. Из известных природных ингибиторов можно назвать интерфероны, которые, кстати, борются и с вирусами. Однако как названные вещества, так и многие другие свойственные организму продукты обмена веществ обладают многофункциональным действием и из-за побочных эффектов не могут быть использованы в качестве лекарственных препаратов. Тем не менее интерес ученых к этой группе соединений не ослабевает.
"СОСУДИСТЫЙ" ПОДХОД К ЛЕЧЕНИЮ РАКА
Долгое время противораковая терапия была направлена лишь на подавление роста опухолевых клеток и усиление иммунного ответа. Сейчас уже ясно, что без формирования новых сосудов не может быть роста злокачественных опухолей. Лишенные возможности стимулировать образование новых капилляров, первичные и метастатические опухоли перестают расти. Поэтому появился новый класс ангиостатиков, то есть лекарств, тормозящих прорастание новых кровеносных сосудов. Такие соединения очень перспективны для борьбы со злокачественными опухолями на любой стадии их развития. Более того, существующие сейчас препараты эффективны по отношению к определенным опухолям, а блокаторы роста сосудов могут стать универсальным средством противораковой терапии, причем тем более эффективными, чем злокачественнее опухоль.
По противоопухолевой активности другой природный ингибитор — эндостатин сильнее, чем ангиостатин. Уже в малых дозах он предотвращает метастазирование крупных опухолей, а в больших — оказывает мощное тормозящее действие на рост первичных опухолей, таких, как карциномы, саркомы и меланома, вызывая в некоторых случаях их полную гибель. Очевидно, после разработки методов получения ангиостатина и эндостатина в промышленных масштабах эти препараты получат широкое клиническое применение, поскольку существенных побочных реакций при их использовании даже в больших дозах пока не выявлено.
Первый класс веществ, которые сейчас испытываются в качестве противоопухолевых препаратов, — соединения, непосредственно блокирующие рост эндотелиальных клеток. К этой категории веществ относится уже упомянутый природный белок эндостатин. Его синтетический аналог комбрестатин А4 — химическая модификация соединения, содержащегося в древесине южноафриканского дерева Combretum caffrum, — проходит клинические испытания. Препарат также проявляет способность подавлять размножение клеток сосудов, стимулируя клеточный апоптоз. В настоящее время большое внимание уделяется созданию веществ, блокирующих размножение уже активированных клеток эндотелия. Из них наиболее удачным по активности и малой токсичности является синтетический препарат TNP-470, прошедший клинические испытания при раке почек, шейки матки и саркоме Капоши.
Ко второй группе препаратов, тормозящих рост сосудов, относятся природные или синтетические вещества, так или иначе блокирующие передачу сигнала на рецепторы факторов роста. Как уже было сказано, ФРЭС взаимодействует с эндотелиальными клетками посредством специальных белковых структур — рецепторов. Клетки здорового организма к этим веществам — блокаторам рецепторов нечувствительны. Клинические испытания проходят препараты антител к ФРЭС, которые эффективно блокируют рецепторы ФРЭС, не давая молекуле фактора роста запустить биохимический каскад, приводящий к прорастанию новых сосудов. Уже понятно, что лекарственные препараты на основе антител замедляют опухолевый рост и продлевают жизнь пациентам. Фактически антитела к ФРЭС — пока единственное антиангиогенное лекарство, уже появившееся на мировом фармацевтическом рынке. Ученые также синтезировали несколько молекул — аналогов ФРЭС, блокирующих рецепторы. Эти вещества тестируются в онкологических клиниках.
На стадии клинических испытаний находится и печально известный препарат талидомид. Почти полвека тому назад он применялся в качестве снотворного, но вызывал уродства плода у беременных женщин. Как случайно выяснилось впоследствии, это было связано с нарушением образования необходимых для роста плода сосудов, хотя механизм действия соединения так и остался до конца не выясненным. Талидомид оказался эффективным при лечении больных миеломой, раком простаты и легких, саркомой и ганглиобластомой.
К третьей группе веществ, подавляющих прорастание сосудов, а следовательно, и рост опухоли, относятся блокаторы (ингибиторы) активности опухолевых ферментов — металлопротеаз, которые разрушают внеклеточный матрикс и оболочку сосуда, давая клеткам эндотелия возможность мигрировать в сторону опухоли. В недавнее время созданы вещества, которые блокируют ионы металлов, входящих в активный центр ферментов, выводя ферменты опухоли из строя и тем лишая ее способности расти. Разработка препаратов такого типа действия — приномастата, маримастата и СOL-3 — находится на стадии клинических испытаний.
Следует различать доброкачественные и злокачественные опухоли, основные их отличия представлены в Таблице 1. Следует отметить, что в ряде случаев доброкачественные опухоли могут достигать значительных размеров. Доброкачественные опухоли, как правило, не представляют непосредственной угрозы для жизни пациента, за исключением опухолей, растущих в головном и спинном мозге – данные опухоли могут сдавливать критически важные структуры в этих органах и приводить к смерти или наносить непоправимый вред здоровью больного.
Многие нормальные клетки обладают способностью к делению, однако эти процессы происходят согласованно и останавливаются или замедляются, когда исчезает необходимость в образовании новых клеток. Так, например, ранение кожи стимулирует ускорение процессов деления клеток, формирующих кожный покров. Как только рана затягивается, скорость деления клеток вновь замедляется до уровня, необходимого только для обновления стареющих клеток.
При развитии опухоли все меняется. Её клетки делятся практически независимо от внешних сигналов (автономно), по мере накопления мутаций они становятся все менее похожими на нормальные, их прежние функции утрачиваются, вместо этого остается только одна - размножение. Клетки опухоли начинают активно поглощать питательные вещества, расти и размножаться. Со временем они начинают вытеснять нормальные клетки, приобретают способность к инвазивному росту (что означает прорастание в другие ткани и кровеносные сосуды) и метастазированию (распространению по организму с током крови, лимфы, по ходу сосудов и нервов и так далее).
Причиной возникновения опухолевых клеток (онкогенеза) является появление некоторых мутаций в ДНК – нарушений в генетическом коде клетки, которые возникают под действием внешних факторов (например, канцерогенных веществ, онкогенных вирусов и так далее – см. ниже) или в процессе естественного деления клетки.
При сочетании вышеперечисленных факторов, в условиях отсутствия контроля за целостностью генетического кода в опухоли продолжается накопление мутаций, вследствие чего со временем она становится все менее похожей на нормальную клетку и приобретает черты злокачественности.
- курение;
- производственные вредности, например постоянный контакт с асбестом, угольной пылью, рядом красителей и так далее;
- хронические инфекции, вызванные вирусами, бактериями и паразитами. Так, в большинстве случаев, рак шейки матки развивается на фоне хронической инфекции, вызванной вирусом папилломы человека (ВПЧ);
- воздействие радиоактивного излучения.
Обязательно сообщите вашему лечащего врачу, если у ваших родственников были случаи развития онкологических заболеваний, в том числе – отличных от вашего. Это может оказать большое влияние на ваше лечение. Поспрашивайте своих родных и близких если не уверены или не знаете.
Под воздействием этих и других факторов постоянно происходит повреждение ДНК клетки. В норме, эти нарушения устраняются специальными белками, которые устраняют подобные повреждения (система репарации). Однако, если повреждаются критически важные структуры, подобные повреждения могут привести к злокачественному перерождению клетки. К таким структурам относятся:
- Прото-онкогены – структуры, которые отвечают за нормальный рост и деление клетки. При определенных повреждениях они могут стать гиперактивными, позволяя клетке выживать в тех условиях, в которых в норме она должна была бы погибнуть;
- Гены, подавляющие опухолей рост (супрессоры опухолевого роста), как и прото-онкогены отвечают за процессы роста и размножения клеток, но в отличие от первых, подавляют эти процессы. При нарушении функций этих генов клетка приобретает способность к бесконтрольному росту и размножению;
- Гены, отвечающие за нормальное функционирование системы репарации. Если они не выполняют свои задачи, в клетке накапливаются мутации, которые с течением времени могут привести к её злокачественной трансформации.
Этот процесс называется процессом метастазирования, у опухолей различных локализаций он протекает неодинаково и зависит от особенностей кровоснабжения опухоли и некоторых её биологических свойств. К примеру, отдаленные метастазы рака толстой кишки чаще всего обнаруживаются в печени, легких и головном мозге, тогда как для рака предстательной железы наиболее характерно метастазирование в кости скелета. Это – наиболее запущенная стадия опухолевого процесса (IV), которая характеризуется наименее благоприятным прогнозом. Тем не менее, достижения современной медицины в ряде случаев позволяют добиться существенного продления и улучшения качества жизни у больных с метастатическими опухолями.
Вторичные опухоли, как правило, обладают такой же гистологической картиной, как и первичный очаг, и аналогичными молекулярно-генетическими нарушениями. Из этого следует, что метастазы рака прямой кишки в печени лечатся так же, как и сам рак прямой кишки, не как рак печени.

В 1628 году английский врач Уильям Гарвей открыл кровообращение, а спустя некоторое время, в 1661 году, итальянский медик Марчелло Мальпиги – мельчайшие сосудики, капилляры, соединяющие артерии и вены у животных и человека. Сегодня наука о сердечно-сосудистой системе, ее функциях, заболеваниях – одна из ключевых в медицине, однако лишь недавно, в конце ХХ века, ученым пришло в голову, что кровеносные сосуды играют важную роль и в опухолевом росте. Теперь уже никто из медиков не сомневается, что раковая опухоль не может расти без постоянно образующихся вокруг нее новых сосудов.

Хотя post factum многое представляется само собой разумеющимся, но прошло немало лет, прежде чем медики догадались, что для интенсивного размножения опухолевых клеток нужны кислород и питательные вещества, поэтому быстрорастущая злокачественная опухоль требует крови больше, чем, скажем, липома, доброкачественная опухоль из жировой ткани. А значит, по мере развития раковая опухоль должна прорастать новыми кровеносными сосудами.
В 1971 году появилась статья американского хирурга Джуды Фолкмана, в которой впервые было высказано предположение, что рост опухолей, превышающих в диаметре несколько миллиметров, возможен только в случае формирования и прорастания в них мелких капилляров. В 1982 году американские ученые Ваупель, Каллиновски и Окуниефф показали, что во всех злокачественных опухолях действительно идет интенсивное новообразование сосудов. Верно и обратное – если образование новых сосудов прекращается, то дальнейший рост опухоли становится невозможен.
Открытие Фолкмана послужило началом целой череды научных достижений, в результате которых на свет явилась стройная теория ангиогенеза. Согласно ей, образование сосудов в раковой опухоли, так же как и в любой поврежденной ткани, протекает в несколько стадий. Что же побуждает организм образовывать новые капилляры?
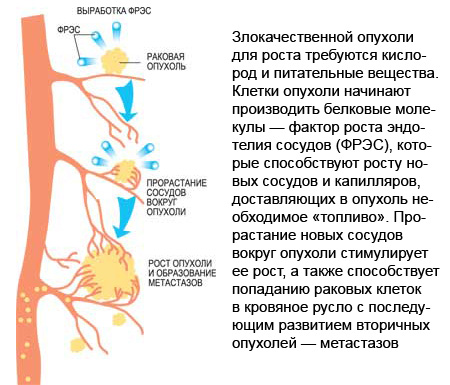


Факторы роста совершенно необходимы здоровому организму для восстановления кровотока при различных повреждениях, но их избыток может стать роковым для онкологического больного. Повышение синтеза ФРЭС стимулирует метастазирование опухолей – под воздействием этого вещества раковые клетки выходят в кровяное русло и распространяются по всему организму. С другой стороны, ФРЭС играет и положительную роль – прорастающие в опухоли сосуды формируют в ней своеобразный мягкий скелет, который удерживает клетки на месте, не давая им метастазировать.
Кстати, при недостатке кислорода выработка ФРЭС и других факторов роста усиливается – ведь организму нужно скомпенсировать гипоксию увеличением кровотока. Отсюда можно сделать вывод об увеличении риска онкологических заболеваний при снижении концентрации кислорода в воздухе из-за уничтожения зеленых насаждений, загрязнения окружающей среды и т.д. Также доказано, что молекулы, вырабатывающиеся в организме человека при стрессе, одновременно стимулируют синтез ФРЭС. Этот факт наводит на мысли о пагубной роли нервного напряжения в возникновении раковых опухолей.
По счастью, помимо молекул, способствующих прорастанию опухоли сосудами, в организме синтезируются и собственные факторы, препятствующие росту сосудов (ингибиторы). В здоровом организме существует баланс между активаторами и ингибиторами роста новых кровеносных сосудов. При многих серьезных заболеваниях организм как бы теряет контроль над поддержанием этого равновесия. Смещение равновесия в сторону избыточного формирования новых сосудов происходит при онкологических заболеваниях, диабете, ревматоидном артрите и т.д. При таких опасных недугах, как заболевания коронарных артерий, инсульт, напротив, скорость роста новых сосудов явно ниже нормы.

Первым известным природным веществом, тормозящим рост новых сосудов, стал гликопротеин тромбоспондин, вырабатываемый различными клетками, в том числе и клетками стенок кровеносных сосудов. Тромбоспондин тормозит размножение и прикрепляемость эндотелиальных клеток, сдерживая таким путем рост капилляров.
В 1997 году тот же О’Рейли при исследовании культуры клеток злокачественной опухоли гемангиоэндотелиомы выделил еще один мощный блокатор формирования кровеносных сосудов – эндостатин. Это вещество является частью молекулы полипептида коллагена. Эндостатин активирует программируемую гибель эндотелиальных клеток и, вероятно, тормозит процесс их активации, размножения и миграции.
Помимо тромбоспондина, ангиостатина и эндостатина в органах и тканях животных исследователи обнаружили множество веществ, которые подавляют рост капилляров. К таким веществам относятся некоторые гормоны, фрагменты гепарина и др. Из известных природных ингибиторов можно назвать интерфероны, которые, кстати, борются и с вирусами. Однако как названные вещества, так и многие другие свойственные организму продукты обмена веществ обладают многофункциональным действием и из-за побочных эффектов не могут быть использованы в качестве лекарственных препаратов. Тем не менее интерес ученых к этой группе соединений не ослабевает.

Долгое время противораковая терапия была направлена лишь на подавление роста опухолевых клеток и усиление иммунного ответа. Сейчас уже ясно, что без формирования новых сосудов не может быть роста злокачественных опухолей. Лишенные возможности стимулировать образование новых капилляров, первичные и метастатические опухоли перестают расти. Поэтому появился новый класс ангиостатиков, то есть лекарств, тормозящих прорастание новых кровеносных сосудов. Такие соединения очень перспективны для борьбы со злокачественными опухолями на любой стадии их развития. Более того, существующие сейчас препараты эффективны по отношению к определенным опухолям, а блокаторы роста сосудов могут стать универсальным средством противораковой терапии, причем тем более эффективными, чем злокачественнее опухоль.
По противоопухолевой активности другой природный ингибитор – эндостатин – сильнее, чем ангиостатин. Уже в малых дозах он предотвращает метастазирование крупных опухолей, а в больших – оказывает мощное тормозящее действие на рост первичных опухолей, таких, как карциномы, саркомы и меланома, вызывая в некоторых случаях их полную гибель. Очевидно, после разработки методов получения ангиостатина и эндостатина в промышленных масштабах эти препараты получат широкое клиническое применение, поскольку существенных побочных реакций при их использовании даже в больших дозах пока не выявлено.

Первый класс веществ, которые сейчас испытываются в качестве противоопухолевых препаратов, – соединения, непосредственно блокирующие рост эндотелиальных клеток. К этой категории веществ относится уже упомянутый природный белок эндостатин. Его синтетический аналог комбрестатин А4 – химическая модификация соединения, содержащегося в древесине южноафриканского дерева Combretum caffrum, – проходит клинические испытания. Препарат также проявляет способность подавлять размножение клеток сосудов, стимулируя клеточный апоптоз. В настоящее время большое внимание уделяется созданию веществ, блокирующих размножение уже активированных клеток эндотелия. Из них наиболее удачным по активности и малой токсичности является синтетический препарат TNP-470, прошедший клинические испытания при раке почек, шейки матки и саркоме Капоши.
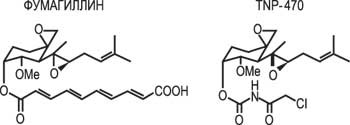
Ко второй группе препаратов, тормозящих рост сосудов, относятся природные или синтетические вещества, так или иначе блокирующие передачу сигнала на рецепторы факторов роста. Как уже было сказано, ФРЭС взаимодействует с эндотелиальными клетками посредством специальных белковых структур – рецепторов. Клетки здорового организма к этим веществам – блокаторам рецепторов нечувствительны. Клинические испытания проходят препараты антител к ФРЭС, которые эффективно блокируют рецепторы ФРЭС, не давая молекуле фактора роста запустить биохимический каскад, приводящий к прорастанию новых сосудов. Уже понятно, что лекарственные препараты на основе антител замедляют опухолевый рост и продлевают жизнь пациентам. Фактически антитела к ФРЭС – пока единственное антиангиогенное лекарство, уже появившееся на мировом фармацевтическом рынке. Ученые также синтезировали несколько молекул – аналогов ФРЭС, блокирующих рецепторы. Эти вещества тестируются в онкологических клиниках.
На стадии клинических испытаний находится и печально известный препарат талидомид. Почти полвека тому назад он применялся в качестве снотворного, но вызывал уродства плода у беременных женщин. Как случайно выяснилось впоследствии, это было связано с нарушением образования необходимых для роста плода сосудов, хотя механизм действия соединения так и остался до конца не выясненным. Талидомид оказался эффективным при лечении больных миеломой, раком простаты и легких, саркомой и ганглиобластомой.


К третьей группе веществ, подавляющих прорастание сосудов, а следовательно, и рост опухоли, относятся блокаторы (ингибиторы) активности опухолевых ферментов – металлопротеаз, которые разрушают внеклеточный матрикс и оболочку сосуда, давая клеткам эндотелия возможность мигрировать в сторону опухоли. В недавнее время созданы вещества, которые блокируют ионы металлов, входящих в активный центр ферментов, выводя ферменты опухоли из строя и тем лишая ее способности расти. Разработка препаратов такого типа действия – приномастата, маримастата и СOL-3 – находится на стадии клинических испытаний.
Читайте также:

