Т лимфоциты убивают раковые клетки
Чтобы опасные старые клетки не накапливались и не провоцировали хронические болезни, их можно устранить с помощью Т-лимфоцитов, распознающих клеточную старость.
Со временем в наших клетках накапливаются разнообразные дефекты – в генах появляются мутации, повреждённые белки перестают работать, как надо. Обычно в ответ на дефекты и повреждения должна включаться программа клеточного суицида: клетка уничтожает сама себя, и делает это так, чтобы доставить окружающим как можно меньше беспокойства. Но часто случается иначе: программа суицида не срабатывает, и клетка продолжает стареть.
С одной стороны, в стареющей клетке отключён механизм деления, и стать раковой она не сможет. (И даже размножение раковой клетки можно остановить, если спровоцировать в ней старение.) С другой стороны, она активно выделяет в окружающую среду целый набор соединений, воспалительные сигналы, ферменты, расщепляющие другие белки и пр. – такой коктейль, выделяемый дряхлеющей клеткой, плохо влияет на окружающую ткань. Стареющие клетки провоцируют общее фоновое воспаление в организме, повышают риск атеросклероза, вредят мозгу и вообще укорачивают жизнь. В норме их должны уничтожать иммунные клетки, которые приходят, так сказать, на запах старости, то есть по следам тех молекул, которые выбрасывают из себя стареющие клетки. Но бывает, что они продолжают накапливаться, накапливаться и накапливаться.
Чтобы избавиться от них, можно использовать специальные сенолитические препараты, уничтожающие старые клетки, и поиском таких препаратов занимаются множество лабораторий по всему миру. Однако исследователи из Мемориального онкологического центра им. Слоуна–Кеттеринга поступили иначе – они улучшили собственные иммунные клетки организма, чтобы они активнее уничтожали клеточный балласт.
Собственно, авторы работы использовали метод CAR Т-лимфоцитов, где CAR означает chimaeric antigen receptor – то есть Т-лимфоциты с химерным рецептором к антигену. Т-клетки узнают, кого нужно уничтожить, с помощью поверхностных рецепторов, которые узнают определённые молекулы – антигены. Но рецепторы работают с разной эффективностью; кроме того, у Т-лимфоцитов вообще может не оказаться рецепторов к нужному антигену. Суть метода CAR Т-лимфоцитов в том, что у индивидуума берут Т-клетки и модифицируют их рецепторы так, чтобы они узнавали конкретные молекулы-антигены и узнавали их хорошо. Обычно CAR T-лимфоциты настраивают на раковые клетки, конструируя им такие рецепторы, которые узнавали бы только раковые молекулы-антигены, отсутствующие на здоровых клетках.
Можно ли Т-лимфоциты настроить на старые клетки? Для начала в старых клетках нужно найти такие белки, которые бы сидели на их наружной клеточной мембране и которые были бы свойственны только старым клеткам. У человеческих и мышиных старых клеток удалось найти восемь наиболее многообещающих в этом смысле белков, из которых выбрали рецептор uPAR, который активно участвует в деградации старой ткани и которого почти нет у нестарых клеток. (Кстати, тот же uPAR, только в растворимой форме, считается одним из маркеров разных хронических болезней, включая диабет и почечные болезни, в которых клеточное старение играет большую роль.)
Исследователи настроили мышиные Т-лимфоциты распознавать рецептор uPAR и запустили их обратно в мышей, откуда их и взяли. В статье в Nature говорится, что модифицированные Т-лимфоциты справились с задачей и уничтожили старые клетки. Причём эти старые клетки были как раз раковые, которых сначала заставили состариться, чтобы они перестали делиться. То есть CAR T-лимфоциты, нацеленные против стареющих клеток, можно использовать как дополнение к противораковой терапии – потому что всё равно раковые клетки, пусть и состарившиеся, нужно куда-то девать. Кроме того, CAR T-лимфоциты улучшили состояние печени у мышей с неалкогольным стеатогепатитом, когда в печени начинается воспаление на фоне жирового перерождения.
Модифицированные Т-лимфоциты, нацеленные против стареющих клеток, могли бы стать удачной альтернативой сенолитическим препаратам, которые, как пишет портал Nature, порой оказываются токсичны, то есть вредят не только старым клеткам, но и всем остальным. Но такие Т-лимфоциты предстоит ещё испытать на людях, и, возможно, для уничтожения человеческих старых клеток Т-лимфоцитам нужен рецептор против какого-то другого белка. Наконец, не стоит забывать, что метод CAR T-клеток пока что очень недёшев, и можно только надеяться на то, что когда-нибудь он станет более-менее обычной медицинской услугой.
В последние годы упоминание о Т-клетках все чаще появляется в заголовках новостей. Чтобы понять, чем прославились эти труженики, доктор биологических наук Татьяна Ткаченко рассказала, какие они бывают и чем занимаются.
При исследовании под микроскопом большинство лимфоцитов в нормальной лимфоидной ткани выглядят одинаково, однако у этих клеток разная судьба. Одна популяция — В-лимфоциты— ответственна за формирование антител и гуморальный иммунитет. Вторая — Т-лимфоциты — обеспечивает клеточный иммунитет, то есть непосредственно взаимодействует с антигенами. Эта популяция тоже неоднородна и представлена несколькими типами клеток с различными функциями.
Детство
Лимфоциты — главные клетки иммунной системы, играющие важную роль в адаптивном (не врожденном) иммунном ответе. Как В-, так и Т-лимфоциты образуются у эмбриона из гемопоэтических стволовых клеток красного костного мозга, после чего проходят дифференцировку: Т-клетки — в тимусе (вилочковой железе), В-клетки — в печени, а затем в костном мозге. В тимусе T-лимфоциты приобретают Т-клеточные рецепторы и различные поверхностные маркеры (корецепторы).
Помимо рецепторов, каждый зрелый T-лимфоцит экспрессирует один из так называемых корецепторов — CD4 или CD8, которые взаимодействуют с молекулами главного комплекса гистосовместимости (ГКГ).
Юность
Активированный Т-лимфоцит начинает делиться и образует клон. Часть клеток клона превращается в эффекторные Т-лимфоциты и активно участвует в иммунном ответе, а часть — превращается в Т-клетки памяти, которые сохраняются в неактивной форме до повторного взаимодействия с тем же антигеном. В таком случае Т-клетки памяти обеспечивают более быстрый иммунный ответ, чем при первичном контакте с антигеном.
Эффекторные Т-лимфоциты
Т-хелперы (англ. helper — помощник) усиливают адаптивный иммунный ответ. Они активируют другие клетки иммунной системы при прямом контакте, а также выделяют цитокины. Т-хелперы несут на поверхности корецептор CD4 и распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами ГКГ II класса.
Т-киллеры (англ. killer — убийца), или цитотоксические T-лимфоциты, уничтожают путем лизиса поврежденные клетки собственного организма — пораженные вирусами или бактериями, а также опухолевые клетки. Т-киллеры несут на поверхности корецептор CD8 и распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами ГКГ I класса, присутствующими на всех ядерных клетках в организме.
Т-клетки против рака
Т-клетки против аутоагрессии
Аутоиммунные заболевания обычно лечат путем общего подавления иммунитета, что грозит тяжелыми последствиями для организма больного. Более адекватным методом лечением стало бы устранение патологических иммунных факторов и, в частности, В-лимфоцитов, ответственных за синтез аутоагрессивных антител. Достичь этого можно с помощью той же технологии CAR-T, позволяющей задавать мишень для атаки Т-киллеров. Технология была испытана в лечении тяжелого аутоиммунного заболевания пузырчатки, или пемфигуса, при котором особая популяция B-лифоцитов выделяет антитела, атакующие один из белков клеточного матрикса — десмоглеин. В результате на коже и слизистых оболочках появляются гноящиеся пузыри, которые затем отслаиваются, обнажая подлежащие ткани.
В Т-лимфоциты вводили ген рецептора, содержащего фрагменты десмоглеина. Такие модифицированные Т-клетки могли связываться только с теми B-лимфоцитами, которые вырабатывали антитела к десмоглеину. После связывания трансгенные Т-киллеры уничтожали патологичные B-лимфоциты. Так происходило и в клеточной культуре, и в экспериментах на мышах, которым искусственно вводили B-лимфоциты против десмоглеина.
Т-клеточная терапия — сложная и дорогостоящая технология. Однако бóльшая часть пути в ее развитии уже пройдена, и есть надежда, что в недалеком будущем она станет доступна тем многочисленным пациентам, которые в ней нуждаются.
- Как работает иммунитет. Т-лимфоциты: клетки хелперы, киллеры, супрессоры
- Как опухоль пытается обмануть иммунную систему
- Нобелевская премия по медицине-2018: в чем суть открытия
- Открытие доктора Джеймс Эллисон
- Открытие доктора Тасуку Хондзё
- Какие препараты используют для иммунотерапии рака: название, стоимость
Первая в этом году Нобелевская премия по медицине-2018 была обнародована Нобелевским Комитетом 1 октября 2018 года на своем официальном сайте, где дан пресс-релиз события. Премию получили двое ученых за исследования в области рака: они нашли способ, как заставить иммунную систему больного самой справиться с раковыми клетками. Лауреатами стали 70-летний профессор Техасского университета в Остине (США) Джеймс Эллисон и его 76-летний коллега Тасуку Хондзё из Киотского университета (Япония).

Они обнаружили два разных механизма, с помощью которых организм подавляет активность Т-лимфоцитов (иммунных клеток-убийц).
Интересно, как фармацевтические картели отнесутся к открытию? Они ведь всегда стоят на страже своих баснословных доходов…. После того, как я выяснила стоимость одного флакона антител — вопрос отпал сам по себе — цена фантастическая (см. в конце статьи), фармацевтическая промышленность только выиграет от изобретения.
Почему пишу эту статью? Хочу объяснить механизм, как можно заставить иммунитет самостоятельно уничтожить опасную опухоль.
Иммунитет состоит из разных клеток. Чтобы легче воспринимать информацию, я постараюсь обойтись минимумом специальной медицинской терминологии. Если говорить в общем, то в иммунная система — это ее активаторы (стимуляторы) и тормоза (ингибиторы). Именно баланс между ними свидетельствует об сильном иммунитете, который справится с любой болезнью.
Как работает иммунитет. Т-лимфоциты: клетки хелперы, киллеры, супрессоры
Названные клетки (хелперы, киллеры и супрессоры) относятся к Т-лимфоцитам — это тип белых кровяных клеток, каждая из которых исполняет определенную функцию. Главное задание иммунитета — уметь распознавать свои и чужие клетки. С этим отлично справляются Т-хелперы — они идентифицируют чужака или свою поврежденную клетку и стимулируют иммунный ответ, вызывая к работе клетки Т-киллеры, клетки-фагоциты и усиленный синтез антител.
Причина гибели — кусочки мембраны, оставленные на их поверхности Т-киллером. Кусочки мембраны вызывают сквозное отверстие в той клетке, к которой они прикоснулись, ее внутренняя среда начинает напрямую сообщаться с внешней — клеточный барьер нарушается. Обреченная клетка раздувается водой, из нее выходят белки цитоплазмы, органеллы разрушаются… Она погибает, а дальше к ней подходят фагоциты и пожирают ее остатки.
Именно Т-киллеры осуществляют агрессивный иммунный ответ при помощи усилителей — Т-хелперов.
Реклама MEDICINETEASER
Как опухоль пытается обмануть иммунную систему
Нобелевская премия по медицине-2018: в чем суть открытия
Оба ученых-лауреата шли к открытию разными путями. Давайте рассмотрим что исследовал каждый из них и как им удалось заставить иммунитет справиться с онкологией.
Джеймс Эллисон сумел разблокировать иммунную систему с помощью антител против белка-тормоза. Доктор изучал действие определенного клеточного белка Т-лимфоцитов (условное название CTLA-4). Он пришел к выводу, что этот белок тормозит работу Т-лимфоцитов.
Ученый искал пути, как разблокировать иммунною систему. Ему пришла идея разработать антитело, которое свяжет белок-тормоз и заблокирует его функцию подавления иммунной системы. Джеймс Эллисон провел ряд экспериментов с мышами, зараженными раком. Его интересовал вопрос, поможет ли блокада белка (CTLA-4) антителами освободить иммунную систему для атаки раковых клеток.
Больных раком лабораторных мышей удалось вылечить с помощью терапии антителами, которые сняли торможение иммунного ответа и разблокировали противоопухолевую активность Т-лимфоцитов.
В 2010 году доктор Эллисон провел клинические исследования пациентов, больных меланомой (рак кожи). У части больных полностью исчезли остаточные следы рака кожи — как следствие иммунотерапии.
Вот так это выглядит на инфографике, созданной Нобелевским комитетом.
Слева на рисунке видно белок-тормоз и клеточный рецептор. Усилитель не работает (зеленый пупырышек). Справа — антитела (зеленого цвета) против CTLA-4 блокируют функцию торможения лимфоцитов, белок-тормоз нейтрализован антителом, клеточный усилитель подает усиленный сигнал иммунной системе и Т-лимфоциты начинают атаковать раковые клетки.
Молекула белка CTLA-4 появлялась только на активированных Т-клетках. Заслуга Эллисона в том, что он предположил, что все наоборот: CTLA-4 появляется на активированных клетках специально, чтобы их можно было остановить! То есть, на каждой активированной Т-клетке есть ингибирующая молекула, которая конкурирует за прием сигнала (и включение или выключение работы иммунитета).
Доктор Тасуку Хондзё на несколько лет раньше также открыл белок-тормоз (PD-1 ), расположенный на поверхности клеток лимфоцитов. Тасуку Хондзё исследовал аналогичный белок иммунных клеток (PD1) и выяснил, что он работает как тормоз, не давая опухоли развиваться и блокируя Т-киллеры.
Ученый также синтезировал антитела к PD-1, которые сняли блокировку и, как результат — усиленная иммунная атака на раковые клетки.

Как видите, одновременно оба ученые сделали открытие, как снять механизм торможения протеинами работы иммунной системы. После блокировки этих белков-тормозов антителами (к каждому конкретному протеину), развязываются руки иммунным клеткам и они активно убивают онкологические опухоли.
Обе блокирующие молекулы — CTLA-4 и PD-1 — и соответствующие им сигнальные пути назвали иммунными чекпоинтами (от англ. checkpoint — контрольная точка).
В настоящее время проводится множество тестов и клинических опытов в области иммунотерапии рака и в качестве цели тестируются новые контрольные белки, обнаруженные нобелевскими лауреатами.
Прошло не меньше 15 лет между открытиями чекпоинтов и одобрением лекарств на основе их ингибиторов. Сейчас применяют шесть таких препаратов: один блокатор CTLA-4 и пять блокаторов PD-1. Почему блокаторы PD-1 оказались удачнее? Дело в том, что клетки многих опухолей тоже несут на своей поверхности PD-L1, чтобы блокировать активность Т-клеток. Таким образом, CTLA-4 активирует Т-киллеры в целом, а PD-L1 более специфично действуют на опухоль. И осложнений в случае блокаторов PD-1 возникает несколько меньше. Источник
Какие препараты используют для иммунотерапии рака: название, стоимость
В нашей стране используют препараты для иммунной терапии онкологических опухолей. Большинство из них недоступны по цене для обычных больных.

К ним относятся:
- пембролизумаб (“Китруда”) — эффективен при раке легкого, меланоме
- ниволумаб (“Опдиво”) — эффективен при раке почки, меланоме
- ипилимумаб (“Ервой”)
- атезолизумаб (“Тецентрик”)
Препарат Китруда — представитель группы моноклональных антител. Его особенностью является возможность получения благоприятных результатов даже при лечении метастатических форм злокачественных опухолей. Несмотря на то что в России Кейтруда зарегистрирован в конце 2016 года, купить его практически не возможно даже в Москве и Санкт-Петербурге. Наши сограждане заказывают лекарство в странах Европы — Бельгии, Германии.
Стоимость одного флакона Кейтруда составляет 3290 евро.
Опдиво — более дешевый аналог Китруды.
Препарат Ервой. В качестве монотерапии назначают взрослым и детям старше 12 лет в дозе 3 мг/кг. Ервой вводят внутривенно на протяжении полутора часов каждые 3 недели в количестве четырех доз на курс лечения. Только по окончании терапии можно оценивать эффективность средства и ответную реакцию пациента.
Цена одного флакона препарата Ервой зависит от дозировки действующего вещества и составляет 4200 — 4500 евро за флакон 50 мг/10 мл и 14900 — 15 000 евро за флакон 200 мг/40 мл.
Тецентрик — препарат для терапии уротелиального рака, а также немелкоклеточного рака легких. Препарат можно купить не везде. Приобрести его можно в специализированных аптеках США, в Ватикане, в некоторых аптеках Германии, а также под заказ он поставляется в Израиль. Атезолизумаб является моноклональным антителом, специфичным к белку PD-L1.
Стоимость его – различная, в зависимости от того, где вы его приобретаете и через какую цепочку посредников он вам достался, составляет от 6,5 до 8 тыс. долларов США за один флакон.
Как видите, цена лечения не каждому по карману. Будем надеяться, что со временем, антитела против рака станут более доступными.
Как итог статьи. За внедрение своих разработок в лечение больных раком Нобелевская премия по медицине-2018 присуждена Нобелевским лауреатам 2018 года: Джеймс Эллисон (James Patrick Allison) и Тасуку Хондзё (Tasuku Honjo). Оба ученые сделали открытие, как снять механизм торможения протеинами работы иммунной системы и помочь иммунным клеткам расправиться с опухолью.
Посмотрите объяснения к открытию Нобелевских лауреатов в этом видео:
Прошу читателей: если статья понравилась — поделитесь информацией в соц. сетях — многие могут искать подобную информацию.
Будьте здоровы и берегите собственный иммунитет — тогда рак вас не коснется!
11 декабря 2015
- 4120
- 3,4
- 0
- 8
![]()
Татьяна Ожаровская
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Медицина перешла на новый уровень: клетки стали живым лекарством
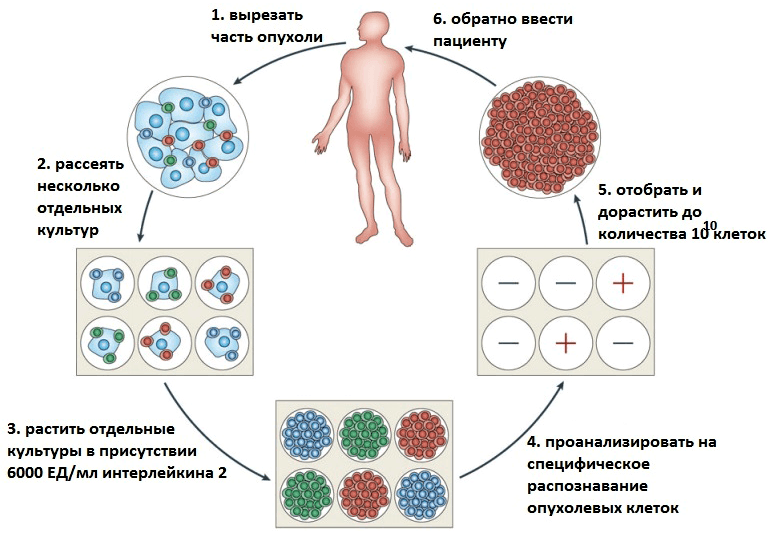
Рисунок 1. Схема получения антиопухолевых Т-клеток для адоптивной иммуноцитотерапии. Рисунок из [3].
Впервые метод адоптивной иммуноцитотерапии был описан еще в 1988 году — у пациентов с метастатической меланомой (то есть раком кожи на четвертой стадии) наблюдалась регрессия заболевания при терапии с помощью их TIL-клеток (лимфоцитов, инфильтрующих опухоль) [2]. В настоящее время терапия метастатической меланомы на основе TIL-клеток является наиболее эффективным способом лечения данного заболевания, поскольку регрессия опухоли наблюдается у половины пациентов [3].
Необходима система наведения
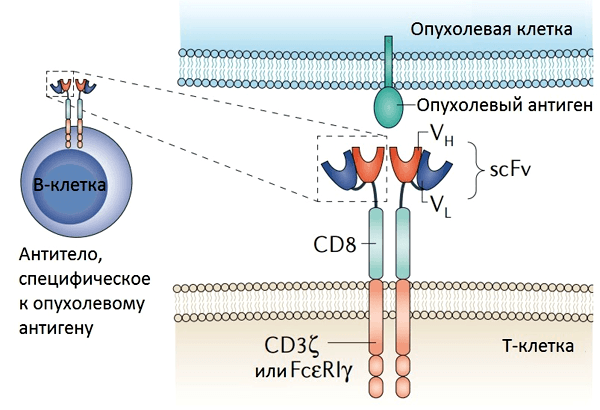
Рисунок 2. Структура химерного антигенного рецептора (CAR). CAR состоит из внеклеточного домена (одноцепочечного вариабельного фрагмента антитела (scFv)), соединенного с помощью цепей и трансмембранных доменов с цитоплазматической сигнальной областью. Гены, кодирующие scFv, получены из В-клеток, продуцирующих антитела, специфичные к опухолевому антигену. CAR существует в виде димера, и распознавание опухоли происходит напрямую (без участия MHC). Рисунок из [5].
Все новое — это хорошо забытое старое. Первые Т-клетки с химерным антигенным рецептором были получены командой ученых под руководством профессора Эсхара (Zelig Eshhar); результаты работы были опубликованы еще в 1989 году [6]. Эсхар понял, что, обладая данной техникой, Т-клетки можно запрограммировать на нацеленную атаку.
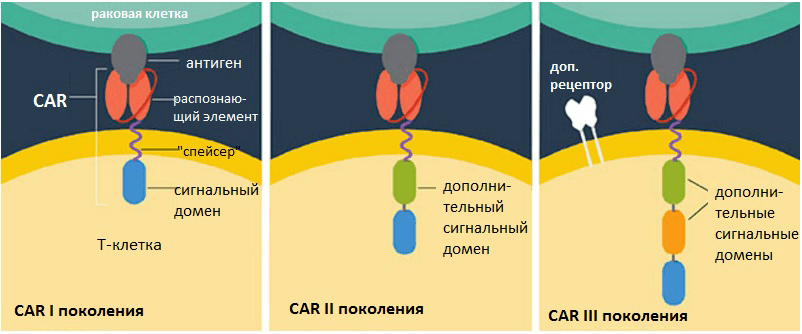

Рисунок 4. Бутылка с питательной средой для Т-клеток, которые после введения в них нового рецептора выращивают около 10 дней до достижения ими количества в несколько миллиардов. Тогда они могут быть введены в вены пациента. Рисунок из [9].
Первые клинические испытания генетически модифицированных Т-лимфоцитов, несущих химерные антигенные рецепторы, прошли в 2012 году. Они выпали на долю девочки по имени Эмили, больной острой лимфобластной лейкемией. После того, как генетически модифицированные Т-клетки были обратно введены девочке, ее состояние резко ухудшилось, и она провела несколько недель в отделении интенсивной терапии на искусственной вентиляции легких. В какой-то момент жизнь Эмили висела на волоске, но в итоге девочка поправилась, и уже три года в ее организме врачи не находят даже единичных раковых клеток [8].
Побочные эффекты новой терапии
Т-клетки взяли под контроль
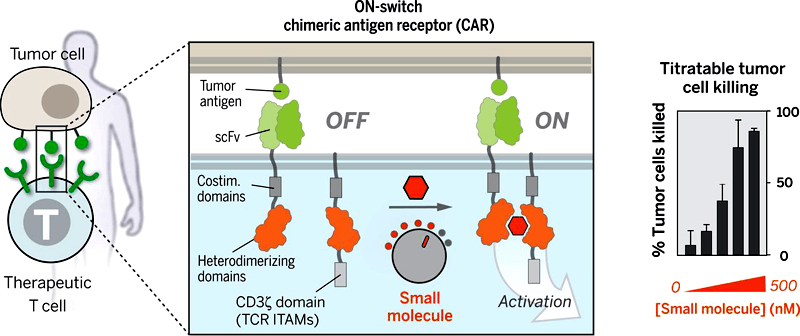
Иммунотерапия с помощью Т-клеток с CAR успешна против рака крови, но, когда дело доходит до твердых опухолей, которые образуются в толстой кишке, молочных железах, мозге и других тканях, модифицированные Т-клетки до сих пор не показывают высокой эффективности. Возможно, метод дистанционного управления Т-клетками позволит разработать более мощные версии химерных антигенных рецепторов, которые позволят Т-клеткам поражать твердые опухоли, при этом не обладая серьезными побочными эффектами.
За последние десятилетия наука серьезно продвинулась вперед в лечении рака. И хотя полная победа над этим заболеванием еще довольно далека, у врачей с каждым годом становится все больше эффективных инструментов для борьбы с опухолями.
Один из них – активизация собственного иммунитета человека против раковых клеток. Именно в иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов.
В чем плюсы и методы механизма, за открытие которого была присвоена Нобелевская премия, беседуем с заведующей дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидатом медицинских наук Еленой Россохой.

Заведующая дневным стационаром №3 Алтайского краевого онкологического диспансера, кандидат медицинских наук Елена Россоха. Фото: Юлия КОРЧАГИНА
- Елена Ивановна, расскажите, как в норме действует иммунный ответ на возникновение злокачественных клеток?
- Иммунитет – это уникальная способность организма защищать себя от губительного воздействия внешних и внутренних потенциально опасных факторов, каковыми являются, в том числе, и раковые клетки.
Давайте разберемся, что такое рак? В норме все клетки организма проходят строго определенные стадии развития, выполняют заданные функции, размножаются по установленным правилам, а со временем стареют и умирают. Эта запрограммированная обязательная смерть нормальных клеток называется апоптоз. Но иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной.
Опухолевые клетки ежедневно появляются в организме любого человека и отличаются от здоровых наличием аномального белка - ракового антигена. Но в норме иммунитет вовремя распознает угрозу и уничтожает чужеродные элементы с помощью Т-лимфоцитов и других компонентов.
Кстати
Доказано, что если иммунитет подавлен ( ВИЧ , терапия иммуносупрессорами после пересадки органов), то риск развития онкологических заболеваний высок. И наоборот, раковые опухоли могут проходить сами собой без какого-либо специального лечения. Это явление получило название синдрома Перегрина по имени молодого священника, жившего в Италии в конце XIII века. У него была саркома (костная опухоль), требующая ампутации ноги. Хирургия тех времен не могла ему помочь, и юноше оставалось только уповать на Бога. Спустя некоторое время опухоль чудесным образом исчезла, а Святой Перегрин прожил долгую жизнь и умер в возрасте 80 лет без признаков рецидива.
- Почему же в какой-то момент иммунитет ослабляет свою защиту?
-В настоящее время механизмы взаимодействия опухолей и иммунной системы активно изучаются.

В иммуноонкологии сегодня проводится максимальное количество исследований и разрабатывается наибольшее число противоопухолевых препаратов. Фото: Юлия КОРЧАГИНА
Кстати
За открытие иммунных контрольных точек PD-1 и CTLA-4, американцу Джеймсу Эллисону и японцу Тасуко Хондзё в 2018 году была вручена Нобелевская премия. Это открытие позволило совершить прорыв в лечении некоторых ранее смертельных опухолей.
- В чем отличие иммунотерапии от других видов лекарственного противоопухолевого лечения?
- Можно сказать, что открытие принципов иммунотерапии изменило саму парадигму противоопухолевой терапии. Раньше в ее основе лежало воздействие на опухолевую клетку. Сейчас в центре внимания онкологов находится иммунная система человека, возможности ее перепрограммирования и восстановления способности самостоятельно противостоять злокачественным опухолям.
- Какие виды опухолей можно лечить с помощью иммунотерапии, и какова эффективность такого лечения?
- В первую очередь, это распространенные метастатические процессы, 3 и 4 стадии рака, когда удалить злокачественное новообразование с помощью операции невозможно. Что касается видов опухолей, то иммунотерапию можно применить практически ко всем из них. Рак легкого, мочеполовой системы у мужчин и женщин, молочной железы, различные виды лимфом, опухоли головы и шеи, меланома.
Кстати, впервые подобные препараты начали использовать именно при меланоме. Это очень агрессивные опухоли, характеризующиеся быстрым ростом и метастазированием. Еще несколько лет назад такие пациенты, даже получая специальное противоопухолевое лечение, жили максимум шесть месяцев. Сейчас благодаря иммунотерапии, медиана выживаемости для них выросла до нескольких лет.
В лечении злокачественной меланомы достигнут самый высокий прогресс. Пожалуй, самый известный онкобольной, излечившийся благодаря иммунотерапии, бывший презедент США Джимми Картер. В возрасте 90 лет он сообщил об успешно перенесенной операции по удалению опухоли печени. Однако вскоре стало известно, что это - метастаз меланомы, тогда же были выявлены и метастазы в головной мозг. Немедленно начатая иммунотерапия дала результаты - уже через год лечения сообщалось, что у экс- президента не обнаружено никаких следов онкологических образований.
Вообще, в последние годы темпы появления новых лекарств для борьбы с опухолями, ускорились в геометрической прогрессии. Сейчас любая уважающая себя фармацевтическая компания одновременно разрабатывает десятки молекул. Не факт, что из каждой из них на выходе появится новый противоопухолевый препарат, но, тем не менее, благодаря такой высокой заинтересованности производителей, в мире регулярно появляются новые эффективные лекарства.
- Если механизм иммунотерапии так эффективен, прост и органичен замыслу самой природы, почему одним пациентам назначают такие препараты, а другим, с таким же диагнозом, - нет?
- Рак настолько сложное заболевание, что вряд ли когда-нибудь будет придумано универсальное лекарство от этой болезни. Поэтому и иммунотерапия – это не панацея, а всего лишь еще одна очень хорошая лекарственная опция.
Почему мы не назначаем одинаковые препараты пациентам с одинаковыми диагнозами - а что вы считаете одинаковым диагнозом? Это раньше мы лечили рак легкого, рак груди, рак почки и так далее. Сейчас пациента с таким определением статуса болезни ни один врач не сможет лечить эффективно.

Иногда у обычной клетки в силу ряда причин происходит сбой в программе деления – она приобретает способность делиться очень быстро и бесконечное количество раз, становится потенциально бессмертной - злокачественной. Фото: Юлия КОРЧАГИНА
Ученые давно доказали, что не существует абсолютно одинаковых раков. Поэтому мы сейчас лечим не опухоли, а их особенности - наличие определенных биомаркеров. В иммунотерапии это уровень экспрессии рецептора PD-L1 на опухолевых клетках. И чем этот уровень этот выше, тем более результативным будет лечение. Вот почему персонализация - тренд современной онкологии.
Онкологи уже научились применять иммунопрепараты не только в монорежиме, но и эффективно использовать их в сочетании с химиопрепаратами, таргетными и даже другими иммунными препаратами. Причем, комбинация двух или нескольких средств, как правило, имеет синергетический эффект, они многократно усиливают действие друг друга.
Полностью излечить метастатический процесс, к сожалению, нельзя. Наша задача, чтобы пациент жил долго и в хорошем качестве. И сегодня мы научились переводить рак в длительное хроническое течение, назначая последовательную терапию при прогрессировании заболевания.
- Может ли человек сам, не дожидаясь лечения в стационаре, купить иммунологический препарат и начать его использовать самостоятельно? Ведь многие из них выпускаются в форме таблеток – ничего сложного.
- Ни в коем случае! Любой иммунологический препарат должен приниматься под контролем врача, имеющего опыт работы с подобными средствами.
Иммунологические препараты при неграмотном применении могут вызывать тяжелые побочные явления. Например, у пациента появилась высокая температура, кашель одышка. Что это – аутоиммунная или обычная пневмония? Знать это крайне важно, ведь при схожем названии тактика лечения будет принципиально различной.
Токсичная реакция на иммунологический препарат может развиться как через несколько дней, так и через несколько лет после его применения, может пройти почти сразу, а может сохраняться годами. Понимание первопричин каждого из явлений крайне важно для его успешного лечения.
Конечно, такие тяжелые побочные эффекты развиваются редко, поэтому мы успешно лечим наших пациентов в условиях дневного стационара, однако быть готовыми к ним просто необходимо. Тем более не понятно, зачем так рисковать собственным здоровьем, ведь все препараты есть в наличии в диспансере, и пациенты получают их абсолютно бесплатно. А это отнюдь немалые деньги – одно введение такого препарата может стоить 500 тысяч рублей, а общий курс составляет до 18 процедур.
- Почему так дорого?
- Разработка нового иммунологического препарата стоит порядка миллиарда долларов. Это многоуровневый процесс, в ходе которого сначала изучаются общие и специфические свойства препарата, потом его тестируют на животных, затем на добровольцах, следующим этапом изучают степень его токсичности, и так далее.
На входе может стартовать десять потенциальных лекарств, а лет эдак через двадцать к финишу придет лишь один препарат. И только семь лет после разработки формула защищается патентом, по истечении этого срока буквально на следующий день заранее скопированный препарат начинает продаваться гораздо дешевле. Вот производители и успевают отбить затраты и заработать на своем изобретении.
- Можно ли профилактически укрепить иммунитет конкретно против онкологии?
- К сожалению, это невозможно. Иммунитету все равно, против кого бороться, для него и раковая клетка и вирус гриппа – одинаково опасны. Он либо работает, либо нет. Чтобы увереннее противостоять, в том числе развитию злокачественных патологий, нужно укреплять свой иммунный ответ в целом. Рекомендации тут стандартные: здоровый образ жизни, отказ от вредных привычек, правильное питание, постоянный контроль за хроническими болезнями высокого онкориска. Кроме этого существуют и специфические меры профилактики, например, вакцинация против рака шейки матки.
Ну а если есть выраженные проблемы с иммунитетом – частые простуды, головные боли, усталость, упадок сил, сонливость, раздражительность – то лучше обратиться к врачу.
- Ваше мнение: действительно ли иммунотерапия – это прорыв в онкологии, как об этом сейчас говорят?
- Это несомненный прорыв. Появление современных иммунных препаратов коренным образом изменило подход к терапии злокачественных опухолей. У этой категории лекарств есть важная особенность: однажды получив полный ответ на иммунотерапию, мы сохраняем его на годы. У цитостатиков и таргетных препаратов такого нет, там этот эффект длится в среднем от полугода до года. То, что новые препараты дают возможность превратить ра нее считавшееся смертельным заболевание в контролируемую хроническую болезнь или полностью от нее излечиться, вселяет надежду в миллионы больных.
Да, мы пока не можем вылечить всех. Но можем выделить иммунозависимую популяцию и полечить ее. Например, для рака легкого это около 25% всех пациентов. Это уже немало!
Бывает, что опухоли уходят полностью, как в случае со Святым Перегрином, однако следует признать, что это случается крайне редко. Чаще – они значительно уменьшаются в размерах или полностью регрессируют и такое состояние при назначении иммунотерапии может длиться очень долго. Сейчас все эти эффекты изучаются более активно, и я уверена, что ученых ждет еще масса революционных открытий.
Читайте также:


