Сутент при раке почки ведение больных
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Рак почки (РП) – одно из наиболее распространенных онкоурологических заболеваний. Около 210 тыс. новых случаев РП диагностируется в мире ежегодно, что в структуре онкологической заболеваемости составляет примерно 2% [1].
В 2007 году в России выявлено 16770 больных со злокачественными новообразованиями почки, что составило 4,13% у мужчин и 2,87% у женщин среди всех злокачественных новообразований. По темпам прироста онкологической заболеваемости в России РП устойчиво занимает третье место после рака предстательной и щитовидной железы (35,83 %). Ежегодно в России от РП умирает более 8 тыс. человек. Стандартизованный показатель заболеваемости населения России злокачественными опухолями почки – 8,09 на 100 тыс. населения [2].
Рост заболеваемости РП частично обусловлен как улучшением диагностики на основе современных инструментальных исследований, таких как трансабдоминальное ультразвуковое исследование (УЗИ) и компьютерная томография (КТ), магнитно–резонансная томография (МРТ), так и ростом истинной заболеваемости РП. В настоящее время в 25–40% случаев заболевание выявляют случайно при профилактическом обследовании.
РП относится к агрессивным и непредсказуемым в своем течении злокачественным опухолям. При первичном обращении у 25–30% больных имеются отдаленные метастазы, а после хирургического лечения больных с локализованной и местнораспространенной стадиями заболевания вероятность возникновения рецидива и метастазов составляет 20–30% [1,3]. Наиболее часто метастатические очаги обнаруживают в легких (55%), лимфатических узлах (34%), костях (32%), печени (32%), надпочечниках (19%), контралатеральной почке (11%) и головном мозге (5,7%) [4].
Показатели общей выживаемости больных диссеминированным РП также разочаровывают: медиана общей выживаемости не превышает 13 месяцев, 5–летняя выживаемость – не более 5%, поэтому проблема лечения данной группы больных крайне актуальна [1,3].
Хирургическое вмешательство – единственный эффективный метод лечения РП, позволяющий излечить большинство больных на ранних стадиях заболевания [5].
Злокачественные опухоли почки нечувствительны к химиотерапии и гормонотерапии, что обусловлено наличием гена множественной лекарственной устойчивости РП. Несмотря на наличие эстрогеновых рецепторов в почечно–клеточных опухолях, использование гормональных препаратов не приводило к улучшению результатов лечения. Общий ответ на гормональную и химиотерапию составляет менее 5% [5,6].
Лучевая терапия используется только у больных РП с нерезектабельными метастазами в головной мозг или костными метастазами, не отвечающими на другие консервативные методы лечения. Лучевая терапия костных метастазов позволяет значительно снизить болевой синдром и улучшить качество жизни больных [5].
На протяжении двух последних десятилетий неспецифическая иммунотерапия прочно занимала ведущие позиции в лечении метастатического РП. В настоящее время накоплен достаточный опыт применения препаратов интерферона–2 и интерлейкина–2, как в монорежиме или в сочетании друг с другом, так и в комбинации с различными химио– и гормонопрепаратами. Суммарный ответ на иммунотерапию колеблется от 10 до 20%, при этом эффект лечения нестойкий, ремиссии непродолжительные, а частота побочных реакций остается высокой. По данным ряда исследователей, иммунотерапия цитокинами эффективна не более чем у 20% больных [6,7].
Во многих клинических исследованиях убедительно доказано влияние целого ряда прогностических параметров на результаты лечения цитокинами и выживаемость больных РП. В 1999 г. R. Motzer и соавт. на основании многофакторного анализа выделили 5 независимых параметров, коррелирующих с выживаемостью 670 больных диссеминированным РП, наблюдавшихся в Memorial Sloan–Kettering Cancer Center (MSKCC) с 1975 по 1996 г. Неблагоприятными прогностическими факторами являлись: соматический статус по шкале Карнофского 10 мг/дл), уровень гемоглобина
В 2002 году этот же автор усовершенствовал данную прогностическую модель и продемонстрировал ее эффективность в отношении 463 больных распространенным РП в качестве первой линии системной терапии. Медиана выживаемости больных в группах плохого, умеренного и благоприятного прогноза составила 5, 14 и 30 месяцев соответственно [9].
Отсутствие эффективного и безопасного метода лечения диссеминированного РП послужило причиной дальнейшего поиска новых вариантов и подходов.
РП встречается в виде двух форм – наследственной и ненаследственной (спорадической). Возникновение спорадического РП в 65% связано с биаллельной инактивацией опухоль–супрессорного гена von Hippel–Lindau (VHL) посредством делеции, мутации или метилирования [10].
Гиперэкспрессия факторов роста и их рецепторов, возникающая в результате инактивации опухоль–супрессорного VHL гена, является важнейшим механизмом активации ангиогенеза в опухолевой ткани и представляет собой потенциальную терапевтическую цель при распространенном ПКР [10,11].
В условиях нормоксии α –субъединица фактора, индуцированного гипоксией (HIF– α – Hypoxia–Inducible Factor– α ) связывается с белком–продуктом гена VHL, который стимулирует разрушение HIF– α по протеосомному пути. При мутации гена VHL HIF– α аккумулируется и активизирует транскрипцию элементов, индуцированных гипоксией, и приводит к гиперэкспрессии сосудисто–эндотелиального фактора роста (VEGF – Vascular Endothelial Growth Factor), тромбоцитарного фактора роста (PDGF – Platelet–Derived Growth Factor) и трансформирующего фактора роста α и β (TGF– α и β –transforming growth factor), которые активируют расположенные вблизи опухолевой ткани клетки эндотелия для построения новой сосудистой сети. Рост сосудов приводит к увеличению поступления в опухолевую ткань кислорода и питательных веществ, что позволяет опухоли развиваться и дальше [10,11].
Прогресс в понимании молекулярной биологии привел к открытию новых препаратов для лечения метастатического РП, относящихся к группе ингибиторов ангиогенеза: сунитиниб ( Сутент), сорафениб, темсиролимус, бевацизумаб и другие. Основным патогенетическим механизмом всех этих препаратов является антиангиогенный эффект, направленный на предотвращение неоангиогенеза опухоли [5].
В 2007 году для лечения метастатического РП в России зарегистрирован таргетный препарат Сутент (сунитиниб). Сунитиниб – таблетированный ингибитор тирозинкиназ, который воздействует на все известные виды рецепторов к PDGF и VEGF (VEGFRs, PDGFR– α , PDGFR– β , c–KIT и FLT–3), участвующих в процессе роста опухоли, патологическом ангиогенезе и метастазировании.
Сунитиниб продемонстрировал эффективность в двух последовательных многоцентровых исследованиях 2 фазы у пациентов с метастатическим РП, не получивших эффекта от терапии цитокинами (интерферон– α 2 и интерлейкин–2) (табл. 1). Дизайн обоих исследований 2–й фазы был идентичный: включали больных метастатическим РП, спрогрессировавших после первой линии цитокиновой иммунотерапии с наличием измеряемых очагов, соматический статус по шкале ECOG 0 или 1 (ECOG – Eastern Cooperative Oncology Group). Сунитиниб назначали циклами по 6 недель (50 мг перорально, 1 раз в сутки): 4 недели лечения с последующим 2–недельным перерывом до прогрессирования заболевания, развития выраженных побочных эффектов или прекращения участия в исследовании по желанию пациента [12,13].
В первое исследование II фазы было включено 63 больных преимущественно со светлоклеточным метастатическим РП (87%). Медиана времени до прогрессирования заболевания составила 8,7 месяцев, в то время как медиана общей выживаемости – 16,4 месяцев. У 25 из 63 пациентов (40%) зарегистрирован частичный ответ, у 17 больных (27%) зафиксирована стабилизация заболевания более 3 месяцев. Неблагоприятные явления 3 и 4 степени токсичности, связанные с лечением, чаще всего включали: нейтропению (13%), слабость (11%), диарею (3%), тошноту (3%) и стоматит (2%) [12].
Во второе исследование II фазы включили 106 больных со светлоклеточным метастатическим РП, перенесших предшествующую нефрэктомию. На основании прогностической модели MSKCC было включено 58, 39 и 4% больных с благоприятным, умеренным и плохим прогнозом соответственно. У 55 и 45% больных соматический статус по шкале ECOG соответствовал 0 и 1 соответственно. Частичный ответ зарегистрирован у 36 (34%) из 105 больных, и у 30 больных (29%) зафиксирована стабилизация заболевания более 3 месяцев. Токсические явления со степенью токсичности >3, связанные с лечением, включали нейтропению (16%), слабость (11%), кожные реакции на конечностях (7%), гипертензию (6%), стоматит (5%), диарею (3%) и в 2,4% случаев снижение фракции выброса левого желудочка [13].
По обновленным данным, во втором исследовании II фазы безрецидивная выживаемость составила 8,8 месяцев и медиана общей выживаемости – 23,9 месяца. 38 больных живы при медиане наблюдения 30 месяцев. По данным независимого центрального пересмотра данных, частота объективных ответов составила 33% [14].
После получения этих обнадеживающих данных было инициировано международное многоцентровое рандомизированное исследование III фазы, сравнивающее сунитиниб с интерфероном– α (ИНФ– α ) в качестве первой линии лечения у 750 больных метастатическим РП. Дизайн исследования включал наличие гистологически подтвержденного светлоклеточного РП, измеряемых очагов, соматический статус по шкале ECOG 0 или 1, отсутствие предшествующей системной терапии. В исследование включали преимущественно больных с благоприятным и промежуточным прогнозом на основании прогностической модели MSKCC. Группы были сбалансированы по основным демографическим и прогностическим критериям. Пациентов рандомизировали 1:1, по 375 человек в каждую лечебную группу, режим дозирования сунитиниба 50 мг ежедневно в течение 4 недель, затем перерыв – 2 недели или ИНФ– α подкожно 3 раза в неделю в дозе 3 млн. ЕД на первой неделе, 6 млн. ЕД на второй неделе и 9 млн. ЕД впоследствии [15].
Медиана безрецидивной выживаемости оказалась существенно более продолжительной для больных, принимавших сунитиниб (11 месяцев), чем для тех, кто принимал ИНФ– α (5,1 месяцев), p α . В группе промежуточного и плохого прогноза медиана безрецидивной выживаемости была также более продолжительной в группе больных, принимавших сунитиниб, чем у пациентов, получавших ИНФ– α (10,8 мес. против 3,8 мес. и 3,9 мес. против 1,2 мес., соответственно) [15–17].
Окончательный анализ общей выживаемости продемонстрировал, что медиана общей выживаемости в группе сунитиниба составила более 2–х лет (26,4 мес.), по сравнению с 21,8 мес. в группе принимавших ИНФ– α (р=0,051). Медиана общей выживаемости после цензурирования больных, перешедших из группы интерферона– α в группу сунитиниба, составила 26,4 мес. для леченных сунитинибом и 20 мес. для больных, принимавших интерферон– α (р=0,0362) [16,17].
Согласно двум исследовательским и независимой центральной оценкам объективный ответ статистически значимо (p α (8%) (табл. 2). Независимая оценка зафиксировала частичный ответ у 143 пациентов (39%), получавших сунитиниб, и у 29 пациентов (8%), получавших ИНФ– α . Стабилизация заболевания наблюдалась у 146 пациентов (40%), получавших сунитиниб, и у 165 пациентов (48%), получавших ИНФ– α [16,17].
Наиболее часто сообщаемые негематологические побочные эффекты всех степеней в клиническом исследовании III фазы включали диарею, утомляемость, тошноту, изменения ротовой полости, рвоту, гипертонию и ладонно–подошвенный синдром. Наиболее клинически значимые негематологические побочные эффекты 3 и 4 степени тяжести выявлялись более часто в группе сунитиниба, чем в группе пациентов, получавших ИНФ– α (p α , чем сунитиниб (12% против 7%, p α (p α (23%), в сравнении с сунитинибом (16%) [16].
Следует отметить, что общая частота зарегистрированных побочных эффектов 3 и 4 степени тяжести относительно низка и составляет не более 10%, а большинство побочных эффектов обратимы и не заканчиваются прекращением приема сунитиниба. При необходимости нежелательные явления могут быть купированы подбором дозы или перерывом в приеме препарата. Сунитиниб обладает важным преимуществом по сравнению с другими ингибиторами тирозинкиназ: препарат выпускается в трех различных дозировках (50 мг, 37,5 мг, 25 мг), что предоставляет врачу возможность гибко регулировать дозу в зависимости от выраженности токсических проявлений.
В настоящее время исследование препарата продолжается в качестве адъювантного лечения в двух крупных исследованиях по изучению безрецидивной выживаемости больных, принимавших сунитиниб, сорафениб или плацебо ( ASSURE ) и по использованию сунитиниба или плацебо у пациентов высокого риска с Т3, Т4 или N+ заболеванием ( S–TRAC ). Кроме того, планируется изучение роли сунитиниба у больных с несветлоклеточным вариантом опухоли почки и сочетание с другими таргетными или химиотерапевтическими препаратами.
Заключение . Данные многоцентровых рандомизированных клинических исследований, изучавших Сутент (сунитиниб) в качестве первой и второй линии лечения на большой когорте больных метастатическим РП, показали его высокую эффективность при низкой частоте зарегистрированных побочных эффектов. В настоящее время Сутент является безопасным и эффективным препаратом для лечения больных метастатическим РП благоприятного и промежуточного прогноза и может быть рекомендован как препарат выбора у данной группы пациентов.
- КЛЮЧЕВЫЕ СЛОВА: Инлита, Торизел, Сутент, метастатический почечноклеточный рак
Последовательная таргетная терапия при метастатическом раке почки
Доцент Клиники медицинского колледжа Университета Case Western Reserve д-р Брайан Рини (Brian J. Rini, Кливленд, США) в своем докладе затронул такие вопросы, как эффективность и безопасность препаратов терапии первой линии, способы оптимизации лечения и возможности последовательного перехода с одной линии терапии на другую.
Одним из препаратов первой линии для лечения метастатического почечно-клеточного рака (мПКР) благоприятного и промежуточного прогноза с доказанной эффективностью уровня IA является сунитиниб. В рандомизированном международном исследовании фазы III сунитиниб (Сутент ® ) сравнивали с интерфероном (ИФН) альфа у пациентов с мПКР, ранее не получавших лечение [1]. Согласно результатам, медиана выживаемости без прогрессирования (ВБП) в группе сунитиниба была достоверно выше (11 месяцев), чем в группе ИФН-альфа (5 месяцев). Кроме того, использование сунитиниба приводило к достоверному увеличению частоты объективных ответов по сравнению с применением ИФН-альфа (47 против 12%; р ® ). Его эффективность и безопасность сравнивали с таковыми сорафениба в качестве терапии второй линии мПКР в рандомизированном исследовании AXIS [7]. Полученные данные показали определенные преимущества акситиниба: медиана ВБП у пациентов группы акситиниба была достоверно выше (р ® ) хорошо изучен и в большей степени продемонстрировал преимущества как препарат первой линии терапии у больных с неблагоприятным прогнозом.
Бесспорно, лечение всех форм почечно-клеточного рака – задача трудная. Дело в том, что полный ответ на терапию таргетными препаратами наблюдается редко, и пациенты с мПКР обычно нуждаются в длительном лечении. На сегодняшний день уже достаточно данных для оптимального выбора лечения не только в первой, но и во второй линии терапии больных распространенным раком почки. Как показывают результаты исследований, медиана ВБП у пациентов с рефрактерным мПКР при использовании акситиниба составляет 6,7 месяца, эверолимуса – 4,9 месяца, сорафениба – 4,7 месяца. При этом акситиниб рекомендуется во второй линии лечения мПКР независимо от предшествующей терапии – как после цитокинов, так и после ингибиторов тирозинкиназ. Безусловно, продолжение таргетной терапии в режиме третьей и последующих линий также способствует увеличению общей выживаемости.
Резюмируя сказанное, д-р Б. Рини отметил, что контроль над заболеванием и сохранение хорошего качества жизни больных мПКР – первоочередная задача врача. Способствовать этому должны в совокупности правильный выбор терапии и дозы препарата, оптимальные схемы лечения, контроль над побочными эффектами.
Мультидисциплинарный подход к терапии пациентов с метастатическим раком почки
Как отметил заместитель директора по науке Национального медицинского исследовательского радиологического центра им. П.А. Герцена, д.м.н., профессор Борис Яковлевич АЛЕКСЕЕВ, основными целями мультидисциплинарного подхода к лечению больных являются:
- скоординированное высокоэффективное взаимодействие медицинских специалистов для своевременного назначения и
проведения всего запланированного объема лечения; - профилактика и коррекция возникающих побочных эффектов для достижения необходимого продолжительного эффекта от проводимого лечения.
Решать эти две основные задачи обязаны члены мультидисциплинарной команды – онкоуролог, патоморфолог, химиотерапевт, лучевой терапевт, нейрохирург, ортопед, кардиолог, эндокринолог, торакальный, абдоминальный хирург.
Онкоуролог и химиотерапевт – два основных члена команды. Между тем в определении наиболее успешной тактики ведения больного мПКР особая роль отводится патоморфологической оценке опухоли. При выборе препарата крайне важно учитывать гистологический вариант. Эффективность препаратов при разных гистологических типах неравнозначна. Как показывают результаты исследований, сунитиниб, например, характеризуется высокой эффективностью у больных светлоклеточным мПКР, а темсиролимус – у пациентов с несветлоклеточным раком почки. Именно поэтому от квалификации патоморфолога и его умения интерпретировать данные гистологии зависит успех лечения.
Роль лучевой терапии в лечении больных мПКР не так велика. Вместе с тем она занимает определенное место в алгоритме ведения данных пациентов, особенно когда речь идет об облучении метастазов в головном мозге при невозможности проведения хирургического вмешательства.
Без терапевтов, кардиологов, эндокринологов и врачей других специальностей успешная профилактика и коррекция нежелательных токсических явлений весьма затруднительна.
Докладчик особо отметил роль хирурга, поскольку удаление метастатических очагов на сегодняшний день признано одним из наиболее эффективных способов лечения больных генерализованным ПКР. Исходя из обзора данных зарубежной литературы, пятилетняя выживаемость больных мПКР с метастазами в легких после метастазэктомии имеет место в 36% случаев. Согласно данным хирургического лечения метастазов рака почки в легких у 90 пациентов в Московском научно-исследовательском онкологическом институте им. П.А. Герцена, пятилетняя выживаемость может достигать 40%.
По словам профессора Б.Я. Алексеева, следует учитывать прогностические факторы, к которым относятся период до развития метастазов, характер операции, состояние внутригрудных лимфоузлов и количество метастазов.
Лечение больных раком почки с метастазами в костях предусматривает как радикальные оперативные вмешательства (сегментарная резекция костей с эндопротезированием, резекция костей таза, вертебрэктомия), так и паллиативные (чрескожный, погружной, накостный остеосинтез, малоинвазивная хирургия).
По мнению докладчика, сочетание хирургического вмешательства с таргетной терапией у больных мПКР приводит к улучшению результатов лечения. В подтверждение он привел клинический случай из собственной практики.
Больная С, 56 лет. Диагноз: рак левой почки T3bN2М1, метастазы в костях, легких. Пациентке 5 июня 2013 г. в связи с переломом позвонка была проведена ламинэктомия L2–L3 с транспедикулярной фиксацией L2–L5, назначена таргетная терапия Торизелом внутривенно в дозе 25 мг в неделю в течение трех недель. После этого больной выполнили нефрадреналэктомию слева, тромбоэктомию из нижней полой вены и парааортальную лимфаденэктомию. В начале августа 2013 г. у пациентки обнаружили метастатическое поражение головного мозга. 5 августа 2013 г. больной провели микрохирургическое удаление метастатической интракраниальной опухоли правой теменно-затылочной области с пластикой твердой мозговой оболочки. С сентября 2013 г. по настоящее время пациентка получает таргетную терапию Сутентом (сунитинибом). На фоне терапии отмечается стабилизация процесса в легких и костях.
Российские клинические рекомендации по ведению пациентов с мПКР
Учитывая назревшую необходимость в единых современных подходах к ведению пациентов с метастатическим почечно-клеточным раком, группа экспертов
(Б.Я. Алексеев, М.И. Волкова, А.С. Калпинский, А.Д. Каприн, В.Б. Матвеев, Д.А. Носов) под эгидой Ассоциации онкологов России разработала Клинические рекомендации по диагностике и лечению рака почки.
По словам ведущего научного сотрудника отделения клинической фармакологии и химиотерапии Российского онкологического научного центра им. Н.Н. Блохина, д.м.н. Дмитрия Александровича НОСОВА, эти рекомендации в большей степени совпадают с рекомендациями Ассоциации онкологов России и Российского общества клинической онкологии
(RUSSCO).
Докладчик ознакомил участников симпозиума с наиболее значимыми разделами новых клинических рекомендаций. Прежде всего он обозначил роль хирургических методов лечения при метастатическом процессе.
Выполнение паллиативной нефрэктомии рекомендовано больным в удовлетворительном общесоматическом состоянии
(ECOG ≤ 2).
Противопоказаниями к паллиативной нефрэктомии являются бурное прогрессирование процесса, высокий операционный риск, неудаляемая опухоль (местнораспространенный процесс), соматический статус ECOG ≥ 2.
Радикальное удаление солитарных и единичных метастазов рассматривается как возможная лечебная опция в хорошо отобранной группе больных ПКР с благоприятным прогнозом и индолентным биологическим течением процесса.
В настоящее время для лечения мПКР помимо ИФН-альфа и интерлейкина 2 зарегистрировано семь таргетных препаратов: ингибиторы VEGFR сунитиниб, сорафениб, пазопаниб, акситиниб, ингибиторы белка mTOR темсиролимус, эверолимус и моноклональное антитело
бевацизумаб.
Представленные в новых клинических рекомендациях режимы применения препаратов в большинстве своем стандартны и практически не отличаются от таковых международных рекомендаций. Отличия состоят лишь в появлении еще одного дополнительного режима назначения сунитиниба, альтернативного стандартному, и возможности повышения дозы
акситиниба.
Затем докладчик представил схему лекарственного лечения мПКР, включающего терапию первой и второй линии.
Терапия первой линии предусматривает:
- при наличии симптомов заболевания, а также у пациентов с неудаленной первичной опухолью использование сунитиниба, пазопаниба, бевацизумаба + ИФН-альфа;
- применение темсиролимуса у больных с неблагоприятным прогнозом;
- использование сорафениба в качестве альтернативной опции;
- при благоприятном прогнозе и удаленной первичной опухоли, отсутствии симптомов болезни, ограниченной распространенности процесса допустимо использование ИФН-альфа в монотерапии, но при условии тщательного мониторинга эффективности лечения и возможности применения таргетных препаратов при прогрессировании болезни.
Терапия второй линии предполагает:
- при прогрессировании после терапии ингибиторами тирозинкиназ назначение эверолимуса или акситиниба;
- при прогрессировании после терапии ИФН-альфа назначение сунитиниба, пазопаниба, акситиниба и сорафениба.
Завершая выступление, Д.А. Носов, основываясь на новых клинических рекомендациях, представил алгоритм назначения таргетных препаратов.
Если у ранее не леченного пациента с любым прогнозом имеются симптомы болезни, первичная опухоль, то в качестве стандарта терапии ему можно назначить сунитиниб, или комбинацию бевацизумаба + ИФН-альфа, или пазопаниб, а в качестве альтернативной
опции сорафениб.
У пациентов с неблагоприятным прогнозом стандартной терапией считается темсиролимус.
У пациентов с благоприятным прогнозом и без симптомов болезни, у которых удалена первичная опухоль, в отдельных случаях допускается назначение ИФН-альфа.
Терапия второй линии при прогрессировании после терапии ингибиторами тирозинкиназ предусматривает применение эверолимуса или акситиниба.
В случае прогрессирования после терапии ИФН-альфа возможно назначение сунитиниба, пазопаниба, акситиниба, сорафениба.
Существенное изменение подходов к лечению метастатического почечно-клеточного рака с использованием таргетной терапии позволило улучшить прогноз заболевания. Особая роль отводится последовательности назначения препаратов, оптимизации доз и режимов лечения, способствующих снижению токсичности и увеличению продолжительности терапии.
Согласно результатам большинства клинических исследований и клиническим рекомендациям по ведению больных мПКР, сунитиниб (Сутент ® ) является препаратом выбора в терапии первой линии, а препарат второго поколения ингибиторов тирозинкиназ акситиниб (Инлита ® ) – в терапии второй линии как после цитокинов, так и после ингибиторов тирозинкиназ. Темсиролимус (Торизел ® ) назначается в качестве терапии первой линии пациентам с неблагоприятным прогнозом.
Современный алгоритм ведения больных мПКР предусматривает оптимизацию терапии сунитинибом (Сутентом) при появлении токсических осложнений 3–4-й степени за счет перехода со стандартного приема сунитиниба 4/2 на прием 2/1. Оптимизация терапии акситинибом (Инлитой) при отсутствии токсических осложнений 3–4-й степени заключается в эскалации дозы акситиниба (Инлиты) с 5 мг два раза в день до 7 мг два раза в день после двух недель терапии и далее до 10 мг два раза в день.
На рак почки в структуре онкологических заболеваний приходится около 4%. По темпам прироста онкологической заболеваемости в России почечно-клеточный рак (ПКР) устойчиво занимает у женщин третье место после рака полости рта и глотки и центральной нервной системы (ЦНС), а у мужчин – четвертое место после рака предстательной и щитовидной желез и ЦНС. Ежегодно в России от рака почки умирают более 8 тыс. человек. Стандартизованный показатель заболеваемости населения России злокачественными опухолями почки составляет 8,09 на 100 тыс. населения [1]. Рост заболеваемости раком почки частично обусловлен как улучшением диагностики на основе современных инструментальных исследований, таких как трансабдоминальное ультразвуковое исследование (УЗИ), компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), так и ростом истинной заболеваемости раком почки. В настоящее время в 25–40% случаев заболевание выявляют случайно при профилактическом обследовании. Мужчины болеют в 2 раза чаще, чем женщины, в основном на 5–7-м десятилетии жизни. Частота почечно-клеточного рака постепенно увеличивается. Пятилетняя выживаемость при этой патологии достигает 60%. Однако при наличии метастазов 2-летняя выживаемость колеблется от 0 до 20%. От 25 до 50% больных имеют метастазы на момент установления диагноза. Более того, приблизительно у половины больных после радикальной нефрэктомии впоследствии появляются метастазы.
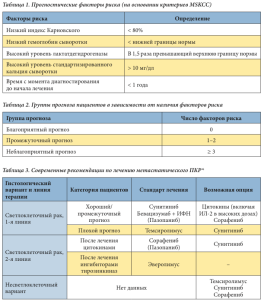
Ангиогенез является одним из ключевых патогенетических механизмов роста злокачественного новообразования и диссеминации опухолевого процесса, в связи с чем одними из основных целей противоопухолевой таргетной терапии являются внутриклеточные мишени, вовлеченные в процесс стимуляции ангиогенеза и опухолевого роста. В настоящее время разработано несколько препаратов, влияющих на разные внутриклеточные мишени, относящиеся к патогенетическому пути, связанному с инактивацией гена VHL. Сунитиниб – таблетированный ингибитор тирозинкиназ, который воздействует на все известные виды рецепторов к PDGF и VEGF (VEGFRs, PDGFR-a, PDGFR-b, c-KIT и FLT-3), участвующих в процессе роста опухоли, патологическом ангиогенезе и метастазировании. Препарат был одобрен в Европе с 2007 г. в качестве первой и второй линий терапии распространенного рака почки и в настоящее время рекомендован в качестве стандарта лечения больных с благоприятным и промежуточным прогнозом заболевания по критериям MSKCC (Memorial Sloan-Kettering Cancer Center) (табл. 1). Основываясь на числе имеющихся факторов риска, R.J. Motzer и соавт. [2, 3] предложили стратифицировать больных на три группы прогноза (табл. 2). На основании проведенных многоцентровых международных исследований [4–6] была разработана и предложена тактика проведения лечения данной болезни в зависимости от группы прогноза (табл. 3).
Материалы и методы
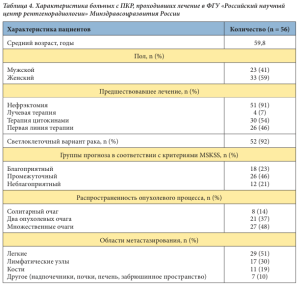
Мониторинг выполнялся каждые 30 дней. При визитах выявлялись нежелательные явления, проводились лабораторные исследования: биохимический анализ крови (глюкоза, билирубин общий, щелочная фосфатаза, аланиновая трансаминаза, аспарагиновая трансаминаза, мочевина, креатинин, коагулограмма), общий анализ мочи. Один раз в 3 месяца выполнялась КТ грудной клетки, брюшной полости, органов малого таза с болюсным усилением; один раз в 6 месяцев – остеосцинтиграфия, по показаниям – электрокардиограмма, при наличии клинических проявлений – КТ головного мозга.
Представлен анализ результатов лечения сунитинибом для пациентов с благоприятным и промежуточным прогнозом заболевания в первой и второй линии терапии (n = 44). Через 24 месяца терапии частичный ответ зарегистрирован у 15 (34%) из 44 больных, стабилизация – у 9 (20%) и регрессия – у 4 (9%). Помимо этого, у 12 (27%) больных отмечена стабилизация в течение 15 месяцев, у 4 (9%) больных – стабилизация в течение 9 месяцев с последующим прогрессированием заболевания (табл. 5). Шесть больных погибли в течение первых шести месяцев лечения. Данные больные относились к группе неблагоприятного прогноза метастатичес- кого ПКР, имели множественные метастазы, в большинстве случаев – костные.
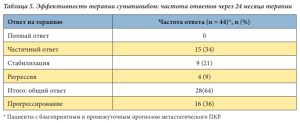
Основными побочными действиями препарата были повышение артериального давления, диарея, слабость. Степень тяжести побочных действий не превышала 2-й. Все побочные действия хорошо контролировались и медикаментозно купировались.
В процессе применения сунитиниба в стандартном режиме первой и второй линии терапии ПКР нами было выявлено, что безрецидивная выживаемость в общей исследуемой популяции больных почечно-клеточным раком в среднем составила 13 месяцев, общая выживаемость – 22 месяца. Было показано, что результаты терапии сунитинибом лучше в группе пациентов с единичными паренхиматозными метастазами, чем у больных, имеющих метастазы в кости и/или множественные метастатические очаги (> 2).
Применение сунитиниба у больных ПКР увеличивает общую и безрецидивную выживаемость. Терапия сунитинибом редко осложняется развитием выраженных нежелательных явлений (3–4-й степени тяжести), требующих проведения специального лечения и/или отмены проводимой терапии, и в целом хорошо переносится.
Литература:
1. Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2007 г. М., 2008.
2. Motzer R.J., Bacik J., Murphy B.A. et al. Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma // J. Clin. Oncol. 2002. Vol. 20. No 1. P. 289–296.
3. Motzer R.J., Hutson T.E., Tomczak P. et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma // N. Engl. J. Med. 2007. Vol. 356. No 2. P. 115–124.
4. Feldman D.R., Kondagunta G.V., Ronnen E.A. et al. Phase I trial of be- vacizumab plus sunitinib in patients (pts) with metastatic renal cell carcinoma (mRCC) // J. Clin. Oncol. 2009. Vol. 27. No 9. P. 1432–1439.
5. Минимальные клинические рекомендации Европейского общества медицинской онкологии (ESMO) / под ред. С.А. Тюляндина, Д.А. Носова, Н.И. Переводчикова. М.: Издательская группа РОНЦ им. Н.Н. Блохина РАМН, 2010. 436 с.
6. Giberti C., Oneto F., Martorana G. et al. Radical nephrectomy for renal cell carcinoma: long-term results and prognostic factors on a series of 328 cases // Eur. Urol. 1997. Vol. 31. No 1. P. 40–48
Читайте также:

