Сульфид аммония с хлором
Составление уравнений химических реакций представляется несложной операцией, смысл которой – подстановка формул веществ в общие схемы, например такие:
1) элемент + кислород = оксид;
2) металл + неметалл = соль;
3) активный металл + вода = основание + водород;
4) кислота + основание = соль + вода.
Однако известны реакции, не укладывающиеся в законы формальной логики. При записи правой части уравнений таких реакций требуется умение рассуждать, какие продукты получатся. Бывает, что процесс протекает в несколько стадий, зависит от мольных соотношений реагентов, температуры и т. п.
Ниже приведены неполные уравнения реакций, которые предлагали на подготовительных курсах в Российском медицинском университете (бывший 2-й Московский государственный медицинский институт им. Н.И.Пирогова).
Изучение этого материала включено в программу по химии для 9-го класса общеобразовательных школ. Здесь мы приводим составление уравнений повышенной сложности.
Заметим, что в нашем распоряжении имелись только задания, без ответов к ним. Попробуйте и вы самостоятельно сориентироваться в незнакомой ситуации. Подобные задачи часто встречаются на олимпиадах, в вопросах конкурсных экзаменов в вуз. Их можно использовать при организации школьных олимпиад.
1. Что случится с тремя предложенными веществами при нагревании? Активный металл магний восстанавливает хром из его оксида. Нитрат серебра при этом разлагается до металлического серебра, диоксида азота и кислорода. Кроме того, магний захватывает один из двух атомов кислорода молекулы NO2, переводя ее в монооксид NO, и связывает молекулярный кислород, полученный при разложении AgNO3. Схема процесса:
Заметим, что в зависимости от мольных соотношений реагентов Сr2О3 и AgNO3, например, равных 1:2 (вариант 1) или 1:1 (вариант 2), коэффициенты в уравнении реакции будут разными.
Поскольку в формуле Сr2О3 два атома хрома, то при составлении электронного баланса удваиваем число атомов хрома. Коэффициенты при атомах серебра и азота в варианте 1 равны 2, а в варианте 2 равны 1. Соответственно коэффициенты при атомах магния будут 7 (вариант 1) и 5 (вариант 2).
Считаем, что цинк и оксид меди(I) взяты в эквимолярных количествах, следовательно, в электронном балансе необходимо удвоить число атомов меди.
Запишем уравнение реакции с коэффициентами:
Предполагая, что выделяется газ NО2, определим коэффициенты в уравнении реакции.
Для уравнивания числа перемещенных электронов исходные вещества необходимо взять в мольных соотношениях:
3. Дело сводится к первоначальному взаимодействию хлора с водой:
Одна из образующихся кислот хлора – НСlO – в условиях реакции (нагревание) разлагается на хлористый водород и кислород:
Реакция обмена между соляной кислотой и гидрокарбонатом бария протекает с выделением углекислого газа и образованием соли ВаСl2 и воды.
Из уравнений реакций образования НCl видно, что для получения молекулы О2 требуется две молекулы Cl2. Остальные коэффициенты легко определяются:
Необычность уравнения в том, что в его левой и правой частях присутствуют формулы молекулы воды. Таким образом задаются условия протекания реакции (в водной среде).
6. Будем считать, что сначала протекает реакция обмена с образованием осадка карбоната бария:
Однако на этом реакция не останавливается. Сода Na2СO3 в водном растворе гидролизуется:
Образующаяся щелочь NaОН переводит кислый дигидрофосфат натрия NaH2PO4 в моногидрофосфат натрия Na2HPO4, а в избытке соды – в средний фосфат Na3PO4. Таким образом, одна формульная единица Na2СO3 осаждает ион бария Ba 2+ в виде BaCO3 и еще четыре Na2СO3 требуются для связывания четырех протонов от Ba(H2PO4)2.
Коэффициент в уравнении перед Na2СO3 – 5. В результате конечное уравнение имеет вид:
Заключительное уравнение имеет вид:
8. Предположим, что хлорид железа(III) вступает в реакцию ионного обмена с сульфидом аммония. Образующийся при этом сульфид железа(III) тут же разлагается водой с осаждением гидроксида железа(III) и выделением газообразного сероводорода. Уравняем прежде всего число атомов хлора и ионов аммония, затем определим остальные коэффициенты:
9. Кислотный оксид NO2 с водой образует азотную кислоту и в качестве побочного продукта – оксид азота(II) NO:
Это окислительно-восстановительная реакция диспропорционирования. Одни атомы азота в диоксиде NO2 отдают электроны (окисляются), другие – принимают эти электроны (восстанавливаются).
Расставим коэффициенты в промежуточном уравнении (1):
Оксид азота NO улетучивается, а азотная кислота взаимодействует с питьевой содой NaНСО3. Сильная кислота НNO3 вытесняет слабую кислоту Н2СО3 из ее соли NaHСО3. Образующаяся угольная кислота Н2СО3 неустойчива и разлагается на углекислый газ и воду:
Все сказанное, просуммировав, можно записать одним уравнением:
Здесь, как и в задании 3, вода фигурирует в левой и правой частях уравнения. На первой стадии процесса (1) вода расходуется, а на второй стадии (2) вода выделяется.
В мягких условиях возможно образование солей двух кислот азота – азотной и азотистой:
10. В результате реакции обмена, протекающей в твердой фазе, образуются нитрат аммония и дигидрофосфат калия:
Вариант 1. При нагревании твердый нитрат аммония NH4NO3 разлагается:
Термическое разложение КН2РО4 приводит к метафосфату калия:
Суммарное уравнение процесса:
Вариант 2. Можно предположить, что при нагревании исходной смеси сначала разложится нитрат калия с выделением кислорода и образованием нитрита калия:
Дальнейшая реакция обмена:
Термолиз нитрита аммония происходит с образованием азота N2 и воды:
Из KН2PO4, как и в варианте 1, при нагревании получается метафосфат калия и вода.
Итоговое уравнение этого варианта реакции:
В реакции мольное соотношение реагентов:
Здесь наряду с ожидаемыми AlPO4 и NО2 получается оксид Р2О5.
Если отношение количеств вещества
то кроме AlРО4 и NO2 в реакции образуется кислород:
Вариант 2. Предполагая, что нитратный азот восстанавливается до степени окисления +2 (оксид NО), имеем:
В этом случае, как и в реакции из варианта 1, фосфорная компонента оказывается в избытке по отношению к мольному количеству ионов алюминия, с которым она образует соль AlPO4.
12. Сначала более активный неметалл углерод (ЭО(С) = 2,5, ЭО(Si) = 1,8) восстанавливает кремний из его оксида:
Затем углерод соединяется с кремнием, образуя карбид углерода – карборунд:
Азот - один из важнейших элементов органической химии. В виде сложных соединений элемент N является важной частью белков, из которых состоят все живые организмы на нашей планете. Этот достаточно активный химический элемент образует множество соединений, одним из которых является соединение аммония.
Что это такое
В молекуле аммиака азот охватывает своими ковалентными связями три атома водорода, причем последняя электронная связь остается свободной. Таким образом, аммоний может выступать донором различных химических реакций, образовывая четвертую – незатраченную ковалентную связь с другими веществами и соединениями. Если такое соединение происходит с атомом водорода, образуется молекула NH4. Полученный элемент может реагировать с различными кислотами, которые находятся в растворенном или концентрированном виде. При взаимодействии аммиак их нейтрализует. В итоге реакции получаются соли аммония - термически неустойчивые соединения. Если соль аммония нагревать, она быстро разлагается на составляющие вещества. При повышении температуры образуется аммиак с кислотой. Возможен и обратный процесс. Например, при взаимодействии с сероводородной кислотой можно получить сульфид аммония.
Формула
Это соединение записывается в химических уравнениях в видеследующей формулы.
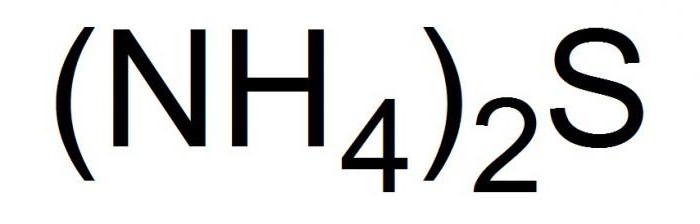

Распространенные химические реакции
Гидролиз сульфида аммония отличается от других реакций подобных солей тем, что в ней принимают участие и катионы, и анионы одного и того же вещества. Процесс реакции зависит от температуры. Гидролиз сульфида аммония может быть записан следующим образом:
- ионное уравнение гидролиза по катиону:
NH4 + +H2O = NH3*H2O + H+; - уравнение гидролиза по аниону проходит в два этапа:
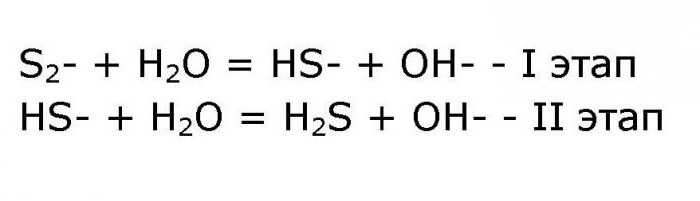
Итоговое ионное уравнение реакции выглядит следующим образом:
- NH4 + +S2- + 2H2O = NH3*H2O + HS- + H+ + OH-.
Стандартная запись этой химической реакции выглядит так:
Без нагревания реакция может быть обратима и происходит по первой ступени. Но если вещество подогреть, реакция станет необратимой – конечные вещества аммиак и сероводород просто покидают поле взаимодействия и улетучиваются.
Получение сульфида аммония
Сульфид аммония чаще всего получают при взаимодействии сероводорода с избытком аммиака:
Одной из наиболее характерных особенностей этого соединения является полное разложение соединения в воде. Цепь химической реакции выгладит следующим образом:
Сульфид аммиака в воде распадается на аммиак и сероводород.

Дальнейшее разложение сопровождается выделением водорода и появлением растворенного в воде аммиака и слабого аниона HS - . Поэтому в таблицах, поясняющих раствормость химических элементов, сульфид аммония помечен пропуском.
Практическое применение
В промышленности практическое применение разработано для паров сульфида аммония. Жидкая форма этого соединения используется при транспортировке. Хранят его в закрытых, химически инертных емкостях.

Это вещество хорошо знакомо фотографам и текстильщикам. В фотографии это соединение используется для обработки пленки. При взаимодействии с сильными основаниями происходит химическая реакция, сопровождающаяся выделением вредных веществ. В текстильной промышленности сульфид аммония используется как компонент отбеливающих смесей. Металлурги и реставраторы успешно пользуются им для превращения патины в бронзу. Сульфид аммония непременно используется при производстве мочевины, как важного удобрения, а также при производстве соды.
Для большинства химия - скучная и сложная наука, но мы же знаем, что это не так )
Лично я заинтересовался химией после посмотра фейерверка, и понеслась душа в рай, как говорится.
Возможно этот пост вызовет интерес у кого-нибудь ещё ( по крайней мере я на это надеюсь ))
Я лично облазил всю Лигу химиков, здесь были посты с опытами, но они были одиночные, да и самих этих постов не очень много. Так вот, я решил сделать пост ( или даже серию ) с опытами, которые можно повторить не имея дорогих реактивов, или особых навыков в химии.
И, наконец-то, спустя 7 месяцев долгой подготовки видео и сдачи экзаменов моей лени я готов выложить этот пост. *троекратное ура*
1) Это, наверное, самый известный эффектный химический опыт. Дихроматный вулканчик.
Всё, что надо вам для проведения этого опыта это: негорючая подложка и дихромат аммония, который есть во многих наборах для проведения опытов ( ну или его можно одолжить у учителя химии, он есть в каждой школьной лаборатории )
Порядок проведения опыта:
1) Насыпать горку дихромата аммония на подложку
Над вулканчиком не дышим, если не хотим получить дозу дихромата в лёгкие.
2) Крайне интересный опыт ( честно представить не могу почему о нем почти никто не знает ) Химический хамелеон. Для проведения этого опыта вам понадобятся: марганцовка,сахар и щёлочь ( прекрасно подойдет средство для очистки труб "Крот" ( лучше брать гранулированный ), именно его я использую. Также щёлочь есть в наборах для проведения опытов) обязательно соблюдаем технику безопасности при работе с щёлочью:
1) не пить, в глаза не капать, попала куда-нибудь - не паниковать и быстренько смыть проточной водой.
2) Если все-таки выпили или накапали в глаза, выполняете первый пункт и бегом к врачу
Для проведения опыта нам понадобятся два раствора:
1) Раствор марганцовки, концентрации приблизительно как на видео ( для этого нужно совсем чуть-чуть маоганцовки )
2) Раствор сахара и щёлочи, я исходил из расчётов: чайная ложка\кубик сахара на 50 мл раствора и около двух третей чайной ложки гранулированной щелочи (ложкой по назначению после этого желательно не пользоваться ) или около 15 мл, если у вас жидкий "Крот"
Растворы слиаются в равных объемах, реакция начнется сразу: сначала раствор потемнеет, потом станет зеленым и потихоньку зелёный перейдёт в жёлтый.
3) Я его назвал "переходы зелёнки", это еще менее известный опыт.
Для его проведения вам понадабятся: зелёнка, серная кислота ( можно купить автомобильный электролит для аккумулятора, я использовал его ) щёлочь и перекись водорода из аптеки.
Здесь мы так же используем два раствора:
1) В 100 мл воды развести пару капель зелёнки.
2) Здесь все немного сложнее, берем около 10 мл перекиси и 50 мл раствора щёлочи ( около чайной ложки гранул). Почему сложнее? Потому что из опыта в опыт может потребоваться разное количество щёлочи, поэтому лучше заготовить дополнительную порцию на всякий случай.
Порядок проведения опыта:
1) В раствор зелёнки добавляем совсем чуть-чуть серной кислоты ( пары мл будет достаточно )
2) Струйкой при перемешивании вливаем второй раствор ( перемешивание для равномерности изменения цвета )
После добавленя серной кислоты раствор зелёнки станет жёлто-оранжевым, при добавлении второго раствора цвет сначала вернется к изначальному, а потом начнётся обесцвечивание, при этом можно будет наблюдать красивый бирюзовый цвет.
Также не забываем про технику безопасности.
4) Вода - сок -газировка
Довольно интересный опыт. Чтобы его провести нам понадобятся: фенолфталеин ( его можно взять из набора для опытов, в школьной лаборатории он однозначно есть. Раньше его продавали в аптеках под названием "пурген", сейчас, вроде, перестали ), любая кислота, щёлочь и сода.
Этот опыт требует небольшой подготовки: перед началом показа на дно стаканчика надо налить немного раствора фенолфталеина.
Нам понадобится раствор соды с щёлочью. Почему с щелочью? Потому что если использовать только соду, то 1) цвет "сока" будет не настолькот насыщенный и 2) пена выльется из стакана, как показано на видео. В 50 мл воды растворите половину чайной ложки соды и еще столько же гранул щёлочи.
Порядой проведения опыта:
( опыт проводится в одной ёмкости )
1) Налить немного раствора фенолфталеина на дно стакана
2) Влить раствор соды с щёлочью
3) Прилить приблизительно столько же кислоты
При приливании раствора соды с щёлочью раствор окрасится в малиновый цвет ( как мы все знаем: Фенолфталеиновый *индикатор* в щелочах малиновый :3 )
Примечание: если у вас есть соли кальция или бария ( для бария весьма маловероятно, а так можно немного мрамора растворить в уксусе или соляной кислоте, у кого что есть ), то можно добавить еще одну "стадию" - молоко. Для этого как кислоту надо использовать серную кислоту, а после ее приливания добавить раствор соли бария или кальция ( на видео я этого не делал )
5) Лёд из стакана
Довольно простой опыт. Нам понадобятся: жидкое стекло\канцелярский клей и любая кислота.
Порядок проведения опыта:
1) В стакан налить немного жидкого стекла\канцелярского клея
2) Прилить кислоту (примерно столько же сколько и жидкого стекла\концелярского клея ) и немного перемешать
3) Можно вывалить гель из стакана на руку и отжать, чтобы показать, что там образовалось что-то твёрдое ( не забываем после этого помыть руки )
Примечание: у этого опыта есть иная варияция, её проводят в пробирке. После приливания кислоты пробирку переворачивают, но из неё ничего не выливается ( если всё сделано правильно: чем меньше воды, тем лучше )
6) Я назвал этот опыт "переходы меди"
Для проведения опыта понадобятся: медный купорос ( его можно купить в садовом магазине ), щёлочь и аммиак ( он продается в аптеке )
Порядак проведения опыта:
1) Растворить немного медного купороса в 50мл воды ( концентреция не очень важна )
2) Прилить 10 мл раствора щёлочи ( половину чайной ложки гранул на 50 мл будет выше крыши )
3) Прилить немного аммиака и перемешать
При добавлении щёлочи из голубого раствора медного купороса выпадет голубай осодок, после приливания аммиака осодок растворится, а раствор приобретет темно-синюю окраску
7) Опыт аналогичный с предыдущим - "переходы железа"
Для его проведения нам понадобятся: железный купорос ( его можно купить в садовом магазине ), перекись водорода, щёлочь, кислота и роданид калия ( он не обязателен, но нужен для последней части, он есть в некоторых наборах для проведения опытов, или можно спросить в школьной лаборатории )
Порядок проведения опыта:
( опыт проводится в одной ёмкости )
1) Растворить немного железного купороса в воде ( около половины чайной ложки на 50 мл )
2) Прилить к железному купоросу 10 мл ( половина чайной ложки гранул на 50 мл воды ) раствора щёлочи
3) Прилить около 10 мл ( точность не важна ) перекиси водорода и перемешать
4) Добавить достаточное количество кислоты ( чтобы растворить осадок )
5) Прилить раствор роданида калия ( буквально на кончике ножа на 50 мл )
Не забываем про технику безопасности, роданид калия - сильный яд, так что с ним надо поосторожнее, не пить то есть.
Примечание: у этого опыта есть не менее интересныая вариация - "хирург"
Для проведения понадобится только раствор трехвалентной соли железа ( можно сделать из железного купороса, добавив немного перекиси с кислотой, или купить хлористое железо на радио рынке ) и роданид калия
Порядок проведения опыта: нанести на руку раствор роданида калия "спирт", а на нож нанести раствор трехвалентного железа "йод". Провести тыльной ( тоо бишь тупой, мы же не хотим сделать порез на месте с ядохимикатом) ) стороной ножа, покрытой "йодом", на этом месте сразу же появится "кровавая рана", которую после можно спокойно убрать тряпкой.
Не забудьте после этого помыть руку.
8) Ну и напоследок немного не химический опыт, но от этого не менее завораживающий.
Для его проведения нам понадобятся: стальная вата ( её можно заказать на алиэкспрессе, а мне посчастливилось наткнуться на неё в фикспрайсе ) и тяжёлый негорючий шнур (я использовал usb шнур старый) . Почему тяжёлый? Для того чтобы можно было по-человечески его раскрутить.
Порядок проведения опыта:
1) Хорошо привязать стальную вату к шнуру ( если она будет привязана не достаточно хорошо, то при вращении она просто разлетится на куски, как показано на видео ) и распушить.
2) Поджечь стальную вату в нескольких местах и начать быстро крутить
Опыт, естественно, лучше проводить в темное время суток.
Сама по себе стальная вата тоже красиво горит.
Вот так выглядит сама вата.

Надеюсь вам понравилось, вы узнали что-то новое.
Не кидайтесь камнями за качество видео, довольно сложно сфокусироваться на прозрачных стаканах на белом фоне.
Если этот пост вызовет большой интерес я постараюсь нашкрести еще опытов на вторую часть и когда-нибудь её выпущу.
Спасибо, что досмотрели пост до конца :3
Только перед публикацией заметил, что чуть не выпустил на свет божий "Химия для смертных или Интересные опяты, которые можно повторить самому" )
Задача 851.
Почему сульфид цинка растворяется в соляной кислоте, а сульфид меди нет? В какой кислоте можно растворить сульфид меди?
Решение:
Взаимодействие сульфида цинка с соляной кислотой выражается уравнением:
ZnS(к) + 2HCl ↔ ZnCl2 + H2S(г)
ZnS + 2H + ↔ Zn 2+ + H2S
Присутствие в числе исходных веществ малорастворимого электролита ZnS, при образовании которого связываются ионы S 2- , обуславливает протекание реакции влево. С другой стороны, при образовании слабого электролита H2S также связываются ионы S 2- , способствующие протеканию реакции вправо. Таким образом, ионы S 2- участвуют в двух процессах, приводящих к установлению двух равновесий:
S 2- + Zn 2+ ↔ ZnS(к);
S 2- + 2Н + ↔ Н 2 S(г).
Протекание того или иного процесса зависит от того, какое из двух веществ – сероводород или сульфид цинка – в большей степени связывает ионы S 2- . Константа диссоциации H2S (K = K1 . K2 = 6 . 10 -22 ), произведение растворимости ZnS равно 1,3 . 10 -23 . Из чего вытекает, что связывание ионов S 2- в молекулы H2S происходит полнее, чем в ZnS. Поэтому рассматриваемая реакция протекает вправо – сульфид цинка растворяется в соляной кислоте. Аналогично два равновесия устанавливаются в системе CuS—HCl:
S 2- +Cu 2+ ↔ CuS(к);
S 2- + 2Н + ↔ Н2S(г).
Но произведение растворимости CuS равно 3,2 . 10 -38 , что меньше, чем 6 . 10 -22 . Поэтому связывание ионов S 2- в CuS происходит полнее, чем в молекулах H2S и, равновесие в системе:
сместится влево; сульфид меди не растворим в растворе соляной кислоты. Следовательно, сульфид меди растворится в растворе той кислоты, суммарная константа диссоциации которой будет иметь меньшее численное значение, чем ПР(CuS), например, ортокремниевая кислота H4SiO4 численное значение К = К1 . К2 . К3 . К4 = 8 . 10 -48 .
Задача 852.
Каковы продукты реакции взаимодействия хлорида железа (III): а) с сероводородом; б) с сульфидом аммония?
Решение:
а) Хлорид железа (III) и сероводород реагируют с образованием хлорида железа (II), серы и хлороводорода:
Данная реакция протекает по окислительно-восстановительному механизму, где роль окислителя играет FeCl3, а восстановителя – H2S.
б) Между хлоридом железа (III) и сульфидом аммония протекает реакция по обменному механизму с образованием сульфида железа (III) и хлорида аммония:
Задача 853.
Объяснить, почему ZnS и РbS можно получить обменной реакцией в водном растворе, а Al2S3 и Cr2S3 нельзя. Указать способ получения Al 2 S 3 и Cr 2 S 3.
Решение:
Малорастворимые сульфиды металлов можно осадить из растворов солей действием сероводорода или сульфида аммония:
Являясь солями слабой кислоты, растворимые сульфиды подвергаются гидролизу. Гидролиз сульфидов, содержащих элементы в высоких степенях окисления Al 2 S 3 и Cr 2 S 3 и др.), часто идет до конца, он необратим. Поэтому Al 2 S 3 и Cr 2 S 3 нельзя получить обменной реакцией в водном растворе. Обычно для их получения используют сплавление метала с серой в отсутствие кислорода и влаги:
2Al + 3S 
Al2S3;
2Cr + 3S 
Cr2S3.
Сульфид хрома поучают:
Сплавление оксида хрома(III) с сероводородом:
2Cr2O3 + 9S 
2Cr2S3 + 3SO2↑
Пропускание сероводорода через нагретый оксид хрома(III):
Cr2O3 + 3H2S 
Cr2S3 + 3H2O
Задача 854.
Какова реакция среды в растворах: а) Na2S; 6) (NH4)2S; в) NaНS?
Решение:
а) Na2S – соль сильного основания си слабой кислоты, гидролизующаяся по аниону:
Na2S ↔ 2Na + + S 2- ;
S 2- + H2O ↔ HS - + OH - (ионно-молекулярная форма);
Na2S + H2O ↔ NaHS + NaOH (молекулярная форма).
Гидролиз преимущественно протекает по первой ступени, при этом образуется избыток ионов ОН - , которые придают раствору соли щелочную среду, рН > 7.
б) (NH4)2S – соль слабого однокислотного основания и слабой двухосновной кислоты, гидролизуется как по катиону, так и по аниону:
(NH4)2S ↔ 2NH4 + + S 2- ;
NH4 + + H2O ↔ NH4OH + H + (ионно-молекулярная форма);
S 2- + H2O ↔ HS - + NH 4 OH ( ионно- молекулярная форма).
При гидролизе солей, образованных слабым основанием и слабой кислотой в растворе образуются в избытке как ионы Н + так и ионы ОН - , которые взаимодействуя друг с другом образуют Н2О:
Н + + ОН - ↔ Н2О
Казалось бы, реакция среды должна быть нейтральной по причине образования воды, но, на самом деле, реакция среды бывает или слабокислой, или слабощелочной, что зависит от силы кислоты и основания, образующие соль. Так, если КD основания меньше, чем KD кислоты, то гидролиз соли будет преимущественно протекать по катиону и, следовательно, в растворе будут незначительно преобладать ионы водорода Н + , что придаст раствору слабокислую среду, рН раствора будет незначительно меньше семи. Так как KD(H2S) - , что придаёт ему слабощелочную среду, рН > 7.
в) NaНS – кислая соль слабой кислоты и сильного основания, которая будет гидролизоваться по аниону:
NaHS ↔ Na + + HS - ;
HS - + H2O ↔ H2S + OH - (ионно-молекулярная форма);
NaHS + H2O ↔ H2S + NaOH (молекулярная форма).
При гидролизе гидросульфида натрия образуется избыток ионов ОН - , которые придают раствору соли щелочную среду, рН > 7.
Аммония сульфид используется в фотографическом развитии, для обращения патину в бронзу, и в текстильной промышленности. Также, из-за противного запаха, это активный ингредиент во множестве грязных розыгрышей, включая распространенную вонючую бомбу.
Химические свойства
Сульфид аммония, будучи солью, образованной из слабого основания и слабой кислоты реагирует с водой следующим образом:
S 2- + H2O ↔ HS - + OH -
Образуется слабодиссоциированный анион HS - и растворенный в воде аммиак. Именно поэтому в таблице растворимости это вещество помечено прочерком.
Получение
Аммония сульфид создается из реакции сероводорода в избытке аммиака:
Безопасность
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Wikimedia Foundation . 2010 .
- Аминосульфоновая кислота
- NHK Trophy 2012
сульфид аммония — сернистый аммоний, замещённый ю … Cловарь химических синонимов I
Сульфид золота(I) — Общие Систематическое наименование Сульфид золота(I) Традиционные названия сернистое золото Химическая формула Au2S Физические свойства Состояние … Википедия
Сульфид золота(II) — Общие Систематическое наименование Сульфид золота(II) Традиционные названия Сернистое золото Химическая формула AuS Физические свойства Состояние ( … Википедия
Сульфид золота(III) — Общие Систематическое наименование Сульфид золота(III) Традиционные названия Сернистое золото Химическая формула Au2S3 Физические свойства … Википедия
Сульфид молибдена(VI) — Общие Систематическое наименование Сульфид молибдена(VI) Традиционные названия Сернистый молибден Химическая формула MoS3 Физические свойства Состояние ( … Википедия
Сульфид молибдена(III) — Общие Систематическое наименование Сульфид молибдена(III) Традиционные названия Сернистый молибден Химическая формула Mo2S3 Физические свойства … Википедия
Сульфид платины(II) — Общие Систематическое наименование Сульфид платины(II) Традиционные названия Сернистая платина Химическая формула PtS Физические свойства Состояние ( … Википедия
Сульфид платины(III) — Общие Систематическое наименование Сульфид платины(III) Традиционные названия Сернистая платина Химическая формула Pt2S3 Физические свойства … Википедия
Сульфид платины(IV) — Общие Систематическое наименование Сульфид платины(IV) Традиционные названия Сернистая платина Химическая формула PtS2 Физические свойства Состоя … Википедия
Сульфид хрома(II) — Общие Систематическое наименование Сульфид хрома(II) Традиционные названия Сернистый хром Химическая формула CrS Физические свойства Состояние ( … Википедия
Читайте также:

