Стернальный пунктат при миеломе

Миелома — злокачественная опухоль, подавляющая нормальное кроветворение, разрушающая кости и вырабатывающая патологические белки, повреждающие внутренние органы. Когда говорят о миеломе крови или костей, или позвоночника, или костного мозга, то имеют ввиду одно заболевание с разнообразными проявлениями.
Относящееся к гемобластозам или онкогематологическим процессам, то есть злокачественным болезням крови и лимфатической ткани заболевание имеет много названий: множественная миелома, миеломная болезнь и генерализованная плазмоцитома, плазмоцитарная миелома.
- Причина миеломы
- Что происходит при миеломе?
- Диагностика миеломной болезни
- Когда диагноз миеломы не вызывает сомнений
- Симптомы миеломы
- Лечение миеломной болезни у молодых
- Лечение миеломы у пожилых
- Прогноз при миеломной болезни
Причина миеломы
Миелома состоит из изменённых плазматических клеток. В нормальном костном мозге плазматические клетки рождаются из В-лимфоцитов, но число их ограничено всего 5%, большее количество — уже патология.
Определённой ясности с первопричиной развития плазматической опухоли нет, в инициации процесса подозревают плохую наследственность и склонность к аллергии против собственных тканей, радиацию и работу с токсичными веществами, под подозрение попал и вирус герпеса 8 типа.

Миеломная болезнь поражает трёх из 100 тысяч россиян, как правило, пожилых — преимущественно на седьмом десятке жизни, у молодых до 40 лет заболевание встречается очень редко.
Среди страдающих заболеваниями крови и лимфатической ткани плазмоцитому имеет 10-13%, но из всех существующих в природе злокачественных процессов на больных плазмоклеточной опухолью приходится не более одного процента.
Что происходит при миеломе?
По какой-то причине в костном мозге появляются ненормальные клетки, размножаясь, они нарушают нормальное кроветворение, что проявляется анемией. Недостаток эритроцитов сказывается на работе всех органов, но особенно сильно на легочной ткани и головном мозге, что проявляется недостаточностью их функций.
Функция нормальных плазматических клеток — выработка антител-иммуноглобулинов для защиты от болезнетворных агентов. Миеломные плазмоциты тоже вырабатывают иммуноглобулины, но дефектные парапротеины, не способные к иммунной защите.
В костях миеломные клетки стимулируют остеокласты, вызывая остеолизис — разъедание кости. Из разрушенной кости кальций выходит в плазму, накапливаясь, приводит к гиперкальциемии — тяжёлому состоянию, требующему принятия срочных мер.
Диагностика миеломной болезни
Диагноз устанавливается по анализам крови, где находят парапротеины и определяют их суммарную и видовую концентрацию. Парапротеины обозначают как иммуноглобулины — IgA, IgG и IgМ. Плазмоциты вырабатывают иммуноглобулины по собственному усмотрению и в разном количестве, по их изменению продукции патологических белков впоследствии оценивают эффективность лечения и активность заболевания.
Степень агрессивности плазматических клеток выясняют при микроскопии костного мозга, его получают из грудины при стернальной пункции или при биопсии тазовой кости. Особенно актуально исследование при невысокой продукции парапротеинов или при изменении характера течения болезни.

Часто заболевание случайно обнаруживается во время обычной рентгенографии органов грудной клетки по литическим дефектам ребер. На первом этапе необходимо выявить все деструктивные изменения в костях, чтобы в дальнейшем следить за процессом и результатами терапии, что позволяет высокочувствительная низкодозная КТ всего скелета.
При МРТ изучается состояние плоских костей — черепа и таза, что обязательно при тлеющей и солитарном варианте опухоли. МРТ помогает оценить не только дефекты кости, но и наличие опухолевой инфильтрации мягких тканей, вовлечение в процесс спинного мозга.
Обязательно проводится анализ на кариотип для выявления генетических аномалий, влияющих на прогноз в отношении жизни больного и эффективность лечения.
Когда диагноз миеломы не вызывает сомнений
Характерные особенности клеток определяют течение процесса от медленной и практически доброкачественной гаммапатии или тлеющей миеломы до стремительного плазмоклеточного лейкоза.
Не всегда изначально удаётся классифицировать заболевание, что усложняет выбор оптимальной терапии. В 2014 году международный консенсус определил критерии, облегчающие постановку точного диагноза и отделяющие один вариант опухолевого процесса от других.
В первую очередь, в костном мозге определяют процент плазматических клеток, так при симптоматической миеломной болезни их должно быть более 10%, а 60% говорит о высокой агрессивности опухоли.
- М-протеин в крови, то есть IgA или IgG;
- легкие цепи иммуноглобулинов;
- в моче белок Бенс-Джонса;
- очаги в костях скелета.
При недостаточности специфических критериев диагностике помогают неспецифические, но часто встречающиеся последствия деятельности плазмоцитов и парапротеинов на органы-мишени:
- повышение уровня кальция крови в результате массивного разрушения костей;
- снижение гемоглобина при опухолевом замещении костного мозга;
- повышение креатинина крови — маркёра почечной недостаточности.
Симптомы миеломы
Замечено, что каждый пул плазматических клеток производит иммуноглобулины с персональными особенностями и по своему графику, отчего клинические проявления очень своеобразны и глубоко индивидуальны. Нет двух одинаковых больных, тем более невозможно найти двух похожих пациентов по диагностическим критериям. Тем не менее, выделяют несколько типов заболевания.
По количеству поражений опухоль может быть генерализованной или множественной и солитарной — с единственным очагом.
По течению различают вялотекущую или тлеющую, она же индолетная, и симптоматическую плазмоцитому, протекающую с явными клиническими проявлениями.

Основное проявление симптоматической миеломы — боли в костях вследствие их разрушения, которые появляются не сразу и часто даже не в первый год заболевания. Болевой синдром возникает при вовлечении в опухолевый процесс надкостницы, пронизанной нервными окончаниями. При медленно текущем процессе до выявления опухоли может пройти несколько лет, поскольку ничего кроме эпизодов слабости у пациента не возникает.
В развёрнутой стадии с множественными поражениями на первый план выходят в разных комбинациях и с индивидуальной интенсивностью переломы в местах деструкции костей и проявления почечной недостаточности, или амилоидоз органов.
Лечение миеломной болезни у молодых
Вялотекущий вариант миеломной болезни не всегда требует лечения, поскольку не угрожает жизни, а терапия совсем не безвредна. В данном случае наблюдение за течением процесса более выгодно пациенту, нежели токсичная химиотерапия. Регулярные обследования позволяют вовремя диагностировать активизацию процесса.
Симптоматическая миелома разделяется по стадиям от I до III по уровню в крови специфического микроглобулина и альбумина, стратегия при стадии I и II-III различается только используемыми препаратами и их комбинациями.
При любой стадии основное и определяющее тактику — состояние пациента и его возраст. Так сохранным больным до 65-летнего возраста и без тяжёлых хронических болезней предлагается агрессивная химиотерапия высокими дозами с пересадкой собственных стволовых клеток крови, по-научному, аутологичной трансплантацией.
Физически сохранные пациенты от 65 до 70-летия тоже могут претендовать на высокодозную химиотерапию, но уже не комбинацией лекарств, а единственным препаратом — мелфаланом.
До начала высокодозной химиотерапии проводится несколько курсов полихимиотерапии обычными дозами, затем специальным препаратом стимулируется выработка костным мозгом собственных стволовых клеток, которые собираются и консервируются. Затем пациент получает очень высокие дозы цитостатиков, в результате чего гибнут все клетки крови — опухолевые и нормальные. Нормальные, заблаговременно законсервированные кровяные элементы и вводят пациенту.
Лечение миеломы у пожилых
Пациенты старше 65 лет и помоложе, но с сопутствующими болезнями, влияющими на общее состояние и активность, тоже на первом этапе проходят цикловую химиотерапию, в том числе с использованием таргетных препаратов. Результат лечения оценивается по анализам крови и костного мозга, где определяют концентрацию специфических для заболевания белков и процент опухолевых клеток.
На результате лечения отражается не только возраст, но и наличие нескольких хронических болезней, астенизация, подразумевающая физическое ослабление с похуданием или без оного.
В последние годы спектр химиопрепаратов существенно расширился за счёт таргетных средств, продемонстрировавших хороший непосредственный результат и увеличение продолжительности жизни участников исследований.
Поражения скелета подлежат длительной терапии бисфосфонатами, уменьшающими болевой синдром, предотвращающими переломы и гиперкальциемию. На отдельные опухолевые очаги воздействуют ионизирующим излучением, обязательна лучевая терапия при угрозе сдавления спинного мозга и поражении шейного отдела позвоночника.

Прогноз при миеломной болезни
Кроме возраста пациента и его физического состояния на прогнозе миеломы и продолжительности жизни отражается чувствительность опухоли к лекарственному лечению и биологические характеристики плазматических клеток, в частности генетические аномалии с делецией участков хромосом и амплификацией — удвоением генов.
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения 2020
Профессиональные ассоциации
- Общероссийский национальный союз "Ассоциация онкологов России"
- Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество"
- Региональная общественная организация "Общество онкогематологов”
Одобрено Научно-практическим Советом Минздрава РФ
Оглавление
1. Краткая информация
Множественная миелома (ММ) или плазмоклеточная миелома (ВОЗ 2017 г.):
- В-клеточная злокачественная опухоль,
- морфологический субстрат - плазматические клетки,
- продуцирует моноклональный иммуноглобулин.
Ведущий патогенетический факт - длительная, хроническая антигенная стимуляция после:
- вирусных инфекций,
- хронических заболеваний,
- длительного воздействия токсических веществ,
- радиации.
Особенности ММ связаны с:
- перестройкой локусов генов тяжелой цепи иммуноглобулина (IGH),
- хромосомными делециями,
- мутациями соматических генов,
- хромосомной гипердиплоидией с участием нечетного числа хромосом.
Вариабельность течения обусловлена количеством разных генетических нарушений.
- 1% среди всех ЗНО,
- 10−15% всех опухолей кроветворной и лимфоидной тканей,
- менее 2% у пациентов моложе 40 лет.
- 2,78 на 100 тыс.,
- 4 075 заболевших,
- 2 587 умерли.
Средний возраст заболевших ≈70 лет.
С90.0 − множественная миелома
- моноклональная гаммапатия неясного генеза (не Ig-M тип);
- моноклинальная гаммапатия неясного генеза с вовлечением легких цепей;
- плазмоклеточная (множественная) миелома;
- варианты плазмоклеточной миеломы:
- вялотекущая (асимптоматическая),
- несекретирующая,
- плазмоклеточный лейкоз;
- плазмоцитома.
Множественная миелома классифицируется по стадиям и факторам риска.
Клинические проявления ММ в значительной мере определяются инфильтрацией костного мозга ПК и органными повреждениями.
Симптомы костных повреждений:
- боль,
- переломы,
- компрессия спинного мозга,
- радикулярные боли.
- полиурия,
- полидипсия,
- тошнота,
- рвота.
Симптомы почечной недостаточности:
- тошнота,
- рвота,
- недомогание,
- слабость.
- периферическая нейропатия,
- отеки,
- органомегалия.
Симптомы инфильтрации миеломными клетками костного мозга:
- анемия,
- геморрагический синдром.
Симптомы снижения нормальных иммуноглобулинов:
- частые инфекции,
- пневмония.
- синдром Рейно,
- акроцианоз.
- одышка,
- транзиторные ишемические атаки,
- тромбоз глубоких вен,
- кровоизлияния в сетчатку глаза,
- тромбоз центральной вены сетчатки или ее ветвей,
- носовые кровотечения.
Длительность заболевания до первых симптомов - от нескольких месяцев до ≥2−3 лет.
2. Диагностика
Критерии установления диагноза/состояния:
Критерии тлеющей (асимптоматической) ММ:
1. Моноклональный протеин:
- сыворотки крови ≥30 г/л и/или
- 500 мг в суточном анализе мочи и/или
- 10−59% клональных ПК в костном мозге.
2. Отсутствие органных повреждений и амилоидоза.
Симптоматическая ММ должна удовлетворять 3 критериям:
1. В костном мозге ≥10 % клональных ПК или верифицированная костная/экстрамедуллярная плазмоцитома + 1 симптом:
a) гиперкальциемия: кальций >11,5 мг/дл (>2,75 ммоль/л);
b) дисфункция почек: креатинина крови >2 мг/дл (>173 ммоль/л), клиренс
c) анемия: нормохромная нормоцитарная, Hb ниже нормы на 2 г/дл (20 г/л) или
d) 1 или более остеолитических очагов;
e) клональных плазмоцитов в костном мозге >60 %;
f) ненормальное соотношение свободных легких цепей (СЛЦ): ≥100 или ≤0,01;
g)более 1 очага поражения костного мозга при МРТ.
2. Другие симптомы: гипервязкость, амилоидоз, >2 бактериальных инфекций за 12 мес.
- в пунктате костного мозга ≥10 % ПК,
- признаки CRAB-синдрома,
- при иммунофиксации в крови и моче нет моноклонального протеина,
- увеличение СЛЦ (2/3 пациентов).
Тщательный сбор жалоб и анамнеза.
- визуальный терапевтический осмотр,
- терапевтические пальпация и аускультация,
- определение общего состояния по ECOG,
- осмотр миндалин и полости рта.
- развернутый клинический анализ крови;
- общий (клинический) анализ мочи;
- количество белка в суточной моче;
- биохимический анализ крови;
- коагулограмма;
- клиренс креатинина;
- СКФ по СКD-EPI или MDRD.
Определение активности ММ или оценка ответа на терапию:
- электрофорез белковых фракций в крови (кроме несекретирующей, вялотекущей и миеломы легких цепей) и моче с количеством моноклонального и поликлональных иммуноглобулинов и β2-микроглобулина;
- иммунофиксация моноклональности иммуноглобулинов в крови и суточной моче с М-градиентом.
Определение СЛЦ в крови:
- несекретирующая ММ,
- олигосекретирующая ММ,
- вялотекущая миелома,
- миелома легких цепей,
- диализзависимая ХПН.
Для трансфузии определение:
- группы крови по AB0,
- антигена D системы Резус (резус-фактора),
- фенотипа антигенов эритроцитов.
Определение антител в крови:
- к вирусу гепатита C в крови;
- к поверхностному антигену (HBsAg) вируса гепатита B;
- классов M, G (IgM, IgG) к ВИЧ-1 и ВИЧ-2.
Уровень поликлональных иммуноглобулинов в крови для оценки гуморального иммунодефицита.
Стернальная пункция:
- миелограмма,
- иммунофенотипическое (проточная цитофлуориметрия) исследование мазка КМ.
Трепанобиопсия для ИГХ костного мозга.
Цитогенетика ПК (кариотипирование и FISH) для выявления прогностически важных аномалий:
- t(4;14),
- t(14;16),
- t(6;14),
- del 17p13,
- t(11;14),
- del13,
- плоидности и изменений хромосомы 1.
КТ:
- всех отделов позвоночника,
- грудной клетки,
- таза.
При невозможности КТ - рентгенологическое исследование костей.
Альтернатива КТ - ПЭТ/КТ.
МРТ всех отделов позвоночника и таза при подозрении:
- на тлеющую миелому;
- на солитарную плазмоцитому;
- на компрессию спинного мозга.
При верифицированной ММ перед началом терапии:
- ЭКГ;
- эхо КГ;
- УЗ допплерография сосудов нижних конечностей;
- рентгенография или КТ органов грудной клетки;
- ЭГДС.
- консультация соответствующего специалиста (кардиолога, невропатолога, ЛОР и др.)
3. Лечение
При тлеющей (бессимптомной) миеломе специфическая терапия не рекомендуется.
Противоопухолевая терапия пациентов с симптоматической ММ:
- моложе 65 лет без сопутствующей патологии - ВДХТ с трансплантацией ауто-ТГСК;
- старше 65 лет или молодым с сопутствующими заболеваниями - комбинации на основе новых лекарственных препаратов;
- при значимой кардиальной патологии - исключаются антрациклины;
- при почечной недостаточности терапия выбора – режимы с бортезомибом + высокие дозы дексаметазона;
- ХТ после купирования жизнеугрожающих состояний.
- Программа с бортезомибом – VMP или VD
- При противопоказаниях к бортезомибу - комбинации с леналидомидом (Rd, MPR)
- Альтернативная опция - добавление даратумумаба к программе VMP
- При противопоказаниях к бортезомибу и леналидомиду - комбинация бендамустина и преднизолона (BP)
- Пациентам с хотя бы с 1 неблагоприятным фактором (≥75 лет, нарушение функции) - редукция доз.
- После 75 лет с плохим состоянием, тяжелой патологией - комбинация мелфалана с преднизолоном.
Моложе 65 лет, 65−70 лет с хорошим соматическим статусом без тяжелых сопутствующих заболеваний - высокодозная консолидация, 1 или 2 трансплантации ауто-ТГСК.
- Бортезомиб/циклофосфамид/дексаметазон (VCD)
- Бортезомиб/доксорубицин/дексаметазон (PAD)
- Бортезомиб/дексаметазон (VD).
При недостаточном ответе на 4−6 цикла индукционной терапии с бортезомибом - 2 линия:
- Леналидомид/дексаметазон (RD/Rd)
- Леналидомид/бортезомиб/дексаметазон (VRD)
- Леналидомид/доксорубицин/дексаметазон (RAD)
- Леналидомид/циклофосфамид/дексаметазон (RCD)
- Леналидомид/циклофосфамид/преднизолон (RCP).
Мобилизация и сбор ауто-ТГСК целесообразна после 4-го курса с леналидомидом.
Для индукции не рекомендуются схемы с мелфаланом из-за миелосупрессии, негативно влияющей на мобилизацию ауто-ТГСК.
При ПР или ЧР после индукционной терапии - мобилизация и сбор ГСК крови:
- под контролем количества стволовых кроветворных клеток в периферической крови и аферезном продукте проточной цитометрией;
- наиболее частый режим мобилизации - сочетание цитостатика (циклофосфамид 2−4 г/м 2 ) за 4 дня до Г-КСФ 5 мкг/кг/сут или монорежим Г-КСФ 10 мкг/кг/сут до афереза;
- при недостаточной/повторной мобилизации включение в режим плериксафора 0,24 мг/кг/сут п/к за 6−11 ч до афереза или 2−4 дня;
- сбор ауто-ТГСК в количестве, достаточном для двух трансплантаций;
- после 4 курса с леналидомидом из-за миелосупрессии.
При успешном сборе ГСК - ВДХТ мелфаланом и последующая трансплантация ауто-ТГСК.
Интервал от мобилизации до предтрансплантационного кондиционирования 2-4 нед.
- 200 мг/м 2 ;
- 140 мг/м 2 при СКФ
- 140−200 мг/м 2 при программном гемодиализе.
Через 100 дней после ВДХТ и ауто-ТГСК - иммунофенотипирование пунктата КМ с выявлением маркеров минимальной остаточной болезни.
После ВДХТ и ауто-ТГСК – консолидация:
- начало через 3 мес. после контрольного обследования;
- 2−3 курса (VCD, VRD);
- при достаточном количестве ГСК возможна 2-я (тандемная) ауто-ТГСК.
- После 1-й или 2-й ауто-ТГСК через 90−100 дней после переливания стволовых клеток.
- Бортезомиб 1,3 мг/м 2 каждые 2 нед. 2 года или до прогрессии.
- Леналидомид 10−15 мг/сут 1−2 года или до прогрессии.
При ММ с иммунохимическим рецидивом или прогрессией, медленном нарастании уровня моноклонального белка без клинических симптомов - выжидательная тактика.
При клиническом рецидиве, быстром нарастании парапротеина - противорецидивная терапия.
CRAB-симптомы клинического рецидива:
- Гиперкальциемия (кальций >2,75 ммоль/л)
- Почечная недостаточность, объясняемая миеломой
- Анемия (Hb
- Костные поражения
Выбор терапии зависит от эффективности предшествующей линии.
При отсутствии рефрактерности к бортезомибу и леналидомиду:
- Бортезомибсодержащие режимы (при анамнезе тромбоза, почечной недостаточности).
- Леналидомидсодержащие режимы (при полинейропатии).
- Бортезомиб, леналидомид и дексаметазон (при агрессивном рецидиве)
- Карфилзомиб, леналидомид и дексаметазон
- Иксазомиб, леналидомид и дексаметазон (при почечной недостаточности).
- Даратумумаб, леналидомид и дексаметазон
- Даратумумаб, бортезомиб и дексаметазон
- Элотузумаб, леналидомид и дексаметазон
При прогрессировании на ингибиторе протеасом и леналидомиде:
- помалидоид и дексаметазон,
- монотерапия даратумумабом,
- монотерапия карфилзомибом.
При невозможности использования таргетных препаратов – традиционная ПХТ:
- VMVP,
- M2,
- DHAP,
- DCEP,
- VD-PACE.
Пациентам старше 80 лет и/или с плохим состоянием паллиативно - циклофосфамид 50 мг внутрь ежедневно или через день с преднизолоном 30 мг через день или дексаметазоном 20 мг раз в неделю.
При цитопении – 4 цикла дексаметазона в высоких дозах либо до восстановления показателей.
Паллиативная ДГТ РОД 8 Гр однократно или РОД 2,0–3,0 Гр, СОД 10−30 Гр.:
- при неконтролируемом болевом синдроме,
- при угрозах патологического перелома,
- при компрессии спинного мозга.
Профилактика тошноты и рвоты.
При иммуноглобулине G
Обезболивание
При остром или хроническом болевом синдроме:
- уточнение этиологии боли;
- при воспалении - лечение очага воспаления;
- применение наркотических и психотропных препаратов.
Диетотерапия
Оценка эффекта по международным критериям (2011 и 2016 гг.)
4. Реабилитация
- индивидуальная программа;
- учёт социальных и психологических проблем пациента.
5. Профилактика
Методов профилактики ММ не существует.
Диспансерное наблюдение гематолога на протяжении всей жизни:
- в процессе терапии иммунохимия белков сыворотки и мочи каждые 2−3 мес.;
- при олиго- или несекретирующей ММ - исследование свободных легких цепей;
- после лечения иммунохимия крови и мочи каждые 3 мес.;
- исследование костного мозга только для подтверждения ПР и оценки эффективности при несекретирующей ММ при невозможности исследовать СЛЦ;
- рентгенография костей по клиническим показаниям.
После использования леналидомида - плановый скрининг вторых опухолей.
6. Организация оказания медицинской помощи
Первичная специализированная МСП оказывается гематологом и иными специалистами:
- центра амбулаторной гематологической/онкологической помощи;
- первичного гематологического/онкологического кабинета;
- первичного гематологического отделения поликлинического отделения онкодиспансера.
При выявлении у пациента ММ или подозрении направление пациента на консультацию гематолога, который организует диагностику или направляет в специализированное ЛПУ.
Показания для плановой госпитализации:
Наличие диагноза симптоматическая ММ для:
1. планового курса специфической терапии,
2. курса ВДХТ,
3. трансплантации аутологичных (аллогенных) стволовых гемопоэтических клеток,
4. мобилизации и сбора аутологичных стволовых гемопоэтических клеток крови,
5. эксфузии аутологичного костного мозга для последующей трансплантации.
Показания для экстренной госпитализации:
Наличие диагноза симптоматическая ММ, осложненная:
1. острым почечным повреждением вследствие миеломной нефропатии,
2. тяжелым оссалгическим синдромом,
3. тромботическими / геморрагическими осложнениями на фоне специфической терапии,
4. тяжелыми инфекционными осложнениями на фоне специфической терапии,
5. кардиальной патологией на фоне специфической терапии,
6. глубокой цитопенией.
Показания к выписке пациента из стационара:
1. Завершение курса специфической терапии,
2. Купирование осложнений, возникших на фоне специфической терапии.
7. Дополнительная информация, влияющая на течение и исход заболевания
Оценка эффективности лечения множественной миеломы
Полный ответ (полная ремиссия) (ПР):
- отсутствие парапротеина в сыворотке и моче при иммунофиксации;
- плазматических клеток в миелограмме
- мягкотканые плазмоцитомы отсутствуют.
Строгий полный ответ (строгая ПР):
- ПР при нормальном соотношении СЛЦ
- отсутствие клональных плазматических клеток в костном мозге при ИГХ или ИФМ.
Очень хороший частичный ответ (очень хорошая частичная ремиссия) (ОХЧР):
Частичный ответ (частичная ремиссия) (ЧР):
Стабилизация: несоответствие критериям ПР, ОХЧР, ЧР или прогрессирования.
Миеломная болезнь (другие названия: множественная миелома, генерализованная плазмоцитома или болезнь Рустицкого-Калера) – это тип рака, который поражает плазматические клетки.
Плазменные клетки представляют собой тип лейкоцитов, обнаруженных в костном мозге, который является мягкой тканью внутри большинства ваших костей и продуцирует клетки крови.
В костном мозге плазматические клетки образуют антитела, которые являются белками помогающими организму бороться с болезнями и инфекциями.
Плазмоцитома возникает, когда в костном мозге развивается и очень быстро воспроизводится аномальная плазменная клетка. Быстрое размножение злокачественных клеток миеломы в конечном итоге перевешивает производство здоровых клеток в костном мозге.
В результате раковые клетки начинают накапливаться в костном мозге, вытесняя здоровые белые кровяные клетки и эритроциты.
Как и здоровые клетки крови, раковые клетки пытаются создать антитела. Однако они могут производить только аномальные антитела, называемые моноклональными белками или М-белками.
Когда эти вредные антитела собираются в организме, они могут вызывать повреждение почек и другие серьезные проблемы.
- Причины возникновения миеломной болезни
- Факторы провоцирующие заболевание
- Симптомы множественной миеломы
- Типы множественной миеломы
- Стадии протекания болезни
- Диагностика
- Лечение множественной миеломы
- Медикаментозное лечение
- Лечение осложнений множественной миеломы.
- Хирургия
- Питание при миеломе
- Как не заболеть болезнью Рустицкого-Калера
- Прогноз
Причины возникновения миеломной болезни
Точная причина отчего возникает болезнь неизвестна. Однако заболевание начинается с одной аномальной плазматической клетки, которая быстро размножается в костном мозге.
Полученные раковые клетки миеломы не имеют нормального жизненного цикла. Вместо того, чтобы размножаться и умирать, они продолжают бесконечно делиться. Это разрушает тело и ухудшить производство здоровых клеток. В основном у больных имеется к заболеванию генетическая предрасположенность.
А вот, что провоцирует развитие множественной миеломы:
- генетическая предрасположенность;
- химическое и радиационное излучение;
- постоянная антигенная стимуляция;
- ожирение, так как нарушается обмен веществ;
- мужской пол, развитие болезни происходит при снижении количества мужских половых гормонов;
- бактериальные и вирусные инфекции;
- хирургические вмешательства.
Симптомы множественной миеломы
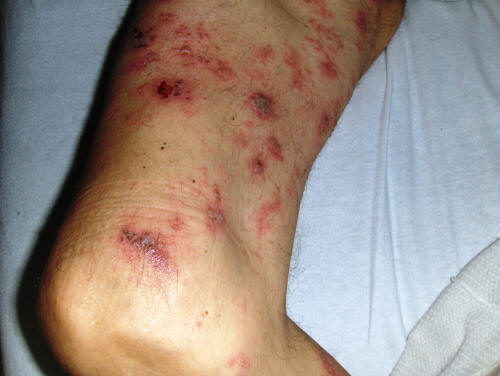
Миеломная болезнь имеет длительное течение. От первых симптомов заболевания до ярких клинических признаков проходит 10-20 лет.
Типы множественной миеломы
Существует два основных типа множественной миеломы, которые классифицируются по их влиянию на организм.
Ленивым миелома не вызывает каких – либо заметных симптомов. Обычно развивается медленно и не вызывает костных опухолей. Наблюдается только небольшое увеличение M-белков и M-плазменных клеток.
Одиночный плазмоцитом вызывает опухоль с образования, как правило , в костях. Он обычно хорошо реагирует на лечение, но нуждается в тщательном мониторинге.
Стадии протекания болезни
- I стадия. Количество гемоглобина больше ста, уровень кальция в крови в пределах нормы, отсутствие разрушения костей. Иммуноглобулин J меньше 50 г/л, иммуноглобулин А меньше 30 г/л. Белок Бенс-Джонска в моче меньше 4 грамм в сутки.
- II стадия. Количество гемоглобина от 85 г/л до 120г/л. Умеренное разрушение костей. Иммуноглобулин J 50 – 70 г/л, иммуноглобулин А 30 – 50 г/л. Белок Бенс-Джонса 4 – 12 грамм в сутки.
- III стадия. Количество гемоглобина меньше 85 г/л. Уровень кальция в кровы превышает нормальные показатели. Заметное разрушение костей. Иммуноглобулин G выше 70 г/л, иммуноглобулин А больше 50 г/л. Белок Бенс-Джонса в моче больше 12 грамм в сутки.
По степени прогрессирования:
- тлеющая – болезнь не прогрессирует в течении многих месяцев и лет;
- медленно прогрессирующая;
- быстро прогрессирующая;
- агрессивная.
Диагностика
Врачи часто обнаруживают множественную миелому до появления каких-либо симптомов. Если есть подозрение болезни, врачи предпримут следующие:
- сбор анамнеза заболевания (врач выясняет с чем по мнению больного связано заболевание, когда появились жалобы);
- общий осмотр (при осмотре можно выявить кровоизлияния на коже, бледность, при перкуссии боли в костях);
- общий анализ крови (для всех форм характерна нормоцитарная анемия, более чем в половине случаев увеличение СОЭ, в белой крови изменений может и не быть, но часто наблюдается нейтрофилез со сдвигом влево);
- пункция костного мозга (в костном мозге выделяются мегакариоциты);
- общий анализ мочи (для анализа используют утреннюю порцию мочи. В течении нескольких часов ее необходимо доставить в лабораторию. В моче – повышенный уровень относительной плотности из-за присутствие белковых молекул, протеинурия. Патогномичный признак множественной миеломы белок Бенс-Джонса);
- биохимический анализ крови (общий белок, АЛТ, АСТ, билирубин, уровня креатинина, мочевой кислоты);
- рентгенография всех костей скелета кроме дистальных отделов (снимки делаются от середины плеча до кисти и от середины бедра до стопы);
- компьютерная томография позволяет обнаружить очаги разрушения костной ткани, сдавление спинного мозга;
- стернальная пункция – главный метод диагностики (делают прокол специальной иглой в грудине или подвздошной кости. Извлекают клетки и изготавливают мазок. В мазке находят опухоль костного мозга, большое количество плазматических клеток, незрелых клеток крови);
- анализ мочи по Зимницкому (позволяет оценить концентрационную способность почек. Для выполнения данного анализа в течении суток человек собирает мочу через каждые три часа, всего получается восемь порций. Оценивают общее количество мочи, плотность, ночной и дневной диурез).
Лечение множественной миеломы
Методы лечения включают:
- локальное облучение опухоли костного мозга;
- стационарная химиотерапия;
- высокодозная химиотерапия с трансплантацией костного мозга.
Начальная тактика ведения пациента определяется его возрастом, наличием или отсутствием тяжёлых сопутствующих заболеваний.
При возрасте пациента до 65 лет и отсутствии тяжёлых патология применяют высокодозную химиотерапию с трансплантацией костного мозга. Локальное облучение миеломы в основном используется в качестве паллиативного метода лечения, особенно при выраженной болезненности в области скелета.
Химиотерапия является наиболее популярным методом лечения множественной миеломы. Препараты может назначать только врач – химиотерапевт.
Во время терапии надо постоянно следить за состоянием пациента и картиной крови.
Различают следующие подходы в химиотерапии:
- монохимиотерапия – лечение одним препаратом;
- полихимиотерапия – использование более двух лекарственных средств.
Препараты, используемые для лечения:
Алкеран (Мелфалан) – противоопухолевое, цитостатическое средство
- диспептические явления: тошнота, рвота;
- кожный зуд;
- аллергические реакции;
- пневмофиброз;
- снижение функции яичников.
Преднизолон – гормональное средство. Обладает иммунодепрессивным эффектом. Снижает синтез белка в плазме крови, усиливает катаболизм белка в мышцах. Назначается с целью профилактики побочных действий химиотерапии.
Циклофосфан – противоопухолевое средство.
- аллергические реакции;
- цистит;
- при высоких дозах кардиотоксичен;
- крапивница.
Винкристин – противоопухолевое средство растительного происхождения. Он блокирует вещества, необходимые для синтеза плазмоцитов. Винкристин вводят непрерывно внутривенно в течении суток.
- судороги;
- тошнота, рвота;
- крапивница;
- дизурия, задержка мочеиспускания.
Адриабластин – антибиотик, который обладает противоопухолевой активностью. Снижает рост и активность неопластических клеток. Под воздействием адриабластина образуются свободные радикалы, которые воздействуют на оболочку клеток.
- флебиты;
- дерматиты;
- нарушение проводимости сердца;
- аллергические реакции
- боли в области сердца.
После курса химиотерапии больным назначают Интерферон для поддержания иммунитета. При возникновении анемии необходимо переливание эритроцитарной массы.
Бортезомиб (Bortezomibum) – является новым препаратом в лечении заболевания. Его механизм действия – стимуляция апоптоза. Вводят внутривенно в условиях стационара.
Схемы сочетания препарата:
- схема VAD. В нее входят три препарата: винкристин, дексаметазон, доксорубицин;
- схема VBMCP. В нее входят 5 препаратов: преднизолон, мелфалан, циклофосфамид, винкристин, кармустин.
Признаки эффективности терапии:
- заживление переломов;
- увеличение эритроцитов и гемоглобина в крови;
- уменьшение размеров опухоли;
- уменьшение количества плазмоцитов в крови.
Локальная лучевая терапия показана больным с высоким риском перелома. Особенно в опорных частях скелета: позвоночник, кости таза.
К сожалению, даже после эффективной терапии и достижении полной ремиссии высок риск рецидивов. Это связано с тем, что в состав опухоли входят разнообразные клетки, которые после прекращения химиотерапии начинают вновь делиться.
Лечение осложнений множественной миеломы.
Обезболивающая терапия проводится в несколько этапов. Для устранения несильной боли используются нестероидные противовоспалительные препараты:
- Спазмалгон;
- Ибупрофен;
- Индометацин.
При сильной боли и неэффективности НПВС (нестероидные противовоспалительные препараты) назначают опиоидные анальгетики:
- Кодеин;
- Трамадол;
- Просидол.
При длительном использовании могут вызвать наркотическую зависимость, поэтому использовать их необходимо с осторожностью. При нестерпимой боли назначают опиоиды сильного действия:
- Морфин;
- Налоксон;
- Бупренорфин.
Магнитотурботрон – это воздействие магнитным полем низкой частоты. Он уменьшает побочные эффекты химиотерапии, уменьшает боль, нарушает деление плазмоцитов. Курс проводят 2 раза в год.
Электросон – воздействие на структуры мозга токами низкой частоты. Токи уменьшают боль, обладают успокаивающим эффектом.
Антибактериальная и противовирусная терапия используется для лечения инфекционных осложнений. Так как иммунитет у всех больных снижен, то развитие инфекции – частое явление. Для лечения используют в основном цефалоспорины III и IV поколения, защищенные пенициллины (ампициллин).
Следует избегать использование антибиотиков, обладающих нефротоксичностью (гентамицин).
Лечение переломов не должно отличаться от терапии у здоровых людей. Применяют операционное лечение и иммобилизирующие повязки. В послеоперационное время показан постельный режим, ношение ортопедических конструкций.
Терапия остеопороза проводится бифосфонатами (золедронат). Они подавляют активность остеокластов.
При миеломной болезни парапротеины (патогенные белки класса иммуноглобулина) откладываются в почках, это приводит к нарушению их функции. Чтобы избежать этого важно остановить прогрессирование роста плазмоцитомы.
Для поддержания функций почек используются специальные препараты.
- Хофитол способствует очищению крови, выводит мочевину.
- Ретаболил – анаболический препарат, способствует росту мышц. Под его воздействием азот идёт на синтез белка.
- Цитрат натрия используется при нарушении кислотно-щелочного обмена, уменьшает количество кальция в крови
- Празозин расширяет периферические сосуды, снижает артериальное давление. Усиливает почечный кровоток.
- Каптоприл – ингибитор АПФ. Расширяет периферические сосуды, снижает в них сопротивление, способствует выведению кальция. Улучшает почечную фильтрацию
- При серьёзном нарушении фильтрационной функции почек – плазмаферез.
При гиперкальциемии применяют глюкокортикостероиды и химиотерапию
При множественной миеломе в качестве хирургического метода лечения применяют трансплантацию костного мозга. Это может быть как аутотрансплантация (пересадка собственного костного мозга), так и аллотрансплантация (пересадка костного мозга донора).
Аутотрансплантация ( или аутологичная трансплантация) позволяет увеличить дозы цитостатиков (группа противоопухолевых препаратов), улучшить результат лечение, увеличить срок ремиссии.
Аллотрансплантация имеет хорошие результаты, но применяется только у молодых пациентов. Так как имеет большой процент летальных исходов.
При любых онкологических заболеваниях важно соблюдать диету. Из меню следует исключить копчёности, жареное, мучное, консервы.
Питание должно быть разнообразным, содержать как можно больше овощей и фруктов. Ограничить потребление белков, чтобы уменьшит парапротеинемию и токсической действие азота, который образуется при разрушении белка, на почки.
Питьевой режим составляет три литра. С мочой должно выделятся около двух с половиной литры за сутки. Если есть отёки, то нужно ограничить потребление поваренной соли.
Как не заболеть болезнью Рустицкого-Калера
Не допустить у себя болезнь Рустицкого-Калера можно следуя следующим советам:
- избегать контакта с инфекционными больными;
- вести здоровый образ жизни, отказаться от вредных привычек (алкоголь, курение);
- в рацион питания включить больше свежих овощей и фруктов;
- поддержание иммунитета: закаливание, спорт, стараться не переохлаждаться;
- внимательно изучать состав продуктов питания.
Прогноз
Прогноз зависит от чувствительности к химиотерапии и стадии заболевания. Лучшие результаты у людей с I и II стадией заболевания и лиц, моложе 60 лет.
Перед лечением проводят оценку факторов риска и на этом строят прогноз. Миелома крови неизлечима, но при правильной тактике можно добиться долгосрочной ремиссии и высокого уровня жизни.
Критерии неблагоприятного прогноза:
- большое количество плазмоцитов;
- стремительный рост опухоли, который определяется клинически и рентгенологически, на рентгенограммах – увеличение площади дефектов;
- увеличение количества парапротеинов (аномальный белок класса иммуноглобулина);
- присутствие метастазов;
Читайте также:

