Степень окисления азота в соединений с хлором
3. Химические свойства соединений азота с точки зрения изменения степеней окисления
Аммиак в реакциях, как правило, окисляется до азота:
8NH3 + 3Cl2 → N2 
+ 6NH4Cl (в атмосфере хлора)
2NH3 + 3CuO → 3Cu + N2 
+ 6H2O
2NH4Cl + 4CuO → 3Cu + N2 
+ CuCl2 + 4H2O
2NH3 + 3H2O2 → N2 
+ 6H2O (t)
2NH3 + 2K2FeO4 + 5H2SO4 → Fe2(SO4)3 + N2 
+ 2K2SO4 + 8H2O
8NH3 + 3KBrO4 → 3KBr + 4N2 
+ 12H2O
2NH3 + 3KClO → 3KCl + N2 
+ 3H2O
4NH3 + 3Ca(ClO)2 → 3CaCl2 + 2N2 
+ 6H2O
2NH3 + 2NaMnO4 → 2MnO2 
+ N2 
+ 2NaOH + 2H2O
2NH3 + 6NaMnO4 + 6NaOH → 6Na2MnO4 + N2 
+ 6H2O
2NH3×H2O + 2KMnO4 → 2MnO2 
+ N2 
+ 2KOH + 4H2O
Чтобы легко запомнить следующие реакции, нужно помнить, что нитрат аммония разлагается при нагревании на оксид азота (I) и воду
Cl + K → 
+ KCl +
А также нужно помнить термическое разложение нитрита аммония на азот и воду (NH4NO2 → N2 + 2H2O):
Cl + Na → 
+ NaCl + 2
Реакции термического разложения нитрата и нитрита аммония также часто встречаются на экзамене.
В присутствии катализатора аммиак окисляется кислородом до оксида азота (II), а не простого вещества:
4NH3 + 5O2 → 2NO + 6H2O (t, Pt)
Нитриды (и для аналогии фосфиды) активных металлов легко реагируют с водой и растворами кислот:
1. Реакции с водой:
Mg3N2 + H2O → 3Mg(OH)2 + 2NH3
Na3N + H2O → NaOH + NH3
Ca3P2 + 6H2O → 3Ca(OH)2 +2PH3
2. В реакциях с кислотами образуются соли (в случае нитридов) или фосфин (в случае фосфидов):
Zn3P2 + 6HCl → 3ZnCl2 + 2PH3
Чем более разбавленной является кислота, тем более сильным окислителем она является.
Изменение степени окисления азота в реакциях с сильным восстановителем:
N +5 + 8e → N –3 (NH3 или NH4NO3) очень разбавленная HNO3
N +5 + 5e → N 0 (N2) разбавленная HNO3
N +5 + 4e → N +1 (N2O) разбавленная HNO3, концентрированная
Изменение степени окисления азота в реакциях со слабым восстановителем:
N +5 + 3e → N +2 (NO) разбавленная HNO3
N +5 + 1e → N +4 (NO2) концентрированная HNO3
Восстановители:
- Металлы от Li до Al
- Металлы, начиная с Fe
- Неметаллы
- Соли (если можем окислить)
- Оксиды (если можем окислить)
- HI и йодиды, H2S и сульфиды
10HNO3(разб.) + 4Mg → 4Mg(NO3)2 + N2O + 5H2O (возможно образование N2)
С неметаллами образуются соответствующие кислоты:
10HNO3(конц.) + I2 → 2HIO3 + 10NO2 + 4H2O (t) (из галогенов реакция идет только с йодом)
8HNO3(к) + H2S → H2SO4 + 8NO2 
+ 4H2O
8HNO3(к) + Na2S → Na2SO4 + 8NO2 
+ 4H2O
4HNO3(конц.) + CuS → Cu(NO3)2 + S 
+ 2NO2 
+ 2H2O
8HNO3 + Cu2S → 2Cu(NO3)2 + S 
+ 4NO2 
+ 4H2O
12HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + 10NO2 
+ 6H2O
16HNO3(к) + Mg3P2 → Mg3(PO4)2 + 16NO2 
+ 8H2O
16HNO3(к) + Ca(HS)2 → H2SO4 + CaSO4 + 16NO2 
+ 8H2O
В избытке кислоты фосфаты растворяются:
11HNO3(к, изб.) + AlP → H3PO4 + Al(NO3)3 + 8NO2 
+ 4H2O
Окисляем металл соли или оксида:
10HNO3(к) + Fe3O4 → 3Fe(NO3)3 + NO2 
+ 5H2O
4HNO3(к) + FeO → Fe(NO3)3 + NO2 
+ 2H2O
HNO3(к) + FeSO4 → Fe(NO3)3 + NO2 
+ H2SO4 + H2O
4HNO3(к) + CrCl2 → Cr(NO3)3 + NO2 
+ 2HCl + H2O (ионы Cl – азотная кислота окислить не может)
Одновременное окисление катиона и аниона:
14HNO3(к) + Cu2S → H2SO4 + 2Cu(NO3)2 + 10NO2 
+ 6H2O
С металлами (Al, Zn, Mg) нитраты восстанавливаются до аммиака:
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3 
+ 8Na[Al(OH)4]
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3 
+ 4Na2[Zn(OH)4]
KNO3 + 4Mg + 6H2O → NH3 
+ 4Mg(OH)2 
+ KOH
При сплавлении в щелочной среде нитраты восстанавливаются до нитритов:
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
Неметаллами нитраты восстанавливаются до азота либо нитрита:
С солями аммония, по сути, идет разложение нитрата аммония:
KNO3 + NH4Cl → N2O 
+ KCl + 2H2O (NH4NO3 → N2O + 2H2O)
В случае нитрата слабого металла именно метал будет окислителем, а не азот:
Термическое разложение нитратов:
MNO3 → MNO2 + O2 
M – металл, находящийся в ряду напряжений металлов левее Mg, исключая Li.
MNO3 → MO + NO2 
+ O2 
M – металл, находящийся в ряду напряжений металлов от Mg до Cu (Mg и Cu включительно), а также Li.
MNO3 → M + NO2 
+ O2 
M – металл, находящийся в ряду напряжений металлов правее Cu.
Сильными окислителями нитриты окисляются до нитратов:
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2 
+ 2KOH
С восстановителями нитриты восстанавливаются до N2 или NO:
1) С солями аммония, по сути, идет разложение нитрита аммония:
NaNO2 + NH4Cl → N2 
+ NaCl + 2H2O (NH4NO2 → N2 + 2H2O)
Ca(NO2)2 + (NH4)2SO4 → 2N2 
+ CaSO4 + 4H2O
2) Соединениями I – , Fe 2+ и др. нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2KI + 2H2SO4 → 2NO 
+ I2 
+ 2K2SO4 + 2H2O
HNO2 + 2HI → 2NO 
+ I2 
+ 2H2O.
Оксид азота (IV), как правило, восстанавливается до NO или N2:
10NO2 + 4P → P2O5 + 10NO (возможно образование N2)
2NO2 + 4Cu → N2 + 4CuO
Оксид азота (IV) диспропорционирует в реакциях с водой и растворами щелочей и карбонатов щелочных металлов:
Т.к. оксиду NO2 соответствуют две кислоты, при взаимодействии с щелочью или карбонатами щелочных металлов образуются две соли: нитрат и нитрит соответствующего металла:
3NO2 + H2O → 2HNO3 + NO 
(растворение газа в воде в отсутствии кислорода)
В аналогичных реакциях с кислородом образуются только соединения с N +5 :
4NO2 + O2 + 2H2O → 4HNO3 (растворение в избытке кислорода)
Оксид азота (II), как правило, окисляется до N +5 :
2NO + 3KClO + 2KOH → 2KNO3 + 3KCl + H2O
8NO + 3HClO4 + 4H2O → 8HNO3 + 3HCl
14NO + 6HBrO4 + 4H2O → 14HNO3 + 3Br2
2NO + O2 → 2NO2 (идет самопроизвольно на воздухе)
2NO + 2Cu → N2 + 2CuO (500-600°C).
Как и все оксиды азота, N2O является окислителем, способным окислять металлы:
N2O + Cu → CuO + N2
N2O + Cu2O → 2CuO + N2
.

Азот, соединения азота
Азот – элемент V A группы главной подгруппы, значит, на внешнем энергетическом уровне у него 5 электронов. До завершения внешнего уровня ему не хватает 3 электрона, которые он может присоединить, в этом случае степень окисления его будет равна -3. Кроме этого, атом азота может и отдавать электроны и приобретать положительные степени окисления. Таким образом, для атома азота в соединениях возможны степени окисления от -3 до +5.
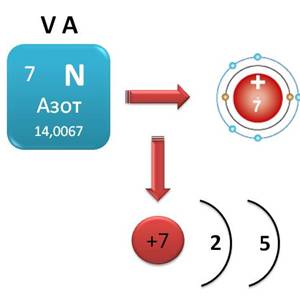
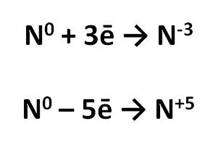
Рассмотрим соединения азота.
Например, в аммиаке – NH3 – степень окисления азота -3; в оксиде азота (I) – N2O – степень окисления азота +1; в оксиде азота (II) – NO – степень окисления азота +2; в азотистой кислоте – HNO2 – степень окисления азота +3; в оксиде азота (IV) – NO2 – степень окисления азота +4; в азотной кислоте – HNO3 – степень окисления азота +5.
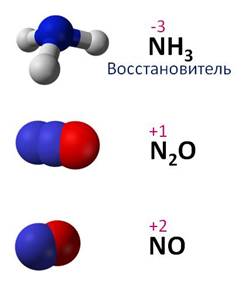
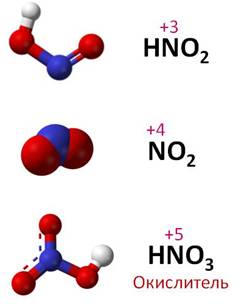
Таким образом, если степень окисления азота -3, то он проявляет восстановительные свойства, если степень окисления +5, то азот проявляет окислительные свойства, а если у азота в соединении промежуточные степени окисления: +1, +2, +3, +4, то он может проявлять и окислительные, и восстановительные свойства.
Азот входит в состав воздуха, где его объёмная доля составляет 78%, он входит в состав земной коры и живых организмов. В космосе азот занимает по распространённости четвёртое место, вслед за водородом, гелием и кислородом.
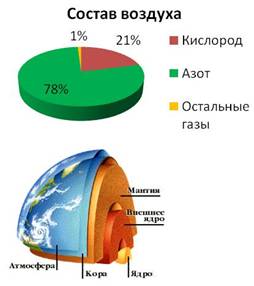
Азот входит и в состав чилийской селитры – NaNO3 – это неорганическое вещество образовалось из остатков птичьего помёта в условиях сухого и жаркого климата. Широко распространена и калийная селитра – KNO3, встречающаяся в Индии.
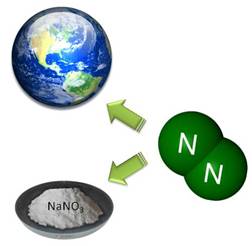
Азот входит в состав всех белков, а белок просто необходим для жизни. Человек получает белок из растительной и животной пищи, а животные получают белок, в основном, из растений. А сами растения являются источником пополнения азота. Поэтому в природе постоянно происходит круговорот азота.
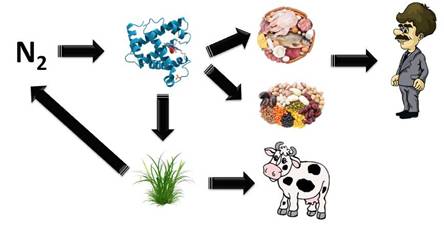
Так как азот входит в состав органических соединений, то он недоступен для растений. Но, в результате жизнедеятельности определённой группы бактэрий, органические соединения превращаются в неорганические – минеральные – это соли аммония и нитраты. И уже эти неорганические вещества усваиваются растениями. Затем растениями, которые усвоили азот, питаются животные и из растений получают необходимый белок.
Большую роль в фиксации азота играют клубеньковые бактерии, которые живут в клубеньках бобовых растений (клевера, гороха, люпина). Они усваивают атмосферный азот и превращают его в соединения, которые доступные растениям.
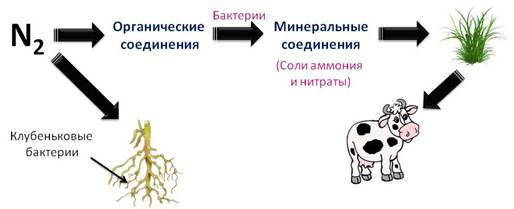
Кроме этого, соединения азота в почве пополняются за счёт грозовых ливней. Сначала из азота и кислорода образуется оксид азота (II), который под действием кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой в присутствии кислорода воздуха и получается азотная кислота. Кислота затем вступает во взаимодействие с соединениями натрия, кальция и калия, которые находятся в почве, и образует соли – селитры, которые нужны для питания растений.

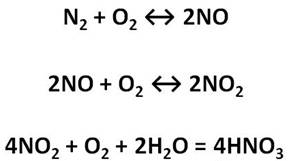
Простое вещество азот состоит из двухатомных молекул – N2. В молекуле азота атомы связаны между собой тройной ковалентной неполярной связью. Эта связь очень прочная, поэтому азот является малоактивным веществом.

Азот является бесцветным газом, не имеет запаха и вкуса, немного легче воздуха. Не сжижается при обычной температуре, плохо растворим в воде, его температура плавления -210 0 C, а температура кипения -196 0 C.
В лаборатории азот получают разложением нитрита аммония при слабом нагревании.
Азот относительно инертен в химических реакциях. Он не реагирует ни с кислотами, ни с водой, ни со щелочами.
При обычных условиях азот реагирует только с литием. При этом образуется нитрид лития.
Литий повышает свою степень окисления с 0 до +1, а азот понижает с 0 до -3. Каждый атом алюминия отдает по 6 электронов молекуле азота, при этом литий является восстановителем, а азот окислителем.
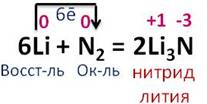
С другими металлами азот реагирует только при высоких температурах.
Например, в реакции с магнием образуется нитрид магния. Магний изменяет свою степень окисления с 0 до +2, а азот понижает с 0 до -3. Каждый атом магния отдаёт по 3 электрона молекуле азота. Магний в реакции является восстановителем, а азот – окислителем.
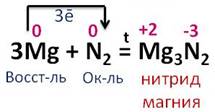
При высоких температуре, давлении и в присутствии катализатора азот реагирует с водородом, образуя при этом аммиак. В этой реакции азот понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот является окислителем, а водород восстановителем.
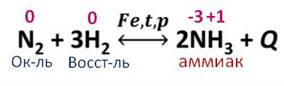
Как видите, это реакция соединения, так как из двух простых веществ образуется одно сложное, реакция экзотермическая, так как протекает с выделением теплоты, обратимая, то есть идёт как в прямом, так и в обратном направлении, каталитическая, потому что в реакции присутствует катализатор – железо. Реакция является окислительно-восстановительной, потому что происходит изменение степеней окисления, реакция гомогенная, так как вступающие в химическую реакцию вещества и продукты реакции в одном агрегатном состоянии – газообразном.
При высокой температуре азот соединяется с кислородом, образуя оксид азота два.
В этой реакции азот повышает свою степень окисления с 0 до +2, а кислород понижает с 0 до -2. Азот является восстановителем, а кислород – окислителем.
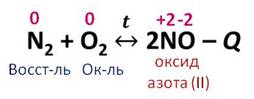
Так как эта реакция идёт с изменением степеней окисления, то она является окислительно-восстановительной, это реакция соединения, потому что из двух простых веществ образуется одно сложное. Реакция обратимая, идёт в прямом и обратном направлении, эндотермическая, так как теплота поглощается, реакция некаталитическая, потому что не требует участия катализатора, является гомогенной, так как все вещества находятся в газообразном состоянии.
Следует отметить, что в реакциях с металлами и водородом азот проявляет окислительные свойства, а в реакциях с кислородом – восстановительные.
Основная область применения азота – производство аммиака и азотной кислоты. Азот применяют также для создания инертной среды при сушке взрывчатых веществ, при хранении ценных произведений живописи и рукописей. Азотом раньше наполняли электрические лампы. Жидкий азот используют в охладительных системах.
В медицине чистый азот применяют в качестве инертной среды при лечении туберкулёза лёгких, а жидкий азот – при лечении заболеваний позвоночника и суставов.





Решим задачу. Определим массу соединения, которое образуется при нагревании металлического магния массой 7,2 г в азоте объёмом 10 л при нормальных условиях.
В условии задачи нам дана масса магния и объём азота. Найти необходимо массу образовавшегося соединения, то есть массу нитрида магния. Найдём количество вещества магния, для этого необходимо массу магния разделить на его молярную массу. То есть 7,2 г разделим на 24 г/моль, получим 0,3 моль, теперь найдём количество вещества азота, для этого нужно объём азота разделить на молярный объём. Для этого разделим 10 л на 22,4 л/моль, получается 0,446 моль. По уравнению реакции видно, что соотношение моль магния и азота составляет 3 : 1. Следовательно, количество вещества азота должно быть в три раза меньше количества вещества магния, то есть 0,1 моль. В результате вычислений мы получили количество вещества азота, равное 0,446 моль. Поэтому азот находится в избытке, и количество вещества нитрида магния находим по магнию.
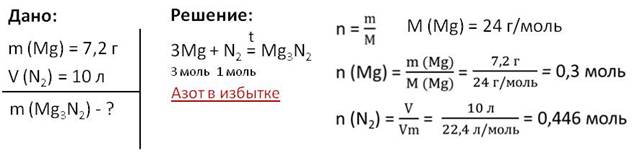
Получается, что количество вещества нитрида магния будет 0,1 моль, то есть 0,3 умножим на 1 и разделим на 3 и получится 0,1 моль. Найдём молярную массу нитрида магния. Для этого относительную атомную массу магния (24) умножим на 3 и прибавим относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль. Найдём массу этого вещества. Для этого следует количество вещества умножить на молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
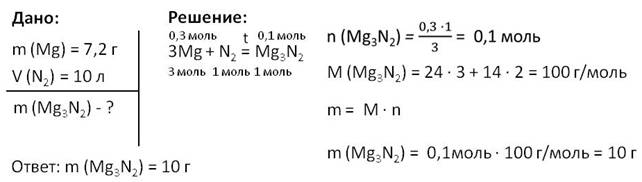
Таким образом масса нитрида магния будет равна десять г.
Азот - неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.

От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма - полуметалл, висмут - металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 3 :
- N - 2s 2 2p 3
- P - 3s 2 3p 3
- As - 4s 2 4p 3
- Sb - 5s 2 5p 3
- Bi - 6s 2 6p 3
При возбуждении атома азота электроны на s-подуровне распариваются и переходят на p-подуровень. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, что проявляется в особенностях электронной конфигурации возбужденного состояния.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.

В природе азот встречается в виде следующих соединений:
- Воздух - во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 - индийская селитра, калиевая селитра
- NaNO3 - чилийская селитра, натриевая селитра
- NH4NO3 - аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
Также азот можно получить путем восстановления азотной кислоты активными металлами.

Азот восхищает - он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
Реакция с неметаллами
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.

В промышленности аммиак получают прямым взаимодействием азота и водорода.
В лабораторных условиях сильными щелочами действуют на соли аммония.
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
-
Реакция с водой
Образует нестойкое соединение - гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.

Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода - реакция идет.
-
Реакции с кислотами
Реакции с щелочами
В реакциях с щелочами образуется гидроксид аммония - NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
Реакции с солями
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.

Закись азота, веселящий газ - N2O - обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
Оксид азота I разлагается на азот и кислород:
Окись азота - NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
В лабораторных условиях - в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
На воздухе быстро окисляется с образованием бурого газа - оксида азота IV - NO2.

При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем охлаждением полученной смеси газов до температуры - 36 °C.
При охлаждении газов образуется оксид азота III.
Является кислотным оксидом. соответствует азотистой кислота - HNO2, соли которой называются нитриты (NO2 - ). Реагирует с водой, основаниями.
Бурый газ, имеет острый запах. Ядовит.

В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.

Проявляет высокую химическую активность, кислотный оксид.
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
Окисляет SO2 в SO3 - на этой реакции основана одна из стадий получения серной кислоты.
Реакции с водой и щелочами
Оксид азота IV соответствует сразу двум кислотам - азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Висмут располагается в 6 периоде и по сравнению с остальными элементами Va группы имеет.
У элементов Va группы на внешнем уровне располагаются 5 электронов.
У элементов V группы главной подгруппы валентных (неспаренных) электронов три.
В промышленности аммиак получают в результате реакции соединения между азотом и водородом.
Формула веселящего газа (закиси азота) - N2O
Читайте также:

