Сравнение кислорода с хлором
[Это сообщение изменил Алексей П. (изменение 12 Января 2005 19:50).]
То есть в водном растворе свободный йод (в морской воде, например) переходит в соединения, а оказавшись на воздухе йодиды и йодаты теряют йод, который замещается хлором и фтором из воздуха. Поэтому йодированная соль имеет ограниченный срок хранения.
Punto
И если не трудно, назовите гораздо более эффективные и более безопасные способы устранения дефицита йода в организме
Йодированная соль, безусловно, безопасна для здоровья, что бы получить передоз йода - надо съесть несколько кило соли, и отравление произойдет солью раньше, чем йодом.
Употребление в пищу морской капусты и креветок вполне имхо обеспечивает организм необходимым йодом.
Добавление от 03 Января 2005 15:29:
Alex P.
Пунто абсолютно прав - единственный элемент, в соединениях с которым кислород имеет положительную степень окисления - это фтор.
Alex P.
А вот воду хлор медленно разлагает с образованием соответствующих соединений
Интересно, каких?
На самом деле хлор прекрасно растворим в воде (до 400 объемов в одном воды, насколько я помню из учебника Общей Химии Глинки), но о реакции хлора с водой я не слышал.
А вот примеров, в которых хлор выступает как менее сильный окислитель, чем кислород - куча.
ссылка . Хлор получают действием различных окислителей на соляную кислоту, например:
МnО2 + 4НСl = МnСl2 + Сl2 + 2Н2О.
[Это сообщение изменил Пъ (изменение 04 Января 2005 15:31).]
Добавление от 04 Января 2005 15:36:
на самом деле обсуждается вкус пищевой соли, представляющей собой смесь солей натрия, калия, магния и кальция (плюс йодиды и йодаты калия, как микроэлемент, на вкус не влияющий).
Добавление от 04 Января 2005 23:29:
Правда, существует и такая реакция:
Сl2 + Н2О НОСl + НСl
Но и в данном случае хлор не "замещает" кислород в воде.
А что же он, простите, делает, вытесняя кислород из его соединения с водородом?
Добавление от 04 Января 2005 23:48:
Добавление от 04 Января 2005 23:52:
Для меня однозначно предпочтение каменной соли относительно неких рафинированных вариантов
Интересно, почему?
Добавление от 04 Января 2005 23:56:
Особенно учитывая смысл слова "рафинированный" - очищеный.
Очищенная соль имеет 99.99% NaCl, я и начал свое повествование про соль с оспаривания полезности потребления чистого хлористого натрия, утверждая, что смесь солей вкуснее и полезнее. Потому как гармонично дополняет организм натрием, калием, магнием и кальцием.
По этому тезису есть возражения?
Добавление от 05 Января 2005 00:04:
Добавление от 05 Января 2005 00:21:
Пъ
Я говорю о явной химической реакции, при которой должен выделяться кислород. Я о такой не слышал.
Дак Вы о ней и написали в Сl2 + Н2О НОСl + НСl, но не рассмотрели процесс в целом, а только его часть
Хлорноватистая кислота немедленно начинает разлагаться сразу после образования, при этом выделяется кислород
Добавление от 05 Января 2005 00:26:
Alex P.
Хлорноватистая кислота немедленно начинает разлагаться сразу после образования, при этом выделяется кислород
Не совсем так. Поскольку реакция обратима - то образование атомарного кислорода должно немедленно привести к образованию Н2О и Cl, причем за атомарным хлором повышенной активности не наблюдается, в отличии от О.
Но в этом я не уверен.
Добавление от 05 Января 2005 00:30:
И заодно - не стоит путать соли с оксидами.
Добавление от 05 Января 2005 00:32:
Alex P.
Почему Вы считаете, что только действие свободных элементов является определяющим в этом вопросе ?
Действительно, азотная кислота тоже воздействует на оксиды металлов - значит азот тоже активнее кислорода?
Добавление от 05 Января 2005 00:39:
Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой вещества более или менее неустойчивые. Наиболее устойчивы соли кислородных кислот, наименее устойчивы — окислы. Во всех кислородных соединениях галогены проявляют положительную валентность, достигающую семи у высших кислородных соединений хлора и иода.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
В табл. 20 для общей ориентировки приведены формулы окислов и кислот, образуемых хлором, а также названия кислот и соответствующих им солей. В скобки заключены предполагаемые, но не полученные пока соединения.
| Кислоты | |||
| Окислы | формула | название | Название солей |
| Сl2O | HClO | Хлорноватистая | Гипохлориты |
| (Cl2O3) | HClO2 | Хлористая | Хлориты |
| СlO2 | — | — | — |
| (Сl2O3) | HClO3 | Хлорноватая | Хлораты |
| Cl2O7 | HClO4 | Хлорная | Перхлораты |
Все кислородные соединения хлора являются сильными окислителями. Производя окисление, положительно валентные атомы хлора обычно восстанавливаются или до нейтрального хлора или до отрицательно заряженных ионов Сl’. Важное практическое применение имеют соли хлорноватистой и хлорноватой кислот — гипохлориты и хлораты.
Гипохлориты. В основе их получения лежит реакция хлора с водой, приводящая к образованию хлорноватистой кислоты:
Эта реакция представляет собой не что иное, как гидролиз хлора. Можно предполагать, что гидролизу предшествует поляризация ковалентной связи между атомами хлора в. молекуле Сl2, т. е. смещение общей пары электронов в сторону одного из атомов под влиянием полярных молекул воды. Затем положительно зарядившийся атом хлора соединяется с гидроксилом воды, вытесняя протон, и одновременно другой атом хлора превращается в ион [:Сl:] — , как это показано на следующей схеме:
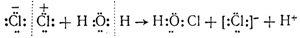
Из схемы видно, что гидролиз хлора является окислительно-восстановительной реакцией, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется:
Сl − e — = Cl (+1)
Cl + e — = C (-1)
Такой процесс, когда одни атомы одного и того же элемента являются окислителями, а другие — восстановителями, называется самоокислением-самовосстановлением.
Получающиеся при гидролизе хлора НСl и НСlO могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается когда прореагирует приблизительно 1 /3растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами Сl2 значительное количество соляной и хлорноватистой кислот.
Расщепление ковалентной связи между атомами хлора при его гидролизе имеет иной характер, чем расщепление связи между ними же, происходящее при действии света на хлор и сопровождающееся образованием свободных атомов хлора

расщепление связи расщепление связи при гидролизе при действии света
Первый вид расщепления ковалентной связи называется неоднород-н ы м, а второй — однородным.
Примерами однородного и неоднородного расщепления связи могут также служить термическая диссоциация йодистого водорода при нагревании:
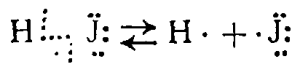
и электролитическая диссоциация иодистого водорода при растворении в воде:
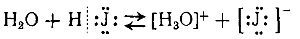
Хлорноватистая кислота НСlO очень неустойчива и в растворе постепенно распадается на хлористый водород и кислород:
По мере разложения хлорноватистой кислоты равновесие приведенной на стр. 324 реакции между хлором и водой смещается вправо и в конце концов весь хлор вступает во взаимодействие с водой, а в растворе остается только НСl. Свет очень ускоряет эту реакцию, поэтому хлорную воду следует всегда хранить в темноте.
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять понемногу щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие реакции гидролиза хлора тоже сдвигается вправо; в результате получается раствор, содержащий соли хлорноватистой и соляной кислот:
HCl + НСlO + 2КОН = КСl + КClO + 2Н2O
Тот же результат, очевидно, получится, если непосредственно пропускать хлор в холодный раствор щелочи: 2КОН + Сl2 = КСl + КСlO + Н2O
или в ионной форме:
Полученная таким путем жидкость, содержащая в растворе смесь солей хлорноватистой и соляной кислот, называется ж а-велевой водой (Javelle — местечко около Парижа, где впервые стали изготовлять эту воду) и применяется для беления; ее белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже под влиянием углекислого газа воздуха, причем выделяется хлорноватистая кислота:
Последняя и действует обесцвечивающим образом на красящие вещества.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор едкого натра. Оба раствора могут быть получены также путем электролиза КCl и NaCl, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами .
При действии хлора на сухую гашеную известь получается так называемая белильная или хлорная известь. Главной составной частью ее является гипохлорит кальция Са(СlO)2, образующийся по реакции
наряду с ним хлорная известь содержит также и другие соли кальция.
Хлорная известь представляет собою белый порошок с резким запахом, обладающий сильными окислительными свойствами. Во влажном воздухе под действием углекислого газа она постепенно разлагается, выделяя хлорноватистую кислоту, чем и обусловливается ее характерный запах:
При действии на хлорную известь соляной кислоты выделяется хлор:
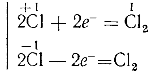
Хлорная известь широко применяется для отбелки растительного волокна (тканей, бумаги), для дезинфекции выгребных ям, отхожих мест, сточных канав и пр. В противохимической обороне хлорная известь играет важную роль как средство дегазации местности, зараженной отравляющими веществами.
В последнее время промышленностью освоено изготовление хлорной извести с очень высоким содержанием активного хлора, состоящей из почти чистого гипохлорита кальция Са(СlO)2. Для ее получения действуют хлором на известковое молоко — смесь гашеной извести с небольшим количеством воды. Образующийся гипохлорит кальция выделяется в виде мелких кристаллов состава Са(СlO )2 • 3Н2О. По окончании реакции осадок отфильтровывают и высушивают. Полученный таким образом технический продукт содержит до 70% активного хлора.
Хлораты представляют собой соли довольно неустойчивой хлорноватой кислоты НСlO3. Общеизвестной и самой важной из этих’солей является хлорат калия КСlO3, или бертолетова соль.
Если нагревать раствор гипохлорита калия, то он утрачивает свои белящие свойства. Это происходит вследствие разложения КСlO с образованием бертолетовой соли по следующему уравнению:
3КСlO = КСlO3 + 2КСl
или в ионной форме
При этой реакции 2 /3 атомов хлора, входящих в состав ионов СlO’ и имеющих валентность +1, превращается в ионы Сl’, т. е. восстанавливается, в то время как 1 /3 тех же атомов из валент ного состояния +1 переходит в валентное состояние +5, т. е. окисляется.
Если пропускать хлор в горячий раствор едкого кали, то вместо КСlO сразу получается КСlO3:
При этом 1 /6 часть атомов хлора окисляется до ионов СlO3‘, а 5 /6 восстанавливаются до ионов Сl’.
Так как бертолетова соль трудно растворима в холодной воде, то при охлаждении раствора она выпадает в виде кристаллов и таким образом отделяется от остающегося в растворе хлористого калия.
При нагревании бертолетова соль легко разлагается с выделением кислорода:
С различными горючими веществами (серой, углем, фосфор ром) бертолетова соль образует смеси, сильно взрывающие при ударе. На этом основано ее применение в артиллерийском деле для устройства запалов. Бертолетова соль употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главнейшим же потребителем бертолетовой соли является спичечная промышленность. В головке обычной спички содержится около 50% бертолетовой соли.
Соответствующая бертолетовой соли хлорноватая кислота НСlO3 известна только в виде водного раствора, который может быть сгущен выпариванием до концентрации в 50%. Хлорноватая кислота действует как сильный окислитель. Структурная формула хлорноватой кислоты:
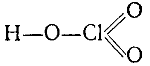
Ангидрид хлорноватой кислоты неизвестен. Вместо него при разложении хлорноватой кислоты, например при действии концентрированной серной .кислоты на бертолетову соль, выделяется желто-бурый газ с характерным запахом — двуокись хлора СlO2. Двуокись хлора очень неустойчива и легко разлагается со взрывом на хлор и кислород от нагревания, соприкосновения с органическими веществами и т. п. Смесь бертолетовой соли с сахаром воспламеняется при смачивании ее каплей серной кислоты, так как выделяющаяся двуокись хлора является сильным окислителем.
При осторожном нагревании в отсутствие катализатора бертолетова соль частично разлагается с выделением кислорода частично же переходит в соль хлорной кислоты — перхлорат калия КСlO4:
Перхлораты — более прочные соединения, чем хлораты. Действуя на перхлорат калия серной кислотой, можно получить свободную хлорную кислоту HClO4, которая в чистом виде представляет собой бесцветную жидкость, замерзающую при —112°.
Хлорная кислота HClO4 наиболее устойчивая из кислородных кислот хлора. В то же время она самая сильная из всех известных кислот: ее кажущаяся степень диссоциации в 0,5 н. растворе равна 88%, т. е. больше, чем кажущаяся степень диссоциация соляной кислоты при тех же условиях. Окислительные свойства у хлорной кислоты выражены слабее, чем у хлорноватой.
Строение хлорной кислоты выражается формулой
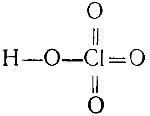
Если нагревать хлорную кислоту с фосфорным ангидридом, отнимающим от нее воду, то образуется хлорный ангидрид:
Хлорный ангидрид — маслянистая жидкость, кипящая при 83°; сильно взрывает при ударе.
Сопоставление свойств важнейших кислородных соединений хлора позволяет сделать следующий общий вывод:С увеличением валентности хлора растет устойчивость его кислородных кислот, и их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота. Наоборот, сила кислородных кислот хлора увеличивается с увеличением валентности последнего. Наиболее слабой является хлорноватистая кислота (константа ее диссоциации около 10 -8 ), наиболее сильной — хлорная кислота.
Кислородные соединения фтора. Наиболее изученным соединением
фтора с кислородом является окись фтора, или фтористый кислород OF2, впервые полученный только в 1927; г. Это — бесцветный газ, сгущающийся в жидкость при —145°, очень ядовитый, малорастворимый в воде.
Фтористый кислород получается при действии фтора на 2%-ный раствор щелочи:
По всем признакам (низкая температура кипения, плохая растворимость в воде) фтористый кислород представляет собой соединение, в котором связи фтора с кислородом ковалентны. Строение его может быть изображено так:

Так как металлоидные свойства выражены у фтора сильнее, чем у кислорода, то следует считать, что во фтористом кислороде фтор отрицательно одновалентен, а кислород положительно двухвалентен.
Кислородные соединения брома и йода
Из кислородных соединений брома известны бромноватистая НВrО и бромноватая НВrО3 кислоты и их соли, которые получаются аналогично соответствующим соединениям хлора, но отличаются меньшей устойчивостью. Бромная кислота и ее соли неизвестны. Окислы брома очень неустойчивые соединения, существующие только при низких температурах.
Иод образует высший окисел J2O5 — йодноватый ангидрид, которому соответствует йодноватая кислота HJO3. Натриевая соль этой кислоты встречается как примесь к чилийской селитре. Калиевую соль можно получить тем же способом, что и бертолетову соль, действуя иодом на горячий раствор щелочи.
Свободная йодноватая кислота получается окислением иода в присутствии воды. Если в качестве окислителя взять хлор, то реакция идет по следующему уравнению:
Йодноватая кислота представляет собой кристаллическое вещество, вполне устойчивое при обычной температуре. При нагревании до 200° йодноватая кислота теряет элементы воды и переходит в твердый йодноватый ангидрид:
Выше 300° йодноватый ангидрид, в свою очередь, распадается на иод и кислород.
Кроме йодноватой кислоты, известна еще йодная кислота HJO4, которая может быть получена действием иода на НСlO4:
При выпаривании раствора HJO4 получаются бесцветные кристаллы, имеющие состав HJO4 x 2H2O и плавящиеся при 130°. Этот кристаллогидрат следует, однако, рассматривать как новую пятиосновную кислоту H5JO6 (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например, Ag5JO6).
Йодный ангидрид J2O7 не получен.
Вы читаете, статья на тему Кислородные соединения галогенов
Галогены с кислородом непосредственно не реагируют. Но кислородсодержащие кислоты галогенов (кроме фтора) могут быть получены как продукты реакций диспропорционирования хлора, брома и йода с водой и щелочами. В параграфе 87 приведена реакция хлора с водой, в результате которой часть растворенного хлора переходит в кислоту НСЮ, называемую хлорноватистой кислотой. В этой молекуле хлор в степени окисления + 1 связан с кислородом:

Хлорноватистая кислота известна только в водном растворе. Это неустойчивое вещество претерпевает различные превращения. На свету кислород отщепляется от хлора:

В момент образования кислород в виде отдельных атомов очень активен, вследствие чего раствор проявляет сильное окислительное действие. При отнятии воды, например, действием безводного хлорида кальция, из сильно охлажденного раствора выделяется оксид хлора (1), С120, в виде красно-бурой жидкости с температурой кипения +3,8°С. Это тоже неустойчивое вещество, способное взрываться. Растворяясь в воде, он снова образует хлорноватистую кислоту. При нагревании раствора НСЮ происходит более глубокое диспропорционирование хлора с переходом в степень окисления +5:

Образующееся кислородсодержащее соединение называется хлорноватой кислотой. Это более устойчивое соединение, сильная кислота, образующая растворы с массовой долей до 40%. Под действием серной кислоты хлорноватая кислота диспропорционирует, образуя еще два новых соединения хлора:

Хлорная кислота НС104 содержит хлор в высшей степени окисления +7. Второй продукт реакции оксид хлора(1У) содержит хлор в необычной для него степени окисления +4. Хлор в этом состоянии имеет неспаренный электрон. Это также неустойчивое, взрывчатое соединение хлора. В водном
растворе С102 диспропорционирует на две кислоты — хлорноватую и хлористую. В последней степень окисления хлора +3:

Таким образом, в рассмотренных реакциях показано образование четырех кислородсодержащих кислот хлора, образующих ряд с возрастающими нечетными степенями окисления и валентностями хлора от +1 до +7 (табл. 18.3). В этом ряду наблюдается последовательное и резкое возрастание силы кислот от очень слабой хлорноватистой до одной из самых сильных хлорной. Усиление кислот в этом ряду связано с увеличением числа атомов кислорода, соединенных с хлором двойными связями. Это способствует делокализации заряда аниона, что затрудняет присоединение к нему иона водорода с образованием молекулы кислоты.
Таблица 18.3
Кислородсодержащие кислоты хлора
Степень окисления хлора
Константа кислотности Ка
Стандартный потенциал пар НС10Х/С1 , в

Приведенные в последней строчке табл. 18.3 значения стандартных потенциалов показывают, что все четыре кислоты являются сильными окислителями, по силе превосходящими хлор. Вместе с тем, как очевидно из протекания многочисленных реакций, окислительная активность резко падает в ряду от НСК) к НСЮ4. Например, хлорноватистая кислота моментально выделяет йод из раствора иодида калия, а разбавленная хлорная кислота с раствором К1 практически не реагирует. Хлорноватистая кислота и ее соли обесцвечивают органические красители, в то время как хлорная кислота окисляющего действия на них не оказывает. Таким образом, увеличение числа атомов кислорода, окружающих атом хлора, способствует стабилизации как молекул кислот, так и анионов их солей. Повышение устойчивости проявляется и в том, что из четырех кислот только хлорная может быть получена в безводном состоянии.
Находящие практическое применение соли хлорноватистой и хлорноватой кислот получаются взаимодействием хлора с растворами щелочей (см. параграф 88). Гипохлорит калия КСЮ служит отбеливающим средством. Он получается пропусканием хлора в раствор гидроксида калия. Одновременно образуется хлорид калия:

Этот раствор называется жавелевой водой ^ауеПе — местечко около Парижа, где впервые стали изготовлять эту воду). Кислота НСЮ настолько слабая, что вытесняется из соли под действием углекислого газа:

Эта кислота и обесцвечивает красители.
Как активные окислители гипохлориты нашли применение в медицине. Они проявляют дезинфицирующее, антисептическое, противомикробное действие. Гипохлорит натрия ЫаСЮ применяется в растворе с массовой долей 0,06% для промывания ран, при операциях па грудной клетке, брюшной или плевральной полостях. Выпускается раствор гипохлорита натрия и для инъекций.
Взаимодействием хлора с другой щелочью — гидроксидом кальция в отсутствие воды получается практически важный продукт хлорная известь. Это белый порошок, иногда серый или желтоватый от присутствия примесей, пахнущий хлором. В составе хлорной извести имеются СаС12, Са(СЮ)2, Са(ОН)2 и вода. Часто хлорную известь представляют, как смешанную соль с двумя разными анионами: СаС1(СЮ). Хлорная известь реагирует даже со слабыми кислотами с выделением хлора:

Выделяющийся хлор реагирует с органическими веществами, в результате чего, в частности, гибнут микроорганизмы. Поэтому хлорная известь широко применяется в санитарных целях. Она применяется также для отбеливания бумаги и тканей и для лабораторного получения хлора.
Пропусканием хлора в горячий раствор гидроксида калия получают смесь двух солей — хлорида калия КС1 и хлората калия КСЮ3. При охлаждении раствора хлорат калия начинает кристаллизоваться. При 20°С его растворимость составляет 7,4 г на 100 г воды, в то время как растворимость хлорида калия равна 34 г. Хлорат калия называют бертолетовой солью, так как он был впервые получен К. Бертолле. Бертолетову соль предполагалось использовать в составе пороха взамен селитры, но при испытаниях быстрая детонация такого пороха приводила к разрыву пушечных стволов. Вместо этого бертолетова соль нашла широкое применение в качестве окислителя в составах для фейерверков. Она является также окисляющей составной частью спичечной головки. Кислород, отщепляющийся от хлора в хлорате калия, в твердых смесях окисляет уголь, серу, фосфор, органические вещества. Реакции сопровождаются яркими вспышками. Напишем реакцию сгорания сахарозы:

При нагревании хлорат калия и другие соли кислородсодержащих кислот хлора разлагаются с выделением кислорода. Разложение хлората калия ускоряется в присутствии оксида марганца(ГУ):

При нагревании бертолетовой соли без катализатора происходит диспропорционирование хлора с образованием перхлората калия:

При еще более сильном нагревании до
520°С перхлорат калия тоже разлагается, выделяя кислород. Относительно высокая термическая устойчивость перхлоратов и устойчивость их в растворах характерна и для других солей с анионами, в которых центральный атом окружен четырьмя атомами кислорода. Такие анионы имеют тетраэдрическое строение, а тт-связи в них полностью делокализованы:

Кислородные соединения брома менее устойчивы по сравнению с кислородными соединениями хлора. Оксид брома Вг20 разлагается уже при температуре плавления -17°С. Свободный бром реагирует со щелочью при нагревании аналогично хлору:

Бромат натрия ЫаВЮ3 применяется как окислитель в аналитической химии. Например, по реакции с броматом калия определяют оксид мышьяка(Ш):

Бром трудно окислить до степени окисления +7. До 1970 г. соли бромной кислоты НВЮ4 не были получены, и в учебниках иногда давались объяснения, почему они не существуют. Впервые пербромат натрия был получен по реакции

Кислородные соединения йода более устойчивы по сравнению с другими галогенами. В щелочном растворе йод диспроиорционирует аналогично брому. При пропускании хлора в водную суспензию йода образуется йодноватая кислота:

Из раствора йодноватая кислота выделяется в виде устойчивого кристаллического вещества. При ее обезвоживании получается оксид 12О5, устойчивый при обычных условиях. Он нашел применение для анализа воздуха на присутствие оксида углерода(И). Анализ основан на реакции, соттовожлаюшейся выделением йода:

Известна также йодная кислота НЮ4, которая может быть получена действием хлорной кислоты на йод:

После испарения воды из раствора йодной кислоты получаются бесцветные кристаллы Н104*2Н20. Из химических свойств этого вещества следует, что все атомы кислорода связаны непосредственно с йодом, и вещество представляет собой ортоиодную кислоту Н5Ю6. Весь водород может быть замещен металлами. Известна, например, нерастворимая соль Ag5I06 черного цвета.
Как известно, в группах ^-элементов усиливается металличность при переходе в группе сверху вниз. В группе галогенов находятся элементы, наиболее далекие по свойствам от металлов. И все же у тяжелого элемента йода проявляются признаки металличности. Черные кристаллы йода имеют слабый металлический блеск, а электрическое сопротивление значительно ниже, чем у такого типичного неметалла, как сера. Йод, подобно металлам, может входить в состав вещества в качестве катиона. Неустойчивый катион 1 + может быть стабилизирован образованием комплексного иона с органическими молекулами. При реакции йода с нитратом серебра в присутствии пиридина С5Н5Ы образуется комплексный ион такого типа:

Кислородные соединения фтора интересны тем, что фтор является единственным элементом, по электроотрицательности превосходящим кислород. Поэтому простейшее из этих соединений ОР2 следует называть не оксидом фтора, а фторидом кислорода. Это газообразное вещество получается при действии фтора на 2%-ный раствор гидроксида натрия:

Своим угловым строением молекула фторида кислорода напоминает молекулу воды, но их дипольные моменты р направлены противоположно:

Фторид кислорода термодинамически неустойчив, при ^ > 200°С распадается на кислород и фтор. Есть и более сложные по составу фториды
кислорода: 02Р2, 03Р2 и др. Это неустойчивые вещества с темной красноватой окраской. В некоторых случаях они используются как фторирующие реагенты.
Фтор, так же как и кислород, не проявляет высокой валентности, соответствующей номеру группы, так как не имеет энергетически доступных свободных орбиталей для перехода в возбужденное состояние.
Далее перейдем к рассмотрению других групп /^-элементов по убыванию номеров.
Читайте также:

