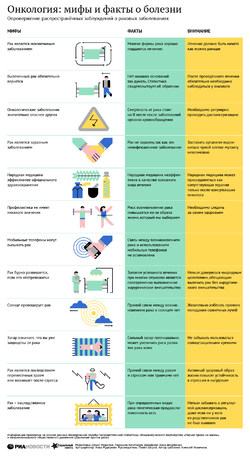
Способность отработанных вызывать образование злокачественных опухолей называется
Злокачественная опухоль – это автономный патологический прогрессирующий процесс, не предусмотренный планом строения и функционирования организма и представляющий собой бесконтрольное размножение клеток, отличающихся способностью к колонизации окружающих тканей и метастазированию.
Для злокачественного новообразования характерен атипизм, то есть утрата характеристик нормальных тканей. Атипизм отмечается на различных уровнях: биохимическом (измененные обменные процессы), антигенном (своеобразный набор антигенов, не свойственный нормальным клеткам и тканям), морфологическом (характерная структура) и т. д.
Ежегодно в мире злокачественные новообразования диагностируются более чем у 10 миллионов человек; в структуре смертности данные заболевания располагаются на втором месте после сердечно-сосудистой патологии. Наиболее часто встречающаяся форма злокачественных опухолей – рак легких, за ним следует рак молочной железы.
В России ежегодная заболеваемость составляет приблизительно 500 тысяч человек, на диспансерном учете по поводу новообразований злокачественного характера находится около 3 миллионов пациентов (приблизительно 2% населения). В последние десятилетия отмечается явная тенденция к росту числа онкологических заболеваний.
Причины и факторы риска
Существует несколько теорий относительно причин и механизмов развития злокачественных опухолей:
- физико-химическая (теория Вирхова);
- дизонтогенетическая (Конгейма);
- вирусно-генетическая (Зильбера);
- иммунологическая (Бернета);
- полиэтиологическая (Петрова).
Физико-химическая теория объясняет развитие злокачественных опухолей как следствие воздействия на организм различных экзо- и эндогенных канцерогенов, систематического травмирования. Наибольшей канцерогенной активностью обладают агрессивные химические вещества, ионизирующее излучение, некоторые продукты собственного метаболизма (метаболиты триптофана и тирозина), ультрафиолетовое излучение, компоненты табачного дыма, афлатоксины и т. д. Воздействие перечисленных веществ на клетку в определенных дозах приводит к повреждению ее генетического аппарата и злокачественному перерождению. Возможно развитие злокачественных опухолей в местах постоянного трения, привычной травматизации.
Вирусно-генетическая теория главенствующую роль в развитии опухолей отводит воздействию онкогенных вирусов, к которым относят, например, вирусы герпеса (в том числе Эпштейна – Барра), папилломавирусы, вирусы гепатитов, иммунодефицита человека, вирус Т-клеточного лейкоза и др. После попадания вирусной частицы внутрь нормальной клетки происходит объединение их генетических аппаратов. Клетка-хозяин начинает функционировать как сборщик компонентов вируса, продуцируя элементы, необходимые для его жизнедеятельности. В этот момент зачастую происходит злокачественное перерождение нормальных клеток организма, запускается неконтролируемая клеточная пролиферация; наличие вируса перестает играть решающую роль в канцерогенезе, и процесс становится необратимым.
Иммунологическая теория Бернета провокатором формирования злокачественных опухолей называет сбой функционирования иммунной системы (повреждение иммунологического надзора), при котором она теряет способность распознавать и уничтожать измененные атипичные клетки, что приводит к их бурному бесконтрольному росту.
Полиэтиологический подход к объяснению развития злокачественных опухолей предполагает сочетанное воздействие на нормальные структуры организма множества провоцирующих факторов, что ведет к их повреждению и дальнейшему перерождению.
В результате провоцирующих воздействий развивается недостаточность естественной системы противораковой защиты, функционирование которой обеспечивается следующими компонентами:
- антиканцерогенный механизм, ответственный за обезвреживание потенциально опасных агентов;
- антитрансформационный механизм, предотвращающий злокачественное перерождение нормальных клеток и тканей;
- антицеллюлярный механизм, заключающийся в своевременном удалении злокачественных клеток и нормальных клеток организма, претерпевших озлокачествление.
В результате повреждения системы противоопухолевой защиты или чрезмерного воздействия провоцирующих факторов формируются злокачественные новообразования.
Формы заболевания
В зависимости от тканей, из которых происходит опухоль, выделяют такие формы злокачественных новообразований:
- эпителиальные органонеспецифические (в местах нетипичной локализации эпителиальной ткани);
- эпителиальные органоспецифические (экзо- и эндокринные железы, покровы тела);
- мезенхимальные;
- меланинобразующей ткани;
- нервной системы и оболочек головного и спинного мозга;
- кроветворной и лимфатической тканей (гемобластозы);
- образованные из зародышевых тканей.
Злокачественные новообразования оказывают на организм множественное воздействие – как местное, так и системное.
Виды опухолей в соответствии с типами исходных клеток:
- карцинома (собственно рак) – эпителиоциты;
- меланома – меланоциты;
- саркома – клетки соединительной ткани;
- лейкоз – кровеобразующие клетки костного мозга;
- лимфома – лимфатические клетки;
- тератома – гоноциты;
- глиома – клетки нейроглии;
- хориокарцинома – клетки трофобласта.
Виды собственно рака (карциномы) выделяются в зависимости от разновидности эпителиальной ткани, из которой он происходит, и особенностей строения:
- плоскоклеточный (без ороговевания, с ороговеванием);
- аденокарцинома;
- рак на месте (in situ);
- солидный (трабекулярный);
- фиброзный;
- медуллярный;
- слизистый;
- мелкоклеточный.
По морфологическим признакам:
- дифференцированный рак (медленно прогрессирующий, метастазирование развивается медленно);
- недифференцированный (быстро эволюционирует, дает распространенные метастазы).
По количеству патологических очагов новообразования могут быть уни- и мультицентрическими (один или несколько первичных очагов соответственно).
В зависимости от особенностей роста в просветах органов злокачественные опухоли бывают:
- экспансивными (экзофитный рост), когда новообразование растет в просвет органа;
- инфильтрирующими (эндофитный рост) – в этом случае опухоль прорастает в стенку органа или окружающие ткани.
Степени
Степень развития основного очага обозначается как Т (tumor) с соответствующим индексом:
- Тis или Т0 – так называемый рак in situ (рак на месте), когда измененные клетки располагаются внутриэпителиально, не прорастая в подлежащие ткани;
- Т1–4 – степень развития злокачественной опухоли, от минимально выраженной (Т1) до максимальной (Т4) соответственно.

Вовлеченность в патологический процесс регионарных лимфоузлов (местное метастазирование) обозначается как N (nodulus):
- Nx – обследование близлежащих лимфатических узлов не проводилось;
- N0 – при обследовании регионарных лимфоузлов изменений не выявлено;
- N1 – в ходе исследования подтверждено метастазирование в близлежащие лимфоузлы.
Наличие метастазов – М (metastasis) – свидетельствует о вовлечении прочих органов, поражении близлежащих тканей и отдаленных лимфоузлов:
- Мx – выявление отдаленных метастазов не проводилось;
- М0 – отдаленные метастазы не выявлены;
- М1 – подтверждено отдаленное метастазирование.
Симптомы
Злокачественные новообразования оказывают на организм множественное воздействие – как местное, так и системное. Местные негативные последствия заключаются в сдавлении прилежащих тканевых структур, сосудистых и нервных стволов, лимфатических узлов разрастающейся опухолью. Системное воздействие проявляется общей интоксикацией продуктами распада, истощением ресурсов организма вплоть до кахексии, нарушением всех видов обмена.
Местные признаки, нередко свидетельствующие о наличии злокачественной опухоли, разнообразны и варьируют в зависимости от заинтересованного органа:
- необычная несимметричная припухлость, уплотнение;
- кровотечения;
- кашель;
- кровохарканье;
- диспепсические расстройства;
- осиплость голоса;
- систематические боли;
- спонтанное увеличение размера и окраски родинок, родимых пятен; и т. д.
Общие неспецифические признаки:
Диагностика
Для диагностики злокачественных опухолей и выявления местного и отдаленного метастазирования используется весь спектр методов исследования – в зависимости от предполагаемой локализации новообразования (лабораторные анализы, рентгенографические и ультразвуковые исследования, компьютерная и магнитно-резонансная томографии, эндоскопические методы и т. д.).
Окончательный диагноз устанавливается после проведения биопсии – забора клеток или фрагмента тканей – с последующим гистологическим или цитологическим исследованием полученного материала. О злокачественном процессе говорит наличие атипичных клеток в исследуемом образце.
Ежегодно в мире злокачественные новообразования диагностируются более чем у 10 миллионов человек; в структуре смертности данные заболевания располагаются на втором месте после сердечно-сосудистой патологии.
Лечение
Тактика лечения злокачественной опухоли определяется в зависимости от ее расположения, размера, степени злокачественности, наличия метастазов, вовлечения прочих органов и тканей и других критериев.
Консервативные методы терапии:
- химиотерапевтическое воздействие (медикаментозное подавление неконтролируемого размножения злокачественных клеток или их прямое уничтожение, уничтожение микрометастазов);
- иммуностимуляция;
- радиолечение (воздействие на опухоль рентгеновскими и γ-лучами);
- криотерапия (влияние на атипичные клетки низкими температурами);
- фотодинамическая терапия;
- экспериментальные методы воздействия, для оценки которых не собрана достаточная доказательная база.
В ряде случаев, помимо указанных методов воздействия, показано хирургическое иссечение злокачественной опухоли с близлежащими тканями, лимфатических узлов, оперативное удаление отдаленных метастазов.
Если пациент находится на терминальной стадии заболевания, назначается так называемое паллиативное лечение – терапия, направленная на уменьшение страданий неизлечимого пациента (например, наркотические анальгетики, снотворные препараты).
Возможные осложнения и последствия
Осложнениями злокачественных опухолей могут быть:
- кровотечения;
- прорастания в соседние органы с их повреждением;
- бесконтрольное бурное прогрессирование;
- метастазирование;
- рецидивирование;
- летальный исход.
Прогноз
Прогноз для пациентов, являющихся носителями злокачественных опухолей, зависит от множества факторов:
- локализации патологического процесса;
- возраста пациента;
- стадии;
- наличия метастазов;
- строения и формы роста опухоли;
- объема и способа оперативного вмешательства.
В последние десятилетия отмечается явная тенденция к росту числа онкологических заболеваний.
Профилактика
Профилактические мероприятия состоят в следующем:
- Устранение или минимизация контакта с канцерогенами.
- Периодические профилактические осмотры с выявлением онкомаркеров.
- Модификация образа жизни.
Видео с YouTube по теме статьи:
Внешние факторы канцерогенеза многолики и обширны. Доказанные химические канцерогены – это около 400 соединений антропогенного и природного происхождения, вызывающие раковые опухоли. Негативное действие на клетки может быть прямым или опосредованным, медленным или быстрым, обратимым или необратимым, но исход один – злокачественное перерождение тканей разных органов и систем организма.

Химические вещества могут стать причиной опухолевого роста
Химические канцерогены
Любые соединения, провоцирующие прямо или опосредованно канцерогенные изменения в здоровых клеточных структурах живого организма, относятся к факторам, вызывающим злокачественные опухоли. Самым первым доказанным химическим канцерогеном стала обычная сажа в печных трубах (у лондонских трубочистов удалось резко снизить частоту рака мошонки после введения закона об обязательном и ежедневном принятии ванны по окончании работы). Сейчас имеется более 6 миллионов различных естественных и искусственно созданных химических соединений, из которых около 400 могут вызвать раковое перерождение. При этом следует понимать, что огромное количество веществ не исследованы с точки зрения возможного канцерогенеза.
Принцип воздействия на клеточные структуры
Химические канцерогены являются значимым фактором риска для 80% всех видов злокачественных опухолей. Выделяют следующие основные механизмы химического канцерогенеза:
- Генотоксический – прямое повреждение или мутация клеточного генетического кода;
- Опосредованный (негенотоксический) – вещество провоцирует внутриклеточные патологические изменения, способствующие возникновению рака.
В первом случае химические канцерогены сразу изменяют ДНК клеточных структур, запуская онкологический процесс, во втором – на начальном этапе в клетке происходят неонкогенные нарушения, но на их фоне возможна стимуляция злокачественного роста.
К важным закономерностям формирования раковой опухоли относятся:
- длительное и медленное влияние (с момента контакта с канцерогенным фактором до выявления опухоли может пройти большое количество времени – 5-20 лет);
- важная зависимость дозы вещества (чем сильнее каждое разовое воздействие, тем больше риск быстрого развития новообразования);
- отсутствие пороговой дозы (доказанные химические канцерогены в любых дозах и количествах вызывают рак);
- необратимость (даже после прекращения внешнего воздействия генотоксического фактора нет никаких гарантий, что через определенный промежуток времени не возникнет опухолевый рост).
Химические канцерогены убивают – отсрочено, медленно, но необратимо: понимая это, необходимо сделать все, чтобы предупредить контактирование с любым видом веществ, провоцирующих онкологию.
Классификация
В зависимости от опасности и значимости все химические вещества разделены на 4 группы:
- Доказанные химические канцерогены;
- Недоказанный фактор канцерогенеза для человека, но имеются факты возникновения рака у животных;
- Нет исследований на животных и людях, поэтому нельзя доказать отсутствие канцерогенности;
- Химическое вещество не вызывает рак.
Особо опасны соединения из 1 группы: именно с этими веществами недопустимо контактировать в быту и на рабочем месте.

Пыль бериллия способна быстро вызвать рак легких (через 3-4 года)
Химические канцерогены – какие виды рака вызывают
Важно знать и понимать, что могут сделать внешние факторы при длительном воздействии небольшими дозами, чтобы предотвратить риск для здоровья. Из наиболее опасных доказанных причин рака выделяют:
- ароматические углеводороды (бензпирен) – рак легких, кожи и мочевого пузыря;
- бензол – лейкоз (рак крови);
- нитрозосоединения (нитриты, нитраты) – рак желудка, пищевода, печени и головного мозга;
- тяжелые металлы (никель, ртуть, свинец, мышьяк, кадмий, бериллий, хром, кобальт) – рак кожи, легких, простаты и желудка;
- асбест – рак легких, органов желудочно-кишечного тракта;
- хлорвинил (газ, используемый для производства пластмасс) – стимулятор пластмассового канцерогенеза в легких, печени и крови;
- афлатоксин (продукт жизнедеятельности плесневого гриба) – рак печени;
- табак (в виде курения, жевания, вдыхания нюхательного порошка) – рак легких, пищевода, гортани, желудка, колоректальной области, почки, мочевого пузыря, цервикального канала.
Химические канцерогены, входящие в состав табачного дыма, вызывают 35% всех видов раковых опухолей. Человек сам создает условия для формирования опухолевого роста, продолжая использовать табак в повседневной жизни. Курение – это медленное и отсроченное самоубийство: когда придет время смертельной болезни, не надо спрашивать у врача, откуда взялась опухоль и кто виноват в возникновении заболевания.
Содержание
- 1 Канцерогенез
- 1.1 Характеристика злокачественной опухоли
- 1.2 Причины
- 2 Интересно
- 3 Читайте также
- 4 Источники
Канцерогенез [ править | править код ]
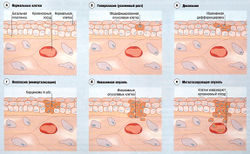
Опухоль - это неопластические разрастания (новообразования) клеток. Рак относится к злокачественным, распространяющимся опухолям.
Доброкачественные опухоли лишены способности распространяться (метастазировать) из места своего начального возникновения.
Злокачественные опухоли, называемые также раковыми, метастазируют в результате клональной экспансии одиночной клетки, которая размножается, превращаясь в опухолевую массу, инвазирующую окружающие нормальные ткани и распространяющуюся по организму по лимфатической системе или через кровь (гематогенно). Рост злокачественной опухоли, называемый канцерогенезом или туморогенезом, представляет собой многоэтапный процесс.
К основным характеристикам раковых образований относится:
Рак может возникнуть под влиянием внешних воздействий (например, химический канцерогенез) или в результате генетической предрасположенности. В большинстве случаев существует очевидная связь между этими двумя факторами. Однако природа и степень ассоциации у разных индивидов могут варьировать. Так, исследования, проведенные на близнецах, показали, что генетические факторы обусловливают 42% относительного риска рака простаты, 35% — колоректального рака и 25% рака молочной железы. Вклад в развитие других типов рака менее значителен.
К внешним факторам, способствующим канцерогенезу, относятся бактерии, например Helicobacter pylori, вирусы, например вирус Эпштейна-Барр, вирусы папилломы человека или гепатита В и С, грибы, продуцирующие афлатоксины, и химические вещества, например бензол.
Онкогены представляют собой ДНК-последовательности, кодирующие ключевые белки, которые участвуют в канцерогенезе. Впервые их выделили из вирусов, вызывающих злокачественные опухоли у лабораторных животных. Онкогены также сверхэкспрессированы злокачественными клетками и способны кодировать факторы роста и митогенные факторы, поэтому злокачественные клетки могут стимулировать собственный рост. (рис. 7.2)
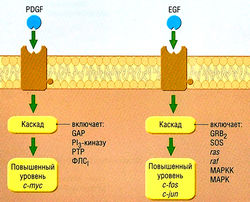
Рис. 7.2 Две схемы, показывающие, как внеклеточные факторы роста стимулируют пролиферацию злокачественных клеток. Сверхэкспрессия любого из этих клеточных гомологов онкогенов или мутация, вызывающая конститутивную активацию, способствуют усилению роста, c-fos, c-jun, с-тус — индукторы синтеза ДНК; ECF — эпидермальный фактор роста; САР — белок, активирующий ГТФазу; GRB2 — белок В2, родственный G-белку; МАРК — активированная митогеном протеинкиназа; МАРКК — активированная митогеном киназа протеинкиназы; PDGF — тромбоцитарный фактор роста; Р13-киназа — фос-фадилинозитол-3-киназа; ФЛС — фосфолипаза С; РТР — фосфоти-розинфосфатаза; ras, raf— клеточные передатчики сигнала.
Функциональные рецепторы факторов роста могут быть экспрессированы конститутивно на поверхности злокачественных клеток, тогда как другие появляются в результате индукции (часто химическими веществами, которые высвобождают сами злокачественные клетки).

Механизмы пролиферации нормальных клеток связаны с антипролиферативными механизмами, что дает возможность контролировать пролиферацию по типу обратной связи. Продукты некоторых онкогенов способны подавлять пролиферацию. Мутации или повышенная экспрессия онкогенов могут изменить баланс между стимуляцией и супрессией пролиферации. При канцерогенезе баланс сдвинут в сторону пролиферации.
Пролиферация нормальных клеток также контролируется серией генов-супрессоров опухолей, действующих на клеточный цикл. Мутации или утрата таких генов-супрессоров, например р53 при синдроме Аи-Фраумени, или rb при ретинобластоме, обусловливают повышенный риск онкогенеза у индивидов и семей.
Пролиферация нормальных клеток уравновешивается клеточной гибелью. Рост популяции злокачественных клеток представляет собой результат баланса между пролиферацией и гибелью клеток. Нормальные клетки подвергаются апоптозу — процессу запрограммированной клеточной гибели старых или поврежденных клеток. Апоптоз происходит либо в результате прямого связывания с рецептором (рецептор Fas и его лиганд лимфоцитов), либо высвобождения цитохрома С в цитоплазму после разрыва мембраны митохондрий вследствие летальных внутриклеточных процессов. Существуют проапоптотические белки, такие как Bad и каспазы, действие которых уравновешивается антиапоптотическими белками, например bcl-2. Повышенная экспрессия bcl-2 может быть обусловлена экспрессией онкогенов и ассоциирована с трансформацией нормальных клеток в опухолевые.
Нарушение нормальной репликации геномной ДНК является важнейшим фактором возникновения рака
Злокачественные клетки могут размножаться лишь в том случае, когда организм утрачивает способность распознавать и репарировать мутации в геноме. Индивиды и семьи с мутациями ДНК генов репарации предрасположены к возникновению опухолей, например:
- в ДНК генов, репарирующих не соответствующие друг другу пары оснований, обнаружены мутации при наследственном неполипозном раке толстой кишки;
- репарация ДНК под контролем хеликаз отсутствует или дефектна в случае пигментной ксеродермы — генетического заболевания, характеризующегося дефектом репарации повреждений, вызванных ультрафиолетовым облучением. Гену-супрессору опухолей р53 принадлежит существенная роль в клеточном ответе на повреждение или мутацию ДНК. В норме р53 останавливает клеточный цикл до репликации ДНК, давая возможность репарировать повреждения; этот ген также инициирует апоптоз. Утрата нормальной функции р53 позволяет реплицироваться поврежденной ДНК и таким образом способствует выживанию аномальных клеток.
Злокачественные клетки представляют собой иммортализованные клетки
Каждая нормальная клетка организма, за исключением зародышевых клеток гонад, запрограммирована на конечное число клеточных делении до своего старения. Эта клеточная программа заключена в теломере. Теломеры расположены на концах хромосом и должны соединиться друг с другом в митозе. Они образуются и сохраняются в зародышевых и эмбриональных клетках под контролем фермента теломеразы. Этот фермент утрачивает свою функцию в течение нормального развития. В связи с этим часть теломеры теряется при каждом клеточном делении, а утрата каждой теломеры служит для клетки сигналом, возвещающим гибель. Злокачественные клетки реэкспрессируют теломеразу, что дает им возможность пролиферировать неопределенно долго. Утрата контроля нормального клеточного цикла, осуществляемого генами rb и р53, способствует возобновлению экспрессии теломеразы. До 95% злокачественных клеток экспрессирует теломеразу, делая ее потенциальной мишенью для лекарственных веществ.
Достигнув определенной стадии развития, злокачественная опухоль проникает через базальную мембрану и инвазирует соседнюю соединительную ткань
Злокачественные клетки экспрессируют коллагеназы, гепараниазы и активаторы плазминогена и продвигаются через поддерживающие ткани по пути наименьшего сопротивления.
Ангиогенез играет существенную роль в доставке питательных веществ распространяющейся опухоли, его стимулируют фактор роста фибробластов и фактор роста сосудистого эндотелия. Синтез коллагена, витронектина и фибронектина злокачественными клетками создает основу для развития клеток опухоли и способствует ее приживлению в участках метастазирования. Многие из необходимых для этого сложного процесса компонентов предоставляют сами нормальные ткани, невольно способствуя собственной гибели. Процессы инвазии и метастазирования менее важны при лейкозах и лимфомах, т.к. эти опухоли представляют собой диффузный рак крови.
Инвазия и метастазирование часто достигают значительной степени развития до появления клинических симптомов и выявления опухоли. Лекарственную терапию необходимо начать сразу же, как только макро- или микроскопически опухоль распространится за пределы места возникновения.
Квалифицированный гистологический диагноз — важный компонент терапии рака
Гистологический диагноз некоторых опухолей играет существенную роль в определении цели лечебного вмешательства — паллиативный эффект или полное излечение, например:
Определение стадии развития злокачественной опухоли основано на степени ее местной инвазии и присутствии лимфатических и гематогенных метастазов
Для каждого гистологического типа рака существует система классификации опухоли по стадиям, основанная на клинических и анатомических характеристиках. Использование биохимических, цитологических и молекулярно-биологических показателей повышает точность такой классификации, которая служит двум целям:
- создание возможности сравнения пациентов и групп пациентов, позволяющего более точно оценить эффективность терапии;
- деление на стадии может служить руководством для выбора соответствующего метода лечения конкретного пациента.
Для пациентов с опухолью, выявленной на ранней стадии, и благоприятным прогнозом может потребоваться менее интенсивная терапия (например, менее обширное хирургическое вмешательство и/или отказ от проведения химиотерапии). Это снижает краткосрочные патологические реакции и отдаленные побочные эффекты, которые проявляются по мере повышения эффективности терапии; все это приводит к увеличению выживаемости пациентов, особенно детей. Отдаленными последствиями применения противоопухолевых препаратов могут быть бесплодие, задержка роста и возникновение вторичных опухолей.
1. Этиология злокачественных опухолей
Из предыдущего материала мы уже убедились, что на протяжении всей истории онкологии было предложено много теорий, пытающихся объяснить, почему и как развиваются опухоли. Некоторые из них имеют чисто исторический интерес, другие же и ныне не потеряли своей актуальности и достоверно сочетаются как с современными клиническими данными, так и с результатами экспериментальных исследований.
По данным Д.Г.Заридзе в 90 – 95 % случаев причинами возникновения злокачественных опухолей является канцерогенные факторы окружающей среды и образа жизни. Среди них курение является этиологическим фактором возникновения злокачественных опухолей в 30% случаев, особенности питания – в 35%, инфекции – в 10%, ионизирующее и ультрафиолетовое излучение в 6 – 8%, загрязнение атмосферы – в 1 – 2% случаев.
Остановимся более подробно на основных этиологических факторах, способных вызвать возникновение злокачественных опухолей.
5.1. Химический канцерогенез
Начало этого направления в изучении причин возникновения рака относится к 1778 году, когда английский врач Уильям Потт указал на факт частого возникновения рака кожи мошонки у английских трубочистов. Вскоре был обнаружен другой профессиональный рак: у грузчиков, которые переносили мешки с каменным углем, часто возникал рак кожи шеи и ушей. В конце девятнадцатого столетия, когда стала бурно развиваться анилокрасочная промышленность, выяснилось, что рабочие фабрик по производству анилиновых красителей часто заболевают раком мочевого пузыря.
Выше уже было указано, что причины некоторых профессиональных раков были объяснены в 1915 году, когда японские ученые, К.Ямагива и К.Итикава, показали, что длительная аппликация каменноугольной смолы на кожу уха кролика приводит к развитию вначале папиллом, а затем и рака кожи. Таким образом, эти исследователи установили, что в продуктах перегонки каменного угля содержатся вещества, которые способны вызывать развитие злокачественных опухолей. Эти вещества получили название химических канцерогенов.
К настоящему времени выделен целый ряд веществ, обладающим мощным канцерогенным действиям. Это в основном - производные циклических углеводородов: метилхолантрен, дибензпирен, дибензантрацен и некоторые другие. Надо сказать, что канцерогенным действием обладают не только вещества этого химического класса. Так, исследованиями Александера и А.Х.Когана было доказано канцерогенное влияние пластмасс. Известно большое количество и других химических канцерогенов, в частности, относящихся к пестицидам, гербицидам и т.д.
Большое количество канцерогенов содержится в табаке, чем и объясняется значительно более высокая заболеваемость раком лёгких у курильщиков, нежели у некурящих людей.
Химические канцерогенные вещества подразделяются на проканцерогены и канцерогены прямого действия. Веществ, относящихся к первой группе, значительно больше, чем канцерогенов прямого действия. Проканцерогены становятся истинными канцерогенами только в результате их метаболических превращений в организме. Такие превращения претерпевают, в частности, такие проканцерогены бензопирен, ароматические амины, нитраты и нитриты. Прямым же канцерогенным действием обладают, например, нитрозамины, β-пропионлактон, диметилкарбамилхлорид и ряд других веществ. Малегнизация клеток под действием химических канцерогенов связана с их способностью образовывать в результате ковалентной связи с молекулой ДНК аддукты[1] / и инициировать одно- и двунитевые разрывы этих молекул. В результате в генах может возникнуть точковая мутация, приводящая к активации онкогенов и инактивации генов-супрессоров.
5.2. Физический (радиационный) канцерогенез
Помимо химических веществ канцерогенным действием обладают и некоторые физические факторы, в частности проникающая радиация и ультрафиолетовое излучение.
Выше мы уже упоминали о том, что еще в 1902 году немецкий ученый Х.Фрибен связал возникновения рака кожи с воздействием на организм рентгеновских лучей, а в 1946 году ученый Г.Д.Мёллер получил Нобелевскую премию, доказав что рентгеновское излучение способно вызывать клеточные мутации.
Особое внимание ученых канцерогенные свойства радиации привлекли к себе после атомных бомбардировок Хиросимы и Нагасаки, ядерных испытаний в атмосфере, на земле и в водной среде, а также после Чернобыльской катастрофы. Статистика уверенно доказывала значительное возрастание онкологических заболеваний у людей, подвергнувшихся даже относительно малому (по крайней мере, не вызывающему лучевую болезнь) облучению. Аналогичные данные были накоплены и по группам риска – людям, чья профессиональная деятельность связана с постоянным радиационным воздействием (рентгенологи, работники радиоактивных производств).
Не зависимо от вида радиационного воздействия, его канцерогенность на клеточном уровне может реализоваться в виде онкогенных мутаций как соматических, так и половых клеток. Мутации соматических клеток способны вызывать возникновение злокачественных опухолей непосредственно у человека, подвергнувшегося облучению. Мутации половых клеток могут привести к наследуемым онкологическим заболеваниям.
5.3. Вирусный канцерогенез
Когда в 1911 году Ф.Раус впервые произвел перевивку саркомы у птиц бесклеточным фильтратом (то есть показал возможность вирусной этиологии злокачественных новообразований), его открытие прошло не замеченным, и о нем вспомнили лишь в 1939 году после того, как Дж. Биттнер описал так называемый фактор молока. К тому времени было известно, что у определенного вида мышей часто возникают злокачественные опухоли молочных желез и высказано предположение, что здесь играет роль наследственный фактор. Тогда Биттнер поставил следующие эксперименты. Он взял новорожденных мышат высокораковой линии и поместил их для выкармливания к самке низкораковой линии. Оказалось, что у этих мышат опухоли молочных желез не развивались. В то же время, если мышата низкораковой линии выкармливались молоком самки высокораковой линии, то у этих животных в дальнейшем опухоли молочных желез возникали. Таким образом, было доказано, что в данном случае дело заключается не в наследственности, а в каком-то факторе, который передается с молоком и не обнаруживается при световой микроскопии; этим фактором оказался вирус. Справедливости ради нужно указать, что до опытов Биттнера вирусная природа некоторых злокачественных опухолей у животных была доказана по отношению, например, по отношению к вирусу папилломы кроликов (Р.Шоуп, 1932 год).
Однако пока обнаружено лишь три вируса, которые связаны с опухолями у человека: вирус Эпштейн–Барр (вызывающий лимфому Беркитта), вирус цитомегалии (саркома Капоши), вирус папилломы человека.
Резюмируя три описанные выше этиологических фактора канцерогенеза (химический, физический и вирусный канцерогенез), можно прийти к выводу о том, что в основе злокачественного перерождения клеток лежит изменение их генома, то есть клеточная мутация. Мутационная теория рака является общепризнанной, имеющей многочисленные экспериментальные и клинические доказательства. Однако, некоторые виды злокачественных опухолей, по-видимому, могут иметь и несколько иное происхождение.
5.5. Предраковые состояния
Предраковые (прекарциноматозные) состояния[2] / представляют собой одну из важнейших проблем современной практической и теоретической онкологии. Теоретической - потому, что, зная, какие процессы дают толчок канцерогенезу, по-видимому, можно понять, почему развивается опухоль. Практической - в связи с тем, что, умея диагностировать предраковые состояния, нередко можно предупредить малигнизацию. Другими словами, решить проблему предрака - это значит прояснить и важнейшие вопросы профилактики злокачественных новообразований.
Прежде всего, рассмотрим наиболее распространенное определение состояния предрак, основа которого была предложена одним из крупнейших российских онкологов академиком Л.М.Шабадом:
Предрак - это патологическое состояние, характеризующееся длительным сосуществованием атрофических, дистрофических и пролиферативных процессов, которое предшествует развитию злокачественной опухоли и в большом числе случаев с нарастающей вероятностью в нее переходит.

Рис. 1. Классификация предопухолевых состояний (по Л.М.Шабаду)
Из представленной схемы видно, что к чисто предраковым состояниям относятся очаговые пролифераты (та стадия процесса, когда уже образуются очаги, узлы бурно размножающихся клеток, но без явлений как клеточного, так и тканевого атипизма) и доброкачественные опухоли, которые уже обладают тканевым атипизмом, но еще не имеют клеточного.
Среди предраковых состояний различают две группы. Первая включает в себя заболевания, которые всегда переходят в злокачественные опухоли, например, дерматоз Боуэна и пигментная ксеродерма. Это - облигатные (обязательные) предраки. Во вторую группу объединяются те прекарциноматозные состояния, которые не всегда озлокачествляются, то есть являются факультативными (необязательными) предраками.[3] /
По особенностям своего развития предраковые состояния разделяются еще на две группы. К первой из них принадлежат предраки, возникающие в тканях и органах, открытых воздействию факторов окружающей среды. Сюда относятся предраковые изменения кожи, слизистой желудочно-кишечного тракта, легких и дыхательных путей. Вторая группа - это предраковые состояния в органах и тканях, непосредственно не контактирующих с внешней средой. Предраки первой группы, как правило, сочетаются с длительно текущей воспалительной пролиферативной реакцией, причем эта пролиферация сопровождается явлениями атрофии и дистрофии. Предраковые состояния второй группы развиваются без предшествующего воспалительного процесса.
Выделяют следующие, наиболее типичные предраковые состояния.
Хронические пролиферативные воспаления. На роль длительного воспалительного процесса в развитии рака указывал еще Рудольф Вирхов. Правда, он предполагал, что именно воспаление - единственная причина рака. И хотя теперь ясна ошибочность этого утверждения Вирхова, тем не менее, он был прав, говоря о возможной связи этих двух процессов. Однако не всякое пролиферативное воспаление следует считать предраковым состоянием. Для этого необходимо еще и то, чтобы клетки воспалительного очага постоянно подвергались воздействию какого-то фактора, ведущего к развитию в них дистрофии. Сочетание пролиферации, то есть бурного разрастания клеток, с дистрофией, то есть с извращением их метаболизма, создает благоприятный фон для малигнизации - превращения нормальных клеток в злокачественные. Наиболее известным предраковым состоянием этого типа является каллезная язва желудка. Это - не просто дефект слизистой желудочной стенки, но сочетающееся с ним воспаление этого участка, края которого покрыты атрофированными, дистрофически измененными и пролиферирующими клетками. По внешнему виду края такой язвы напоминают мозоль (откуда название каллезная, то есть омозоленная). Каллезная язва желудка очень часто переходит в его рак и поэтому является прямым показанием к операции - резекции желудка.
К этой же группе предраков относится эрозия шейки матки, в основе которой лежит хроническая воспалительная реакция, характеризующаяся атрофией ткани в месте эрозии и пролиферацией окружающего эпителия. Эрозии шейки матки требуют самого пристального внимания гинекологов и тщательного незамедлительного лечения, так как они нередко переходят в рак шейки матки.
Гиперпластические процессы. Длительно существующие в органах очаги гиперплазий, то есть разрастания клеток тканей, но без явлений клеточного и тканевого атипизма, также нередко бывают предраковым состоянием. Из наиболее распространенных процессов этого типа необходимо отметить кистозно-фиброзную мастопатию - заболевание молочной железы, при котором наблюдается очаговое разрастание железистой ткани с образованием довольно крупных полостей - кист, окруженных плотным фиброзным барьером. Это заболевание часто переходит в рак грудной железы, и наличие кистозно - фиброзной мастопатии может быть показанием к операции.
Доброкачественные опухоли. Третьей распространенной группой предраковых состояний являются различные доброкачественные опухоли. Так, папилломы могут переходить в рак, доброкачественные миомы матки - в злокачественные, пигментные пятна - в меланому.
5.6. Роль наследственных факторов в возникновении злокачественных опухолей
А. Кнудсона определяется следующей закономерностью. Все раки, каждый из которых происходит из одной - единственной клетки, являются следствием двух возможных вариантов мутаций. Первый вариант Кнудсон назвал предзиготной мутацией, то есть такой, которая появляется в половой клетке, второй вариант представляет собой постзиготную (то есть соматическую) мутацию. Предзиготная мутация охватывает все клетки индивида, возникшего от данной половой клетки, и таким образом является наследственной, то есть наличествует у всего потомства. Если же мутация является постзиготной, то она характерна только для данного индивида и по наследству не передается. Наличие мутации первого типа само по себе может и не быть основанием для возникновения опухолей, но если на этом фоне происходит мутация второго типа, то, поскольку первая мутация имеется во всех клетках организма, одной - единственной мутации второго типа достаточно, чтобы вызвать образование опухоли. Это значит, что рак, передающийся по наследству (то есть являющийся результатом мутации первого типа), имеет большую вероятность появиться в более ранние сроки и быть множественным, в то время как ненаследственный рак, будучи результатом редких мутационных явлений, имеет большую вероятность возникнуть позднее и быть не множественным.
Эта имеющая определенное распространение концепция является, конечно, гипотетической. Возникновение опухолей в молодом возрасте можно объяснить тем, что молодой контингент людей наиболее интенсивно занят в сфере производства, а, следовательно, и более интенсивно, чем остальные возрастные группы, подвергается воздействию вредных факторов. И как раз то, что опухоли в молодом возрасте возникают относительно редко, говорит о наличии в этом возрасте высокой противоопухолевой резистентности организма. Кроме того, возникает вопрос: если бы опухолевая болезнь была бы развившимся и закрепленным в процессе эволюции механизмом, обеспечивающим поддержание чистоты вида, то есть направленным против неполноценных в генетическом отношении индивидов, то почему существуют до сих пор наследственные болезни, почему в процессе эволюции опухоли не убили всех носителей патологических генов?
Словом, изучение роли наследственных факторов в развитии злокачественных опухолей требуют дальнейшего глубокого изучения.
[1] / Аддукты – продукты химической реакции, в результате которой дополнительная малая химическая группа соединяется с относительно большой молекулой реципиента, например, с молекулой ДНК
Читайте также:

