Современное представление о патогенезе опухолей
Несмотря на большое число канцерогенных агентов и разнообразие клинических форм опухолевого роста на уровне клетки происходит общее закономерное изменение — трансформация нормальной генетической программы в программу формирования опухолевого атипизма.
В основе опухолевой трансформации лежат стойкие изменения ДНК. При этом программа опухолевого роста становится фрагментом общей реализуемой клеткой программы, закодированной в её геноме.
Единый конечный результат действия канцерогенов различной природы (химической, биологической, физической) на клетки и как результат — их опухолевая трансформация, обеспечивается нарушением взаимодействия в клеточном геноме онкогенов и антионкогенов. Стимуляция канцерогенными агентами экспрессии онкогенов и/или депрессия антионкогенов и обеспечивает опухолевую трансформацию клеток.
Онкогены. Вирусные онкогены и контролирующие клеточный цикл и пролиферацию клеточные гены имеют как сходство, так и важные отличия. В связи с этим говорят о протоонкогенах и онкогенах.
Протоонкоген — ген нормального генома человека; участвует в регуляции пролиферации клеток. Продукты экспрессии протоонкогенов во многих случаях важны для нормальной дифференцировки клеток и межклеточных взаимодействий. В результате соматических мутаций протоонкоген может стать онкогенным.
Онкоген
• Онкоген — один из генов, в обычных условиях (т.е. в качестве протоонкогена) кодирующий белок, обеспечивающий пролиферацию и диф-ференцировку клеточных популяций. У опухолевых ДНК-вирусов онкогены кодируют нормальные вирусные белки; онкогены, однако, могут спровоцировать — в случае их мутаций или активации ретровирусами — злокачественный рост.
• Онкогены найдены в некоторых ДНКовых опухолевых вирусах. Они необходимы для репликации вируса (трансформирующий ген).
• К онкогенам относятся также гены вируса или ретровируса, вызывающие злокачественное перерождение клетки-хозяина, но необязательные для репликации вируса.
Онкосупрессоры. Трансформированные (опухолевые) клетки делятся бесконтрольно и неограниченно долго. Онкосупрессоры, или антионкогены тормозят их пролиферацию.
Этапы канцерогенеза
Основными теориями канцерогенеза являются:
1) химических канцерогенов, 2) физических канцерогенов, 3) вирусно-генетическая,
4) инфекционная и 5) полиэтиологическая.
Вне зависимости от конкретной причины опухолевой трансформации клетки, гистологической структуры и локализации новообразования, в процессе онкогенеза можно условно выделить несколько общих этапов.
• На первом этапе происходит взаимодействие канцерогенов химической, физической и биологической природы с протоонкогенами и антионкогенами (онкосупрессорами) генома нормальной клетки.
• В результате такого взаимодействия на втором этапе канцерогенеза подавляется активность онкосупрессоров, а также происходит трансформация протоонкогенов в онкогены. Экспрессия онкогена — необходимое и достаточное условие для трансформации нормальной клетки в опухолевую.
• В результате подавления активности онкосупрессоров и экспрессии онкогенов на третьем этапе синтезируются и реализуют свои эффекты (непосредственно или с участием клеточных факторов роста и рецепторов к ним) он-кобелки. С этого момента генотипически изменённая клетка приобретает опухолевый фенотип.
• На четвёртом этапе опухолевая клетка начинает бесконтрольно проли-ферировать, что ведёт к формированию новообразования (опухолевого узла).
Злокачественные и доброкачественные опухоли. Взаимодействие опухоли и организма.
Злокачественные новообразования — не редкость в природе: опухолеподобные разрастания тканей (корончатые галлы) описаны у растений, животные — от беспозвоночных (членистоногие, моллюски) и рыб и кончая птицами и млекопитающими — поражаются лейкозами и различными опухолями.
Считается, что неоплазии чаще бывают у домашних и содержащихся в неволе животных, чем в дикой природе, но это оспаривается, так как может быть следствием более внимательного ветеринарного надзора за животными в неволе.
Имеются интересные видовые различия в распространенности злокачественных опухолей: у человека, утратившего такие защитные производные покровов тела, как шерсть, и перешедшего к питанию кулинарно обработанной пищей, чаще встречаются эпителиальные опухоли, в то время как у животных доминируют гемобластозы и саркомы.
Ни для одного новообразования человека не доказана прямая заразность, в то время как некоторые неоплазии животных (болезнь Марека у кур, инфекционная саркома наружных половых органов у собак, рак молочной железы у мышей) — контагиозны.
Изложение основ этиологии и патогенеза опухолевого роста является необходимым и важным разделом общей онкологии. В настоящее время, благодаря успехам молекулярной биологии, механизмы канцерогенеза, в основном, изучены. Знакомство с его основами составляет важную часть профессиональной эрудиции врача любой специальности.
Интересно отметить, что почти все изложенные ниже основы различных ранее предложенных теорий органически вписываются в рамки современной синтетической теории этиологии и патогенеза рака и, принципиально, не противоречат друг другу.
Теория эмбриональной дистопии
Теория эмбриональной дистопии [Конгейм, 1882] стала первой научной теорией опухолевого роста. По ее версии, злокачественная опухоль — результат своеобразной формы дизэмбриогенеза.
В организме сохраняются дистопированные дремлющие клетки эмбриональных зачатков, которые могут под воздействием различных экзогенных и эндогенных стимулов переходят в активное пролиферирующее состояние, ведущее к развитию опухоли.
Данная теория имеет множество очевидных подтверждений. Это и эмбриоподобный вид многих неопластических клеток с выраженной степенью их анаплазии, и эмбриоподобный тип биохимических аномалий (энергетический обмен), и частая локализация рака (например, базальнокпеточного) у мест контакта производных различных эмбриональных зачатков и листков.
С позиций данной теории признается большое значение не только пренатальных, но и постнатапьных дистопий зародышевых клеток, то есть решающей роли высвобождения группы клеток зачатка из-под физиологических ростоингибирующих влияний, что иллюстрируется, например, возникновением невусов и меланом.
Важным в теории является положение, что существует необходимость экспрессии (активации) протоонкогенов, как в эмбриогенезе, так и при развитии рака, что хорошо встраивается в современную теорию опухолевого роста.
Теория хронического неспецифического раздражения
Теория хронического неспецифического раздражения [Вирхов, 1885] постулирует: там, где клетки повторно повреждаются и регенерируют — возникает повышенный риск рака. По данной теории повреждающими факторами могут быть механическое раздражение (Вирхов) и признанные в настоящее время химические и иные немеханические агенты (канцерогены).
Принципиально важно, что теория Вирхова вводит представление о полиэтиологичности рака. Как и предсказывал Вирхов, роль хронических пролиферативных воспалительных процессов, как фактора риска рака, достаточно велика. В ходе воспаления при повреждении ядра и клетки стимулируется экспрессия протоонкогенов.
Повреждение может иметь разные последствия (рак или гиперплазия и регенерация), в зависимости от генетического состояния клеток-мишеней и/или индуцированных в них генетических изменений.
Многочисленные доказательства теории Вирхова включают данные по эпидемиологии профессиональных форм рака (рак кожи мошонки у трубочистов, кожи рук у рентгенологов и др.). Теория раздражения легла в основу представлений, ставящих на первое место в этиологии неоплазии действие тех или иных конкретных канцерогенных факторов.
В настоящее время, по оценке ВОЗ, в основе 90% случаев рака лежит тот или иной внешний повреждающий фактор. Уже сам этот факт свидетельствует о ценности прародительницы современных концепций — теории неспецифического раздражения.
Теория трансплацентарного канцерогенеза
Теория трансплацентарного канцерогенеза, т.е. индукции опухолей у потомков в результате действия канцерогенных веществ на их матерей в период беременности, является общепризнанным фактом.
Действительно, через плаценту проходят почти все лекарственные препараты, применяемые в акушерской практике. Известно более 60 соединений, вызывающих трансплацентарный канцерогенный эффект в опытах на животных.
Есть работы, основанные на большом статистическом материале, указывающие на трансппацентарное воздействие табака, алкоголя на потомство. Так, у курящих женщин дети заболевали в два раза чаще, чем у некурящих.
Трансплацентарно действуют некоторые применяемые в сельском хозяйстве пестициды. Имеются данные о трансплацентарной индукции опухолей у цетей под влиянием противоэпилептического препарата дифенина.
Трагический эксперимент был поставлен жизнью. В США в 70-е годы было зарегистрировано более 500 случаев рака влагалища у девочек и девушек (15-20 лет), матери которых во время беременности принимали синтетические эстрогены (стильбестроп, диэтилс-тильбестроп). В связи с этим, очевидна необходимость тщательной проверки всех веществ и препаратов, с которыми контактирует беременная женщина.
Полевая теория опухолевого роста
Полевая теория опухолевого роста [Уиллис, 1951] развилась на основных идеях теории Вирхова и формально противостоит теории моноклонального возникновения опухолей, которая в настоящее время стала доминирующей.
В основе полевой теории лежит положение, что хронические пропиферативные воспалительные процессы, как факторы риска, формируют поле (зону) в органе, где и происходит развитие опухоли. При этом на опухолевом поле могут сосуществовать опухолевые зачатки, находящиеся одномоментно на разных стадиях онкогенеза и дающие начало мупьтицентрическому развитию рака.
Сейчас предлагается объяснение, основанное на том, что в ткани, испытывающей канцерогенные влияния, «возможно параллельное (и не всегда одновременное) возникновение нескольких трансформированных клеток — источников возникновения нескольких опухолевых клонов.
Теория химического канцерогенеза
Теория химического канцерогенеза также сформировалась, по мере развития индустриального общества, в русле вирховской концепции.
Теория начала развиваться с 1775 года, когда английский врач P. Pott описал опухоли мошонки у трубочистов. Развитие профессиональной гигиены и индустрии дало много новых тревожных свидетельств в пользу теории химического канцерогенеза. Но решающую роль в признании вклада данной теории в онкологию имело создание химической экспериментальной модели злокачественной опухоли.
В 1918 году японские исследователи Ямагива и Ишикава получили рак кожи у мышей и кроликов, которым в течение нескольких месяцев наносили на кожу угольный деготь. С этого момента начинаются систематические исследования в области химического канцерогенеза.
Теория физического канцерогенеза
Основу ее формируют положения, отводящие этиологическую роль в развитии рака различным физическим воздействиям на ткани. Исторически наиболее ранними являются наблюдения о роли механических повреждений в канцерогенезе (например, рак кожи большого пальца у закройщиков и др.).
Постепенно накапливались эпидемиологические и экспериментальные свидетельства о возможности развития рака при различных видах ионизирующих излучений, инсоляции, длительном тепловом воздействии.
Инфекционно-паразитарная теория канцерогенеза
Впервые идею об инфекционной этиологии опухолей выдвинули исследователи бильгарциоза — паразитарного заболевания, вызываемого печеночной двуусткой. В местах локализации в организме человека яиц двуустки с высокой частотой отмечаются рак и саркомы.
В экспериментах установлена связь между цистицеркозом и саркомой печени крыс, спироптерой и плоскоклеточным раком желудка или языка. Предполагается, что с паразитами в организм попадают опухолеродные вирусы или другие канцерогены, которые на фоне вызываемой паразитами иммуносупрессии, способствует развитию рака.
Вирусная теория канцерогенеза
Приоритет формулировки предположения о вирусном онкогенезе принадлежит французским авторам Борелю и Боску (1903), дальнейшая разработка проблемы — Раусу (1910), Люке (1934), Биттнеру (1936) и др., рассматривающими связь между вирусами и раком как чисто инфекционную.
Огромное значение в развитии вирусной теории онкогене за имели работы выдающегося российского вирусолога Г.Ш. Зильбера, превратившие ее инфекционный вариант в вирусо-генетический, делающий упор на интегративном взаимодействии опухолеродногo вируса с определенными участками генома клеток-мишеней.
Современная теория канцерогенеза может быть названа синтетической, поскольку на роль этиологических факторов, вызывающих генетические повреждения (мутации), как единой основы канцерогенеза, могут претендовать все факторы, выдвигавшиеся различными ранними теориями как исключительная причина рака.
Таким образом, и химическая, и лучевая, и вирусная, и другие теории этиологии рака имеют право на существование, как частные случаи современной концепции, т.е. злокачественные новообразования рассматриваются сейчас как истинно полиэтиологические заболевания.
При всем широком разнообразии макро- и микроскопических признаков, ультраструктурных, биохимических, иммунологических и генетических параметров, характеризующих новообразования, последние развиваются по определенным общим законам возникновения и роста.
Прежде чем обратиться к анализу причин и механизма развития злокачественных новообразований, представляется целесообразным изложить главные концептуальные принципы современной онкогенно-антиокогенной теории канцерогенеза.
Концептуальные принципы современной онкогенно-антиокогенной теории канцерогенеза
1. В основе современной модели канцерогенеза лежит концепция онкогенов (протоонкогенов) и антионкогенов (генов-супрессоров), что стало переломным этапом в понимании механизмов развития рака.
Установлено, что ведущую роль в формировании опухоли играют два класса нормальных регупяторных генов: протоонкогены — активаторы пролиферации и дифференцировки клеток и супрессорные гены (антионкогены) — ингибиторы этих процессов. В последнее время выделяют третий класс онкоассоциированных генов, к которым относят мутаторные гены.
2. Пусковым и обязательным событием в канцерогенезе являются нелетальные повреждения протоонкогенов и генов-супрессоров в виде их структурных изменений. Последствиями таких генетических повреждений (мутаций) является активация онкогенов и инактивация генов-супрессоров и мутаторных генов.
В результате мутаций возникают нарушения баланса между ними, происходит утрата контроля за нормальным клеточным ростом, дифференцировкой и пролиферацией, которые, в конечном счете, приводят к злокачественной трансформации клетки и развитию новообразования.
3. Малигнизированный клон, как таковой, не возникает путем однократного мутационного собьпия. Активации одного онкогена или, наоборот, потери функции одного антионкогена, недостаточно для превращения нормальной клетки в опухолевую.
На основании математического моделирования предполагается, что для превращения нормальной клетки в опухолевую требуется от 5 до 7 независимых случайных мутаций как минимум в 4-5 генах (протоонкогенах. генах-супрессорах) тогда как доброкачественные onyxоли могут развиваться в результате мутации 1-2 генов.
Условие состоит в том, чтобы оба события совпали в одной и той же клетке. Только при этом нормальная клетка становится раковой. На деле, при возникновении конкретного опухолевого клона для реализации конечного результата необходимо гораздо большее количество мутационных шагов. Каждая опухоль, таким образом, имеет свой генетический портрет, который и определяет ее свойства.
4. Происхождение мутантных генов, участвующих в канцерогенезе может быть различным. Повреждения онкогенов и генов-супрессоров в соматических клетках организма могут быть следствием воздействия на человека различных экзогенных и эндогенных факторов.
В этом случае они не наследуются, но определяют трансформацию именно той клетки, которая их приобретает. Большинство известных раков относится к данному типу. Повреждения, затрагивающие потенциальные онкогены (антионкогены), могут быть в половых клетках.
В этом случае они наследуются через половинный набор хромосом одного из родителей, создавая предпосылки для реализации наследуемых семейных форм рака (наследственной предрасположенности к раку).
5. Раковая клетка передает свою аномальность по наследству своим дочерним клеткам через механизмы генетического классического наследования. Поэтому, с позиций молекулярной генетики, рак является генетическим заболеванием (заболеванием генома клетки!), вызванным изменениями в протоонкогенах (или генах-супрессорах).
В связи с этим, часто обсуждаемый вопрос канцерогенеза — эпидемиологический. Очевидно, поскольку опухоль — генетическая болезнь — она незаразна.
6. Пролиферация является необходимым компонентом процесса канцерогенеза. Она может быть результатом генетических изменений в клетке, или связана с другими физиологическими или патологическими процессами и предшествовать изменению в геноме.
Репликация ДНК в пролиферирующих клетках делает их более чувствительными к мутациям. В активно делящихся клетках увеличивается также вероятность спонтанных мутаций, поэтому пролиферация может быть охарактеризована как ранняя стадия канцерогенеза. Не делящаяся, дифференцированная клетка не озлокачествляется.
7. Генетическая концепция канцерогенеза подразумевает, что популяция опухолевых клеток — это результат размножения, начавшийся от одной клетки — родоначальницы клона, претерпевшей опухолевую трансформацию. В этом состоит смысл представления о моноклональном развитии злокачественных опухолей.
8. В настоящее вреин канцерогенез понимается как стадийный, ступенчатый процесс, в основе которого лежит концепция инициации, промоции и прогрессии. Согласно этой концепции, в результате инициации клетка претерпевает необратимые изменения генотипа, которых, однако, недостаточно для ее превращения в опухолевую.
На стадии промоции в клетке происходят процессы, приводящие к формированию опухолевого фенотипа, т.е. превращению инициированной клетки в злокачественную. В основе прогрессии опухоли (теория Foulds) лежит процесс наращивания злокачественных свойств опухолевых клеток путем отбора соответствующих клонов.
Переход от одной стадии канцерогенеза к другой (последующей или предыдущей) происходит в результате воздействия экзогенных и эндогенных факторов, которые могут, как способствовать, так и противодействовать этому процессу.
9. Важную роль в реализации мутаций и канцерогенеза играют также факторы риска и антириска. Имеется в виду роль возраста, попа, питания, вредных привычек, наследственности, социально-географических и природно-этнических факторов.
Доказано, что факторы образа жизни и окружающей среды являются основной причиной развития 90-95% злокачественных опухолей человека. Около 80 веществ и сложных смесей являются канцерогенными для человека. Не вызывает сомнений роль онкогенных вирусов, некоторых бактерий и паразитов, ультрафиолетовой и ионизирующей радиации в этиологии рака.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Канцерогенез – это сложный, длительный, многоэтапный и многостадийный процесс, основу которого составляет стойкая и необратимая патология генома клетки, приводящая к изменению программы жизнедеятельности, и, как правило, выбраковкой ее из популяции.
В настоящее время принято рассматривать опухолевый рост как двуэтапный и трехстадийный процесс.
Первый этап, именуемый как бластомоцитогенез претерпевает две стадии: 1) инициации (трансформации)и 2) промоции (активации пролиферации).
Второй этап, именуемый как бластомогенез, включает стадию прогресии.
Стадия инициации - повреждение генома клетки без изменения ее фенотипических свойств. Инициация вызывается генотоксическими химическими канцерогенами, вирусами и физическими факторами. Клетка может находиться в этом состоянии любое время: от нескольких дней до десятков и более лет.
Стадия промоции - изменение фенотипических свойств клетки. Эта стадия чаще всего вызывается химическими веществами - промоторами. В качестве промоторов могут быть любые вещества, в том числе эндогенные канцерогены, химические вещества, относящиеся к возможным канцерогенам, а также вещества, стимулирующие деление клеток. Время влияния промотора после действия инициатора не имеет большого значения. Описан случай развития рака мочевого пузыря через 48 лет после прекращения контакта с анилиновыми красителями. Химические вещества, обладающие промоторным действием на развитие опухолей у человека изучены недостаточно.
В эту стадию происходит более быстрое увеличение количества дочерних опухолевых клеток, образующих первичный опухолевый узел. Как только достигается критическое число (около 10 млрд) опухолевых клеток, их пролиферация становится прогрессирующей, неуправляемой, необратимой.
Стадия опухолевой прогрессии - рост одной или нескольких малигнизированных клеток до морфологически и клинически определяемой опухоли. Рост опухоли происходит медленно. Так, для роста от одной клетки до опухоли массой 1 грамм требуется деление 30-ти поколений клеток (минимальный срок такого роста - 90 дней). Для роста от 1 грамма до 1 килограмма - всего лишь 10 поколений и соответственно требуется как минимум 30 дней. Поскольку в опухоли пролиферирует лишь небольшой процент клеток, реальные сроки роста опухоли значительно дольше. Таким образом, наиболее медленный рост опухоли (до нескольких лет) может происходить на самых ранних стадиях, еще до клинических проявлений. В процессе роста происходит постепенное нарастание генетических повреждений клеток, что приводит к дальнейшему озлокачествлению опухоли. Это связано с тем, что по мере роста опухоли ее клетки оказываются в неравных условиях: на некоторые клетки продолжают действовать канцерогенные вещества, часть клеток подвергается воздействию со стороны иммунной системы, возникают разные условия для поступления к клеткам кислорода и питательных веществ. Это приводит к тому, что в опухоли появляются несколько клонов клеток, что повышает степень злокачественности опухоли. Постепенно наименее дифференцированный клон становится доминирующим.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Факторы, вызывающие развитие опухоли, называются канцерогенными (от лат. cancer- рак) или бластомогенными(от греч. blastoma - опухоль). По своей природе делятся на физические, химические и биологические. Соответственно этим трем группам причин исторически сложились и три основные теории канцерогенеза: химическая, физическая и биологическая (вирусная), которые взаимно дополняют друг друга, формируя общее представление о механизмах канцерогенеза.
Канцерогены – вещества или факторы внешние или внутренней среды, способные превращать нормальную клетку в опухолевую. Причинойопухолей являются канцерогенные агенты химической, биологической и физической природы, а главным условием, способствующим реализации их действия (фактором риска) – снижение эффективности антиканцерогенных механизмов противоопухолевой защиты организма. В значительной мере это определяется генетической предрасположенностью. К числу наиболее значимых особенностей относятся:
· Аномалии генов, осуществляющих репарацию ДНК. Это определяет повышенную чувствительность к канцерогенным эффектам ультрафиолетового облучения, химических воздействий, радиации и других факторов.
· Аномалии генов-супрессоров опухолевого роста:
По исходной канцерогенной активности химические канцерогены делят на истинные или конечные канцерогены и про- или преканцерогены. Истинные канцерогены – это вещества, молекулы которых способны непосредственно превращать нормальную клетку в опухолевую, не изменяя структуры своей молекулы. По химической природе канцерогены делят на органические(ароматические амины и амиды) и неорганические. (мышьяк)
К канцерогенам биологической природы в первую очередь относят онкогенные (опухолеродные) вирусы. По типу вирусной нуклеиновой кислоты онкогенные вирусы подразделяют на ДНК-содержащие и РНК-содержащие. Физические канцерогенные факторы
К ним относятся, главным образом, радиационное и ультрафиолетовое излучения
Патогенез. Несмотря на большое число канцерогенных агентов и разнообразие клинических форм опухолей очевидно, что на уровне клетки происходит общее закономерное изменение — трансформация нормальной генетической программы в программу формирования опухолевого атипизма. В основе опухолевой трансформации лежат стойкие изменения ДНК.
Канцерогенез – длительный процесс накопления генетических повреждений. Латентный период – время от начальных изменений в клетке до первых клинических проявлений – может длиться от 10 до 20 лет. О. имеет клональное происхождение, т.е. каждый первичный опухолевый очаг состоит из клона клеток, потомков одной материнской трансформированной клетки, унаследовавших ее главное свойство – нерегулируемое размножение.
Возникновение опухоли – это многостадийный процесс, включающий 3 этапа (стадии):
Ι этап - инициация (трансформация) - приобретение исходно нормальной клеткой способности беспредельно размножаться.
II этап — промоция, или активация опухолевых клеток Главное в промоции – стимуляция клеточного деления, вследствие чего создается критическая масса инициированных клеток, что обусловливает высвобождение инициированных клеток из-под тканевого контроля и способствует мутационному процессу.
III этап – опухолевая прогрессия, или стойкие качественные изменения
свойств опухоли, возникающие по мере ее роста.
Доброкачественные опухоли
Клетки доброкачественной опухоли морфологически идентичны или похожи на нормальные клетки-предшественники и формируют характерные — высокодифференцированные для данной ткани структуры, т.е. имеют лишь тканевой атипизм (см. ниже). Такие опухоли растут медленно, не метастазируют и с клинической и прогностической точек зрения их расценивают как доброкачественные. Исключение - опухоли, локализация которых угрожает жизнедеятельности организма (О. головного мозга, сдавливающая нервные центры).
Злокачественные опухоли.
Клетки злокачественной опухоли морфологически отличаются (часто до неузнаваемости) от нормальной клетки-предшественника, соседних опухолевых клеток и образуют искажённые тканевые структуры (или вовсе их не образуют) — низкодифференцированные, т.е. обладают клеточныматипизмом. Эти опухоли растут быстро, прорастают в соседние структуры, а отдельные опухолевые клетки формируют близко расположенные или отдалённые точки роста, образуя метастазы. В их ткани нередко развивается некроз, расстройства кровообращения. С клинической и прогностической точек зрения такие опухоли расценивают как злокачественные.
Дата добавления: 2020-01-07 ; просмотров: 124 ;
Молекулярно-генетические механизмы опухолевой трансформации клетки
Современная концепция канцерогенеза получила название концепции онкогена. Основополагающие положения ее были сформулированы еще в 1981-1985 гг. Этому предшествовали сложные поиски ведущего патогенетического звена в механизме опухолевой трансформации клетки. Все исследователи второй половины 20-го столетия считали, что данный процесс осуществляется на молекулярно-генетическом уровне, но суть его трактовали по-разному.
Мутационная концепция канцерогенеза
Нормальная клетка превращается в опухолевую в результате структурных изменений в генетическом материале, т.е. мутаций. В этом заключается суть мутационной концепции. Различают три ее варианта. Первый вариант концепции (Т. Bovery, 1914) касается хромосомных аббераций и геномных мутаций, затрагивающих значительную часть генома. Второй вариант (Н.Н. Петров, К.Н. Bayer, 1924) учитывает еще и точечные или генные мутации. Третий вариант касается возможности участия в канцерогенезе мутации регуляторных генов.
О возможной роли мутационных механизмов в канцерогенезе свидетельствуют следующие факты:
Мутагенность подавляющей части (90 %) известных канцерогенов и канцерогенность большинства (у 85-87 % исследованных образцов) мутагенов.
Обнаружение в клетках ряда опухолей человека и животных так называемых маркерных хромосом (например, филадельфийской хромосомы примиелоцитарном лейкозе человека).
Резкое увеличение заболеваемости лейкозом и опухолевой болезнью людей с различного рода генетическими дефектами (при болезни Дауна, синдромах Клайнфельтера, Шерешевского-Тернера и др).
Эпигеномная концепция канцерогенеза
Согласно этой концепции (Ю.М. Оленов, А.Ю. Броновицкий, B.C. Ша-пот), в основе превращения нормальной клетки в злокачественную лежат стойкие нарушения регуляции генной активности, а не изменения структуры генетического материала. Под влиянием химических и физических канцерогенов, а также онкогенных вирусов происходит сдвиг в строго специфичной для каждой ткани регуляции генной активности: дерепрессируются группы генов, которые в данной ткани должны быть зарепрессированы и (или) блокируются активные гены. В результате клетка в значительной мере утрачивает присущую ей специфику, становится нечувствительной или малочувствительной к регуляторным влияниям целостного организма, неуправляемой.
С точки зрения эпигеномной концепции канцерогенеза можно объяснить ряд особенностей неоплазмы: изоферментное упрощение, антигенную реверсию, выработку некоторыми опухолями гормонов, не присущих клеткам гомологичной ткани и др.
Вирусо-генетическая концепция канцерогенеза
Современная концепция онкогена
Альтернативные точки зрения относительно природы неопластической трансформации в 70-е годы значительно сблизились, поскольку появились неопровержимые факты участия в канцерогенезе и мутационных, и эпигеномных, и вирусно-генетических механизмов, последовательно включающихся в процесс опухолевой трансформации. Стало аксиомой представление о многоэтапности процесса канцерогенеза, решающей предпосылкой которого является нерегулируемая экспрессия трансформирующего гена - онкогена, предсущест-вующего и геноме.
Согласно современной концепции онкогена мишенью для изменений, обусловливающих начаяо опухолевого роста, являются протоонкогены, или потенциальные онкогены, существующие в геноме нормальных клеток и обеспечивающие yсловия для нормальной жизнедеятельности организма. В эмбриональный период они обеспечивают условия для интенсивного размножения клеток и нормального развития организма. В постэмбриональном периоде функциональная их активность в значительной степени снижается — большая часть их оказывается в репрессированном состоянии, а остальные обеспечивают лишь периодическое обновление клеток.
Механизмы превращения протоонкогена в онкоген
Превращение протоонкогена в активно действующий онкоген обеспечивается следующими механизмами.
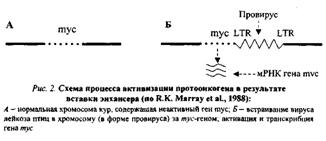
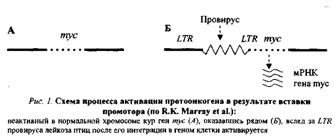
1. Присоединение к протоонокгену промотора — участка ДНК, с которым связывается РНК-полимераза, инициирующая транскрипцию гена, в том числе и онкогена, располагающегося непосредственно за ним (рис.1). Такого рода участки (промоторы) содержатся в больших терминальных повторах (LTR) ДНК-копий РНК-содержащих вирусов. Роль промотора могут выполнять и транспозирующие элементы генома — мобильные генетические элементы, способные перемещаться по геному и встраиваться в различные его участки.
2. Вставка в геном клетки энхансера (enchancer — усилитель) — участка ДНК, способного активизировать работу структурного гена, находящегося не только в непосредственной близости от него, но и на расстоянии многих тысяч пар нуклеотидов или даже встроенного в хромосому после него. Свойствами усилителя обладают подвижные гены, LTR ДНК-копий. В случае, проиллюстрированном рис. 2, LTR провируса не может работать как промотор (см. рис. 1, Б) и выступает в роли энхансера, в результате чего ген туе активизируется и транскрибируется.
3. Хромосомные абберации с явлениями транслокации, роль которых в механизмах опухолевой трансформации клетки можно проиллюстрировать следующим примером.
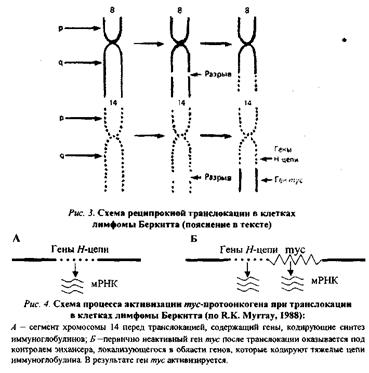
При лимфоме Беркитта конец (q-плеча хромосомы 8, отделившись от нее, переходит к хромосоме 14: гомологичный фрагмент последней перемещается к хромосоме 8; а неактивный ген туе (протоонкоген), находившийся в том ее сегменте, который попадает на хромосому 14, встраивается вслед за активными генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активизируется (рис. 3, 4). Явления реципрокной транслокации между 9-й и 22-й хромосомами имеют место в 95 % случаев миелоцитарного лейкоза. Хромосома 22 с укороченным в результате такой транслокации одним плечом получила название Филадельфийской.
Точечные мутации протоонкогена, к примеру, C-H-raS, согласно имеющимся сведениям, отличается от нормального гена (C-H-raS) всего одной аминокислотой, но тем не менее обусловливает снижение гуанозинтрифосфатазной активности в клетке, что может вызвать рак мочевого пузыря у человека.
Амплификация (умножение) прогоонкогенов, обладающих в норме небольшой следовой активностью, обусловливает увеличение их общей актив ности до уровня, достаточного для инициации опухолевой трансформации. Известно, что в икринке шпорцевой лягушки около 5 млн копий гена туc. После оплодотворения и дальнейшего деления яйцеклетки число их прогрессирующе уменьшается. В каждой клетке будущего головастика в эмбриональный период развития содержится не более 20—50 копий тус-гена, обеспечивающих быстрое деление клеток и рост эмбриона. В клетках же взрослой лягушки выявляются лишь единичные гены туc, в то время как в раковых клетках той же лягушки число их вновь достигает 20-50.
Поможем написать любую работу на аналогичную тему
Патогенез опухолей. Современные представления о молекулярно-генетических механизмах неопластической трансформации. Современная трактовка концепции онкогена. Роль мутаций, вирусов и эпигеномных нарушений в механизмах превращения протоонкогена в онкоген.
Патогенез опухолей. Современные представления о молекулярно-генетических механизмах неопластической трансформации. Современная трактовка концепции онкогена. Роль мутаций, вирусов и эпигеномных нарушений в механизмах превращения протоонкогена в онкоген.
Патогенез опухолей. Современные представления о молекулярно-генетических механизмах неопластической трансформации. Современная трактовка концепции онкогена. Роль мутаций, вирусов и эпигеномных нарушений в механизмах превращения протоонкогена в онкоген.
Читайте также:

