Ск-7 положительная в клетках опухоли
Ежегодно в мире раком мочевого пузыря заболевают 335,8 тыс. человек, с развитием летального исхода у 132 тыс. человек, то есть каждый третий умирает от данного заболевания. В России регистрируется ежегодно примерно 12700 новых случаев рака мочевого пузыря. Его доля в структуре онкологической заболеваемости среди мужского населения составляет 4,5 %, среди женского населения - 1,1 % [1].
В Российской Федерации выявление больных с поверхностной формой рака (I стадия) составляет всего лишь 20-30 % наблюдений, в противоположность зарубежным данным, в соответствии с которыми I стадия рака мочевого пузыря диагностируется в 80 % случаев [2]. В нашей стране в 11,6-15,6 % наблюдений выявляется IV стадия рака мочевого пузыря.
Следует указать и тот факт, что при адекватной диагностике и своевременном лечении жизнь умерших от рака мочевого пузыря можно было бы продлить в среднем на 14 лет. Именно поэтому, своевременная диагностика опухолей мочевого пузыря остается одной из важнейших задач современной онкоморфологии.
В современной литературе имеется большой объем опубликованных работ по применению диагностических иммуногистохимических маркеров при раке мочевого пузыря [3,5,6]. Однако, в клинических рекомендациях, выпущенных по инициативе Российского общества онкоурологов с разрешения Европейской ассоциации по урологии, в 2009 году сведения по применению конкретных иммуногистохимических маркеров для диагностики рака мочевого пузыря отсутствуют. Нет их и в стандартах диагностики и лечения рака мочевого пузыря, как в России, так и в Европе. Все вышесказанное позволило нам сформулировать цель нашего исследования.
Разработать панель иммуногистохимических маркеров ранней диагностики, стадирования и прогноза рака мочевого пузыря.
Материалы и методы исследования
Иммуногистохимические реакции проводили на серийных парафиновых срезах (5мкм), используя стрептавидин-биотиновый метод. В качестве детекционной системы применяли систему LSAB2 System, HRP (K0675), Dako, в качестве хромогена - диаминобензидин (Dako).
Иммуногистохимическое исследование 13 маркеров было проведено на биопсийном и операционном материале 66 пациентов. Все используемые моноклональные антитела были разделены на группы по функциональной значимости:
- маркеры пролиферативной активности - Ki67, PCNA, p63;
- супрессор опухолевого роста - р53;
- маркер апоптоза - Bcl2;
- рецептор эпидермального фактора роста - EGFR;
- цитокератиновый профиль - СК7, СК8, СК10/13, СК17, СК18, СК19.
Интенсивность реакций с антигенами, локализованными в цитоплазме (цитокератины 7,8,13,17,18,19) и на мембранах клеток (EGFR), оценивали полуколичественным способом по балльной шкале от 0 до 3, учитывая выраженность реакции и ее локализацию: 0 - отсутствие реакции, 1 - слабая реакция, 2 - умеренная реакция, 3 - сильная реакция.
Результаты реакций с антигенами, имеющими ядерную локализацию (PCNA, Ki67, p53, p63, bcl-2), оценивали по системе подсчета histochemical score. Система подсчета включает в себя интенсивность иммуногистохимической окраски по 3-балльной шкале и долю (%) окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски 0 - нет окрашивания, 1 - слабое окрашивание, 2 - умеренное окрашивание, 3 - сильное окрашивание.
Формула подсчета следующая: histochemical score = ∑ P (i) х I,
где i - интенсивность окрашивания, выраженная в баллах от 0 до 3.
P (i) - процент клеток, окрашенных с разной интенсивностью. Максимальное значение гистосчета должно соответствовать 300.
Статистический анализ проводили с использованием пакета программ статистической обработки результатов SSPS 13.0 for Windows.
Результаты исследования
При анализе показателей экспрессии иммуногистохимических маркеров, имеющих ядерное окрашивание, необходимо выделить маркер пролиферации Ki67, который четко показал отрицательную экспрессию в группе сравнения и имел корреляционную зависимость высокой степени значимости между стадией рака мочевого пузыря, процентом экспрессирующих клеток и интенсивностью иммуногистохимической реакции. То есть, с увеличением глубины инвазии опухоли возрастал процент экспрессирующих клеток и степень их экспрессии. Учитывая это, мы считаем, что данный маркер может использоваться в качестве критерия на ранних этапах диагностики рака мочевого пузыря.
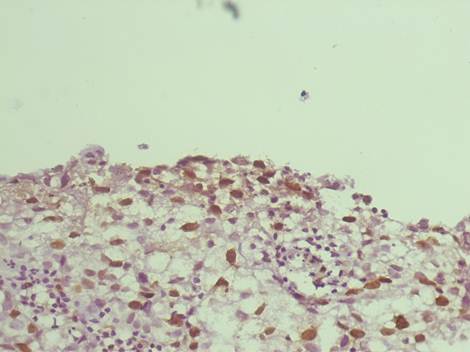
Рис. 1. Инвазивный уротелиальный рак. Умеренная и высокая экспрессия Кi-67 в ядрах уротелия
Равнозначные показатели получили при анализе экспрессии моноклонального антитела р53, являющегося белком-регулятором клеточного цикла и апоптоза. Отмечалось отсутствие окрашивания препаратов в группе сравнения, а интенсивность экспрессии и процент клеток с выраженной окраской имели четкую тенденцию к увеличению с возрастанием глубины инвазии опухоли. Раковые клетки с интенсивной иммуногистохимической реакцией маркера р53 появляются только в тех случаях, когда уротелиальная карцинома начинает прорастать в мышечный слой. Данные показатели позволяют использовать р53 как критерий прогноза заболевания, так и для определения глубины инвазии.
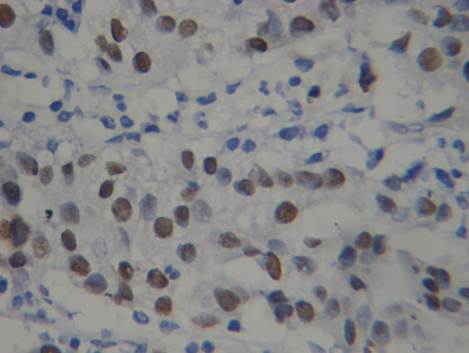
Рис. 2. Умеренная и выраженная экспрессия маркера Р53 в клетках инвазивной уротелиальной карциномы
Белок р63 также не дает экспрессии в группе сравнения. Однако достоверных различий частоты и интенсивности иммуногистохимической реакции в группах больных с различной стадией заболевания не выявлено.
При иммуногистохимической реакции на антигены, локализованные в цитоплазме, было установлено, что их экспрессия во всех исследованных группах больных является положительной. Достоверно значимых различий между группами больных по показателям иммуногистохимических реакций с цитокератинами (СК7, СК8, СК10/13, СК17, СК18, СК19) не установлено.
При исследовании полученных результатов иммуногистохимической реакции рецептора эпидермального фактора роста (EGFR) установлено, что его экспрессия отсутствует в группе сравнения и в группе больных с неинвазивными раками мочевого пузыря и нарастает с увеличением глубины инвазии. Таким образом, данное антитело не дает возможности на ранних этапах развития дифференцировать между собой доброкачественные процессы и злокачественные опухоли, поэтому данный маркер целесообразно использовать только для определения глубины инвазии опухоли.
Маркеры PCNA, Bcl2 не показали достоверной разницы в экспрессии ни в одной из изучаемых групп.
Выводы
Таким образом, проведенные исследования 13 моноклональных иммуногистохимических антител позволили разработать три основных направления в использовании данных маркеров:
- Для ранней и дифференциальной диагностики - определение маркеров Кi-67, р53, p63.
- Для глубины инвазии (стадирующая) - определение онкомаркера р53, рецептора эпидермального фактора роста (EGFR).
- Для прогноза заболевания - определение маркера пролиферативной активности Кi67.
Рецензенты:
Страница 1 из 5
Добрый день всем. Несколько дней гениколог, хирург и околог не могли поставить диагноз. Было предположение на меланому. Выдали на руки другую информацию. Самостоятельно приняли решение прорваться в РОНЦ на каширку (мы с подмосковья и нам светит Балашиха). Здравствуйте. С уважением, С уважением, Тип опухоли определили? С уважением, Иммуногистохимию можно сделать у нас в институте. Звоните и приезжайте. Телефон я указал выше. С уважением, УЗИ всего, флюорография,ирригоскопия- обнаружена опухоль в груди и образование в малом тазу. Сегодня взяли материал. В понедельник делаем комп. томографию. С уважением, Доброго время суток. В левой груди обнаружен "инфильтративный рост долькового рака с обширными полями некроза и фиброза. Опухоль отличается по гистол. строению от новообразования брюшной полости" 13*14*17 мм Реакция с рецепторами эстрогенов отрицательная. флюорография,ирригоскопия, КТ, сцистоскопия- больше ничего не найдено. Просьба подсказать дальнейший алгоритм продвижения. Прошу прощения за сумбурность. Боюсь, что бесплатно жителей Подмосковья могут лечить только в МООД в Балашихе, можете обратиться туда, но я не уверен, что из этого будет толк. С уважением, Спасибо за ответы. Почему радикальную мастэктомию + химия+ лучевая? Ведь РМЖ начальной стадии, лимфоузлы чистые? Что даст выделение мутантных генов? В случае совпадения позволит подобрать общую для обоих опухолей химтерапию? Сколько примерно стоит? Как часто делать КТ брюшной полости? Может лапроскапически фотометодом глянуть? Как часто проверять СА125? Он сейчас в крови на уровне 30, если не изменяет память. О чем это говорит, ведь до операции не делали анализа. Что значит комплексно? Я пока в Герцена комплексного подхода не увидел. Но я технарь. Может я зря пытаюсь найти клинику в которой займутся обеими проблемами сразу? Думаю на консультацию на Каширку съездить. Стоит ли сделать повторно стекла? В Герцена сделали все что смогли, на мой взгляд. Уважаемый serg.r, С уважением, Андрей, спаибо за ответ. Я правильно понял: Смогут ли в Герцена воспользоваться данными полученными у Вас в лаборатории? Есть рекомендации изнутри института, не оперировать РМЖ у отдельных известных товарищей. Это пусть будет на их совести. Общее ощущение: заехал в сервис на машине- мотор стучит, глушак сипит. Предлогают заварить глушак, а потом подумать о моторе. Уважемый Сергей, С уважением, Спасибо огромное. Карциномы ЖКТ Колоректальный рак является третьим по частоте диагностируемым раком в Соединенных Штатах (за исключением рака кожи) среди мужского и женского населения. Показатели заболеваемости колоректальным раком снижаются на протяжении последних двух десятилетий (с 66,3 случаев на 100000 человек в 1985 году до 45,5 случаев в 2006 году). Это связывают с увеличением использования колоректальных скрининг-тестов, которые позволяют обнаруживать и удалять полипы ЖКТ до их перерождения в рак. В отличие от общего сокращения, среди взрослого молодого населения в возрасте до 50 лет, для которого скрининг не рекомендуется из-за средней степени риска, заболеваемость раком ободочной и прямой кишки увеличивались с 1994 года примерно на 2% в год у мужчин и женщин. Смертность В 2016 году США смертность от колоректального рака ожидается на уровне 49500 случаев. Смертность от колоректального рака снизились в обоих группах мужчин и женщин за последние несколько десятилетий, с более крутым снижением в последний период времени. Это снижение отражает снижение показателей заболеваемости и улучшение ранней диагностики и лечения. Признаки и симптомы Ранние стадии рака ободочной и прямой кишки обычно не имеют симптомов, поэтому, чтобы выявить заболевание на этой ранней стадии часто необходим скрининг. Прогрессирование болезни может вызвать кровотечение из прямой кишки, появление крови в кале, изменение в опорожнении кишечника, схваткообразные боли в нижней части живота. Иммуногистохимия (ИГХ) при раке толстой кишки Применение ИГХ при раках толстого кишечника рассматривается на нескольких уровнях: для характеристики опухолей (эндокринный или эпителиальный тип), наследственной предрасположенности и для целей прогноза. Преобладающее использование ИГХ это определение возможных или предполагаемых метастазов, в которых толстой кишки является возможным первичным. Типичной локализацией для метастазов толстой кишки являются печень и легкие, оба органа, которые могут производить морфологию рака идентичную метастазам из толстой кишки. ИГХ, ( класс I правил регулирования FDA), используется после первичной диагностики опухоли путем гистопатологического исследования и не включается для клиницистов как независимое исследование. Метастатическая карцинома Наиболее часто применение иммуногистохимии в изучени опухолей печени – это определение источника метастаза, когда первичная локализация опухоли не известна. Развитие и применение панели для иммунных окрашиваний может помочь решить почти все диагностические проблемы. 2-6 Цитокератины (CK) 7 и CK 20 – первая ступень в идентификации многих опухолей и с дополнительными иммунными реакциями относительно специфичными для опухолей женского и мужского полового тракта, нередко дает возможность идентифицировать первичную локализацию метастатической опухоли. Желудок Иммуногистохимические исследования (ИГХ) , как правило, не требуются для оценки доброкачественных и злокачественных эпителиальных опухолей желудка, так как гистопатология, как правило, обеспечивает диагностику, но ИГХ нужна при изучении метастатического рака желудка, когда источник происхождения опухоли не ясен, или когда макроскопические / рентгенологическое проявления опухоли сбивают с толку (например, рак желудка напрямую и широко прорастает в печень и гистологически неотличим от холангиокарциномой). К тому же, ИГХ может быть полезна для идентификации некоторых вариантов желудочных карцином, включая гепатоидную аденокарциному, в которой печеночная дифференцировка может быть подтверждена позитивной реакцией на альфа-фетопротеин AFP. Аденокарцинома Нейроэндокринная карцинома Нейроэндокринная карцинома характеризуется положительным окрашиванием на синаптофизин, хромогранин, виллин и CD57.17-18 В отличие от аденокарциномы желудка, раки, происходящие во второй части двенадца-типерстной кишки могут быть отрицательными для обоих маркеров- синаптофизина и хромогранина, но часто вступают в реакцию с антителами против соматостатина. Маркер пролиферации Ki-67 и молекула адгезии Е-кадгерин, были использованы для оценки агрессивности нейроэндокринных carcinoma.19 Увеличение индекса пролиферации Ki-67 ( 20% для G1, G2, G3 и поражений соответственно) 20 предсказывает агрессивное поведение, и потеря Е-кадгерина может предсказать развитие метастазов в лимфатических узлах. Желудочно-кишечная аденокарцинома с нейроэндокринной дифференцировкой Аденокарцинома желудка, как кишечного типа, так и типа перстневидноклеточной карциномы, могут иметь нейроэндокринную дифференцировку и что может быть не очевидно по гистологической картине, но проявляться по окрашиванию хромогранином и /или синаптофизином. ГИСТ - гастроинтестинальные стромальные опухоли Антитело против CD117 окрашивает большинство случаев гастроинтестинальных стромальных опухолей (ГИСТ), в том числе метастазов.21-25 Хотя могут быть вариации в распределении CD117(+) клеток в пределах данной опухоли, в большинстве случаев окрашивание является диффузным. Когда реакция на CD117 положительна в опухолях отличных от ГИСТ, окрашивание почти всегда неоднородно. Окрашивание на CD34 также можно увидеть в ГИСТ. ГИСТ негативны на CD117 в 10 -15% случаев. Антитело Dog1, как было показано, маркирует большинство CD117 отрицательных ГИСТ.26 Кроме того, потеря SDHB, как было доказано, - постоянный признак ГИСТ с дефицитом SDHB, что ,таким образом, может быть полезным для выявления особого варианта этого заболевания. Толстый кишечник. Аденома и аденокарцинома. Аденомы (трубчатые аденомы, тубулярные аденомы, аденомы ворсинок) демонстрируют те же иммуногистохимические реакции, что и аденокарцинома кишки. Почти все они реагируют с антителами, направленными против CK 20 и меньшинство также окрашивается очагово с CK 7, в отличие от панкреатических аденокарцином, большинство из которых являются CK 20 отрицательными и положительными по СК 7. Дифференциальная диагностика метастатической колоректальногй аденокарциномы и аденокарциномы, возникающей в других местах зачастую представляет из себя сложную задачу. Легочная аденокарцинома может напоминать колоректальную. CK 7 и CK 20 могут быть полезными в этой ситуации, поскольку CK 7, как правило, сильно положителен в аденокарциноме легкого, а CK 20 обычно отрицателен; обратная картина наблюдается с колоректальными аденокарциномами. Кроме того, транскрипционный фактор щитовидной железы 1 (TTF-1) обычно положителен в раковых заболеваниях легких, а CDX-2 и бета-катенин как правило положительны в колоректальном раке. Карциномы эндометриоидного типа могут также гистологически быть неотличимы от колоректальной карциномы. Здесь, опять же, CK 7 положителен почти во всех эндометриоидных аденокарциномах и лишь слегка реактивен в колоректальной аденокарциноме. CK 20, как правило, негативен для первичных опухолей легких, но дает положительный результат на ободочной и прямой кишке. Аденокарцинома аппендикса Аденокарциномы аппендикса, как правило, показывают окрашивание на MUC5AC, в отличие от аденокарциномы ободочной кишки, в которой данное антитело редко реактивно. Это особенно полезно при изучении муцинозных аденокарцином, которые образуют метастазы в брюшной полости. Бета-катенин является еще одной мишенью дифференцировочных антител, положительных почти во всех ободочных аденокарциномах и отрицательных в аденокарциноме аппендикса. У женщин с абдоминальным муцинозным карциноматозом, различие ободочной и аппендикулярной аденокарциномы из яичников играет важную роль. В ободочной опухоли, часто экспрессируются виллин и бета-катенин; в метастазах в аппендиксе часто экспрессирован виллин, но бета-катенин является редким и в овариальных муцинозных аденокарциномах ни виллин, ни бета-катенин не выявляются. Подобно поражениям аппендикса, аденокарциномы экспрессируют MUC5AC и подобно колоректальным аденокарциномам, яичниковые муцинозные аденокарциномы экспрессируют CDX-2. Полезными добавками к основным панелям для неизвестных первичных опухолей, в которых подозреваются аппендикулярные или муцинозные опухоли яичников, являются MUC5AC и бета-катенин. Виллин также может быть полезным, поскольку он обычно имеет “brush-border” картину окрашивания и в ободочной и в аппендикулярной аденокарциномах и, как правило, цитоплазматическую в поражениях яичников и поджелудочной железы. Инвазивная аденокарцинома протоков Аденокарциномы поджелудочной железы, как правило, происходят из предшествующих стадий дисплазии протока поджелудочной железы. Иммуногистохимический паттерн высокодифференцированных панкреатических интраэпителиальных неоплазий такой же, как у инвазивной аденокарциномы поджелудочной железы и не может быть использован для их дифференциальной диагностики. Аденокарцинома протока поджелудочной железы напоминают аденокарциному желчных протоков и желчного пузыря по картине световой микроскопии, а также по иммунофенотипическим проявлениям. Панкреатические аденокарциномы реагируют с антителами к различным цитокератинам, в том числе CK 8, CK 17, CK 18, CK 19, CAM 5.2 и AE1 & AE3.5,32. Аденокарциномы поджелудочной железы, как правило, являются CK 7 и CK 20 положительными. Поджелудочная аденокарцинома также может быть слабо позитивной по CDX-2. Почти все аденокарциномы поджелудочной железы являются CEA и СА-125 положительными. Они также могут иметь незначительную составляющую нейроэндокринных клеток, которые будут реагировать с антителами к соматостатину, синаптофизину, хромогранину или другим нейроэндокринным маркерам. Терапия также может быть предсказана при положительном окрашивании на фактор роста эндотелия сосудов и отрицательном - на SMAD4 (DPC4). Потеря экспрессии SMAD4 в эпителии желчных протоков также была показана в случае хронической желчнокаменной болезни. Хорошо дифференцированные метастатические аденокарциномы поджелудочной железы в печени могут быть сложно отличимы от доброкачественных поражений желчных протоков при исследовании биопсийного материала. Тем не менее, в отличие от доброкачественных поражений, они как правило, экспрессируют р53, цитоплазматический mCEA, и другие маркеры, включая CA-125. Нейроэндокринные опухоли и опухоли из эндокринных клеток, низкодифференцированные и высокодифференцированные. Низко- и высокого дифференцированные нейроэндокринные опухоли, как правило, оцениваются по иммунофенотипическим проявлениям, однако в целом, интенсивность окрашивания меньше у полноценных опухолей. Они могут быть сгруппированы по преобладанию секретируется гормона (например: соматостатин, гастрин), но, как правило, также окрашиваются антителами к синаптофизину и хромогранину, а также к различным кератинам, в том числе CK 8, CK 18, CK и 35betaH11. CK 7 и CK 20, как правило, негативны. CD56 и CD57, как правило, окрашиваются более интенсивно в высокодифференцированных нейроэндокринных опухолях, чем в низкодифференцированных; в мембранном рисунке CD56 также будет положительным в большей степени, нежели SATB2. Поэтому SATB2 является хорошим маркером идентификации рака ободочного происхождения при работе с опухолью неизвестного происхождения. Другим потенциальным полезным свойством полезность SATB2 является выявление нейроэндокринных опухолей и карцином левой толстой и прямой кишки, так как SATB2 как правило, отрицателен в других нейроэндокринных новообразованиях ЖКТ, поджелудочной железы и легких. Новость от 26/04/2017 Читайте также:
|


