Самый высокий показатель злокачественности у полипов группы
На основе гистологического заключения. Злокачественность опухоли напрямую влияет на исход болезни: чем выше степень, тем агрессивнее рак, и тем хуже прогноз для выздоровления.
Врач-гистолог оценит степень злокачественности
Злокачественность опухоли
Морфологическое исследование удаленных раковых тканей, как обязательный этап диагностики, помогает определить злокачественность опухоли. В организме человека триллионы клеточных структур, основой которых являются около 100 различных типов клеток: каждая из них может переродиться в раковую. При этом результат перерождения-трансформации может быть морфологически очень близок к исходно нормальной клетке. Или настолько сильно отличаться, что, кажется, и сравнивать не с чем.
Злокачественность опухоли – это степень клеточных изменений, указывающая на агрессивность Карциномы: чем выше цифра после буквы G, тем сильнее отличается злокачественное новообразование от исходной ткани в месте возникновения рака.
Степени злокачественности
Гистологический диагноз – это морфологический вариант опухоли и степень злокачественности. Выделяют 3 степени:
- Высокая степень дифференцировки опухолевой ткани (G1) – клетки первичного очага отличаются от нормальных клеточных структур удаленного органа или ткани, но морфологически похожи: у врача-гистолога нет никаких сомнений в том, что основой злокачественного перерождения стали клетки именно из этого органа или ткани;
- Средняя степень дифференцировки (G2) – схожие черты исходной ткани сохраняются, но различий больше: гистологически опухоль сильно отличается от нормы, но отошла еще не так далеко;
- Низкая степень (G3) – раковые клетки имеют крайне мало сходства с органом или тканью в первичном очаге: гистолог сразу понимает, что это чужеродный и агрессивный зверь.
Необходимо обращать внимание на цифровое значение критерия G в диагнозе: низкодифференцированные опухоли всегда прогностически хуже, при G1 шансы на выздоровление значительно выше.
Значимость клеточных изменений опухоли
Важно понимать: злокачественность опухоли – это одно из значений диагноза, необходимое для реального понимания силы Карциномы. Это вовсе не означает, что при G3 нет никаких шансов для выживания, а при G1 можно радостно подбрасывать чепчики – типа, мы уже почти победили врага.
Высокодифференцированные опухоли – это:
- Сравнительно медленная скорость прогрессирования;
- Низкий риск быстрого и раннего метастазирования;
- Высокая чувствительность к лекарственной терапии;
- Высокие шансы на длительную ремиссию.
Низкодифференцированные раки – это:
- Быстрый рост первичного опухолевого очага;
- Ранние метастазы в лимфоузлы и отдаленные органы;
- Отсутствие положительного ответа на химиотерапию;
- Низкие шансы на выживаемость.
Казалось бы, все просто: G1 – это благоприятно, G3 – это плохо. Но в жизни все значительно сложнее, потому что на прогноз при онкологии влияют масса факторов. Злокачественность опухоли – это важный элемент диагностики, на который надо обращать внимание: низкая степень дифференцировки раковых клеток указывает на то, что враг силен, зол, беспринципен и агрессивен. Война будет изнурительно-длительной, не каждая битва будет успешной, после каждого боя будет казаться, что Карцинома становится сильнее, но, тем не менее, шансы на победу есть всегда.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.

Под действием определенных факторов любое новообразование, возникшее в организме, может принять злокачественную форму. Это относится и к внутриматочным полипозным разрастаниям. Чаще всего их диагностируют у женщин старшего возраста (менопауза, постменопауза).
Диагностика злокачественных полипов эндометрия проводится с помощью гистологического исследования. Собранные в процессе гистероскопии ткани отправляют на анализ. По результатам гистологии могут быть выявлены такие предраковые состояния:
- Аденоматозное новообразование.
- Железистый полип с пролиферацией клеток.
- Рак in situ (начальные формы онкологии).
Согласно проведенным исследованиям, основная причина озлокачествления доброкачественных наростов – это генетические и гормональные нарушения. В первом случае, это наследственная предрасположенность. Риск развития рака повышается при действии таких факторов:
- Эндокринные патологии.
- Гинекологические заболевания.
- Воспалительные процессы в эндометрии.
- Опухолевые поражения матки и ее придатков.
Особую опасность представляют маточные полипы в период климакса и возникшие на фоне эндокринных расстройств. К первым признакам внутриматочных патологий относятся нарушения менструального цикла. Это проявляется нерегулярными или обильными месячными. Могут возникать тянущие боли в нижней части живота, увеличение вагинальных выделений, слабость и общая усталость.
Диагностика патологии проводится с помощью трансвагинального ультразвукового исследования. Диагноз подтверждают путем гистероскопии с последующим гистологическим изучением собранных тканей.
Лечением занимается гинеколог-онколог. Проводится удаление злокачественного новообразования и выскабливание маточной полости. В дальнейшем пациентке назначают медикаментозную терапию для коррекции гормонального фона. Особое внимание уделяется профилактическим мероприятиям: нормализация массы тела, отказ от абортов, своевременное лечение гинекологических и любых других заболеваний организма, регулярные осмотры у гинеколога.
Атипический полип эндометрия
Новообразование эндометрия с аномальными структурами, возникшее в результате опухолевых трансформаций и воспалительных процессов тканей – это полип атипичного характера. Наличие атипичных клеток указывает на риск злокачественного перерождения нароста.
Атипический (аденоматозный) полип может сформироваться из любого типа тканей. Трансформация связана с действием определенных факторов. В зависимости от степени структурного изменения слизистой оболочки выделяют два вида атипичной гиперплазии:
- Простая – в гистологическом анализе повышенное количество железистых и стромальных элементов, но без структурно измененного эндометрия. Железы имеют повышенную митотическую активность. Это могут быть полипы железистого или железисто-кистозного вида.
- Сложная – эндометрий с выраженной пролиферацией железистого компонента. Есть признаки атипии на тканевом и клеточном уровне. Инвазия базальной мембраны железистых структур отсутствует. Гистология указывает на скопление анормальных клеток, потерю полярности желез. Клеточная атипия характеризуется разрастанием и искажением формы желез с инфильтратами и эндометриальной стромой.
Атипичные изменения – это предраковое состояние, то есть промежуточное положение между обычными формами железистой гиперплазии и онкологией. Злокачественный потенциал атипичных полипов составляет 30-50%.

[1], [2], [3], [4], [5], [6], [7], [8]
Полип эндометрия без атипии
Согласно гистологической классификации, гиперпластические процессы эндометрия делятся на такие группы:
- Железисто-кистозная гиперплазия.
- Полипы эндометрия: железистые, кистозные, фиброзные.
- Атипическая гиперплазия (полипы, аденоматоз и другое).
Первые две группы выступают фоном для рака эндометрия и встречаются в 2-4% случаев. Атипические процессы характеризуются нарушением клеточной дифференцировки в пределах эпителиального пласта, то есть являются предраком.
Полип эндометрия без атипии указывает на доброкачественное разрастание тканей слизистой. При гистологическом исследовании новообразования злокачественные клетки не выявляют. К наиболее безопасным наростам относятся аномалии функционального слоя слизистой железистого или фиброзного характера.
Для лечения полипов без атипии показано их хирургическое удаление и восстановление гормонального фона с помощью медикаментозных препаратов.

[9], [10], [11], [12], [13], [14], [15]
Вопрос об озлокачествлении одиночных и групповых полипов не может считаться окончательно решенным. Если одни исследователи придерживаются положения о потенциальной злокачественности аденоматозных полипов, то другие полагают, что раковое превращение полипа встречается редко либо не происходит вовсе, а злокачественные опухоли толстой кишки являются злокачественными с самого момента их возникновения.
Существенным критерием злокачественности полипа является его размер. Вероятность злокачественного характера полиповидной опухоли возрастает, если ее размер превышает 1 см. По данным Grinell (1964), среди опухолей толстой кишки менее 0,9 см раковые опухоли выявлены только в 1,9% случаев, при размерах от 1 до 1,4 см — в 5%, а при диаметре опухоли от 1,5 до 1,9 см — в 22,7%. Опухоли (полипы) диаметром более 3 см практически всегда являются злокачественными.
Таким образом, полипы диаметром менее 1 см в большинстве случаев доброкачественные, но некоторые из них могут перерождаться в злокачественные опухоли и карциномы. В связи с этим рентгенологическое исследование толстой кишки у больных с мелкими одиночными полипами следует проводить каждые полгода в течение 2 лет и только при отсутствии рентгенологической динамики перейти на более длительные интервалы.
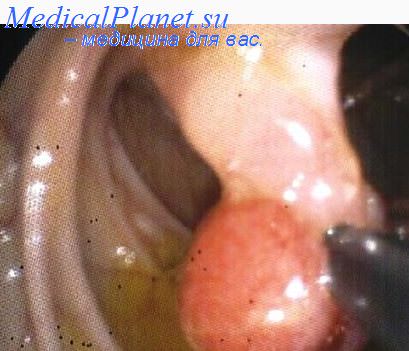
Другим важным симптомом злокачественности полипа является его быстрый рост. Если размер опухоли увеличивается вдвое по истечении 1155 дней, то вероятность ее озлокачествления не превышает 2%) при удвоении за 300—1155 дней составляет — 29%, а при удвоении менее чем за 300 дней —35%. Таким образом все полипы, увеличивающиеся в течение 6—12 мес, должны быть признаны злокачественными и оперативно удалены.
К рентгеноморфологическим признакам злокачественности полипа следует отнести инфильтрацию кишечной стенки у основания полипа, появление неправильности его контуров и бугристой поверхности. Первый из этих признаков может быть не связан со злокачественным ростом, а отражать воспалительную инфильтрацию кишечной стенки, однако из клинических соображений лучше рассматривать его как признак злокачественности.
К наиболее частым причинам, симулирующим рентгенологическую картину полипов в толстой кишке, относятся пузырьки воздуха, попадающие в нее вместе с контрастпой взвесью, комочки слизи и кала, жировые капли (касторовое и вазелиновое масло). Эти образования обычно перемещаются по кишке; в сомнительных случаях приходится проводить повторное исследование. Обнаружение дефекта наполнения в том же месте свидетельствует о наличии полипа.
Заполненные воздухом и обмазанные бариевой взвесью дивертикулы, накладываясь на изображение кишки, могут давать картину, внешне сходную с полипом. Выявление в дивертикуле уровня жидкости при вертикальном положении больного, а также результаты снимков, сделанных при разных поворотах больного для выведения сомнительного образования на контур кишки, позволяют решить эту диагностическую задачу.
Полипы толстой кишки – небольшие скопления из клеток, формирующих покровный эпителий толстой кишки. Большинство полипов безвредны. Однако со временем, некоторые полипы могут перерождаться в рак толстой кишки, который часто заканчивается смертельно, если обнаруживается на поздних стадиях.
Полипы могут развиться у кого угодно. Вы в группе повышенного риска, если вам больше 50 лет, вы курите или имеете избыточный вес, или у вас есть семейный анамнез опухолей или полипов толстой кишки.
Полипы толстой кишки часто не вызывают симптомов. Важно регулярно проводить скрининговые исследования, например, колоноскопию, поскольку полипы, обнаруженные на ранних стадиях, могут быть безопасно и полностью удалены. Наилучший метод предохранения от рака толстой кишки – регулярный скрининг на предмет полипов.
Полипы толстой кишки часто не вызывают симптомов. Вы можете не знать, что у вас есть полипы до тех пор, пока врач не обнаружит их в течение осмотра пищеварительного тракта.
Но некоторые люди с полипами испытывают:
Обратитесь к врачу, если испытываете:
- Боли в животе
- Кровь в стуле
- Изменения в характере стула, длящиеся более недели
Вам следует регулярно наблюдаться на предмет появления полипов, если:
- Вы старше 50 лет.
- У вас есть факторы риска, такие как семейный анамнез рака толстой кишки. Некоторым пациентам из групп высокого риска начало наблюдений следует проводить намного ранее 50 лет.
Здоровые клетки растут и делятся в строгом порядке. Мутации в некоторых генах могут приводить к тому, что клетки продолжают делиться даже в ситуациях, когда новые клетки уже не нужны. В толстой и прямой кишке такое деление клеток приводит к образованию полипов.
Полипы могут развиться в любом отделе кишечника. В общих чертах – чем больше полип, тем выше вероятность развития рака.
Факторы, которые могут приводить к развитию рака толстой кишки, включают:
- Возраст. Большинство людей с полипами толстой кишки старше 50 лет.
- Воспалительные заболевания кишечника, такие как язвенный колит и болезнь Крона.
- Семейный анамнез. Риск развития полипов выше, если у вас есть кровыне родственники с полипами. Если они развиваются у многих членов вашей семьи, риск ещё выше. У некоторых людей данная связь не является генетической.
- Употребление алкоголя и табака.
- Ожирение и отсутствие физических упражнений.
- Расовая принадлежность. У афроамериканцев риск развития полипов и рака выше.
- Диабет 2 типа, который не контролируется.
Наследственные заболевания, приводящие к образованию полипов
Редко, люди наследуют генетические мутации, которые приводят к образованию полипов толстой кишки. Если у вас есть такие мутации – вы в группе высокого риска развития колоректального рака. Скрининговые исследования и раннее обнаружение могут помочь предотвратить развитие данных типов рака.
Наследственные заболевания, ведущие к полипообразованию, включают:
- Синдром Линча, также известный как наследственный неполипозный колоректальный рак. Люди с синдромом Линча имеют предрасположение к образованию сравнительно небольшого количества полипов, но они быстро становятся злокачественными. Синдром Линча – наиболее частая форма наследственного рака толстой кишки, а также он связан с опухолями в грудной клетке, желудке, тонкой кишке, мочевыводящем тракте и яичниках.
- Семейный аденоматозный полипоз (САП) – редкое заболевание, которое приводит к образованию сотен и тысяч полипов в покровном эпителии кишечника, начиная с подросткового возраста. Если данные полипы не лечить, риск развития рака составляет примерно 100%, обычно в возрасте до 40 лет. Генетическое тестирование может помочь определить риск САП.
- Синдром Гарднера, вариант САП, который приводит к развитию полипов на протяжении тонкой и толстой кишки. При данном синдроме также могут развиваться опухоли в других частях тела, включая кожу, кости и брюшную полость.
- MYH-связанный полипоз (МСП), состояние, схожее с САП, которое вызвано мутациями в гене MYH. У людей с МСП часто развиваются множественные аденоматозные полипы и рак толстой кишки в молодом возрасте. Генетическое тестирование может помочь определить ваш риск МСП.
- Синдром Пейтца-Егерса, состояние, которое обычно начинается с образования веснушек по всему телу, включая губы, десны и ноги. Далее в просвете толстой кишки развиваются доброкачественные полипы. Данные полипы могут становиться злокачественными, поэтому у людей с данным состоянием повышен риск рака толстой кишки.
- Синдром зубчатых полипов, состояние, которое ведет к образованию множества зубчатых аденоматозных полипов в верхних о
Вас могут направить к врачу, который специализируется на заболеваниях пищеварительного тракта (гастроэнтерологу).
Что вы можете сделать
- Будьте осведомлены о возможных ограничениях перед обращением, таких как ограничениях в рационе к моменту визита к врачу.
- Запишите ваши симптомы, включая дату их начала и динамику их изменения с течением времени.
- Предоставьте список всех лекарств, витаминов и добавок, что вы принимаете.
- Запишите ключевую медицинскую информацию, включая информацию о других заболеваниях.
- Запишите ключевую личную информацию, включая любые недавние изменения или стрессы в вашей жизни.
- Возьмите с собой друга или члена семьи для того чтобы запомнить больше информации.
- Запишите вопросы, которые вы бы хотели задать врачу.
Вопросы, которые следует задать врачу
- Каковы наиболее вероятные причины моих симптомов?
- Какие исследования мне необходимы? Требуют ли они специальной подготовки?
- Какова вероятность малигнизации полипов?
- Возможно ли, что у меня генетическое заболевание, которое ведет к образованию полипов?
- Какие дополнительные исследования мне необходимы?
- Следует ли мне изменить рацион?
- У меня есть другие хронические заболевания. Как мне лечить их совместно?
В дополнение к вопросам, которые вы подготовили, чтобы задать врачу, не стесняйтесь задавать любые другие вопросы по ходу обращения.
Чего следует ждать от врача
Врач, вероятно, задаст вам несколько вопросов. Готовность ответить на них может помочь сохранить больше времени, чтобы уделить его тем моментам, на которых вы бы хотели остановиться подробнее. Вас могут спросить:
- Когда вы впервые начали испытывать симптомы?
- Ваши симптомы являются постоянными или периодическими?
- Есть ли у вас семейная история полипов, рака толстой кишки или других видов рака?
- Как много вы курите/употребляете алкоголя?
Скрининговые исследования играют ключевую роль в обнаружении полипов до того, как они станут злокачественными. Эти исследования также могут помочь обнаружить колоректальный рак на ранних стадиях, что увеличивает шансы на выздоровление.
- Колоноскопия – наиболее чувствительное исследование для обнаружения полипов и рака. При обнаружении полипов, врач может удалить их немедленно или взять образцы для биопсии.
- Виртуальная колоноскопия (КТ колонография), неинвазивное исследование, при котором для визуализации толстой кишки используется компьютерный томограф. Для данного исследования требуется такая же подготовка, как и для колоноскопии. Если полипы обнаружены, для их удаления потребуется колоноскопия.
- Гибкая сигмоскопия, при проведении которой в прямую кишку вводится тонкая трубка с подсветкой, для осмотра и изучения прямой и сигмовидной кишки. Если полип обнаружен, может потребоваться колоноскопия для его удаления.
Врач, вероятно, удалит все полипы, которые обнаружит при исследовании. Варианты удаления включают:
- Удаление в момент скринингового исследование. Большинство полипов могут быть удалены с помощью биопсийных щипцов или специальной петли. Данные методы могут быть использованы совместно с введением жидкости под основание полипа, что отделит его от стенки кишки для удаления. Если полип в размере больше 2 сантиметров, жидкость может быть введена для изолирования полипа от окружающих тканей, что обеспечивает возможность удаления.
- Миниинвазивная хирургия. Полипы, которые являются слишком большими для удаления в течение колоноскопии, могут быть удалены с использованием методов миниинвазивной хирургии.
- Удаление толстой и прямой кишки. При наличии наследственных синдромов (САП) может потребоваться операция по удалению толстой и прямой кишки целиком.
Некоторые типы полипов толстой кишки имеют выраженно большую вероятность малигнизации. Но для определения типа полипа требуется его патологоанатомическое и гистологическое изучение специалистом.
Последующее наблюдение
Если у вас обнаружен зубчатый или аденоматозный полип – у вас повышен риск рака толстой кишки. Уровень риска зависит от размера полипов, количества и характеристик конкретного полипа, который был удален.
Далее, необходимо наблюдение по поводу полипов. Врач может порекомендовать колоноскопию:
- Через пять лет, если были удалены 1-2 небольших аденоматозных полипа
- Через три года, если были удалены более двух полипов, полипы более 1см размером или ворсинчатые полипы
- В течение трех лет, если было удалено более 10 полипов
- В течение 6 месяцев, если полип был очень больших или удалялся по кусочкам
Важно правильно подготовить кишечник к исследованию. Если в кишке остаются каловые массы, это затрудняет обзор для врача и может потребовать более скорой повторной колоноскопии.
Вы можете значительно снизить вероятность рака толстой кишки, путем регулярных скрининговых исследований. Также вам могут помочь:
- Употребление фруктов, овощей, цельных злаков.
- Снижение употребления жиров.
- Ограничение употребления алкоголя.
- Отказоткурения.
- Наличие физической активности, поддержание здорового веса.
- Поговорите с врачом об употреблении кальция. Некоторые исследования показали, что повышение уровня употребляемого кальция могут снизить частоту образования полипов толстой кишки. Но механизмы данного феномена остаются неясными.
- Поговорите с врачом об употреблении аспирина. Регулярное использование аспирина может снизить риск возникновения полипов. Однако аспирин повышает риск желудочно-кишечного кровотечения.
- Рассмотрите все возможные варианты, если вы в группе высокого риска. Если у вас есть семейный анамнез развития полипов, рассмотрите вариант генетического тестирования. Если у вас диагностировано наследственное заболевание, ведущее к образованию полипов, вам необходимы регулярные колоноскопии с молодого возраста.

Зубчатые образования толстой кишки в современной классификации [4] разделены на три основные категории: гиперпластический полип (НР), зубчатая аденома/полип на широком основании (SSA/P) и традиционная зубчатая аденома (TSA). В целом тип зубчатого образования определяется его цитологическими и архитектурными особенностями. Одной из основных проблем в дифференциальной диагностике зубчатых образований толстой кишки является дифференциальный диагноз между НР и SSA/P. Несмотря на существующие сложности, патологам рекомендуется прилагать все возможные усилия для выявления SSA/P, так как их потенциал малигнизации выше, чем у НР, и в ряде исследований схож с потенциалом малигнизации классических аденом [5].
Клаудины – семейство трансмембранных белков, относящихся к белкам плотных контактов. В плотных контактах злокачественных клеток часто наблюдаются структурные и функциональные аномалии, проявляющиеся в изменении уровня экспрессии различных типов клаудинов.
В качестве источника колоректального рака обсуждаются cancer stem cells (CSC), которые способны к самоподдержанию и мультипотентной дифференцировке и могут образовываться из мутантных стволовых клеток или путем дедифференцировки эпителиальных клеток крипты. Маркер Musashi-1 (Msi-1) рассматривается некоторыми авторами как маркер CSC в раке толстой кишки и желудка [7]. Белок CD44, являющийся молекулой адгезии, также рассматривается в качестве маркера CSC. Изменение уровня CD44 ассоциировано с плохим прогнозом, увеличением количества метастазов у пациентов с колоректальным раком [8]. Возможно, изменение уровня или характера реакции этих маркеров может быть обнаружено и в зубчатых образованиях толстой кишки, обладающих большим потенциалом злокачественности.
Бета-катенин – цитоплазматический белок, ядерное накопление которого вследствие инактивирующей мутации в APC или мутации в бета-катенине приводит к активации Wnt-сигнального пути и опухолевой трансформации толстой кишки.
Интенсивность реакции Msi-1 отдельно оценивалась в цитоплазме (0; "+", "++", "+++") и в ядре (0; "+", "++", "+++"; "++++"; "+++++").
Производилась раздельная полуколичественная оценка мембранной и цитоплазматической реакции CD44 с использованием следующей шкалы: "–" – отрицательная, "+" – слабая, "++" – умеренная, "+++" – выраженная. Также обращали внимание на распределение метки по отделам крипты, разделенным на трети (нижняя, средняя и верхняя).
Нами была оценена интенсивность p53 (слабая, умеренная или выраженная), распределение маркера (нижняя часть крипты, поверхностная часть крипты или крипта целиком) и распределение позитивных клеток.
Маркер пролиферативной активности: Ki67
В HP индекс пролиферативной активности варьировал от 3% до 45% (среднее значение 24,1%), и отмечалось два типа распределения метки:
· реакция в базальных отделах полипа (нижней трети крипты) – наблюдалась в 69,2%;
· реакция в базальных отделах с распространением на среднюю треть полипа (рис. 1a) – наблюдалась в 30,8%.
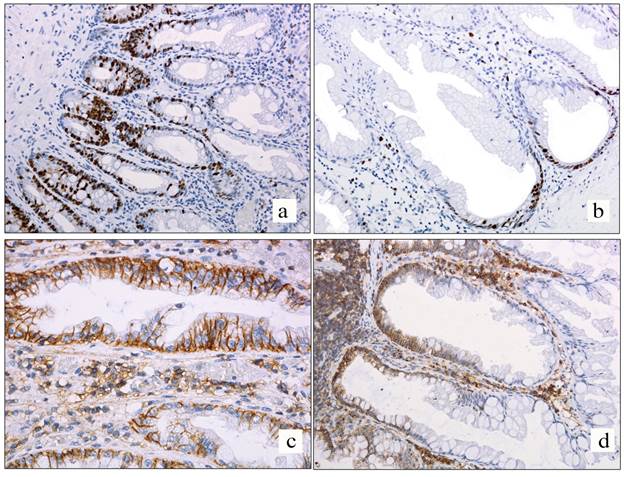
Рис. 1. Ядерная реакция Ki67 в зубчатых образованиях толстой кишки:
d – мембранная реакция CD44 в зубчатой аденоме на широком основании в базальных отделах и средней трети крипты; в верхней трети крипты реакция отсутствует, х200
В SSA/P индекс пролиферативной активности варьировал от 10% до 40% (среднее значение – 22,1%). Отмечался только один вариант распределения метки: в базальных отделах полипа, то есть в нижней трети крипты (100%), без распространения на среднюю треть (рис. 1b).
Принципиально иным был характер реакции Ki67 в TSA. Уровень Ki67 в TSA оказался выше, чем в HP и SSA: среднее значение составило 39,7%, иным было и распределение метки по высоте крипты:
· равномерно диффузно по всему полипу (76,5%);
· преимущественно в поверхностных отделах аденомы – (23,5%). Поверхностные отделы аденомы в обязательном порядке включали верхнюю треть крипты.
Маркеры опухолевых стволовых клеток: CD44 и Musashi-1
Во всех наблюдениях в HP и SSA реакция CD44 носила мембранный характер, что является типичной локализацией для данного маркера (рис. 1c), и выявлялась в базальных отделах крипт (нижняя треть) (рис. 1d). В чуть более чем в половине случаев гиперпластических полипов (53,9%) и лишь в 11,4% SSA реакция также обнаруживалась в средних отделах. Интенсивность реакции уменьшалась по направлению к просвету кишки, но последнего не достигала. По исследуемым маркерам Ki67 и CD44, а также маркерам, описанным в предыдущих исследованиях, выявить статистически значимых различий между HP и SSA не удалось (p>0,05). Эти результаты не кажутся нам противоречащими современной классификации, поскольку источник SSA не определен. По некоторым данным, SSA часто развивается из микровезикулярного HP [14], но существует мнение, что SSA развивается de novo. Возможно, данные разногласия связаны с противоречивыми критериями определения SSA. Так, согласно рекомендациям American Gastroenterology Association, наличие одной крипты с расширением базальных отделов достаточно для верификации SSA, а по классификации ВОЗ необходимо минимум три (или две соседние крипты) для подтверждения диагноза [15]. В зависимости от критериев варьирует и общая численность SSA, и их происхождение. Экспрессия CD44 характеризовалась точно такими же закономерностями распределения по полипам, как и Ki67, хотя CD44 не отражает пролиферативную активность. Такая коэкспрессия может быть объяснена участием молекул CD44 в передаче специфических сигналов через компоненты цитоскелета, что стимулирует увеличение митотической активности клеток.
Маркер Msi-1 во всех наблюдениях HP и SSA/P имел ядерную локализацию. Статистической разницы между группами выявить не удалось. В группе TSA в 59,0% реакция оказалась смешанной (цитоплазматическая + ядерная), в остальных 35,0% случаев – ядерная. Статистически распределение реакции и уровень Msi-1 был выше в TSA по сравнению с HP и SSA/P (p 0,05). TSA значительно отличались от двух остальных групп.
Маркеры белков плотных контактов: клаудин-1; -3; -4
Уровни клаудина-1 и клаудина-3 в HP (среднее значение 2,38 и 2,38 соответственно) и в SSA/P (среднее значение 3,63 и 3,21 соответственно) оказались примерно одинаковыми. Была выявлена только мембранная локализация маркера, цитоплазматическая реакция маркеров не встречалась. Реакция клаудина-4 носила преимущественно мембранный характер. В 15,4% HP и 26,3% помимо мембранной наблюдалась также цитоплазматическая реакция. Также в 26,3% на фоне мембранной и цитоплазматической реакций была выявлена парадоксальная ядерная реакция с характерной мозаичностью реакции. В TSA уровень всех клаудинов статистически был выше (p
Читайте также:

