С чем реагирует уксусная кислота с хлором
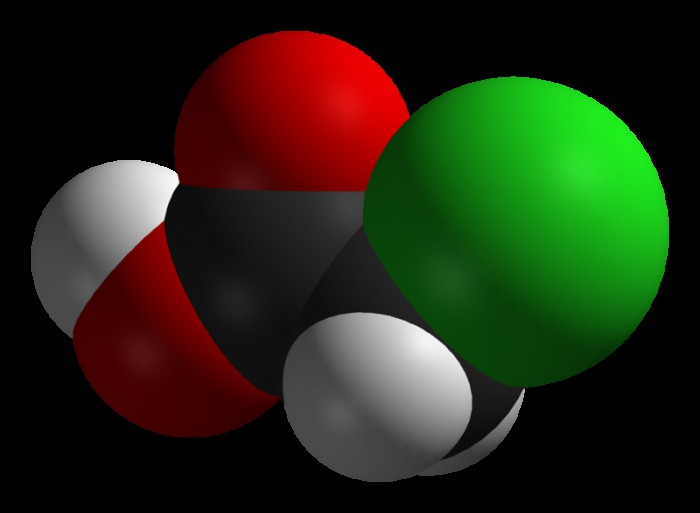
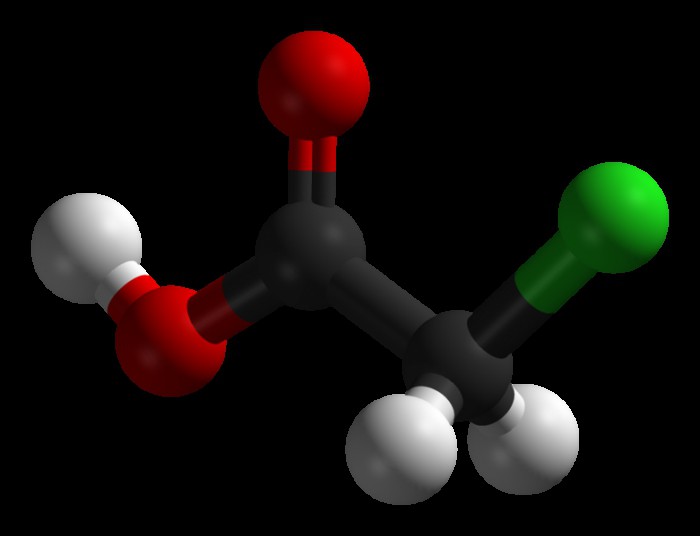
Хлоруксусная кислота представляет собой уксусную кислоту, в которой один из атомов водорода, находящийся в метильной группе, замещен на свободный атом хлора. Ее получают в результате взаимодействия уксусной кислоты с хлором.
Основным сырьем для получения является уксусная кислота. Хлоруксусная кислота также может быть получена при гидролизе трихлорэтилена.
В результате гидролиза получают химически чистый продукт. Однако данный метод подразумевает использование чистой дистиллированной воды без каких-либо примесей.
Хлоруксусная кислота применяется для получения различного рода красителей, лекарственных препаратов, витаминов и всевозможных пестицидов. Ее также используют в качестве поверхностно-активного вещества (ПАВ).
При хлорировании уксусной кислоты в среде неорганических катализаторов (а именно уксусного ангидрида, серы и фосфора) получается хлоруксусная кислота, формула которой CH2Cl-COOH:
Хлоруксусная кислота представляет собой гигроскопические, прозрачные кристаллы с температурой плавления 61,2°С и температурой кипения 189,5°С. Вещество легкорастворимое (как в спирту, так и в водной среде, а также в ацетоне, бензоле и четыреххлористом углероде).
Монохлоруксусная кислота – ядовитое и чрезвычайно опасное вещество, при проглатывании которого довольно часто наблюдается летальный исход. При попадании на кожные покровы хлоруксусная кислота вызывает сильнейшие ожоги, которые длительное время не заживают.
При вдыхании паров кислоты могут наблюдаться воспалительные изменения в легких, а также в верхних и нижних дыхательных путях.
Рабочие производственных цехов по производству монохлоруксусной кислоты страдают нарушением обоняния, хроническими ринофарингитами, шелушением и сухостью кожи.
Также при длительном взаимодействии с агрессивным веществом наблюдаются поражения эпидермиса кожи, выраженные дерматитами в области лица, шеи, верхних и нижних конечностей, в редких случаях - туловища.
Хлоруксусная кислота в человеческом организме превращается в тиодиуксусную кислоту, которая выводиться из организма с калом и мочой.
Основные методы предосторожности при эксплуатации:
- категорически запрещается вдыхать пары, газ, дым и пыль;
- обязательно использовать средства индивидуальной защиты при выполнении работ, связанных с любым контактом с кислотой (непроницаемый комбинезон, защитные очки, резиновые сапоги и перчатки);
- в случае вдыхании паров или попадании кислоты на кожу следует незамедлительно обратиться за квалифицированной помощью в ближайшее медицинское учреждение.

Предельно допустимая и теоретически безопасная концентрация хлоруксусной кислоты в воздухе производственного помещения составляет около одного мг/м 3 .
При транспортировке кислоты ее упаковывают в полимерную тару (контейнера или бочки), картонные барабаны, а также стальные емкости. Допускается транспортировка любым видом крытого транспорта.
Следует помнить, что монохлоруксусная кислота пожаро- и взрывоопасна. Это вещество легко воспламеняется.
| Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН. |
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO – + H +
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода . |

Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды . |

| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H 2О + ( CH 3 COO )2 Cu
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |

| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |

2. Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |

При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:

При нагревании карбоновые соли аммония разлагаются на амид и воду:

Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |

3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
| Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу. |
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
| Например, уксусная кислота реагирует с бромом в присутствии красного фосфора |

4. Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |

Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.

При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):

Муравьиная кислота окисляется хлором до углекислого газа.

Муравьиная кислота окисляется перманганатом калия до углекислого газа:
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:

5. Особенности бензойной кислоты
При нагревании бензойная кислота разлагается на бензол и углекислый газ:

| Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. |

6. Особенности щавелевой кислоты
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:

Щавелевая кислота окисляется перманганатом калия до углекислого газа:

7. Особенности непредельных кислот (акриловой и олеиновой)
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:

К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:

Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:

Физические свойства
Уксусная кислота (CH3COOH) – это концентрированный уксус, знакомый человечеству с давних времён. Его изготовляли путём брожения вина, т.е. углеводов и спиртов.
По физическим свойствам уксусная кислота – бесцветная жидкость с кислым вкусом и резким запахом. Попадание жидкости на слизистые оболочки вызывает химический ожог. Уксусная кислота обладает гигроскопичностью, т.е. способна поглощать водяные пары. Хорошо растворима в воде.

Рис. 1. Уксусная кислота.
Основные физические свойства уксуса:
- температура плавления – 16,75°C;
- плотность – 1,0492 г/см 3 ;
- температура кипения – 118,1°C;
- молярная масса – 60,05 г/моль;
- теплота сгорания – 876,1 кДж/моль.
В уксусе растворяются неорганические вещества и газы, например, бескислородные кислоты – HF, HCl, HBr.
Получение
Способы получения уксусной кислоты:
- из ацетальдегида путём окисления атмосферным кислородом в присутствии катализатора Mn(CH3COO)2 и высокой температуре (50-60°С) – 2CH3CHO + O2 → 2CH3COOH;
- из метанола и угарного газа в присутствии катализаторов (Rh или Ir) – CH3OH + CO → CH3COOH;
- из н-бутана путём окисления в присутствии катализатора при давлении 50 атм и температуре 200°C – 2CH3CH2CH2CH3 + 5O2 → 4CH3COOH + 2H2O.

Рис. 2. Графическая формула уксусной кислоты.
Уравнение брожения выглядит следующим образом – СН3СН2ОН + О2 → СН3СООН + Н2О. В качестве сырья используется сок или вино, кислород и ферменты бактерий или дрожжей.
Химические свойства
Уксусная кислота проявляет слабые кислотные свойства. Основные реакции уксусной кислоты с различными веществами описаны в таблице.
Взаимодействие
Что образуется
Пример
Соль, углекислый газ, вода
С неметаллами (реакция замещения)
Органическая и неорганическая кислоты
– CH3COOH + Cl2 → CH2ClCOOH (хлоруксусная кислота) + HCl;
– CH3COOH + F2 → CH2FCOOH (фторуксусная кислота) + HF;
– CH3COOH + I2 → CH2ICOOH (иодуксусная кислота) + HI
С кислородом (реакция окисления)
Углекислый газ и вода
Эфиры и соли, которые образует уксусная кислота, называются ацетатами.
Применение
Уксусная кислота широко применяется в различных отраслях:
- в фармацевтике – входит в состав лекарственных препаратов;
- в химической промышленности – используется для производства ацетона, красителей, ацетилцеллюлозы;
- в пищевой промышленности – применяется для консервации и вкуса;
- в лёгкой промышленности – используется для закрепления краски на ткани.
Уксусная кислота является пищевой добавкой под маркировкой Е260.

Рис. 3. Использование уксусной кислоты.
Что мы узнали?
CH3COOH – уксусная кислота, получаемая из ацетальдегида, метанола, н-бутана. Это бесцветная жидкость с кислым вкусом и резким запахом. Из разбавленной уксусной кислоты производят уксус. Кислота обладает слабыми кислотными свойствами и реагирует с металлами, неметаллами, оксидами, основаниями, солями, кислородом. Уксусная кислота широко применяется в фармацевтике, пищевой, химической и лёгкой промышленности.
Тест по теме
Средняя оценка: 4.2 . Всего получено оценок: 345.
Не понравилось? - Напиши в комментариях, чего не хватает.
Содержание
- Физические свойства
- Получение
- Химические свойства
- Применение
- Что мы узнали?
- Тест по теме
- Неметаллы
- Химические свойства неметаллов
- Получение водорода
- Получение кислорода Химические свойства уксусной кислоты
- Аммиак
- Получение аммиака
- Окисление аммиака
- Фосфор
- Химические свойства фосфора
- Адсорбция
- Природные источники углеводородов
- Кристаллогидраты
- Круговорот азота в природе
- Круговорот углерода в природе
- Аллотропные модификации углерода
- Силикатная промышленность
- Сульфиды
- Сера
- Алкены
- Сероводород
- Озон
- Азот
- Раствор аммиака
- Кремний
- Оксид азота
- Химические свойства алканов
- Формула алканов
- Алканы
- Получение азотной кислоты
- Химические свойства кремния
- Соединения кремния
- Валентность кремния
- Непредельные углеводороды
- Предмет органической химии
- Азотная кислота
- Применение кислорода
- Химические свойства серной кислоты

По многочисленным просьбам теперь можно: сохранять все свои результаты, получать баллы и участвовать в общем рейтинге.
- 1.
![]()
Николь Пак 285 - 2.
![]()
Мария Уразовская 223 - 3.
![]()
Ангелина Ященко 201 - 4.
![]()
Светлана Бабенко 199 - 5.
![]()
Gleb Apple 182 - 6.
![]()
Морин Егор 170 - 7.
![]()
Катя Деева 164 - 8.
![]()
Никита Дейнеко 160 - 9.
![]()
Дима Карасев 108 - 10.
![]()
Елена Васильева 105
- 1.
![]()
Кристина Волосочева 19,120 - 2.
![]()
Ekaterina 18,721 - 3.
![]()
Юлия Бронникова 18,580 - 4.
![]()
Darth Vader 17,856 - 5.
![]()
Алина Сайбель 16,787 - 6.
![]()
Мария Николаевна 15,775 - 7.
![]()
Лариса Самодурова 15,735 - 8.
![]()
Liza 15,165 - 9.
![]()
TorkMen 14,876 - 10.
![]()
Влад Лубенков 13,530
Самые активные участники недели:
- 1. Виктория Нойманн - подарочная карта книжного магазина на 500 рублей.
- 2. Bulat Sadykov - подарочная карта книжного магазина на 500 рублей.
- 3. Дарья Волкова - подарочная карта книжного магазина на 500 рублей.
Три счастливчика, которые прошли хотя бы 1 тест:
- 1. Наталья Старостина - подарочная карта книжного магазина на 500 рублей.
- 2. Николай З - подарочная карта книжного магазина на 500 рублей.
- 3. Давид Мельников - подарочная карта книжного магазина на 500 рублей.
Карты электронные(код), они будут отправлены в ближайшие дни сообщением Вконтакте или электронным письмом.
Задание 33.1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
1) При указанных условиях (H2SO4, 180 ᴼC) происходит внутримолекулярная дегидратация пропанола-1 с образованием пропилена (вещество Х1): 
2) Взаимодействие пропилена с HCl приводит к образованию 2-хлорпропана (вещество Х2) (реакция гидрогалогенирования): 
3) При взаимодействии 2-хлорпропана с водным раствором NaOH происходит замещение –Cl на гидроксильную группу, образуется изопропанол (вещество Х3): 
4) Изопропанол под действием H2SO4 при нагревании (180 ᴼC) подвергается внутримолекулярной дегидратации с образованием пропилена (вещество Х1): 
5) При воздействии водного раствора KMnO4 пропилен вступает в реакцию гидроксилирования с образованием пропиленгликоля (вещество Х4): 
Задание 33.2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Щелочной гидролиз 1,1-дибромпропана приведет к образованию альдегида - пропаналя: 
2) При взаимодействии с подкисленным раствором дихромата калия пропаналь окисляется в пропановую кислоту: 
3) В результате реакции пропановой кислоты с хлором в присуствии красного фосфора образуется 2-хлорпропановая кислота: 
4) 2-Хлорпропановая кислота взаимодействует с гидрокарбонатом натрия с образованием соответствующей натриевой соли: 
5) Взаимодействие натриевой соли 2-хлорпропановой кислоты с иодэтаном приводит к образованию соответствующего сложного эфира - этилового эфира 2-хлорпропановой кислоты: 
Задание 33.3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Метилциклогексан в присутствии платины при нагревании вступит в реакцию дегидрирования с образованием толуола: 
2) В результате реакции с водным раствором перманганата калия толуол окисляется в бензоат калия: 
3) Сплавление бензоата калия с гидроксидом калия приведет к образованию бензола: 
4) Нитробензол получают нитрованием бензола смесью концентрированных азотной и серной кислот: 
5) Нитробензол восстанавливается водородом, выделяющимся при взаимодействии Fe и HCl, до анилина. Последний далее может взаимодействовать с HCl с образованием соответствующей соли - хлорида фениламмония: 
Суммарное уравнение реакции: 
Задание 33.4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) н-Бутан в присутствии катализатора AlCl3 изомеризуется в изобутан: 
2) Взаимодействие изобутана с бромом на свету приведет к образованию 2-бром-2-метилпропана: 
3) 2-Бром-2-метилпропан под действием спиртового раствора гидроксида калия дегидрогалогенируется с образованием изобутена (изобутилена): 
4) Реакция изобутена с подкисленным серной кислотой раствором перманганата калия приведет к окислению углеводорода с образованием ацетона и углекислого газа: 
5) Гидрирование ацетона на никеле приведет к образованию изопропилового спирта (изопропанола): 
Задание 33.5
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) В результате взаимодействия бензола с хлорметаном в присутствии катализатора AlCl3 протекает реакция алкилирования с образованием толуола: 
2) Бромирование толуола в присутствии катализатора FeBr3 приводит к образованию 4-бромтолуола (п-бромтолуола) и 2-бромтолуола (о-бромтолуола): 
3) Реакция 4-бромтолуола (п-бромтолуола) с бромметаном и металлическим натрием приводит к образованию п-ксилола (реакция Вюрца-Фиттига): 
4) Окисление п-ксилола по действием подкисленного серной кислотой раствора перманганата калия приведет к образованию терефталевой кислоты: 
5) Терефталевая кислота с этиловым спиртом в присутствии катализатора H2SO4 вступит в реакцию этерификации с образованием сложного эфира - диэтилового эфира терефталевой кислоты (диэтилтерефталата): 
Задание 33.6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Термическое разложение метана (температура около 1000 о С) приводит к образованию ацетилена: 
2) Ацетилен присоединяет воду в присутствии катионов двухвалентной ртути с образованием ацетальдегида (реакция Кучерова): 
3) Образовавшийся этаналь (ацетальдегид) взаимодействует с аммиачным раствором оксида серебра (I) (реакция серебряного зеркала), в результате окисления альдегида образуется ацетат аммония: 
4) Последующее взаимодействие с гидроксидом кальция переводит ацетат аммония в ацетат кальция: 
5) Разложение ацетата кальция при нагревании приведет к образованию ацетона: 
Задание 33.7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Каталитическое гидрирование дивинила (бутадиена-1,3) приводит к образованию бутена-2: 
2) Реакция бутена-2 с подкисленным серной кислотой раствором перманганата калия приведет к окислению углеводорода с образованием уксусной кислоты: 
3) Хлорирование уксусной кислоты в присутствии красного фосфора приведет к образованию хлоруксусной кислоты: 
4) Хлоруксусная кислота взаимодействует с избытком аммиака с образованием аминоуксусной кислоты (глицина):
5) Последующее взаимодействие аминоуксусной кислоты с гидроксидом магния переводит аминокислоту в соответствующую магниевую соль:
Задание 33.8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Тримеризация этина (ацетилена) при нагревании в присутствии активированного угля приводит к образованию бензола: 
2) В результате алкилирования бензола хлорметаном в присутствии хлорида алюминия (III) образуется толуол: 
3) Хлорирование толуола на свету приведет к образованию бензилхлорида: 
4) Бензилхлорид реагирует с водным раствором гидроксида натрия с образованием бензилового спирта: 
5) Подкисленный серной кислотой раствор дихромата калия окисляет бензиловый спирт в бензойную кислоту: 
Задание 33.9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) В результате реакции с водным раствором перманганата калия толуол окисляется в бензоат калия: 
2) Сплавление бензоата калия с гидроксидом калия приведет к образованию бензола: 
3) В результате алкилирования бензола пропиленом в присутствии хлорида алюминия (III) и хлороводорода образуется изопропилбензол (кумол): 
4) Изопропилбензол хлорируется на свету с получением 2-хлор-2-фенилпропана: 
5) 2-Хлор-2-фенилпропан реагирует с водным раствором гидроксида натрия с образованием 2-фенилпропанола-2: 
Задание 33.10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Бензол гидрируется избытком водорода в присутствии платины до циклогексана: 
2) Циклогексан бромируется на свету с образованием бромциклогексана: 
3) Бромциклогексан под действием спиртового раствора гидроксида калия дегидробромируется с образованием циклогексена: 
4) Циклогексен присоединяет воду с образованием циклогексанола: 
5) Циклогексанол окиcляется под действием подкисленного серной кислотой раствора дихромата калия в циклогексанон: 
Задание 33.11
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При написании уравнений реакций используйте структурные формулы органических веществ.
Источник - Открытый банк заданий ЕГЭ
1) Метилпропионат вступает в реакцию гидролиза с образованием пропионовой кислоты и метанола: 
2) Метанол взаимодействует с хлороводородом с образованием хлорметана: 
3) Хлорметан алкилирует бензол с образованием толуола: 
4) В результате нитрования толуола смесью концентрированных азотной и серной кислот получают 4-нитротолуол (п-нитротолуол): 
5) 4-Нитротолуол восстанавливается водородом, выделяющимся при взаимодействии Fe и HCl, до 4-метиланилина (п-толуидин). Последний далее взаимодействует с HCl с образованием соответствующей соли: 
Суммарное уравнение реакции: 
Читайте также:

