Молекулярная классификация рака желудка

Рак желудка (РЖ) – стабильный игрок на площадке онкологических заболеваний, не уступающий своих позиций в бронзе по уровню смертности от новообразований во всем мире [1]. Это связано с затрудненной диагностикой вследствие позднего появления клинических симптомов, что значительно ограничивает эффективность проводимого лечения. Удручающие результаты отражают неэффективность шаблонного подхода [2].
Увеличение объема информации об этой патологии является ошеломляющим. Ежедневно тысячи статей приносят элемент новизны, который способствует лучшему пониманию гастроканцерогенеза. Много надежд связано с поиском оптимальных биомаркеров. Современный медицинский подход к онкологическим заболеваниям является интегративным: информация из всех областей должна быть объединена, как в головоломке. Опухолевые маркеры - не что иное, как кусок этой головоломки.
Мутационный ландшафт РЖ
Гистологически РЖ демонстрирует значительную гетерогенность и часто имеет несколько сосуществующих типов тканей, таких как хорошо развитые тубулярные структуры и единичные перстневидные клетки [4]. Впервые гистопатологическая классификация РЖ предложена в 1965 году Р. Lauren [5]. Она включает два типа аденокарцином желудка: диффузный и кишечный. Относительная частота кишечных, диффузных и недифференцированных типов составляют около 54%, 32% и 15% соответственно [6,7]. Кишечный и диффузный РЖ имеют значительные различия в этиологии, эпидемиологии, механизмах канцерогенеза, биологическом поведении и прогнозе [8, 9]. РЖ диффузного типа ассоциирован с мутацией в гене, кодирующем молекулу клеточной адгезии E-кадгерин [10, 11] и часто демонстрирует изменение экспрессии гена ras-гомологичной малой гуанозин-трифосфатазы (ras homolog family member A, RhoA) [12]; кишечный тип связан с атрофическим гастритом, КМ и инфекцией Helicobacter pylori [5]. Доказано несоответствие генетических изменений гистопатологическим типам аденокарцином желудка [13, 14]. Отсутствие хорошо зарекомендовавшей себя системы классификации рака желудка остается основным препятствием, препятствующим совершенной клинической практике.
Мутационный ландшафт РЖ был расшифрован с помощью крупномасштабного анализа данных геномных (экспрессионные и мутационные профили) и эпигеномных исследований (рис.1). В 16,4% случаев РЖ обнаруживаются гипергенные мутации [15,16].
Современные комплексные молекулярные классификации РЖ. Огромные массивы данных, полученные в ходе геномного секвенирования, требуют разработки эффективных методов интеграции в рутинную клиническую практику. Систематизация и выделение наиболее часто встречающихся паттернов РЖ позволит реализовать потенциал молекулярных исследований.
Таблица 1 | Наиболее масштабные исследования молекулярных сигнатур РЖ
| авторы | молекулярные подтипы | объем выборки | частота встречаемости, % |
| TCGA | EBV + | 295 | 8,81 |
| MSI высокий | 21,69 | ||
| GS | 19,66 | ||
| CIN | 49,83 | ||
| ACRG | MSS / TP53 + | 300 | 35,70 |
| MSS / TP53 - | 26,30 | ||
| MSS / EMT | 15,30 | ||
| MSI | 22,70 | ||
| Deng и др. | FGFR2 | 233 | 9,00 |
| KRAS | 9,00 | ||
| EGFR | 8,00 | ||
| ERBB2 | 7,00 | ||
| MET | 37,00 | ||
| Wong и др. | ТрТ | 49 | 36,73 |
| CpG | не представлены | ||
| TpCp [A / T] | не представлены | ||
| Kakiuchi и др. | RHOA + | 87 | 25,3 |
| RHOA - | 74,7 |
Примечания
1. Исследование The Cancer Genome Atlas (TCGA): Эпштейн-Барр-инфицированные опухоли (EBV+); опухоли с высоким уровнем микросателлитной нестабильности (microsatellite instability, MSI), геномно-стабильные опухоли (genomically stable, GS), хромосомно-нестабильные опухоли (chromosomal instability, CIN) (рис. 2) [17, 18].
2. Исследование The Asian Cancer Research Group (ACRG): на основе комплексных генетических характеристик РЖ ACRG проанализировали экспрессию гена в 300 образцах первичных опухолей желудка. Они выделили четыре молекулярных подтипа (рис. 2): опухоли с низким уровнем микросателлитной нестабильности (microsatellite stable, MSS) с/без мутаций tumor protein 53 (TP53), демонстрирующие эпителиально-мезенхимальную пластичность (epithelial-to-mesenchymal transition, EMT), опухоли с высоким уровнем MSI [20]. Опухоли MSS / EMT имеют самую высокую частоту рецидивов (63%) и неблагоприятный прогноз; подтип MSI рецидивирует реже (22%) и характеризуется самым благоприятным общим прогнозом; МSS/ТР53-положительные и МSS/ТР53-отрицательные подтипы имеют промежуточный прогноз и вероятность рецидивов. Таким образом, ACRG предлагает молекулярную классификацию, которая фокусируется на ассоциации между генетическим профилированием и клиническими исходами.
3. Deng и др. исследовали наиболее распространенные молекулярные мишени при РЖ: рецептор фактора роста фибробластов-2 (fibroblast growth factor receptor 2, FGFR2); гомолог вирусного онкогена саркомы крыс 2 Кирстен (Kirsten rat sarcoma viral oncogene homolog, KRAS); рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR); ERBB2 – ген, кодирующий human epidermal growth factor receptor 2 (HER2); ген, кодирующий рецептор фактора роста гепатоцитов (MET) [20].
4. Wong и др. определили три комбинации динуклеотидов, наиболее часто подверженные альтерации: thymine-phosphate-thyminе (TpT); cytosine-phosphate-guanine (CpG); thymine-phosphate-cytosine-phosphate (TpCp [A / T]) [6].
5. Kakiuchi и др. исследовали РЖ диффузного типа изменение экспрессии гена ras-гомологичной малой гуанозин-трифосфатазы (ras homolog family member A, RhoA) в образцах РЖ диффузного типа [12].
Наиболее валидными являются молекулярные классификации, предложенные Азиатской онкологической исследовательской группой (the Asia Cancer Research Group, ACRG) и проектом Центра Атлас генома рака (The Cancer Genome Atlas, TCGA) [21].
Поиск новых драйверных мутаций. Технологии геномного секвенирования нового поколения (next-generation sequencing, NGS) подтвердили ведущую роль мутаций TP53 и CDH1 (ген, кодирующий E-кадгерин) при РЖ, но в настоящее время наличие или отсутствие этих мутаций не изменяет стратегии лечения [22, 23].
Новые терапевтические мишени, обнаруженные методами NGS, значительно дополняют существующие представления о путях гастроканцерогенеза (рис.2). Основное внимание исследователей направлено на изучение механизмов ремоделирования хроматина, клеточной активности, модификации цитоскелета, феномену эпителиально-мезенхимальной пластичности [1, 24].
Терапевтическая стратегия у конкретного больного РЖ должна соответствовать требованием прецизионной медицины (рис. 3). Такой результат возможен при комплексном анализе фенотипических, геномных и эпигеномных характеристик, использовании новых доклинических моделей (тканевая инженерия опухолей) [20].
Рисунок 3 | Интегрированная стратегия прецизионной медицины для РЖ. Опухолевые образцы, полученные методом биопсии или циркулирующих опухолевых клеток, подвергаются клинико-гистопатологическому исследованию и геномному анализу NGS. Определяют геномные изменения – потенциальные мишени терапии. Формируют модель злокачественной опухоли с использованием технологий тканевой инженерии (ксенографты, органоиды). Эффективность и безопасность методов лечения исследуется в экспериментальных моделях. В итоге пациент получает оптимизированную таргетную терапию на основе этой интегрированной стратегии [19, 20, 24. 25].
Заключение
Геномика РЖ испытывает сейчас настоящую революцию благодаря развитию технологий NGS. Достижения в этой области привели к созданию нового подхода к классификации РЖ: помимо набора гистопатологических характеристик проводится анализ полного генома, а в перспективе также эпигенома, метаболома, протеома, транскриптома (мультиомиксный анализ). Это огромное количество информации определяет уникальный индивидуальный профиль опухоли. Для интерпретации данных секвенирования требуется разработка систем визуализации, позволяющих интегрировать гетерогенные данные. Однако истинная ценность молекулярных сигнатур определяется возможностями клинического применения. Например, в исследовании TCGA обнаружена сверхэкспрессия PD-1/PD-L1 (белок программируемой смерти клеток 1 типа и его лиганд) в клетках Эпштейн-Барр-позитивного РЖ. Антагонисты PD-L1 – потенциальные высокоточные таргетные препараты для таких пациентов[11]. Разработаны два моноклональных антитела PD-1: Opdivo (nivolumab) и Keytruda (pembrolizumab). Потенциальными мишенями являются рецепторы тирозиновых киназ, RAS сигнальные белки, МЕТ [25]. Новые стратегии терапии, модификация сигнальных путей, вовлеченных в канцерогенез у конкретного пациента, моделирование биологического поведения опухоли, прогнозирование результатов и выживаемости - таким представляется будущее прецизионной медицины. И фундамент новой парадигмы закладывается уже сегодня.
В зависимости от локализации опухоли в желудке выделяют:
- рак пилорического отдела желудка
- рак малой кривизны тела с переходом на заднюю и переднюю стенки желудка
- рак кардиального отдела желудка
- рак большой кривизны желудка
- рак дна желудка
Наиболее часто опухоль локализуется в нижнем (дистальном) отделе желудка, по малой кривизне желудка и его задней стенке/
По распространенности опухоли в органе рак желудка может быть субтотальным (поражено более одного из вышеуказанных отделов) и тотальным (поражены практически все отделы органа).
Понимание точной локализации опухоли и её распространения на отделы желудка очень важна для выбора тактики хирургического лечения рака желудка. В зависимости от распространенности и локализации рака желудка принимается решение о возможности выполнения резекции желудка (удаления части органа) или гастрэктомии (удаления всего желудка целиком)
Выделяют различные макроскопические формы рака желудка, которые характеризуют рост опухоли (В.В. Серов, 1970):
1. Рак с преимущественным экзофитным (опухоль растет внутрь просвета желудка) ростом:
- бляшковидный рак желудка представляет собой небольшую площадку с уплощенными желудочными складками, незначительно выступающую в просвет желудка. Гистологически опухоль чаще имеет строение недифференцированного рака или аденокарциномы, произрастающих из слизистой оболочки или подслизистой основе, т.е. относится к раннему раку
- полипозный и грибовидный раки желудка крайне редкий - всего 2-3% случаев всех желудочных карцином. Они представляют собой новообразования, возвышающиеся над поверхностью слизистой, хорошо отграниченные от окружающих тканей, красного цвета, могут быть дольчатыми. Размеры их варьируют в широких пределах. Полипозный рак имеет вид полипа на тонкой ножке. В отличие от него грибовидный рак имеет широкое основание и напоминает цветную капусту. Часто на поверхности данных карцином выявляются участки кровоизлияний, эрозии и отложения фибрина. Гистологически полиповидный рак чаще имеет строение папиллярной аденокарциномы, грибовидный – аденокарциномы или недифференцированного рака
- изъязвленный рак желудка, а именно:
- первично-язвенный характеризуется изъязвлением в самом начале своего возникновения. Обычно появляется бляшковидный очаг малигнизации, поверхность которого быстро эрозируется и изъязвляется. Гистологически чаще имеет строение недифференцированного рака.
- блюдцеобразный (рак-язва) представляет собой распавшееся экзофитное новообразование. Имеет вид язвы с валообразными краями на широком основании. От окружающей слизистой желудка опухоль обычно хорошо отграничена. Блюдцеобразная форма встречается в 25-30% наблюдений. Гистологически чаще имеет строение аденокарциномы.
- рак из хронической язвы (язва-рак) возникает при малигнизации хронической язвы. Опухоль локализуется в месте излюбленного расположения хронической язвы желудка – на малой кривизне и макроскопически на нее похожа. Она имеет форму глубокого дефекта (кратера) в стенке желудка с подрытыми плотными, как мозоль краями, проксимальным подрытым и дистальным пологим. Малигнизация обычно возникает в одном из краев, что приводит к появлению сероватой экзофитной массы без четких границ. В дифференциальной диагностике с блюдцеобразным раком помогает язвенный анамнез, а также обнаружение при микроскопическом исследовании среди опухолевой ткани разрастаний рубцовой на месте мышечной оболочки, а также сосудов с утолщенными склерозированными стенками, ампутационных невром, свойственных хронической язве желудка. Гистологически язва-рак чаще имеет строение аденокарциномы.
2. Рак с преимущественным эндофитным (опухоль растет внутрь стенки желудка) ростом:
- инфильтративно-язвенный рак желудка рак наблюдается у 50-55% больных. Характеризуется значительным прорастанием опухолью стенки желудка в сочетании с эрозированием и изъязвлением его слизистой оболочки. Одна или несколько язв могут иметь различные размеры и глубину. Характерна атрофия и инфильтрация слизистой вокруг опухоли. Стенка желудка обычно утолщена и ригидна. Описаны гигантские изъязвления, занимающие несколько отделов желудка. В клинической практике часто встречаются случаи пенетрации язвенного рака желудка в соседние органы.
- диффузный рак желудка развивается в 10-15% наблюдений. Выраженный эндофитный характер роста приводит к равномерному утолщению, уплотнению и деформированию стенки желудка. В ее толще развиваются плотные фиброзные тяжи, а на поверхности слизистой могут формироваться небольшие изъязвления. Диффузный рак, как правило, характеризуется скиррозным типом роста, при этом опухолевые клетки немногочисленны по сравнению с количеством фиброзной стромы. Гистологически чаще всего выявляют недифференцированную карциному или слизистый рак.
3. Рак желудка с смешанным (экзо-эндофитным) характером роста:
- переходные формы рака желудка примерно 8-10 % наблюдений
Кроме классификации ВОЗ (1977), широкое распространение при эпидемиологических исследованиях получила классификация К. Lauren (1965). Эпидемиологические исследования, проведенные с учетом гистологического строения опухолей, показали определенные различия в преобладающей структуре опухолей в зависимости от возраста и пола, состояния окружающей слизистой оболочки, а также в регионах высокого и низкого риска. Эти различия предположительно объясняют неоднородностью форм рака желудка и различием этиологических факторов.
Отмечено, что в регионах с повышенной заболеваемостью раком желудка, а также у мужчин пожилого возраста преобладают относигельно высокодифференцированные аденокарциномы обычно на фоне атрофического гастрита с кишечной метаплазией (так называемый рак кишечного типа). Главным образом за счет этих опухолей происходит снижение заболеваемости. Развитие рака кишечного типа, по-видимому, связано с воздействием факторов окружающей среды, в первую очередь - с характером питания. Другую форму рака (так называемый диффузный рак -низкодифференцированные аденокарциномы, перстневидно-клеточный и анаплазированный мелкоклеточный рак с диффузным характером роста) приблизительно одинаково часто наблюдают в регионах высокого и низкого риска; выявляется в более молодом возрасте, чаще у женщин.
Эта форма рака желудка часто ассоциируется с группой крови (А) II, ее возникновение предположительно связывают с генетическими факторами.
В ряде исследований показана целесообразность применения классификации, предложенной Японским обществом по изучению рака желудка (1972). В этой классификации выделяют: 1) аденокарциному; 2) карциному simplex (рак, не образующий железистых структур); 3) аденоакантому; 4) плоскоклеточный рак.
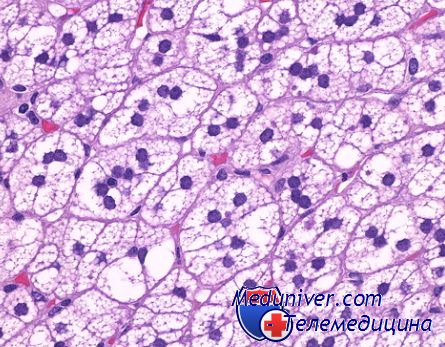
Дополнительно дается характеристика клеточного атинизма (I, II, III степени), структурного атинизма (1-й, 2-й, 3-й степени), роста опухоли по отношению к окружающей ткани (а-четко отграниченный, оттесняющий, у-инфильтративный, диффузный, промежуточный), функциональных свойств опухолевых клеток (наличие или отсутствие слизеобразования, локализация слизи, наличие или отсутствие ороговения), соотношение паренхимы и стромы в опухоли.
Классификация позволяет охарактеризовать важнейшие свойства каждой опухоли и оставляет меньше возможностей для субъективной их оценки и путаницы в терминологии.
В ряде случаев могут возникнуть трудности при микроскопическом исследовании рака желудка. В частности, сложно бывает дифференцировать тяжелую дисплазию от рака. При недифференцированном и перстневидно-клеточном раке разрозненные раковые клетки иногда с трудом обнаруживают в слое слизистой оболочки, среди фиброзной ткани в более глубоких слоях стенки желудка, а также в области хронической язвы.
Выявление перстневидных раковых клеток отмечается с помощью ШИК-реакции, окраски альциановым сипим и др. Для обнаружения недифференцированных раковых клеток и их идентификации иногда необходимо исследовать большое количество материала стенки желудка.
Следует помнить и о том, что молодые фибробласты и набухший эндотелий капилляров в грануляционной ткани могут быть ошибочно приняты за недифференцированные раковые клетки, а поперечно срезанные капилляры в грануляционной ткани или в собственной пластинке (строме) слизистой оболочки за перстневидные раковые клетки. Последние могут напоминать группы ксантомных клеток с широкой светлой пенистой цитоплазмой и центрально или несколько эксцентрично расположенным ядром, которые иногда встречаются в строме слизистой оболочки на уровне ямок. Постановке правильного диагноза помогают окраска на слизь и дополнительные срезы.
Особенно сложной и ответственной является диагностика рака по материалу гастробиопсии. Необходимое для этого высокое качество гистологических препаратов требует парафиновой заливки материала, проведения реакций на слизь, приготовления большого числа срезов.
Диагноз рака по гастробиопсии может быть поставлен только при наличии совершенно достоверных его признаков. В сомнительных случаях нужны повторные биопсии.

Рак желудка - злокачественная опухоль, которая развивается из клеток слизистой оболочки желудка. По распространенности он занимает пятое место среди всех видов рака. Как правило, болеют люди старше 40 лет. Основной метод лечения - хирургический, удаление всего желудка или его пораженной части.
- Причины рака желудка
- Классификация рака желудка: каким он бывает?
- Симптомы: как проявляется рак желудка?
- Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
- Какие методы диагностики может назначить врач?
- Современные принципы лечения рака желудка
- Какой прогноз при раке желудка?
- Цены на лечение рака желудка на 1-4 стадиях в Европейской онкологической клинике
Причины рака желудка
Роль питания в возникновении злокачественных опухолей желудка изучена хорошо. Риски повышает большое количество соли, крахмала, нитратов, некоторых углеводов. Чаще болеют люди, которые едят много соленых, копченых, маринованных продуктов, мало овощей и фруктов.

Курение повышает риск рака желудка примерно вдвое. Ученые в Великобритании считают, что примерно каждый пятый случай связан именно с курением. Когда человек вдыхает табачный дым, часть его попадает в желудок, и содержащиеся в нем вредные вещества повреждают клетки слизистой оболочки. Риски тем выше, чем больше стаж курильщика и ежедневное количество сигарет. Алкоголь тоже в списке подозреваемых, но прямых доказательств пока нет.
H. Pylori — бактерия, которая способна вызывать язвенную болезнь и хронический атрофический гастрит. В настоящее время она считается важным фактором развития рака желудка. При хеликобактерной инфекции вероятность возникновения злокачественной опухоли в желудке повышается в 4 раза. В половине удаленных опухолей обнаруживают этого возбудителя.
- Язвенная болезнь. Данные исследований по этому поводу противоречивы. Если язва находится в теле желудка, риск рака повышается почти в 2 раза. При язве нижнего отдела риски, видимо, не повышаются.
- Аденоматозные полипы слизистой оболочки.
- Семейный аденоматозный полипоз - заболевание, вызванное мутацией в гене APC и приводящее к возникновению множества полипов в желудке, кишечнике. При этом незначительно повышается риск рака.
- Перенесенные на желудке операции повышают риск рака в 2,5 раза. Это происходит из-за того, что желудок производит меньше соляной кислоты, и в нем активнее размножаются бактерии, продуцирующие нитриты, происходит обратный заброс желчи из тонкой кишки. Обычно злокачественные опухоли возникают спустя 10-15 лет после хирургического вмешательства.
- Социальное и материальное положение: риск увеличивается при низком уровне доходов, проживании в перенаселенной квартире, без удобств, в неблагоприятном районе.
- Другие онкологические заболевания: рак пищевода, простаты, мочевого пузыря, молочных желез, яичников, яичек.
- Болезнь Менетрие (гипертрофическая гастропатия) характеризуется разрастанием слизистой оболочки желудка, появлением в ней складок и снижением продукции соляной кислоты. Патология встречается редко, поэтому неизвестно, как часто она приводит к раку желудка.
- В группе повышенного риска работники угольной, металлургической и резиновой промышленности.
- Иммунодефицит повышает вероятность развития рака, лимфомы желудка.
Классификация рака желудка: каким он бывает?
Злокачественные опухоли желудка, согласно Международной гистологической классификации ВОЗ, делят на 11 типов, в зависимости от того, из каких клеток они происходят. Преобладает рак из железистых клеток, которые выстилают слизистую оболочку и вырабатывают слизь — аденокарцинома. Он составляет 90-95% всех случаев. Также встречаются опухоли из иммунных (лимфома), гормонпродуцирующих (карциноид) клеток, из нервной ткани.
Одна из старейших классификаций делит злокачественные опухоли желудка на 3 типа:
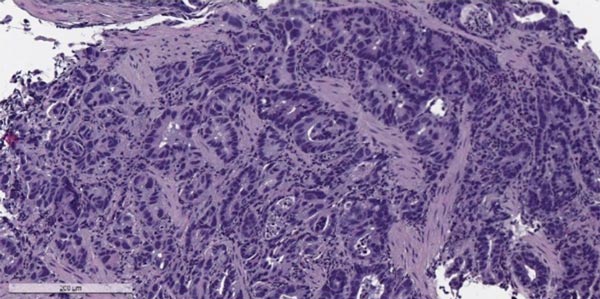
Рак желудка делят на ранний (начальный) и распространенный. При раннем опухоль не прорастает глубже слизистой оболочки и подслизистой основы. Такие опухоли проще удалить (в том числе эндоскопическим путем), при них лучше прогноз. Также используют классификацию TNM, которая учитывает размеры и прорастание в разные ткани первичной опухоли (T), метастазы в регионарных (близлежащих) лимфатических узлах (N), отдаленные метастазы (M).
Классификация в зависимости от состояния первичной опухоли (T):
- Tx - первичную опухоль невозможно оценить;
- T0 - первичная опухоль не обнаруживается;
- T1 - тяжелая дисплазия клеток слизистой оболочки, опухоль находится в поверхностном слое слизистой оболочки ("рак на месте");
- T2 - опухоль проросла в мышечный слой стенки органа;
- T3 - рак достиг серозной (наружной) оболочки желудка, но не пророс в нее;
- T4 - опухоль проросла в серозную оболочку (T4a), в соседние структуры (T4b).
Классификация в зависимости от наличия поражения в регионарных лимфатических узлах:
- Nx - невозможно оценить метастазы в лимфатических узлах;
- N0 - метастазы в регионарных лимфоузлах не обнаружены;
- N1 - поражены 1-2 лимфоузла;
- N2 - опухолевые клетки распространились в 3-6 лимфоузлов;
- N3 - метастазы в 7-15 (N3a) или в 16 и более (N3b) лимфоузлах.
Классификация в зависимости от наличия отдаленных метастазов:
- M0 - отдаленные метастазы не обнаружены;
- M1 - обнаружены отдаленные метастазы.
Аденокарциному делят на 4 стадии:
- I стадия (T1M0N0 - стадия Ia; T1N1M0, T2N0M0 - стадия Ib). Опухоль находится в пределах слизистой оболочки и подслизистой основы, не прорастает вглубь стенки желудка. Иногда раковые клетки обнаруживают в близлежащих лимфатических узлах.
- II стадия (T1N2M0, T2N1M0, T3N0M0 - стадия IIa; T1N3aM0, T2N2M0, T3N1M0, T4aN0M0 - стадия IIb). Опухоль прорастает в мышечный слой стенки желудка и распространяется в лимфатические узлы.
- III стадия (T2N3aN0, T3N2M0, T4aN1M0, T4aN2M0 - стадия IIIa; T1N3bM0, T2N3bM0, T3N3aM0, T4aN3aM0, T4bN1M0 - стадия IIIb; T3N3bM0, T4aN3bM0, T4bN3aM0 - стадия IIIc). Рак пророс через всю стенку желудка и, возможно, распространился на соседние органы, успел сильнее поразить близлежащие лимфатические узлы.
- IV стадия (любые T и N, M1). Есть отдаленные метастазы.
Метастазы рака желудка
Раковые клетки могут отрываться от материнской опухоли и мигрировать в другие части тела различными путями:
- С током лимфы они могут попасть в лимфатические узлы брюшной полости, а из них — в лимфоузлы надключичной области — метастаз Вирхова. Метастаз в лимфоузлы, окружающие прямую кишку, называют метастазом Шницлера.
- С током крови раковые клетки чаще всего распространяются в печень, реже — в легкие.
- Также раковые клетки могут рассеиваться по брюшной полости. Если они оседают на яичниках, образуется метастаз Крукенберга, в пупке — метастаз сестры Марии Джозеф.Редко при раке желудка обнаруживают метастазы в головном мозге, костях.
Симптомы: как проявляется рак желудка?
- Дисфагия. Возникает, если новообразование сдавливает место перехода желудка в пищевод. Сначала становится сложно глотать твердую пищу, затем и жидкую.
- Рвота недавно съеденной пищей. Характерна для опухолей в нижней части желудка, в месте перехода в двенадцатиперстную кишку.
- Стойкая изжога.
- Постоянные боли в области желудка, которые отдают в спину. Они не проходят ни днем, ни ночью.
- Потеря веса.
- Увеличение живота. Возникает из-за асцита — скопления жидкости в брюшной полости.
- Под ложечкой можно почувствовать и нащупать жесткое выпирающее образование. Это — опухоль, которая срослась с передней брюшной стенкой.
Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
Статистика говорит о том, что в 75% случаев рак желудка диагностируют уже на распространенной стадии, когда опухоль успевает прорасти в соседние ткани, дать метастазы. Лечить таких больных сложно, прогноз, как правило, неблагоприятный. Обычно выраженные симптомы говорят о том, что рак уже успел распространиться по организму.
Как проверить желудок на рак: на ранних стадиях помогает скрининг — регулярные обследования людей, которые не испытывают никаких симптомов. В качестве скринингового исследования применяют гастроскопию — эндоскопическое исследование, во время которого в желудок вводят гибкую трубку с миниатюрной видеокамерой и лампочкой на конце. Насколько эффективна гастроскопия? Лучше всего это демонстрирует японский опыт. Распространенность рака желудка в Японии очень высока, а смертность от него одна из самых низких в мире. Достичь этого удалось благодаря внедрению массового скрининга.
В Европейской онкологической клинике существуют специальные скрининговые программы, которые помогают вовремя диагностировать разные онкологические заболевания. Посетите врача, узнайте о своих рисках и получите индивидуальные рекомендации по поводу скрининга.
Какие методы диагностики может назначить врач?
Помимо гастроскопии, программа диагностики рака желудка может включать:
- Рентгенографию, перед которой пациенту дают выпить контрастный раствор. При этом контуры желудка хорошо видны на снимках.
- Компьютерную томографию, позитронно-эмиссионную томографию.
- Диагностическую лапароскопию. Это операция, во время которой в живот пациента через отверстия вводят лапароскоп с миниатюрной видеокамерой и специальные инструменты. Процедура помогает оценить, как далеко за пределы желудка успел распространиться процесс.
- Биопсию. Врач получает образец подозрительной ткани и отправляет в лабораторию для изучения под микроскопом. Этот метод диагностики помогает максимально точно диагностировать онкологическое заболевание и установить тип рака. Биопсию можно провести во время гастроскопии, хирургического вмешательства.

Современные принципы лечения рака желудка
Основной метод лечения рака желудка — хирургический. Объем операции зависит от того, на какой стадии обнаружена опухоль. Если она не успела распространиться вглубь стенки органа, проводят эндоскопическую резекцию — удаление пораженного участка при помощи инструмента, введенного через рот, как во время гастроскопии.
При субтотальной гастрэктомии удаляют часть органа, пораженную опухолевым процессом. На более поздних стадиях орган приходится удалять целиком вместе с окружающими тканями. При этом пищевод соединяют с тонкой кишкой. Если лимфатические узлы в брюшной полости поражены метастазами, их также нужно удалить.
В запущенных случаях, когда излечение невозможно, проводят паллиативную операцию. Хирург удаляет пораженную часть желудка, чтобы облегчить состояние пациента.
Лучевая терапия при раке желудка бывает:
- неоадъювантной — проводится перед операцией, чтобы уменьшить размеры опухоли и облегчить её удаление;
- адъювантной — чтобы уничтожить раковые клетки, которые остались в организме после операции.
Наиболее распространенные побочные эффекты лучевой терапии при облучении области живота: тошнота, нарушение пищеварения, диарея.
Химиотерапия также бывает адъювантной и неоадъювантной. Часто её сочетают с лучевой терапией. Химиолучевая терапия может стать основным методом лечения при метастатическом раке на поздних стадиях, когда прогноз неблагоприятный, но есть возможность облегчить симптомы и продлить жизнь больного.
В некоторых случаях эффективны таргетные препараты: трастузумаб, рамуцирумаб, иматиниб, сунитиниб, регорафениб. Но они подходят лишь в тех случаях, когда опухолевые клетки обладают определенными молекулярно-генетическими свойствами.
Какой прогноз при раке желудка?
Прогноз при раке желудка зависит от стадии опухоли, на которой был установлен диагноз и начато лечение. Шансы на стойкую ремиссию наиболее высоки, если опухоль не проросла за пределы слизистой оболочки и подслизистой основы. При метастазах прогноз, как правило, неблагоприятен.
В онкологии существует такой показатель, как пятилетняя выживаемость. Он показывает, какой процент больных остаются живы в течение 5-ти лет. Срок достаточно большой, в определенном смысле его можно приравнять к выздоровлению. Пятилетняя выживаемость при разных стадиях рака желудка составляет:
- I стадия — 57-71%;
- II стадия — 33-46%;
- III стадия — 9-20%;
- IV стадия — 4%.
Некоторые цифры и факты:
- Эксперты Всемирной организации здравоохранения (ВОЗ) утверждают, что ежегодно от рака желудка во всем мире погибают 754 000 людей.
- В XXI веке распространенность заболевания снижается, но в разных странах неодинаково. Так, на одного больного из Великобритании приходится двое из России и трое из Японии.
- По распространенности среди прочих онкозаболеваний рак желудка занимает пятое место, но среди причин смерти — третье.
- Одна из лидирующих стран по распространенности рака - Япония, во многом за счет характера питания.
В Европейской онкологической клинике применяются наиболее современные методы лечения рака желудка и других онкологических заболеваний. Даже если прогноз неблагоприятен, это не означает, что больному ничем нельзя помочь. Наши врачи знают, как облегчить симптомы, обеспечить приемлемое качество жизни, продлить жизнь
Читайте также:

