Роль травмы в патогенезе лимфомы
Лимфома Ходжкина (название введено ВОЗ в 2001 г., син. — болезнь Ходжкина, лимфогранулематоз) — это злокачественная опухоль, первично возникающая в лимфатических узлах и распространяющаяся преимущественно по лимфатической системе путем лимфогенного метастазирования. Поражение нелимфоидных органов происходит путем лимфогенного и гематогенного метастазирования. Патоморфологическим субстратом опухоли являются крупные многоядерные клетки Березовского — Рид — Штернберга.
Вирус Эпштейна — Барр (EBV — Epstein— Barr virus) является главным претендентом на роль этиологического фактора при лимфоме Ходжкина. В 1971 г. A. S. Evans, а затем в конце 80-х годов N. Mueller опубликовали исследования, выявившие зависимость между инфицированностью вирусом Эпштейна — Барр и частотой возникновения лимфомы Ходжкина. Они показали, что риск заболевания лимфомой Ходжкина среди тех, кто перенес инфекционный мононуклеоз, т. е. инфицирован вирусом Эпштейна — Барр, втрое выше по сравнению с неинфицированной популяцией.
Эти авторы также выявили повышенный по сравнению с контрольной группой титр антител к вирусному капсидному антигену и нуклеарному антигену вируса Эпштейна — Барр (EBNA — Epstein—Barr nuclear antigen — нуклеарный антиген вируса Эпштейна — Барр) при появлении клинических симптомов лимфомы Ходжкина. При изучении связи вируса Эпштейна — Барр с лимфомой Ходжкина выявлено еще несколько особенностей. Положительная реакция на вирус Эпштейна — Барр чаще отмечается у людей с низким социально-экономическим уровнем в экономически слаборазвитых странах и среди детей по сравнению с группой молодых взрослых и группой больных, имеющих высокий социально-экономический статус.
Последующие работы, в которых были использованы более чувствительные молекулярные методики (гибридизация in situ, полимеразная цепная реакция), показали, что в 30—50 % случаев лимфомы Ходжкина клетки Березовского — Рид — Штернберга содержат фрагменты генома вируса Эпштейна — Барр. Положительная реакция на вирус Эпштейна — Барр чаще выявляется у больных со смешанно-клеточным вариантом лимфомы Ходжкина (50—70 %) и реже — среди больных с нодулярным склерозом (10-42%).
Морфологической особенностью лимфомы Ходжкина является малое количество злокачественных клеток в опухолевой ткани. Пораженный лимфатический узел на 99 % состоит из различных реактивных клеток: Т- и В-лимфоцитов, гистиоцитов, эозинофилов, плазматических клеток, фибробластов, дендритных клеток и других клеточных элементов, а на долю опухолевого субстрата — гигантских одноядерных клеток Ходжкина и многоядерных клеток Березовского — Рид — Штернберга — приходится лишь 1 % всей клеточной популяции.
Эти опухолевые клетки имеют необычный фенотип, резко отличающийся от всех известных нормальных гемопоэтических клеточных типов. Эти обстоятельства объясняют, почему в течение длительного времени так трудно было установить происхождение клеток Березовского — Рид — Штернберга. И только в последнее десятилетие, когда значительное развитие получили методы иммунофенотипирования и цитогенетики в изучении и диагностике лимфомы Ходжкина, появились методики, позволяющие работать с одной отдельно выделенной клеткой, удалось расшифровать природу клетки Березовского — Рид — Штернберга. Дополнительные трудности в понимании происхождения клетки Березовского — Рид — Штернберга возникали в связи с тем, что в отличие от всех других лимфом у клетки Березовского — Рид — Штернберга не существует аналога в нормальном лимфопоэзе.
Современная концепция, объясняющая природу клеток Березовского — Рид — Штернберга, основана на том, что эти клетки происходят из периферических В-лимфоцитов. Исследования последнего десятилетия уточнили, что клетки Березовского — Рид — Штернберга происходят из тех центробластов зародышевого (терминального) центра вторичного фолликула лимфатического узла, которые в силу своего несовершенства должны были бы подвергнуться апоптозу (клеточной смерти), но избежали такового.
Не останавливаясь на деталях онтогенеза, которые изложены в главе, посвященной лимфопоэзу, следует напомнить, что в зародышевом центре вторичного фолликула в ходе В-клеточных иммунных ответов на Т-зависимые антигены происходит пролиферация и селекция В-лимфоцитов. В-лимфоциты, активированные в паракортикальной зоне, мигрируют в фолликул, где пролиферируют и образуют зародышевый центр. Крупные пролиферирующие клетки этого центра называются центробластами. В пролиферирующих В-клетках терминального центра происходят соматические гипермутации, в результате которых образуются случайные модификации генов вариабельных областей иммуноглобулинов (Ig). В процессе этих соматических гипермутаций происходит переключение генов с продукции IgM на продукцию Ig класса G или A (IgG или IgA).

Конечной целью соматических гипермутаций генов Ig является повышение аффинности (соответствия, сродства) кодируемого этими генами иммуноглобулина (антитела) к соответствующему антигену. Центробласты, прошедшие этап соматических гипермутаций, называются центроцитами. Центроциты, получившие в результате соматических гипермутаций способность продуцировать высокоспецифичные (высокоаффинные) антитела (иммуноглобулины), взаимодействуют с Т-хелперами зародышевого центра и фолликулярными дендритными клетками. В результате этого взаимодействия центроциты, способные продуцировать высокоаффинные антитела, выживают и дифференцируются в плазматические клетки или клетки памяти. Поскольку происходящие в центробластах соматические гипермутации случайны, абсолютное большинство их не приводит к повышению афинности Ig.
Молекулярно-генетические исследования генов Ig показали, что клетки Березовского — Рид — Штернберга являются именно такими В-клетками терминального центра лимфатического узла, в которых произошли бессмысленные и вредные мутации и которые по каким-то причинам не погибли, а сохранили способность к пролиферации и малигнизировались.
Происхождение клеток Ходжкина и Березовского — Рид — Штернберга из терминального центра лимфатического узла было доказано не только при изучении реаранжировки генов Ig, но также и при изучении иммунофенотипа этих клеток.
В процессе нормального лимфопоэза В-лимфоциты на различных этапах созревания теряют одни маркеры и приобретают другие. Большинство клеток Березовского — Рид — Штернберга либо не экспрес-сирует многие более ранние В-клеточные маркеры, такие как CD19, CD20, J-цепь (J chain), CD79a и CD79b, либо эти маркеры экспрессируются лишь небольшой частью клеток Ходжкина и Березовского—Рид—Штернберга. Клетки Березовского — Рид — Штернберга в случаях классической лимфомы Ходжкина экспрессируют активационные маркеры CD30 (Ki-1), а также различные маркеры, которые не характерны для В-лимфоцитов.
В очень многих случаях клетки Березовского — Рид — Штернберга экспрессируют CD15 — маркер, характерный для гранулоцитов и моноцитов, и продуцируют хемокин TARC, который секретируют только дендритные клетки. На клетках Березовского — Рид — Штернберга была обнаружена экспрессия и других маркеров дендритных клеток, включая фасцин и CD83. В 10—15 % случаев классической лимфомы Ходжкина клетки Березовского — Рид — Штернберга экспрессируют один или более Т-клеточных маркеров, таких как CD3, TIA-1, перфорин и гранзим В, имея при этом В-клеточное происхождение. Очень редко (около 2 % случаев) лимфома Ходжкина имеет Т-клеточную природу.
Несмотря на то что на клетках Березовского — Рид — Штернберга при классической лимфоме Ходжкина не определяются многие В-клеточные маркеры, тем не менее некоторые В-линейно-ассоциированные белки экспрессируются у большинства больных. Это факторы транскрипции РАХ-5, MUM1, BCL-6, а также плазмоклеточный маркер CD138. Так как фенотип BCL-6-/CD138+ характерен для плазматических клеток, было сделано предположение, что клетки Березовского — Рид — Штернберга с подобным фенотипом при лимфоме Ходжкина происходят из В-клеток, уже прошедших преобразования в терминальном центре.
С этой точки зрения потеря некоторых В-клеточных маркеров, например CD20, может указывать на начало плазмоклеточной дифференцировки клеток Березовского — Рид — Штернберга, так как плазматические клетки утрачивают большинство В-клеточных антигенов. Все эти факты с учетом мутационного статуса клетки Березовского — Рид — Штернберга являются аргументом для предположения, что ключевой шаг в злокачественной трансформации произошел в терминальном центре или ранее.

На этом основана гипотеза, что клетки Березовского — Рид — Штернберга в случаях классической лимфомы Ходжкина происходят преимущественно из уже трансформировавшихся клеток терминального центра, но не из клеток, эффективно прошедших все этапы селекции и дифференцировки в зародышевом центре.
Наиболее доказана в патогенезе лимфомы Ходжкина роль вируса Эпштейна — Барр. Особенно важен тот факт, что в большинстве случаев наличие структур вирусного генома в клетках Березовского — Рид — Штернберга выявляет клон опухолевых клеток, и это прямо указывает на роль вируса Эпштейна — Барр в патогенезе лимфомы Ходжкина.
Вирус Эпштейна — Барр находится в клетках Березовского — Рид — Штернберга в латентном состоянии. Клетки Березовского — Рид — Штернберга, содержащие геном вируса Эпштейна — Барр (EBV-позитивные), кроме EBNAI и EBNA2, экспрессируют латентный мембранный протеин (LMP — latent membrane protein) LMP1 и LMP2. Коэкспрессия LMP1 и LMP2 (частично в кооперации с EBNA2), возможно, играет решающую роль в развитии EBV-позитивной лимфомы Ходжкина.
Имитируя основные сигналы к выживанию В-клеток герминального центра (например, сигнальный CD40), эти вирусные протеины позволяют выжить тем В-клеткам герминального центра, которые должны были подвергнуться апоптозу. В В-клетках с дефектными мутациями экспрессия LMP1 заменяет нормальные CD40-медиаторные сигналы, которые контролируют выживаемость и дифференцировку В-клеток герминального центра. Тем самым LMP1 отменяет сигнал к апоптозу в В-клетках с нежелательными мутациями и инициирует их выход из герминального центра. Наличие LMP1 и LMP2 предотвращает гибель инфицированных вирусом Эпштейна — Барр В-клеток и превращает их в клетки Ходжкина и Березовского — Рид — Штернберга.
Однако тот факт, что вирус Эпштейна — Барр обнаруживается не во всех случаях лимфомы Ходжкина, оставляет открытым вопрос о патогенезе лимфомы Ходжкина у EBV-негативных больных. Существует несколько гипотез, объясняющих EBV-негативные случаи лимфомы Ходжкина. Одна из них заключается в том, что другой вирус является этиологическим фактором в этих случаях, однако попытки найти другой вирус в большинстве случаев потерпели неудачу. В 2001 г. J. Gopas и соавт. сообщили о присутствии вируса кори в клетках Березовского — Рид — Штернберга у половины больных лимфомой Ходжкина.
Классический цитогенетический анализ клеток Березовского — Рид — Штернберга затруднен, так как эти клетки редко разбросаны в опухолевой ткани и обладают низкой пролиферативной активностью, что делает сложным определение принадлежности метафаз к опухолевым клеткам. При анализе кариотипа клеток Ходжкина и Березовского — Рид — Штернберга в 30—80 % случаев выявляют количественные и структурные нарушения. Среди различных хромосомных изменений при лимфоме Ходжкина наиболее часто встречаются анеуплоидия — в 100%, при этом гиперплоидия — в 70%. Однако специфического хромосомного маркера найдено не было.
Имеются лишь указания на более частые хромосомные аберрации в нормальных лимфоцитах у больных лимфомой Ходжкина, но значение этого феномена пока неясно.
Лимфома Ходжкина
В обзорной клинической статье приводятся сведения о патогенезе, диагностике и лечении лимфомы Ходжкина, рассматриваются вопросы ранней диагностики, подчеркивается роль раннего морфологического исследования, лучевых методов диагностики, необходимость создания семенного фонда у молодых мужчин перед началом химиотерапии, важность строгого соблюдения стадирования, уточнения факторов прогноза, неукоснительного соблюдения программ терапии.
Лимфома Ходжкина (болезнь Ходжкина, лимфогранулематоз) – группа заболеваний лимфоидной ткани, включающая как минимум классическую лимфому Ходжкина и нодулярный тип лимфоидного преобладания. Классическая лимфома Ходжкина (ЛХ) – моноклональная опухоль, субстратом которой являются клетки Березовского-Рид-Штернберга (БРШ) и Ходжкина, которые происходят из В-клеток герминального центра фолликула. Они составляют около 1% от массы всей опухолевой ткани, состоящей из реактивных, неопухолевых Т- и В-лимфоцитов с примесью гранулоцитов и макрофагов.
В РФ общее количество впервые заболевших лимфогранулематозом составляет около 3,5 тыс. человек в год. Выявляются 2 основных пика заболеваемости ЛХ: первый приходится на 15–35 лет, второй наблюдается после 60 лет; соотношение мужчины/женщины примерно равное. В средней полосе России заболеваемость ЛХ составляет около 2,5 на 100 тыс. человек за год. В Москве и Московской области с численностью около 20 млн человек число заболевших может составить около 500 человек в год.
Этиология заболевания не известна. Пристально изучается роль вируса Эпштейна-Барр в возникновении заболевания.
В патогенезе ЛХ рассматриваются следующие проблемы. Морфологическим субстратом болезни является небольшое количество опухолевых клеток в массе опухоли, которая в основном состоит из реактивных Т-клеток, в частности CD4+. Цитокины, выделяемые этими клетками в ответ на опухоль, определяют клинические В-симптомы болезни, а также структуру опухоли, инвазирующей соседние ткани.
С.М. Алещенко с соавт. выделили группы генов, сцепленные с плохим прогнозом – резистентностью к терапии и рецидивирующим на фоне полихимиотерапии (ПХТ) течением.
В целом патогенез ЛХ может рассматриваться как ряд последовательных событий: больной ЛХ получает по одному неблагоприятному признаку вероятности развития ЛХ от каждого из родителей, став гомозиготой по этому признаку. Родители больного ЛХ передают HLA-DR признак, который выявляется определенным набором HLA-DR маркеров. Гены системы HLA-DR локализованы на коротком плече 6-й хромосомы.
По данным Алещенко, у части больных ЛХ выявлены генетические маркеры. Она исследовала 112 больных ЛХ, наблюдавшихся в отделении химиотерапии гематологических заболеваний и интенсивной терапии (ГИИТ) ГНЦ РАМН с 1996 по 2000 г. Изучены образцы геномной ДНК из лимфоцитов периферической крови. Показано, что существует положительная ассоциация между развитием ЛХ и наличием генов Cw7 и DRB1*11. Для носителей специфичности DRB1*07 выявлена значимая отрицательная ассоциация с восприимчивостью к ЛХ. Выявлено снижение риска развития ЛХ в молодом возрасте для лиц, имеющих в HLА-генотипе специфичность DRB1*01. Установлено повышение частоты общих НLA-специфичностей 1-го класса у родительских пар, имеющих больного ребенка. Значение данного показателя составляет соответственно 100% против 60%. Ген DRB1*04 ассоциирован у больных ЛХ с достижением полной ремиссии – частота DRВ1*04 в группе пациентов в ремиссии 5 и более лет (20%) выше частоты данной специфичности в группе больных, рефрактерных к ПХТ первой линии (8%) [1]. У пациентов с факторами риска по системе немецких авторов Хасанклевера и Уолкера Диля, основанной на наблюдении почти 6 тыс. больных ЛХ (мужской пол, возраст старше 45 лет, IV стадия заболевания, уровень гемоглобина менее 105 г/л, лейкоцитоз более 16х10/*9, лимфопения
Представляет интерес изучение полиморфизма генов, ответственных за метаболизм цитостатических препаратов, т. к. в ряде случаев при малой активности соответствующих ферментов мы не получаем противоопухолевого эффекта, при повышенной активности ферментов наблюдаются проявления избыточной токсичности. Возможно, полиморфизм генов системы HLA-DR и генетические механизмы лекарственной резистентности взаимосвязаны.
При изучении изолированных клеток БРШ выявлены глобальные механизмы, которые подавляют специфическую экспрессию генов В-клеток. Показано нарушение активности рецептора тирозинкиназы в клетках БРШ при классическом варианте ЛХ и в меньшей степени при варианте лимфоцитарного преобладания. Эта находка является уникальной для ЛХ и может способствовать более успешной химиотерапии [2].
Наши наблюдения за больными ЛХ с ВИЧ-инфекцией выявляют очень интересную проблему. При рассмотрении кривых заболеваемости ВИЧ-инфицированных больных разными болезнями в течение 15 лет до начала высокоактивной антиретровирусной терапии (ВААРТ) (1981–1996 гг.) и в течение такого же времени после введения ВААРТ (1996 – по настоящее время) оказалось, что в левой части графика заболеваемость злокачественными лимфомами, включая первичную лимфому ЦНС и саркому Капоши, возросла в сравнении с неинфицированной популяцией в 168 раз! Заболеваемость ЛХ и солидными опухолями до начала ВААРТ не отличалась от таковой в здоровой популяции (2,5 на 100 тыс. населения). Напротив, в правой половине графика (т. е. после начала ВААРТ) кривые первых двух болезней резко снизились, первичная лимфома ЦНС и саркома Капоши стали встречаться очень редко. Заболеваемость солидными опухолями не изменилась. Интересным фактом стало увеличение заболеваемости ЛХ до 8 раз с началом приема ВААРТ! Это означает, что для реализации ЛХ как болезни необходимо как минимум присутствие CD4+-лимфоцитов. Продолжение наблюдения за больными ЛХ с ВИЧ-инфекцией показало, что ЛХ у этой группы пациентов излечивается лучше, чем у неинфицированных больных: быстрый регресс симптомов, возможность достичь излечения при грубых нарушениях протокола лечения по времени (чрезмерно затянутые интервалы между курсами ПХТ). Эти два факта, полученные при непосредственном наблюдении и лечении больных ЛХ с ВИЧ-инфекцией, нуждаются в научном объяснении, которого пока нет.
Известен воспалительный синдром иммунологического восстановления у ВИЧ-инфицированных больных (Immune Reconstitution Inflammatory Syndrome – IRIS) –появление новых или обострение ранее пролеченных инфекционных или неинфекционных заболеваний на фоне положительного иммунологического и вирусологического ответа на ВААРТ. Он изучен при туберкулезе и грибковых инфекциях у ВИЧ-инфицированных больных. Оказалось, что при сочетании туберкулеза и ВИЧ-инфекции начало ВААРТ с повышением CD4+ клеток приводит к резкому ухудшению течения туберкулеза, и, напротив, первоначальная терапия туберкулеза с последующим присоединением ВААРТ не сопровождается развитием IRIS. CD4+ клетки необходимы для реализации туберкулезного процесса. Аналогичную картину мы наблюдаем при росте заболеваемости ЛХ в начале ВААРТ. Рассмотрение этого феномена в рамках IRIS заслуживает внимательного изучения. Если при туберкулезе в случае IRIS этиологическим фактором являются микобактерии, то при ЛХ одним из этиологических факторов может быть вирус Эпштейна-Барр.
Ранее в комплексе работ акад. В.Т. Иванова с соавт., А.А. Карелина с соавт. [3, 4] показано, что короткие пептиды обладают действием нейропептидов, обусловливая, в частности, гибернацию некоторых животных (медведей). Поводом для этих экспериментов явились клинические наблюдения врачей-гематологов за проявлением высшей нервной деятельности у пациентов, страдающих ЛХ. А.В. Пивник с соавт. [5] отметил своеобразные черты личности и характера этих пациентов: эмоциональная холодность, упрямство, скрытность. Отмечено, что характерологические особенности больных ЛХ ярко проявляются у матерей заболевших. До трети пациентов ЛХ категорически отказываются от рекомендованной полихимио- и лучевой терапии, что ведет к гибели больных в течение ближайших лет.
В результате обсуждений этих психологических особенностей пациентов с ЛХ с психологами и психиатрами было сделано заключение, что для больных ЛХ характерна особенность, отмеченная ранее у пациентов со злокачественными опухолями, а именно инфантильность – отказ согласиться с существованием болезни.
Психиатрами отмечены пограничные состояния и достоверное увеличение числа истинной шизофрении среди пациентов с ЛХ.
Таким образом, накапливается все больше данных об этиотропном действии вируса Эпштейна-Барр у субъекта с широким фоном разнообразных событий, таких как наличие сцепленных с плохим прогнозом генов системы HLA, наличие коротких пептидов, факты их онкогенного действия (О.Н. Блищенко с соавт.), наличие достаточного количества CD4+ Т-лимфоцитов [6, 7].
Морфологические варианты ЛХ
Выделяют следующие морфологические варианты лимфо¬гранулемато¬за (классификация ВОЗ, 2008 г.):
Лимфома Ходжкина, нодулярный тип лимфоидного преобладания.
Классическая лимфома Ходжкина:
• классическая лимфома Ходжкина, лимфоидное преобладание (С81.0 по МКБ);
• классическая лимфома Ходжкина, нодулярный склероз (С81.1);
• классическая лимфома Ходжкина, смешанно-клеточная (С81.2);
• классическая лимфома Ходжкина, лимфоидное истощение (С81.3).
При диагностике обычно биопсии подвергается один из увеличенных периферических лимфоузлов. В случае увеличения только внутригрудных или абдоминальных лимфоузлов или селезенки производится диагностическая торакотомия и лапаротомия или спленэктомия.
При первичном осмотре отсутствие общих симптомов (т. н. В-симптомы активности заболевания) определяется как А-стадия заболевания.
Увеличение лимфоузлов относится к местным симптомам ЛХ, чаще всего это периферические лимфоузлы выше диафрагмы (подчелюстные, шейные, надключичные, подмышечные, лимфоузлы средостения). Выявление увеличенных лимфоузлов в нетипичных местах – по ходу нервно-сосудистого пучка плеча, в кубитальной ямке, в поясничной области или экстранодальной локализации (молочная железа, мягкие ткани) – всегда свидетельствует о запущенной стадии ЛХ и неблагоприятном прогнозе. В этих случаях проводится дифференциальная диагностика между неопухолевым и опухолевым поражением лимфоузлов. Поражения ЦНС крайне редки, мы наблюдали одну пожилую больную ЛХ с общемозговой симптоматикой и объемным поражением мозга, доказанным с помощью МРТ. Обязательно исключается диагноз боковой кисты шеи, нередко симулирующей ЛХ. Увеличение размеров селезенки обычно выявляется при первичном осмотре, она плотная, гладкая, пальпируется ниже края реберной дуги на несколько сантиметров. Иногда спленомегалия может быть массивной, достигая массы 1 кг и более. Чаще небольшая спленомегалия выявляется при УЗИ живота, превышая нормальные размеры 11х4 см. Значительное увеличение размеров печени подтверждает IV стадию заболевания, которая выявляется нечасто. При ЛХ отмечается появление В-симптомов: лихорадка 38 °С в течение нескольких недель, профузная потливость с необходимостью смены постельного белья, потеря веса на 10% за последние 6 месяцев. Кожный зуд исключен из этих признаков, однако он является прогностическим признаком, который, так же как и гиперэозинофилия, превышающая 10–15% в общем анализе крови, определяет эффект терапии и возникновение рецидивов.
Дифференциальный диагноз проводится с метастазами рака, опухолями головы и шеи, включая назофарингеальную карциному, опухоль Шнитке, опухоли щитовидной железы, опухоли слюнных желез, а также опухолями других локализаций – молочной железы, ЖКТ, гениталий, внегонадными герминогенными опухолями. К неопухолевым заболеваниям относятся: вирусные лимфаденопатии, в первую очередь инфекционный мононуклеоз, в этих случаях не следует торопиться с биопсией лимфоузла, наблюдая за больным несколько недель. Также нельзя забывать о бактериальных лимфаденитах, обычно одонтогенного происхождения. В этих случаях следует назначить пациенту санацию полости рта, лечение антибиотиками и понаблюдать больного в течение нескольких недель. Все чаще при биопсии шейных и надключичных лимфоузлов наблюдается туберкулезное поражение. Мы наблюдали больных с шейной лимфаденопатией при локализации сифилитического шанкра на миндалине и губе. Нам приходилось за 1 неделю работы получать заключения по биопсии лимфоузлов этой области с диагнозами: беспигментная меланома, саркома Капоши, болезнь Гоше, туберкулезный лимфаденит.
Диагноз ЛХ всегда ставится морфологически – по результатам биопсии лимфоузла, селезенки или другой пораженной ткани. Исследование включает описание гистологических срезов, окрашенных гематоксилин-эозином, при световой микроскопии. Недопустимым является предположительный диагноз по цитологическому анализу тонкоигольной пункционной биопсии, полученной при пункции лимфоузла.
Морфологи ввели новые методы исследования, без которых современный диагноз лимфомы, ЛХ был нередко недостижим. Были введены анти-CD-антитела – иммунные маркеры, прицельно высвечивающие характерные для каждого варианта лимфом клетки. Молекулярно-биологические методы с использованием единичной изолированной опухолевой клетки позволяют изучать в деталях геном опухолевой клетки. Именно комплексные исследования (световое микроскопическое, иммуногистохимическое, молекулярно-биологическое) позволяют сделать патологоанатомическое заключение по поводу конкретного больного [8]. Результаты этих методов исследований, проведенных у нескольких тысяч больных лимфомами, легли в основу классификации злокачественных заболеваний кроветворной и лимфоидной ткани, предложенной ВОЗ в 2008 г.
После завершения этих исследований проводится стадирование с определением объема поражения лимфатической ткани, т. е. устанавливается стадия ЛХ.
Классификация по стадиям ( Ann . Arbor , 1971, с дополнением в Costwolds , 1989)
Поражение одной лимфатической зоны или одного лимфоидного органа (селезенка, тимус, Вальдейрово кольцо) или одного нелимфоидного органа
Поражение 2 и более лимфатических зон с одной стороны диафрагмы (поражение воротных лимфоузлов с обеих сторон диафрагмы относят ко II стадии); локализованное поражение только одного нелимфоидного органа или ткани (например, стенки грудной клетки) по протяжению с одной стороны диафрагмы (IIE). Число пораженных анатомических зон указывается арабской цифрой, нижним индексом (II 3 )
Поражение лимфатических зон с обеих сторон диафрагмы (III), которое может сопровождаться поражением селезенки (III S ) или локальным поражением по протяжению только одного нелимфоидного органа/ткани или и того и другого (IIISE).
III 1 с поражением селезеночных, воротных или портальных лимфоузлов либо без него
III 2 с поражением парааортальных, подвздошных и мезентериальных лимфоузлов
Диффузное или диссеминированное поражение нелимфоидного органа (или ткани) с поражением лимфоузлов или без него
Дополнительные обозначения, указываемые с любой стадией
Информация только для специалистов в сфере медицины, фармации и здравоохранения!

Руководство по лечению лимфомы Ходжкина
Для успешного лечения кЛХ необходимо понимать патогенез заболевания. В настоящее время большинством исследователей принята гипотеза патогенеза ЛХ, выдвинутая группой немецких ученых во главе с профессором V. Diehl в 1997 г. Современные взгляды на патогенез кЛХ основываются на том, что в большинстве случаев клетки Ходжкина (крупные одноядерные клетки) и Б-Р-Ш являются результатом моноклональной пролиферации зрелых В-клеток, происходящей в зародышевом центре фолликула лимфатического узла.
В зародышевом центре фолликула лимфатического узла в норме происходит процесс антиген-зависимой пролиферации и клональной селекции зрелых В-лимфоцитов.
Очевидно, что в ходе соматических мутаций могут возникать ошибки. Около 50% пролиферирующих В-лимфоцитов выбраковываются, поскольку в результате так называемых запрещенных мутаций они теряют свою В-клеточную программу и не могут закончить процесс дифференцировки, чтобы, превратившись в плазматическую клетку, продуцировать высокоспецифичный IgG. Такие клетки в процессе селекции получают сигнал к апоптозу (запрограммированной клеточной смерти). Однако одно или несколько последовательных онкогенных событий позволяют некоторым из них избежать апоптоза, получить возможность неконтролируемой пролиферации и стать опухолевыми клетками (Б-Р-Ш и др.) (рис. 1).
Рисунок 1. Патогенез классической лимфомы Ходжкина

События, которые происходят в зародышевом центре фолликула лимфатического узла, играют решающую роль в патогенезе кЛХ, а первичным событием, которое лежит в основе формирования опухолевого клона, является блок апоптоза.
Таким образом, опухолевые клетки Б-Р-Ш при кЛХ – это В-клетки, которые потеряли В-клеточную программу и не в состоянии продуцировать высокоспецифичный Ig.
Предполагают, что в ряде случаев участником одного из онкогенных событий является вирус Эпштейна – Барр (ВЭБ). Существует зависимость между инфицированностью ВЭБ и частотой возникновения кЛХ. Положительная серологическая реакция на ВЭБ достоверно чаще встречается среди больных со смешанно-клеточным вариантом заболевания (50–70%) и реже – среди больных, имеющих вариант с нодулярным склерозом (10–42%). Интересно, что прямая связь между наличием серологических признаков инфекции и обнаружением компонентов ВЭБ в опухолевых клетках отсутствует.
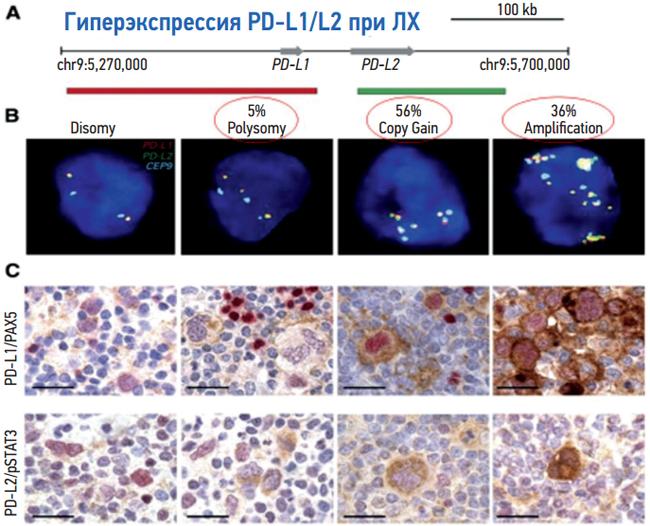
Особенностью клеток Б-Р-Ш являются дополнительные генетические нарушения, которые приводят к амплификации (увеличению числа копий) локуса 9р24.1 (рис. 2). Этот участок хромосомы определяет экспрессию лигандов (PD-L1 и PD-L2) для молекулы PD-1 на поверхности клеток Б-Р-Ш. Молекула PD-1 (PD – programmed death) является важным регулятором активности Т-клеток (и эффекторов, и регуляторов). Лиганды PD-L1 и PD-L2, связываясь с PD-1 рецепторами на поверхности Т-клеток, блокируют механизм распознавания и эффекторную активность Т-клеток в отношении опухоли. Поэтому Т-клетки перестают распознавать и убивать опухолевые клетки. Этим механизмом во многом объясняется неэффективность иммунного ответа, столь распространенная при кЛХ. Блокада взаимодействия PD-1 и PD-L1/2 успешно используется в иммунотерапии заболевания.
Рисунок 2. Амплификация хромосомы 9р24.1 при лимфоме Ходжкина (адаптировано из [93])
Патогенез нодулярной лимфомы Ходжкина с лимфоидным преобладанием
В отличие от кЛХ, при которой опухолевые клетки Б-Р-Ш теряют свою В-клеточную программу и возможность продуцировать Ig, при НЛХЛП В-клеточная программа, как правило, сохраняется, хотя и может быть частичная потеря/деформация фенотипа. Это происходит потому, что событие, приводящее к онкогенной трансформации, происходит на другом (более позднем) этапе дифференцировки В-клеток в фолликулах имфатического узла.
Эти клетки успешно прошли этап селекции и сохраняют В-клеточную программу, в т. ч. возможность продукции Ig (рис. 3)
Рисунок 3. Патогенез нодулярной лимфомы Ходжкина с лимфоидным преобладанием

Клиническая картина
Классическая лимфома Ходжкина
Метастазирование в органы и ткани происходит преимущественно лимфогенно, в т. ч. в легкие, ЦНС – по лимфатическим сосудам из региональных лимфатических узлов. Чаще всего поражаются легкие (около 10–15% случаев), значительно реже (менее 10%) – печень, кости, костный мозг, плевра. Крайне редко поражается ЦНС, преимущественно это сдавление спинного мозга при распространении по лимфатическим сосудам из близлежащих пораженных лимфатических узлов. Имеются единичные описания поражения головного мозга, почек, молочных желез, яичников, других органов. При крупных конгломератах возможно прорастание в близлежащие ткани и органы: кожу, плевру, перикард, щитовидную железу, желудок. Поражение плевры и перикарда сопровождается экссудативным плевритом, перикардитом, опухолевые клетки в котором обнаруживаются крайне редко. У трети больных заболевание сопровождается симптомами интоксикации: лихорадкой, ночными проливными потами, значительной потерей веса. Лихорадка носит либо волнообразный характер, либо повторяется через различные промежутки, обусловлена повышением активности простагландина Е-2 и хорошо купируется его ингибиторами – нестероидными противовоспалительными препаратами (бутадион, индометацин, вольтарен и др.). Проливные поты могут сопровождать лихорадку или возникать самостоятельно. Нередко к этим симптомам присоединяется прогрессирующее похудание. У части больных возникает мучительный, до расчесов, кожный зуд, который почти не купируется симптоматическими средствами. Очень редкий, но характерный симптом – боли в увеличенных лимфатических узлах при приеме алкоголя. Последние два симптома могут сопровождать течение заболевания, но не относятся к симптомам интоксикации.
Характерных изменений в анализах периферической крови не существует. У части больных отмечается ускорение СОЭ, иногда встречается тенденция к нейтрофильному лейкоцитозу или лимфоцитопения. Тромбоцитоз может указывать на поражение костного мозга. Из биохимических проб обращает на себя внимание повышение уровня фибриногена, альфа-2 глобулина, гаптоглобина, церулоплазмина, которые, как и СОЭ, отражают активность процесса и не являются специфическими. Повышение уровня ЛДГ встречается редко, так же как и повышение уровня щелочной фосфатазы.
НЛХЛП имеет индолентное течение – умеренная лимфаденопатия нередко выявляется за много лет до установления диагноза. Преобладают ранние стадии заболевания – более 70%. Распространенные стадии, так же как и симптомы интоксикации, бывают редко. В отличие от кЛХ, при НЛХЛП реже бывают массивное поражение средостения, вовлечение большого числа зон лимфатических коллекторов, превышение нормальных показателей ЛДГ и ускорение СОЭ. Крайне редко отмечается экстранодальное поражение, еще реже – поражение костного мозга.
По вопросам приобретения обращайтесь в отдел подписки:
Читайте также:

