Резистентность к химиотерапии при лейкозе
Н.Н. Мамаев, Я.В. Гудожникова, Т.Л. Гиндина, И.М. Бархатов, А.И. Шакирова, В.А. Катерина, М.В. Губина, Е.С. Николаева, Е.В. Семенова, О.В. Паина, Е.И. Дарская, О.В. Пирогова, В.В. Порунова, И.С. Моисеев, И.А. Михайлова, Б.И. Аюбова, В.М. Кравцова, С.Н. Бондаренко, Л.С. Зубаровская, Б.В. Афанасьев
Для переписки: Николай Николаевич Мамаев, д-р мед. наук, профессор, ул. Льва Толстого, д. 6/8, Санкт-Петербург, Российская Федерация, 197022; тел.: +7(812)233-12-43; e-mail: nikmamaev524@gmail.com
Для цитирования: Мамаев Н.Н., Гудожникова Я.В., Гиндина Т.Л. и др. Эффективность химиотерапии у больных острыми лейкозами с резистентностью к предшествующему стандартному лечению по данным серийного измерения уровня экспрессии гена WT1. Клиническая онкогематология. 2018;11(1):78-88.
РЕФЕРАТ
Цель. Оценить эффективность химиотерапии при резистентности к стандартному лечению у больных острыми лейкозами по данным серийного измерения уровня экспрессии гена WT1.
Материалы и методы. С помощью серийного измерения уровня экспрессии гена WT1 оценена эффективность индукционных курсов химиотерапии у 31 больного (лиц мужского пола — 15, женского — 16, возраст от 3 мес. до 68 лет, медиана 28 лет) с прогностически неблагоприятными вариантами острых миелоидных и лимфобластных лейкозов (23 с ОМЛ, 8 с ОЛЛ). Уровень экспрессии гена WT1 до начала химиотерапии и через 2–3 нед. после ее завершения определяли методом количественной ПЦР в реальном времени. Пороговым уровнем было 250 копий гена WT1 на 10 4 копий гена ABL. Цитогенетический профиль лейкозных клеток оценивали в динамике методами стандартной цитогенетики и флюоресцентной in situ гибридизации.
Результаты. Исходный уровень экспрессии гена WT1 варьировал от 305 до 58 569 копий/10 4 копий ABL. Ожидаемое снижение уровня экспрессии гена WT1 после первого индукционного курса химиотерапии было отмечено у 22 (96 %) из 23 больных ОМЛ и у 6 (75 %) из 8 — с ОЛЛ. По нашим данным, экспрессия WT1 достигла порогового уровня у 13 (42 %) из 31 пациента, в т. ч. у 9 с ОМЛ и 4 с ОЛЛ. После второго курса химиотерапии у 11/31 (35 %) больных нормализация уровня этого молекулярного маркера была зарегистрирована еще у 8 пациентов (5 с ОМЛ, 3 с ОЛЛ). Несмотря на использование высокодозной химиотерапии, ТГСК и таких современных препаратов, как блинатумомаб и гемтузумаб, у 18 (58 %) из 31 больного исход заболевания был неблагоприятным. Среди них было 6 пациентов со сложным кариотипом (СК+) и 2 — с моносомным кариотипом (МК+). В 1 наблюдении имела место комбинация МК+ и СК+, а в другом — МК+ и прогностически неблагоприятная инверсия inv(3)(q21q26).
Заключение. Лечение прогностически неблагоприятных острых лейкозов целесообразно проводить в условиях молекулярного мониторинга. Ген WT1 — наиболее подходящий для этого маркер. Его экспрессия коррелирует с наиболее известными слитными генами, и на молекулярном уровне создаются условия для количественной оценки содержания бластных клеток в анализируемых тканях.
Ключевые слова: острые лейкозы, индукционная химиотерапия, молекулярный мониторинг, ген WT1.
Получено: 18 августа 2017 г.
Принято в печать: 12 ноября 2017 г.
На эффективность препарата большое влияние оказывает скорость его превращения в активную форму и скорость выведения из организма. Различия в этих ферментативных процессах отчасти имеют конституционный характер, являясь результатом генетических особенностей индивидуума. Для опухолей, помимо конституционных факторов, существуют механизмы, свойственные самой опухоли.
К их числу относится усиление или подавление метаболических процессов в клетках опухоли, которое может происходить за счет соматических мутаций, а также различная активность процессов, ответственных за доставку препарата в клетки опухоли, которые определяются степенью ее васкуляризации.
Таким образом, некоторые механизмы устойчивости опухолей к химиотерапевтическим средствам отражают особенности метаболизма и лекарственной устойчивости организма, в то время как другие связаны с самой опухолью.
Индивидуальная чувствительность к лекарственным средствам зависит от конституционных факторов, ответственных за поступление лекарства, распределение его в организме и метаболические изменения до момента его попадания в опухоль. Эффективность этих процессов определяется генети-чески-детерминированными различиями среди индивидуумов.
Эти различия определяют структуру белков, принимающих участие в процессах метаболизма лекарственных препаратов. В основе таких наследственных вариаций в характере метаболизма лекарств лежит фармакогенетика. Для некоторых противоопухолевых препаратов понятны причины их различной эффективности, и генетически-детерминированные различия метаболизма определяют их такие важные характеристики, как противоопухолевая активность или токсичность. Они определяются различными генетическими факторами
За счет мутаций может происходить изменение активности или полная инактивация ферментов, отвечающих за метаболизм лекарства, в результате которого оно превращается в активную форму или распадается. В качестве примера можно привести изменения в метаболизме тамоксифена, при которых полиморфизм фермента CYP2D6, участвующего в обмене цитохрома Р450 в печени, изменяет вероятность развития побочных эффектов и лекарственного взаимодействия.
Часто наблюдается полиморфизм генетических структур, например изменение какого-либо нуклеотида в ДНК, или аминокислоты в белке. Обычно при этом функция меняется незначительно, хотя иногда наступающие изменения важны для клиники.
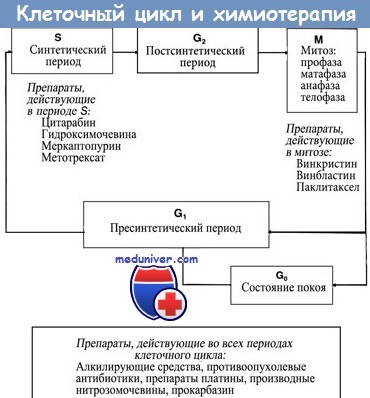
Примеры:
1. Меркаптопурин превращается в неактивную форму при участии фермента ТРМТ (тиопурин метилтрансферазы). Десять процентов населения гетерозиготны по мутантному аллелю, в то время как 0,3% гомозиготны. Мутантный аллель вызывает утрату способности клетки разрушать меркаптопурин (особенно это проявляется у гомозиготных организмов).
В результате возрастает токсичность препарата, однако усиливается его противоопухолевая эффективность.
2. Иринотекан представляет собой ингибитор топоизомеразы I. При участии СУР3А (цитохрома печени) он превращается в неактивную форму, а фермент СЕ (карбоксиэстераза) переводит его в активную форму, которая носит название SN38. Последняя инактивируется в печени под действием глюкоуронилтрансферазы (UGT1).
Полиморфизм промоторного участка UGT1 приводит к снижению метаболизма препарата и к увеличению его токсичности. Аналогичный эффект наблюдается при снижении активности СУР3А.
Приведенные примеры иллюстрируют возможности использования этого подхода в лечении рака. При помощи простых методов генотипирования можно обнаружить полиморфизм, который обусловливает такие результаты лечения цитотоксическими препаратами, как эффективность лечения, чувствительность к острой токсичности препаратов или проявление осложнений после продолжительного лечения (например, развитие вторичных опухолей).
Конечная цель состоит в разработке более индивидуального подхода к лечению больных, чем это удается делать до сих пор.

До начала лечения клетки солидных опухолей проявляют различную чувствительность к лекарственным препаратам. Развивающаяся по мере роста опухоли генетическая нестабильность и образование соматических мутаций обусловливают проявление гетерогенности клеток по их устойчивости к действию химиотерапевтических препаратов. Это частично объясняет лекарственную устойчивость клеток больших опухолей, в которых такие процессы прогрессируют.
По мере роста опухоли частота возникновения устойчивых клеток увеличивается, и таким образом в больших опухолях их содержится много. Эта устойчивость обусловлена существованием одного или нескольких механизмов, перечисленных в таблице, которые рассматриваются ниже. Причиной является генетическая нестабильность, которая приводит к изменениям количества и функций внутриклеточных ферментов или транспортных белков.
Защитные механизмы организма и цитотоксические препараты оказывают на клетки селекционное давление, тем самым способствуя выживаемости устойчивых клеток, которые растут и делятся.
Наряду с перечисленным типом клеточной устойчивости, важную роль играют, по крайней мере, еще два других механизма. Один из них — понижение степени васкуляризации участков опухоли по мере ее роста. Это приводит к гипоксии и к снижению проникновения препарата в опухолевую ткань. Есть основания предполагать, что так же, как при радиотерапии, клеточная гипоксия может определять чувствительность опухоли к цитотоксическим препаратам.
Второй механизм связан с тем, что лишь небольшое количество клеток находится в цикле. Это дает дополнительное время для протекания репарации повреждений до момента вступления клетки в деление.
Успехи последних двух десятилетий в терапии злокачественных заболеваний, особенно острых лейкозов и лимфом у детей, связаны с введением высоко агрессивной программной полихимиотерапии. Детально разработанные программы, включающие адекватную сопроводительную терапию, направленную на борьбу с высокой токсичностью лечения, привели к изменению патоморфоза и течения этих заболеваний: в настоящее время при остром лимфобластном лейкозе выздоравливает 70-75%, при остром миелобластном лейкозе — 40-50% детей, а при неходжкинской лимфоме бессобытийная выживаемость у детей составляет более 75%.
Как показывает анализ причин неэффективности программной полихимиотерапии при острых лейкозах и лимфомах у детей, смерть, связанная с осложнениями агрессивной химиотерапии и неадекватностью сопроводительного лечения, наступает примерно в трети таких случаев, неуспех лечения в остальных обусловлен первичной и вторичной резистентностью опухолевых клеток к химиотерапии.
Таким образом, резистентность опухолевых клеток к химиотерапии является ведущей причиной неэффективности современных методов программного лечения, а преодоление лекарственной резистентности опухолевых клеток — основной резерв повышения результативности терапии, направленной на максимальную санацию организма от опухолевых клеток.
Первичная и вторичная резистентность опухолевых клеток к химиотерапии — процессы многофакторные, сложные, зависящие как от индивидуальных особенностей циторедуктивного действия препаратов, так и от биологических свойств самих опухолевых клеток. Анализ этих процессов необходим для понимания путей и разработки методов преодоления лекарственной резистентности клеток опухоли к терапии.
Для понимания причин лекарственной резистентности опухолевых клеток необходим анализ условий реализации цитотоксического действия химиотерапии.
Условия реализации цитотоксического действия химиопрепаратов:
- Проникновение в клетку.
- Наличие внутриклеточных мишеней для действия препарата.
- Внутриклеточная трансформация в активную форму.
- Достижение адекватной внутриклеточной концентрации.
- Способность клетки к апоптозу.
У каждого цитостатического препарата имеются свои механизмы и приоритеты в реализации киллерной функции.
Целью этого очерка является анализ общих механизмов взаимодействия антилейкемических препаратов с биологическими структурами опухолевых клеток и поиск ключевых моментов этого взаимодействия, нарушения в которых делают невозможным осуществление цитотоксической функции химиотерапии.
Остановимся последовательно на каждом условии реализации цитоксического эффекта.
Проникновение препарата в опухолевую клетку
Существуют следующие механизмы поступления препаратов в опухолевые клетки:
- Пассивная диффузия;
- Использование специфических носителей;
- Использование высокоактинных рецепторов.
Каждый препарат имеет свои приоритетные пути поступления, некоторые пользуются одновременно всеми. Так, Метотрексат (МТХ) использует все вышеперечисленные пути проникновения в клетку. Однако пассивная диффузия выражена в большей степени при создании высокой экстраклеточной концентрации путем введении больших доз МТХ, например, детям с вновь диагностированным В-ОЛЛ.
При использовании средних доз или длительном введении высоких доз преимущественными путями проникновения МТХ в лейкемические клетки является соединение с носителем-фолатом и/или со специфическим рецептором. Снижение активности последних нередко обуславливает резистентность лейкемических клеток к метотрексату в рецидиве ОЛЛ и при манифестации Т-ОЛЛ.
Наличие внутриклеточных мишеней для действия препаратов.
Для реализации цитотоксического действия препарата необходимо наличие в опухолевой клетке мишени для его действия. Так, например, для МТХ такой мишенью является фермент дегидрофолатредуктаза, участвующий в синтезе нуклеотидов и аминокислот, необходимых для образования белка и ДНК. При редукции этого фермента под действием активной формы МТХ опухолевая клетка теряет способность к репарации ДНК и погибает.
Однако в некоторых опухолевых клетках, например, при ОМЛ для репарации ДНК и белка могут использоваться другие метаболические пути, их характеризует низкий уровень фермента дегидрофолатредуктазы, с чем может быть связана резистентность таких клеток к метотрексату.
Некоторые антилейкемические препараты (этопозид, тенипозид, антрациклины, амасакрин, митоксантрон) осуществляют свой цитотоксический эффект через подавление внутриядерных энзимов Топоизомеразы-1 и 2 (Торо-1 и 2). Эти энзимы следят за правильным пространственным расположением ДНК: Торо-1 контролирует начало репликации ДНК, Торо-2 — завершение репликации и окончательное оформление структуры и топологии вновь образованной ДНК. Медикаментозная ингибиция этих энзимов в клетках с их высокой экспрессией ведет к быстрой апоптотической гибели клеток.
Подавление или модуляция активности топоизомераз — частый феномен в лейкемических клетках, особенно в рецидиве заболевания. Теоретически это является основанием для развития резистентности к вышеперечисленным химиопрепаратам. В настоящее время доказана связь резистентности к терапии этопозидом и антрациклинами при ОМЛ с низким содержанием Торо-2 в лейкемических клетках этих больных, подобной корреляции при ОЛЛ и НХЛ получить не удалось.
Внутриклеточная трансформация в активную форму
Многие химиопрепараты для реализации цитотоксического эффекта нуждаются во внутриклеточной активации. Нарушения в этих механизмах обуславливает их неэффективность. Рассмотрим это на нескольких примерах. На рис.3.1 приведены события, превращающие МТХ в активную форму — Метотрексатполиглютамат (MTXPG). Это происходит под действием внутриклеточного фермента фолиополиглютамат синтетазы (FPGS), другой лизосомальный фермент — гаммаглютаматгидролаза (GGH) — обладает противоположным действием, расщепляя MTXPG. Первичная резистентность лейкемических клеток при ОМЛ к МТХ обусловлена сочетанным метаболическим дефектом опухолевых клеток: снижение активности FPGS и повышение активности GGH.

Рисунок 3.1. Внутриклеточная трансформация метотрексата в активную форму: МТХ - метотрексат; MTXPG - метотрексатполиглютамат (активная форма); FPGS - фолиополиглютамат синтетаза (фермент); GGH - гаммаглкламатгидролаза (фермент)
Происхождение вторичной резистентности к метотрексату у лейкемических клеток в рецидиве ОЛЛ другое — резкая активация фермента GGH. Исходя из этих данных, представляется актуальным поиск новых антифолатов, не зависящих в своем действии от дефектов метаболизма метотрексатполиглютамата.
Антагонисты пуриновых оснований (6-меркаптопурин и тиогуанин) также требуют внутриклеточной активации. Этот процесс представлен схематически на рис.3.2.

Рисунок 3.2. Внутриклеточная трансформация 6-MP в активную форму: 6-МР - 6-меркаптопурин; HGPRT - гипоксантил гуанин фосфорибозил трансфераза (фермент)
Перевод 6-МР и тиогуанина в активную форму происходит под действием внутриклеточного фермента гипоксантил-гуанин-фосфорибозилтрансфераза (HGPRT), ингибируют этот переход ферменты: фосфатазы и 5-нуклеотидаза.
Резистентность к 6-МР при ОАЛ связана с высокой активностью внутриклеточных ферментов 5-нуклеотидазы и фосфатазы, но не с понижением активности HGPRT.
Достижение адекватной внутриклеточной концентрации
К таким белкам относятся: Р-гликопротеин (P-gp), раньше и лучше всех изученный транспортный белок белок множественной лекарственной резистентности (MRP); белок легочной резистентности (LRP), впервые выделенный из клеточных линий немелкоклеточного рака легкого, не содержащих P-gp и MRP. При исследованиях, проведенных на клеточных линиях, было показано, что синтез этих белков кодируется соответсвующими генами: P-gp является продуктом MDR-1-гена, локализованного на 7 хромосоме, гены кодирующие MRP и LRP, располагаются на 16 хромосоме, в регионах р13.1 и р11.2 соответственно.
Были разработаны способы молекулярно-генетического определения содержания белков лекарственной резистентности, позволившие изучать и модулировать их активность. Так, были идентифицированы препараты, способные блокировать активность белков лекарственной резистентности и повышать внутриклеточную концентрацию цитостатиков, они получили название "хемосинтетайзеры". В таблице 3.2 перечислены основные хемосинтетайзеры, используемые для блокирования тех или иных транспортных белков.
Таблица 3.2. Хемосинтетайзеры

Из приведенных в табл. 3.2 препаратов только первые два (Циклоспорин-А и Вероапамил) находят пока клиническое применение. Использовать хомосинтетайзеры в клинике следует с большой осторожностью, т.к. функция рассмотренных выше транспортных белков является общебиологическим феноменом, они экспрессированы в норме во многих клеточных системах, участвующих в выведении токсических продуктов из организма (клетки печени, почек, кишечного эпителия и др.), подавление их активности в этих системах может явиться серьезным осложнением такой терапии.
Многочисленные данные о структуре и функции белков MDR получены, в основном, в эксперименте, сведения об их роли в формировании первичной и вторичной рефрактерности к терапии лейкозов и лимфом в клинике, особенно у детей, немногочисленны и противоречивы. Особого внимания заслуживает публикация кооперативного исследования отдела детской гематологии/онкологии Университетского госпиталя Врийе (Нидерланды), группы COALL (Гамбург, Германия), группы ALL-Rez BFM (Берлин, Германия), группы AML-BFM (Мюнстер, Германия).
Было изучено клиническое и прогностическое значение экспрессии P-gp, MRP и LRP у 141 ребенка с ОЛЛ и 27 детей с ОМЛ. Сравнивали внутриклеточное содержание этих белков в острой фазе и рецидиве, при разных формах острого лейкоза, изучали его корреляцию с клиническими факторами риска и тестом цитотоксичности ex vivo. Проведенные исследования убедительно доказывают отсутствие значения белков P-gp и MRP в развитии лекарственной резистентности при острых лейкозах у детей.
Белок LRP, по-видимому, участвует в формировании некоторых форм лекарственной резистентности у детей: его экспрессия была выше при ОМЛ, по сравнению с ОЛЛ, в рецидивах выше, чем в острой фазе; была выявлена значимая обратная корреляционная связь с чувствительностью к даунорубицину.
Таким образом, исследования последнего времени позволяют считать несколько преувеличенной установленную ранее в эксперименте роль белков MDR в формировании лекарственной резистентности, по крайней мере, при острых лейкозах у детей.
Способность клеток к апоптозу
Реализация циторедуктивного эффекта химиотерапевтических средств, независимо от конкретных механизмов их действия, происходит чаще всего через активацию в опухолевых клеток программы апоптоза.
С этой точки зрения, резистентность опухолевых клеток к терапии может быть следствием двух процессов: неспособности химиопрепарата запустить программу апоптоза (недостаточная внутриклеточная концентрация активной формы препарата и/или отсутствие внутриклеточных мишеней, воспринимающих действие препарата и включающих программу апоптоза) и нарушения в механизмах апоптоза в опухолевых клетках.
Апоптоз — это физиологическая клеточная смерть, происходящая путем самопереваривания. Программа апоптоза может быть включена множеством внешних и внутренних сигналов и направлена на освобождение от старых или наработанных в излишке клеток.
Способность к спонтанному апоптозу лейкемических клеток ex vivo коррелирует с их лекарственной чувствительностью.
Определение уровня способности к спонтанному апоптозу лейкемических клеток при ОМЛ является хорошим тестом чувствительности клеток к химиотерапии.
Как показали исследования последних лет, противоопухолевые химиопрепараты включают апоптоз, в основном, через две сигнальные системы: ген Р-53 и FAS-R/TNF.
Антиметаболиты (6-меркаптопурин, метотрексат) и химиопрепараты, мишенью для действия которых являются топоизомеразы (этопозид, тенипозид) вызывают апоптоз опухолевых клеток через активацию Р-53.
Однако повреждение ДНК цитотоксическими агентами может найти свою реализацию и в обход Р53 гена (см.рис 3.3).

Рисунок 3.3. Схематический путь апоптоза при повреждении ДНК
Дело в том, что повреждение ДНК цитотоксическими агентами вызывает активацию атаксия-телеангиоэктазия-мутировавшего протеина (ATM), у которого имеется 3 мишени действия, ген Р53 только одна из них. Две другие (продукты онкогенов с-аbl и chk-1) ответственны за остановку клеток в фазах G1 и G2 с возможной последующей репарацией повреждения ДНК. Компоненты активации этих путей рассматриваются как возможные мишени для разработки новых лекарственных средств, усиливающих противоопухолевую активность агентов, повреждающих ДНК.
Как представлено на схеме (см.рис.3.3), при прохождении сигнала повреждения ДНК только ген Р53 отвечает за развития апоптоза.
В процессе опухолевой трансформации нередко происходит мутация в гене Р-53, отменяющая его проапоптотическую функцию. Обычно эта мутация сопровождается делецией 17р хромосомы, где картирован ген Р-53. Такая трансформация делает опухолевую клетку невосприимчивой к ДНК-токсическим препаратам. Мутация Р-53 гена чаще наблюдается в солидных опухолях (рак толстой кишки, простаты), реже при лейкозах и лимфомах, но всегда сопровождается лекарственной резистентностью и характеризуется плохим прогнозом.
Так, при исследовании 330 детей с ОЛЛ мутация в Р-53 была обнаружена при постановке диагноза всего у 10 детей (
В настоящее время онкологи исходят из концепции, что только раннее выявление злокачественной опухоли и ее адекватное лечение обеспечивают стойкий и длительный клинический эффект. Практика онкологической службы показала, что только диспансерный метод, являющийся достижением отечественного здравоохран.
Общеизвестно, что дистантное распространение по лимфатическим и кровеносным сосудам (метастазирование) — это высшее выражение автономности опухоли, главный отличительный признак злокачественного процесса и наиболее частая причина смерти больных. Способность к метастазированию позволяет опухо.
Морфологическое исследование опухоли играет ведущую роль в определении прогноза и выборе оптимальной тактики лечения онкологического больного. Патоморфолог информирует клинициста о характере опухопи (доброкачественная или злокачественная), ее гистологической принадлежности, степени дифференц.
Цитологический метод, основанный на микроскопическом изучении и оценке клеточного материала, полученного различным способом из патологического очага, является ветвью онкоморфологии. Цель цитологического исследования — установить правильный диагноз злокачественных опухолей любой локализации и в любой.
Химиотерапия обычно применяется как метод лечения первично-распространенных форм, рецидивов и метастазов злокачественных опухолей. Наряду с этим она может проводиться в дополнение к локальному лечению опухоли (удаление, облучение) вне зависимости от его радикальности. Подобная химиотерапия, .
Хирургический метод лечения злокачественных опухолей остается доминирующим, хотя его отдаленные результаты можно считать удовлетворительными лишь в I-II стадии заболевания, а в остальных — операция рассматривается как обязательный компонент специального лечения. Совершенствование хирургической техни.
Низкодозовое применение уже известного химиотерапевтического препарата, в обычных протоколах угнетающего иммунитет, помогло иммунным клеткам бороться с раком, а также получить ответ у больных с резистентностью к лечению.
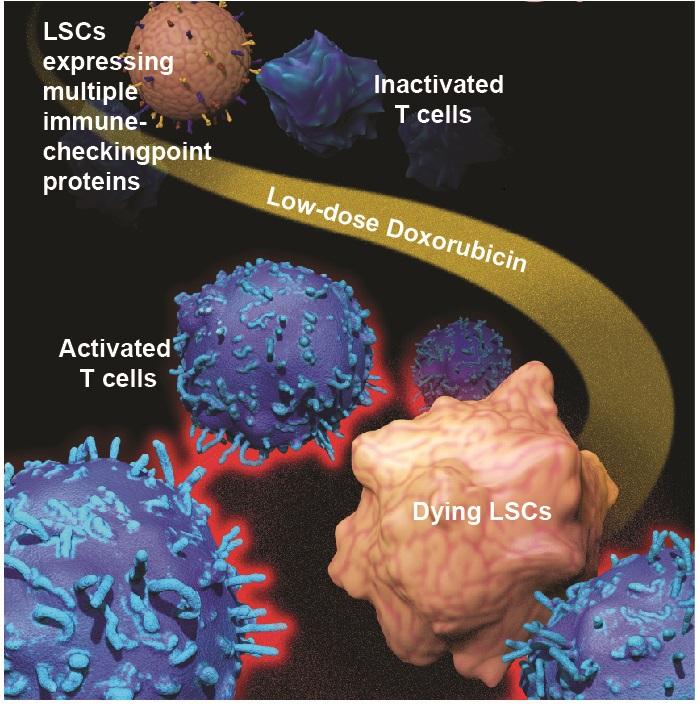
Исследователи из нескольких университетских и медицинских учреждений США в своей работе, опубликованной в издании Nature Cell Biology, сообщают о новой многообещающей стратегии преодоления лекарственной устойчивости при лейкемии и, вероятно, других злокачественных заболеваниях. Их стратегия основана на использовании целевых доз широко используемых химиотерапевтических препаратов антрациклинового ряда.
Вначале ученые обратили внимание на то, что протеинкиназа Akt может усиливать передачу сигналов Wnt посредством фосфорилирования бетакатенина. Это способствовало онкогенезу в кишечнике. Исследовав связанные пути Wnt/бетакатенин и PI3K/Akt в кроветворной системе на мышах с генетическими модификациями этих путей, ученые обнаружили, как они взаимодействуют. Оказалось, они стимулируют обновление стволовых клеток, что приводит к избыточной продукции кроветворных стволовых клеток. Постоянная активация путей вызывала у мышей развитие лейкемии как побочный эффект.
Целью ученых был поиск такого препарата, который сможет блокировать взаимодействие между Wnt/бетакатенином и PI3K/Akt и при этом не быть чрезмерно токсичным. Для этого они рассмотрели библиотеку уже существующих препаратов, чтобы определить, как их можно направить на несколько измененную задачу.
Скрининг показал, что доксорубицин наилучшим образом подавляет взаимодействие между двумя путями. Его ингибирующие свойства при низких дозах имеют преимущество по сравнению с высокодозовым применением в качестве химиотерапевтического препарата, при котором он может вызвать серьезное повреждение сердца.
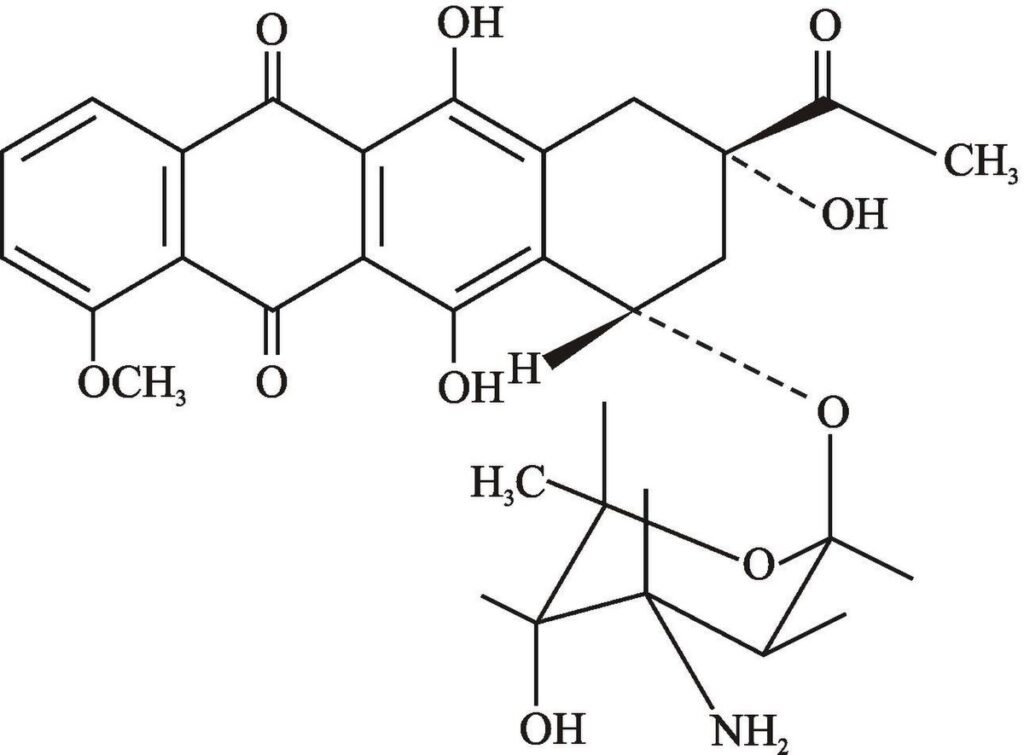
Даунорубицин (структурная формула)
В последующем клиническом тестировании на взрослых людях, устойчивых к лечению острого миелобластного лейкоза, половине больных помог низкодозовый даунорубицин (химиопрепарат того же класса, что и доксорубицин). У них был ответ на лечение и уменьшение количества стволовых клеток лейкемии, имеющих активированный Akt биомаркер бетакатенина.
Кроме прочего, ученым удалось узнать больше о механизме, который обеспечивает раковым клеткам возможность уклоняться от иммунного ответа. Они обнаружили, что стволовые клетки лейкемии экспрессируют множество белков, известных как иммунные контрольные точки, отключающие иммунный ответ, который в противном случае распознал и устранил бы стволовые клетки лейкемии. Кроме того, бетакатенин связывается с несколькими локусами гена иммунной контрольной точки. Обработка низкими дозами доксорубицина снижала экспрессию этих иммунных контрольных точек, включая PD-L1, TIM3 и CD24.
Дальнейшие исследования команды направлены на тестирование аналогичных стратегий для преодоления устойчивости к терапии таких видов рака, как рак молочной железы, толстой кишки и глиобластома.
Отделение кардиологии и кардиохирургии
Отделение пластической хирургии
Лечение псориаза на Мертвом море
Лечение радиоактивным йодом
Отделение внутренних болезней
CHECK-UP в Израиле
Передовые методы лечения
Ученые выявили новый способ преодоления резистентности к химиотерапии при остром миелоидном лейкозе. Если прорыв в лаборатории будет переведен в клинические исследования, это может значительно улучшить перспективы выживания людей с редким раком крови.
Исследователи из Оттавской больницы и Университета Оттавы, как в Канаде, видели, что отсутствие белка, называемого MTF2, помогает изменять экспрессию генов в ядре миелоидной лейкемии (ОМЛ) таким образом, что они будут развивать устойчивость к химиотерапии.

MTF2-дефицитные ОМЛ-клетки, считают ученые, сверхэкспрессируют ген, способствующий развитию рака, называемый MDM2. Он блокирует белок-супрессор опухоли p53 и нарушает процесс клеточного цикла, который приводит к их гибели, когда химиотерапия повреждает клетки.
Отчет об исследовании - вместе с подробным описанием механизмов, лежащих в основе основных механизмов экспрессии генов, - теперь присутствует в журнале Cancer Discovery.
ОМЛ - это рак крови, который начинается в костном мозге, где организм создает новые клетки крови. Рак вскоре распространяется в кровоток. В некоторых случаях он может распространяться и на другие части тела, такие как печень, селезенка, лимфатическая система, яички, мозг и спинной мозг.
Хотя редко, ОМЛ является наиболее распространенным раком крови у взрослых. Обычно он наступает после 45 лет, но также может появляться у молодых людей, включая детей. Средний риск развития в течение жизни в Соединенных Штатах составляет около 0,5 процента.
По данным Американского онкологического общества (ACS), в 2018 году в США будет зарегистрировано около 19 520 новых случаев заболевания ОМЛ и около 10 670 смертей от этой болезни.
Преодоление резистентности к химиотерапии является серьезной проблемой в лечении ОМЛ. Большинство людей, которые умирают из-за хеморезистентности. Около трети людей вообще не реагируют, тогда как 40-50 процентов могут ответить сначала, но затем их рак возвращается.
В предыдущей работе профессор Стэнфорд и его команда обнаружили, что MTF2 играет важную роль в создании крови. Они создали это новое исследование, чтобы изучить роль белка в раке.
MTF2 помогает блокировать ген, способствующий развитию рака
Сначала они подумали об использовании MTF2 в качестве биомаркера для определения того, какие люди с ОМЛ могут извлечь наибольшую пользу из экспериментальных методов лечения.
Затем они углубились в активность MTF2 и обнаружили, что белок изменил экспрессию гена, позволив размещать химические метки рядом с геном MDM2, способствующим раку. Эти метки уменьшают экспрессию гена.
Когда группа открыла клетки ОМЛ с нормальной активностью MTF2 для химиотерапии, они испытали нормальную судьбу поврежденных клеток: тип запрограммированной гибели клеток, называемый апоптозом. Это связано с тем, что наличие MTF2 позволило химическому тегу, который ингибирует MDM2.
Тем не менее, клетки ОМЛ с низкой активностью MTF2 не имели возможности размещать метки вблизи MDM2 и уменьшать его экспрессию. Поэтому они не вошли в путь смерти клеток и продолжали жить и делиться, даже когда команда подвергала их воздействию большого количества химиотерапии.
Исследователи затем тестировали препараты, которые блокируют MDM2 на мышиных моделях ОМЛ. Они разработали модели с использованием химиорезистентных клеток ОМЛ у людей.
Все мыши, которые получали как блокаторы MDM2, так и химиотерапию, пережили 4-месячное исследование, тогда как те, которые получали только химиотерапию - умерли.
Соавтор исследования доктор Кэрин Я. Ито, старший следователь больницы Оттавы, говорит, что они очень воодушевлены доклиническими данными из исследования на животных.
До сих пор много работы, например, поиск подходящих лекарств для испытания и разработка теста для выявления пациентов, которые, скорее всего, будут реагировать на экспериментальное лечение.

Гематология в Израиле в больнице Асаф-ха-Рофэ занимается лечением анемии, нарушений свертываемости крови, всех видов рака крови, детской гематологии и других болезней кровеносной системы
Хронический миелолейкоз: симптомы, причины и факторы риска, прогноз заболевания, диагностика и лечение (целевая терапия, цитостатическое лечение, трансплантация костного мозга).

Лечение лейкоза в Израиле в одной лучших клиник Израиля проходит под контролем специалистов - онкологов и с помощью новых препаратов.

На лечение лимфомы в Израиле цену узнайте в клинике Асаф-ха-Рофэ. Направьте диагностические документы для составления терапевтического протокола и определения стоимости.
Для связи с медицинским консультантом заполните форму:
Отправляя форму Вы соглашаетесь с политикой конфиденциальности
Читайте также:

