Резистентность что это в онкологии
Появление новых антимикробных средств и рекомбинантных ростовых кроветворных факторов, организация специализированной амбулаторной помощи, широкое использование отделений реанимации и современных методов трансфузионной терапии существенно повысили эффективность симптоматического лечения онкологических больных. В этих условиях едва ли не единственным серьезным препятствием для улучшения результатов лечения остается устойчивость опухолевых клеток к цитостатикам .
Лекарственная устойчивость бывает двух типов: первичная (возникшая спонтанно) и вторичная (приобретенная в процессе химиотерапии).
Первично-резистентные опухолевые клетки не чувствительны к химиотерапии с самого начала. К сожалению, первичной устойчивостью к цитостатикам обладают многие из распространенных солидных опухолей .
Вторичная устойчивость возникает в ходе химиотерапии изначально чувствительных к ней опухолей. Именно из-за нее лишь малая часть таких опухолей излечивается с помощью одной только химиотерапии.
Механизмы возникновения устойчивых клонов внутри большой популяции клеток были впервые изучены на бактериях Дельбрюком и Лурией. Позже Лоу, а затем Гоулди и Коулдмен исследовали их на опухолевых клетках.
Дельбрюк и Лурия обнаружили, что популяции бактерий неоднородны по своей чувствительности к бактериофагам, и показали, что устойчивые бактерии появляются в результате спонтанных мутаций. Развитие устойчивости зависело от частоты мутаций и численности популяции. Те же закономерности лежат в основе развития резистентности к химиотерапии.
Важнейшее свойство опухолевых клеток - нестабильность генома. Пока из одной трансформированной клетки получится 10 в степени 9 клеток (что соответствует клинически выявляемой опухоли объемом 1 куб. см, спонтанные мутации сделают эту популяцию гетерогенной. При этом некоторые из мутантных клеток по воле случая станут устойчивыми к противоопухолевым средствам. Химиотерапия устранит большую часть чувствительных клеток, но не остановит роста резистентных субклонов.
Эта последовательность событий воспроизводится в клинике: сначала опухоль поддается химиотерапии, и наступает полная или частичная ремиссия, но в дальнейшем развивается рецидив, и рецидивная опухоль оказывается резистентной к химиотерапии.
Чтобы извлечь из химиотерапии максимальную пользу, надо придерживаться следующих правил.
- Наиболее чувствительны к химиотерапии маленькие опухоли, в которых еще не появились субклоны резистентных клеток.
- Химиотерапевтические схемы, не эффективные сами по себе при массивных опухолях, могут способствовать излечению, если используются как адъювантные .
- При полихимиотерапии следует использовать препараты, к которым не возникает перекрестной устойчивости. Вероятность того, что одновременно произойдут две мутации, делающие опухолевую клетку устойчивой к двум группам цитостатиков, очень мала, так как она равна произведению вероятностей каждой из мутаций. Поэтому чем больше используется препаратов, к которым нет перекрестной устойчивости, тем выше шанс уничтожить всю популяцию опухолевых клеток.
При всей своей неоспоримой ценности полихимиотерапия имеет ограничения. Многие противоопухолевые средства, в частности алкилирующие средства , антрациклины и эпиподофиллотоксины , обладают мутагенными свойствами и сами способствуют появлению резистентных субклонов опухолевых клеток. Более того, устойчивость, возникшая к одной группе цитостатиков, может распространиться и на другие препараты, отличающиеся по структуре и механизму действия.
На эффективность препарата большое влияние оказывает скорость его превращения в активную форму и скорость выведения из организма. Различия в этих ферментативных процессах отчасти имеют конституционный характер, являясь результатом генетических особенностей индивидуума. Для опухолей, помимо конституционных факторов, существуют механизмы, свойственные самой опухоли.
К их числу относится усиление или подавление метаболических процессов в клетках опухоли, которое может происходить за счет соматических мутаций, а также различная активность процессов, ответственных за доставку препарата в клетки опухоли, которые определяются степенью ее васкуляризации.
Таким образом, некоторые механизмы устойчивости опухолей к химиотерапевтическим средствам отражают особенности метаболизма и лекарственной устойчивости организма, в то время как другие связаны с самой опухолью.
Индивидуальная чувствительность к лекарственным средствам зависит от конституционных факторов, ответственных за поступление лекарства, распределение его в организме и метаболические изменения до момента его попадания в опухоль. Эффективность этих процессов определяется генети-чески-детерминированными различиями среди индивидуумов.
Эти различия определяют структуру белков, принимающих участие в процессах метаболизма лекарственных препаратов. В основе таких наследственных вариаций в характере метаболизма лекарств лежит фармакогенетика. Для некоторых противоопухолевых препаратов понятны причины их различной эффективности, и генетически-детерминированные различия метаболизма определяют их такие важные характеристики, как противоопухолевая активность или токсичность. Они определяются различными генетическими факторами
За счет мутаций может происходить изменение активности или полная инактивация ферментов, отвечающих за метаболизм лекарства, в результате которого оно превращается в активную форму или распадается. В качестве примера можно привести изменения в метаболизме тамоксифена, при которых полиморфизм фермента CYP2D6, участвующего в обмене цитохрома Р450 в печени, изменяет вероятность развития побочных эффектов и лекарственного взаимодействия.
Часто наблюдается полиморфизм генетических структур, например изменение какого-либо нуклеотида в ДНК, или аминокислоты в белке. Обычно при этом функция меняется незначительно, хотя иногда наступающие изменения важны для клиники.
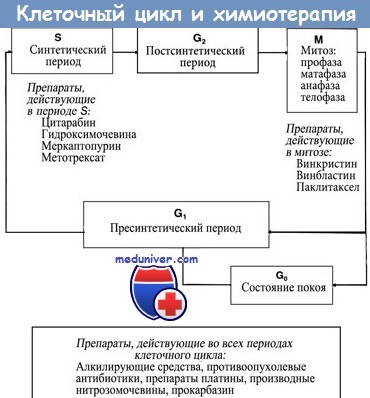
Примеры:
1. Меркаптопурин превращается в неактивную форму при участии фермента ТРМТ (тиопурин метилтрансферазы). Десять процентов населения гетерозиготны по мутантному аллелю, в то время как 0,3% гомозиготны. Мутантный аллель вызывает утрату способности клетки разрушать меркаптопурин (особенно это проявляется у гомозиготных организмов).
В результате возрастает токсичность препарата, однако усиливается его противоопухолевая эффективность.
2. Иринотекан представляет собой ингибитор топоизомеразы I. При участии СУР3А (цитохрома печени) он превращается в неактивную форму, а фермент СЕ (карбоксиэстераза) переводит его в активную форму, которая носит название SN38. Последняя инактивируется в печени под действием глюкоуронилтрансферазы (UGT1).
Полиморфизм промоторного участка UGT1 приводит к снижению метаболизма препарата и к увеличению его токсичности. Аналогичный эффект наблюдается при снижении активности СУР3А.
Приведенные примеры иллюстрируют возможности использования этого подхода в лечении рака. При помощи простых методов генотипирования можно обнаружить полиморфизм, который обусловливает такие результаты лечения цитотоксическими препаратами, как эффективность лечения, чувствительность к острой токсичности препаратов или проявление осложнений после продолжительного лечения (например, развитие вторичных опухолей).
Конечная цель состоит в разработке более индивидуального подхода к лечению больных, чем это удается делать до сих пор.

До начала лечения клетки солидных опухолей проявляют различную чувствительность к лекарственным препаратам. Развивающаяся по мере роста опухоли генетическая нестабильность и образование соматических мутаций обусловливают проявление гетерогенности клеток по их устойчивости к действию химиотерапевтических препаратов. Это частично объясняет лекарственную устойчивость клеток больших опухолей, в которых такие процессы прогрессируют.
По мере роста опухоли частота возникновения устойчивых клеток увеличивается, и таким образом в больших опухолях их содержится много. Эта устойчивость обусловлена существованием одного или нескольких механизмов, перечисленных в таблице, которые рассматриваются ниже. Причиной является генетическая нестабильность, которая приводит к изменениям количества и функций внутриклеточных ферментов или транспортных белков.
Защитные механизмы организма и цитотоксические препараты оказывают на клетки селекционное давление, тем самым способствуя выживаемости устойчивых клеток, которые растут и делятся.
Наряду с перечисленным типом клеточной устойчивости, важную роль играют, по крайней мере, еще два других механизма. Один из них — понижение степени васкуляризации участков опухоли по мере ее роста. Это приводит к гипоксии и к снижению проникновения препарата в опухолевую ткань. Есть основания предполагать, что так же, как при радиотерапии, клеточная гипоксия может определять чувствительность опухоли к цитотоксическим препаратам.
Второй механизм связан с тем, что лишь небольшое количество клеток находится в цикле. Это дает дополнительное время для протекания репарации повреждений до момента вступления клетки в деление.

Прорывное исследование, результаты которого были недавно опубликованы в научном журнале Science, показало, что раковые клетки могут активировать альтернативные пути копирования ДНК, чтобы стать устойчивыми к противоопухолевым препаратам. Этот процесс называется мутагенезом. Бактерии также его используют, чтобы выработать устойчивость к антибиотикам.
Проблема резистентности рака
Ученым давно известно, что раковые клетки вырабатывают резистентность (устойчивость) к терапии в результате мутаций. Но пока непонятно, какие механизмы приводят к этим мутациям, и можно ли на них повлиять.
Команда ученых из Института медицинских исследований Гарвана (Garvan Institute of Medical Research, Австралия) во главе с профессором Дэвидом Томасом (David Thomas) проанализировала образцы опухолевой ткани, полученные от пациентов до и после курса таргетной терапии.
Исследователи были удивлены, когда увидели, что в опухолевых клетках после применения таргетных препаратов резко увеличился уровень повреждения ДНК, даже в случаях, когда ее не повреждал сам препарат. Было проведено секвенирование ДНК раковых клеток, чтобы оценить, как лечение привело к ускоренной эволюции генома опухолевой ткани.
Первый автор исследования, Аркади Сиппони (Arcadi Cipponi) отмечает:
Наши исследования показали, что в раковых клетках, подвергшихся воздействию таргетных препаратов, происходит мутагенез. Они генерируют случайные генетические вариации с гораздо большей скоростью, чем раковые клетки, не подвергшиеся воздействию таргетных препаратов. Этот же механизм используют бактерии, когда оказываются в стрессовых условиях.
Рак использует двухступенчатую стратегию
Доктор Сиппони объясняет:
MTOR является сенсорным белком, он сигнализирует нормальным клеткам о том, что они оказались в стрессовых условиях, и им нужно прекратить расти. Мы обнаружили, что во время противоопухолевой терапии сигналы MTOR способствуют тому, что в раковых клетках меняется экспрессия (активность) генов, кодирующих белки, которые копируют и восстанавливают ДНК. Например, активируются ферменты, которые копируют ДНК и при этом часто совершают ошибки. этого в генах опухолевых клеток происходит большое количество изменений, благодаря чему и развивается резистентность к противоопухолевым препаратам.
Не менее интересен и тот факт, что такие реакции со стороны опухолевой ткани носят временный характер. Как только развивается устойчивость к препаратам, копирование ДНК снова становится точным, и генетические изменения перестают накапливаться в таком большом количестве.
Новые подходы к лечению онкологических заболеваний
Авторы исследования считают, что можно повысить эффективность лечения рака, если сочетать традиционную таргетную терапию с препаратами, влияющими на репарацию ДНК. Ученые проверили свое предположение на мышах с раком поджелудочной железы. Животным вводили два препарата:
- Палбоциклиб — блокирует ферменты циклинзависимые киназы, которые активируют размножение клеток.
- Рукапариб (Рубрака) — блокирует фермент PARP, который восстанавливает поврежденную ДНК.
В течение 30 дней терапии этой комбинацией рост злокачественной опухоли удалось затормозить на 60% эффективнее, чем при использовании только палбоциклиба.
В Европейской клинике есть все противоопухолевые препараты, зарегистрированные в России. Если пациенту перестали помогать химиопрепараты, которые были эффективны ранее, врач сможет подобрать другую схему в соответствии с последними версиями международных протоколов лечения. В самых сложных случаях, когда исчерпаны все возможности в рамках современных протоколов и рекомендаций, в Европейской клинике можно провести анализ и подобрать персонализированную терапию.
Успехи последних двух десятилетий в терапии злокачественных заболеваний, особенно острых лейкозов и лимфом у детей, связаны с введением высоко агрессивной программной полихимиотерапии. Детально разработанные программы, включающие адекватную сопроводительную терапию, направленную на борьбу с высокой токсичностью лечения, привели к изменению патоморфоза и течения этих заболеваний: в настоящее время при остром лимфобластном лейкозе выздоравливает 70-75%, при остром миелобластном лейкозе — 40-50% детей, а при неходжкинской лимфоме бессобытийная выживаемость у детей составляет более 75%.
Как показывает анализ причин неэффективности программной полихимиотерапии при острых лейкозах и лимфомах у детей, смерть, связанная с осложнениями агрессивной химиотерапии и неадекватностью сопроводительного лечения, наступает примерно в трети таких случаев, неуспех лечения в остальных обусловлен первичной и вторичной резистентностью опухолевых клеток к химиотерапии.
Таким образом, резистентность опухолевых клеток к химиотерапии является ведущей причиной неэффективности современных методов программного лечения, а преодоление лекарственной резистентности опухолевых клеток — основной резерв повышения результативности терапии, направленной на максимальную санацию организма от опухолевых клеток.
Первичная и вторичная резистентность опухолевых клеток к химиотерапии — процессы многофакторные, сложные, зависящие как от индивидуальных особенностей циторедуктивного действия препаратов, так и от биологических свойств самих опухолевых клеток. Анализ этих процессов необходим для понимания путей и разработки методов преодоления лекарственной резистентности клеток опухоли к терапии.
Для понимания причин лекарственной резистентности опухолевых клеток необходим анализ условий реализации цитотоксического действия химиотерапии.
Условия реализации цитотоксического действия химиопрепаратов:
- Проникновение в клетку.
- Наличие внутриклеточных мишеней для действия препарата.
- Внутриклеточная трансформация в активную форму.
- Достижение адекватной внутриклеточной концентрации.
- Способность клетки к апоптозу.
У каждого цитостатического препарата имеются свои механизмы и приоритеты в реализации киллерной функции.
Целью этого очерка является анализ общих механизмов взаимодействия антилейкемических препаратов с биологическими структурами опухолевых клеток и поиск ключевых моментов этого взаимодействия, нарушения в которых делают невозможным осуществление цитотоксической функции химиотерапии.
Остановимся последовательно на каждом условии реализации цитоксического эффекта.
Проникновение препарата в опухолевую клетку
Существуют следующие механизмы поступления препаратов в опухолевые клетки:
- Пассивная диффузия;
- Использование специфических носителей;
- Использование высокоактинных рецепторов.
Каждый препарат имеет свои приоритетные пути поступления, некоторые пользуются одновременно всеми. Так, Метотрексат (МТХ) использует все вышеперечисленные пути проникновения в клетку. Однако пассивная диффузия выражена в большей степени при создании высокой экстраклеточной концентрации путем введении больших доз МТХ, например, детям с вновь диагностированным В-ОЛЛ.
При использовании средних доз или длительном введении высоких доз преимущественными путями проникновения МТХ в лейкемические клетки является соединение с носителем-фолатом и/или со специфическим рецептором. Снижение активности последних нередко обуславливает резистентность лейкемических клеток к метотрексату в рецидиве ОЛЛ и при манифестации Т-ОЛЛ.
Наличие внутриклеточных мишеней для действия препаратов.
Для реализации цитотоксического действия препарата необходимо наличие в опухолевой клетке мишени для его действия. Так, например, для МТХ такой мишенью является фермент дегидрофолатредуктаза, участвующий в синтезе нуклеотидов и аминокислот, необходимых для образования белка и ДНК. При редукции этого фермента под действием активной формы МТХ опухолевая клетка теряет способность к репарации ДНК и погибает.
Однако в некоторых опухолевых клетках, например, при ОМЛ для репарации ДНК и белка могут использоваться другие метаболические пути, их характеризует низкий уровень фермента дегидрофолатредуктазы, с чем может быть связана резистентность таких клеток к метотрексату.
Некоторые антилейкемические препараты (этопозид, тенипозид, антрациклины, амасакрин, митоксантрон) осуществляют свой цитотоксический эффект через подавление внутриядерных энзимов Топоизомеразы-1 и 2 (Торо-1 и 2). Эти энзимы следят за правильным пространственным расположением ДНК: Торо-1 контролирует начало репликации ДНК, Торо-2 — завершение репликации и окончательное оформление структуры и топологии вновь образованной ДНК. Медикаментозная ингибиция этих энзимов в клетках с их высокой экспрессией ведет к быстрой апоптотической гибели клеток.
Подавление или модуляция активности топоизомераз — частый феномен в лейкемических клетках, особенно в рецидиве заболевания. Теоретически это является основанием для развития резистентности к вышеперечисленным химиопрепаратам. В настоящее время доказана связь резистентности к терапии этопозидом и антрациклинами при ОМЛ с низким содержанием Торо-2 в лейкемических клетках этих больных, подобной корреляции при ОЛЛ и НХЛ получить не удалось.
Внутриклеточная трансформация в активную форму
Многие химиопрепараты для реализации цитотоксического эффекта нуждаются во внутриклеточной активации. Нарушения в этих механизмах обуславливает их неэффективность. Рассмотрим это на нескольких примерах. На рис.3.1 приведены события, превращающие МТХ в активную форму — Метотрексатполиглютамат (MTXPG). Это происходит под действием внутриклеточного фермента фолиополиглютамат синтетазы (FPGS), другой лизосомальный фермент — гаммаглютаматгидролаза (GGH) — обладает противоположным действием, расщепляя MTXPG. Первичная резистентность лейкемических клеток при ОМЛ к МТХ обусловлена сочетанным метаболическим дефектом опухолевых клеток: снижение активности FPGS и повышение активности GGH.

Рисунок 3.1. Внутриклеточная трансформация метотрексата в активную форму: МТХ - метотрексат; MTXPG - метотрексатполиглютамат (активная форма); FPGS - фолиополиглютамат синтетаза (фермент); GGH - гаммаглкламатгидролаза (фермент)
Происхождение вторичной резистентности к метотрексату у лейкемических клеток в рецидиве ОЛЛ другое — резкая активация фермента GGH. Исходя из этих данных, представляется актуальным поиск новых антифолатов, не зависящих в своем действии от дефектов метаболизма метотрексатполиглютамата.
Антагонисты пуриновых оснований (6-меркаптопурин и тиогуанин) также требуют внутриклеточной активации. Этот процесс представлен схематически на рис.3.2.

Рисунок 3.2. Внутриклеточная трансформация 6-MP в активную форму: 6-МР - 6-меркаптопурин; HGPRT - гипоксантил гуанин фосфорибозил трансфераза (фермент)
Перевод 6-МР и тиогуанина в активную форму происходит под действием внутриклеточного фермента гипоксантил-гуанин-фосфорибозилтрансфераза (HGPRT), ингибируют этот переход ферменты: фосфатазы и 5-нуклеотидаза.
Резистентность к 6-МР при ОАЛ связана с высокой активностью внутриклеточных ферментов 5-нуклеотидазы и фосфатазы, но не с понижением активности HGPRT.
Достижение адекватной внутриклеточной концентрации
К таким белкам относятся: Р-гликопротеин (P-gp), раньше и лучше всех изученный транспортный белок белок множественной лекарственной резистентности (MRP); белок легочной резистентности (LRP), впервые выделенный из клеточных линий немелкоклеточного рака легкого, не содержащих P-gp и MRP. При исследованиях, проведенных на клеточных линиях, было показано, что синтез этих белков кодируется соответсвующими генами: P-gp является продуктом MDR-1-гена, локализованного на 7 хромосоме, гены кодирующие MRP и LRP, располагаются на 16 хромосоме, в регионах р13.1 и р11.2 соответственно.
Были разработаны способы молекулярно-генетического определения содержания белков лекарственной резистентности, позволившие изучать и модулировать их активность. Так, были идентифицированы препараты, способные блокировать активность белков лекарственной резистентности и повышать внутриклеточную концентрацию цитостатиков, они получили название "хемосинтетайзеры". В таблице 3.2 перечислены основные хемосинтетайзеры, используемые для блокирования тех или иных транспортных белков.
Таблица 3.2. Хемосинтетайзеры

Из приведенных в табл. 3.2 препаратов только первые два (Циклоспорин-А и Вероапамил) находят пока клиническое применение. Использовать хомосинтетайзеры в клинике следует с большой осторожностью, т.к. функция рассмотренных выше транспортных белков является общебиологическим феноменом, они экспрессированы в норме во многих клеточных системах, участвующих в выведении токсических продуктов из организма (клетки печени, почек, кишечного эпителия и др.), подавление их активности в этих системах может явиться серьезным осложнением такой терапии.
Многочисленные данные о структуре и функции белков MDR получены, в основном, в эксперименте, сведения об их роли в формировании первичной и вторичной рефрактерности к терапии лейкозов и лимфом в клинике, особенно у детей, немногочисленны и противоречивы. Особого внимания заслуживает публикация кооперативного исследования отдела детской гематологии/онкологии Университетского госпиталя Врийе (Нидерланды), группы COALL (Гамбург, Германия), группы ALL-Rez BFM (Берлин, Германия), группы AML-BFM (Мюнстер, Германия).
Было изучено клиническое и прогностическое значение экспрессии P-gp, MRP и LRP у 141 ребенка с ОЛЛ и 27 детей с ОМЛ. Сравнивали внутриклеточное содержание этих белков в острой фазе и рецидиве, при разных формах острого лейкоза, изучали его корреляцию с клиническими факторами риска и тестом цитотоксичности ex vivo. Проведенные исследования убедительно доказывают отсутствие значения белков P-gp и MRP в развитии лекарственной резистентности при острых лейкозах у детей.
Белок LRP, по-видимому, участвует в формировании некоторых форм лекарственной резистентности у детей: его экспрессия была выше при ОМЛ, по сравнению с ОЛЛ, в рецидивах выше, чем в острой фазе; была выявлена значимая обратная корреляционная связь с чувствительностью к даунорубицину.
Таким образом, исследования последнего времени позволяют считать несколько преувеличенной установленную ранее в эксперименте роль белков MDR в формировании лекарственной резистентности, по крайней мере, при острых лейкозах у детей.
Способность клеток к апоптозу
Реализация циторедуктивного эффекта химиотерапевтических средств, независимо от конкретных механизмов их действия, происходит чаще всего через активацию в опухолевых клеток программы апоптоза.
С этой точки зрения, резистентность опухолевых клеток к терапии может быть следствием двух процессов: неспособности химиопрепарата запустить программу апоптоза (недостаточная внутриклеточная концентрация активной формы препарата и/или отсутствие внутриклеточных мишеней, воспринимающих действие препарата и включающих программу апоптоза) и нарушения в механизмах апоптоза в опухолевых клетках.
Апоптоз — это физиологическая клеточная смерть, происходящая путем самопереваривания. Программа апоптоза может быть включена множеством внешних и внутренних сигналов и направлена на освобождение от старых или наработанных в излишке клеток.
Способность к спонтанному апоптозу лейкемических клеток ex vivo коррелирует с их лекарственной чувствительностью.
Определение уровня способности к спонтанному апоптозу лейкемических клеток при ОМЛ является хорошим тестом чувствительности клеток к химиотерапии.
Как показали исследования последних лет, противоопухолевые химиопрепараты включают апоптоз, в основном, через две сигнальные системы: ген Р-53 и FAS-R/TNF.
Антиметаболиты (6-меркаптопурин, метотрексат) и химиопрепараты, мишенью для действия которых являются топоизомеразы (этопозид, тенипозид) вызывают апоптоз опухолевых клеток через активацию Р-53.
Однако повреждение ДНК цитотоксическими агентами может найти свою реализацию и в обход Р53 гена (см.рис 3.3).

Рисунок 3.3. Схематический путь апоптоза при повреждении ДНК
Дело в том, что повреждение ДНК цитотоксическими агентами вызывает активацию атаксия-телеангиоэктазия-мутировавшего протеина (ATM), у которого имеется 3 мишени действия, ген Р53 только одна из них. Две другие (продукты онкогенов с-аbl и chk-1) ответственны за остановку клеток в фазах G1 и G2 с возможной последующей репарацией повреждения ДНК. Компоненты активации этих путей рассматриваются как возможные мишени для разработки новых лекарственных средств, усиливающих противоопухолевую активность агентов, повреждающих ДНК.
Как представлено на схеме (см.рис.3.3), при прохождении сигнала повреждения ДНК только ген Р53 отвечает за развития апоптоза.
В процессе опухолевой трансформации нередко происходит мутация в гене Р-53, отменяющая его проапоптотическую функцию. Обычно эта мутация сопровождается делецией 17р хромосомы, где картирован ген Р-53. Такая трансформация делает опухолевую клетку невосприимчивой к ДНК-токсическим препаратам. Мутация Р-53 гена чаще наблюдается в солидных опухолях (рак толстой кишки, простаты), реже при лейкозах и лимфомах, но всегда сопровождается лекарственной резистентностью и характеризуется плохим прогнозом.
Так, при исследовании 330 детей с ОЛЛ мутация в Р-53 была обнаружена при постановке диагноза всего у 10 детей (
В настоящее время онкологи исходят из концепции, что только раннее выявление злокачественной опухоли и ее адекватное лечение обеспечивают стойкий и длительный клинический эффект. Практика онкологической службы показала, что только диспансерный метод, являющийся достижением отечественного здравоохран.
Общеизвестно, что дистантное распространение по лимфатическим и кровеносным сосудам (метастазирование) — это высшее выражение автономности опухоли, главный отличительный признак злокачественного процесса и наиболее частая причина смерти больных. Способность к метастазированию позволяет опухо.
Морфологическое исследование опухоли играет ведущую роль в определении прогноза и выборе оптимальной тактики лечения онкологического больного. Патоморфолог информирует клинициста о характере опухопи (доброкачественная или злокачественная), ее гистологической принадлежности, степени дифференц.
Цитологический метод, основанный на микроскопическом изучении и оценке клеточного материала, полученного различным способом из патологического очага, является ветвью онкоморфологии. Цель цитологического исследования — установить правильный диагноз злокачественных опухолей любой локализации и в любой.
Химиотерапия обычно применяется как метод лечения первично-распространенных форм, рецидивов и метастазов злокачественных опухолей. Наряду с этим она может проводиться в дополнение к локальному лечению опухоли (удаление, облучение) вне зависимости от его радикальности. Подобная химиотерапия, .
Хирургический метод лечения злокачественных опухолей остается доминирующим, хотя его отдаленные результаты можно считать удовлетворительными лишь в I-II стадии заболевания, а в остальных — операция рассматривается как обязательный компонент специального лечения. Совершенствование хирургической техни.

Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
Деление соматических клеток происходит во всех органах и тканях
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
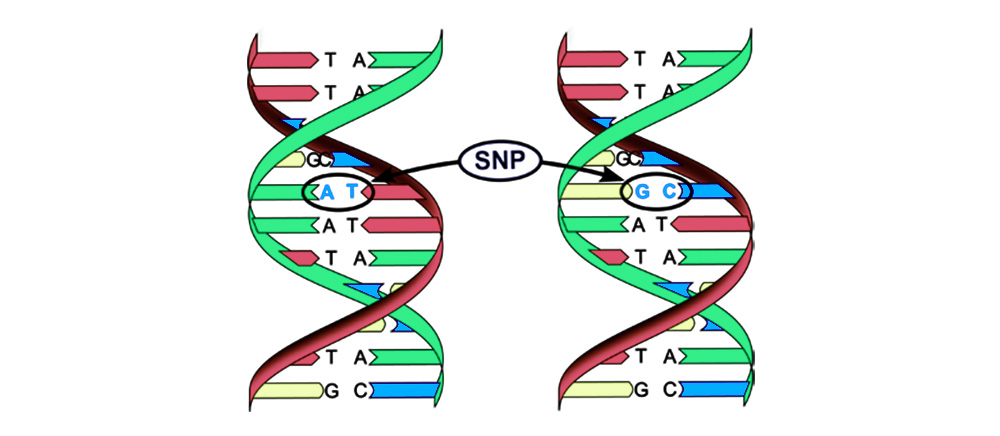
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
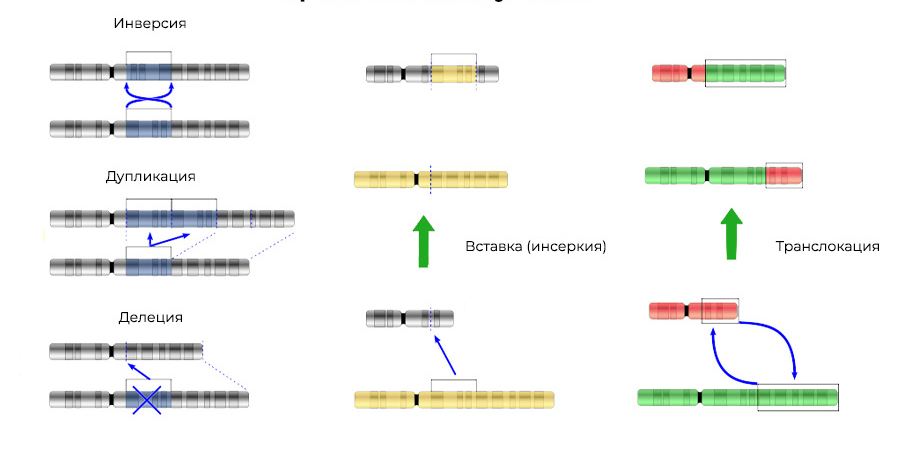
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
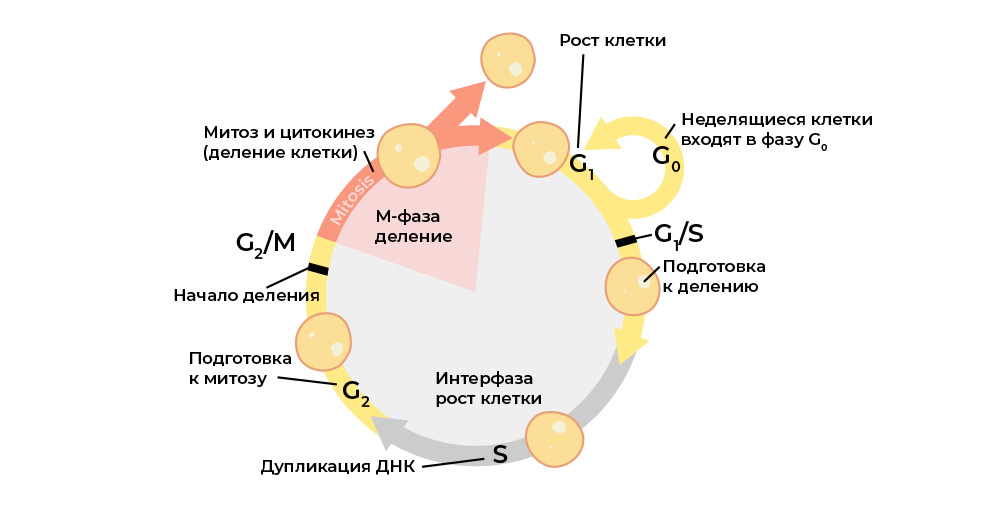
Каждый этап клеточного цикла контролируется белками-регуляторами
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
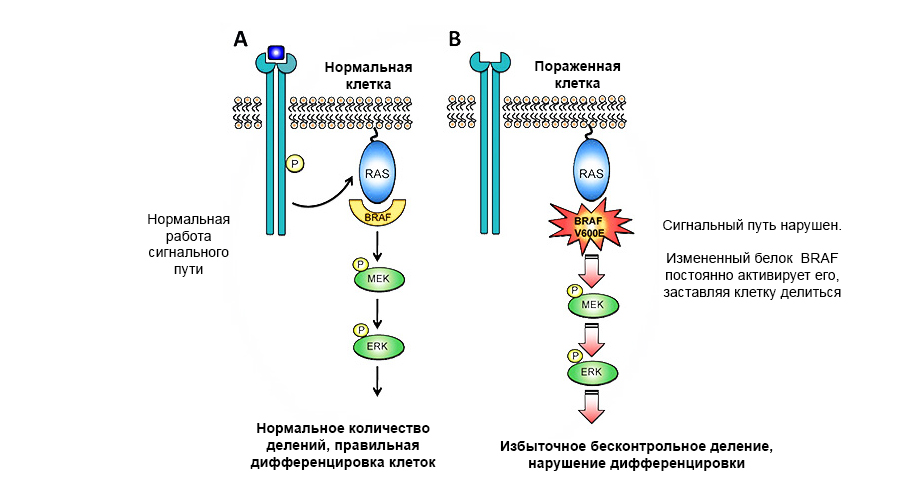
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
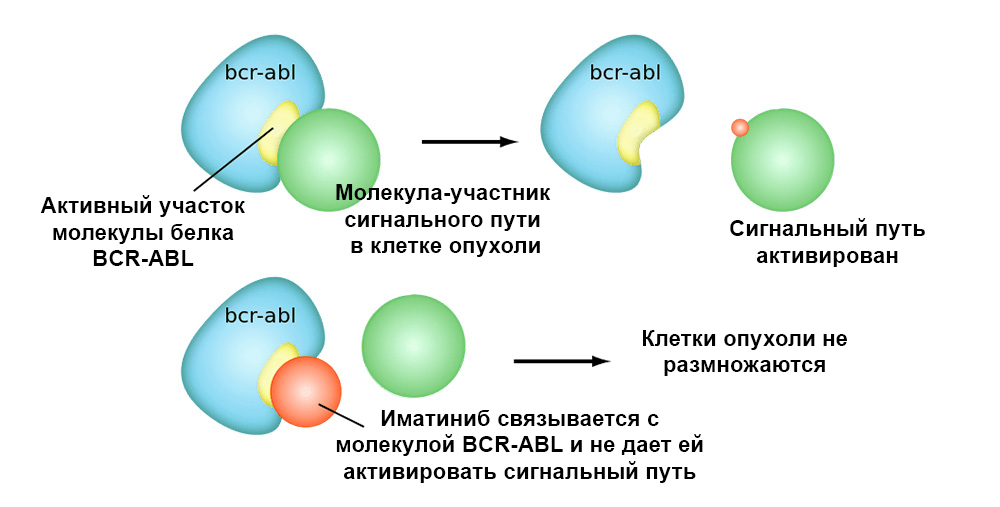
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
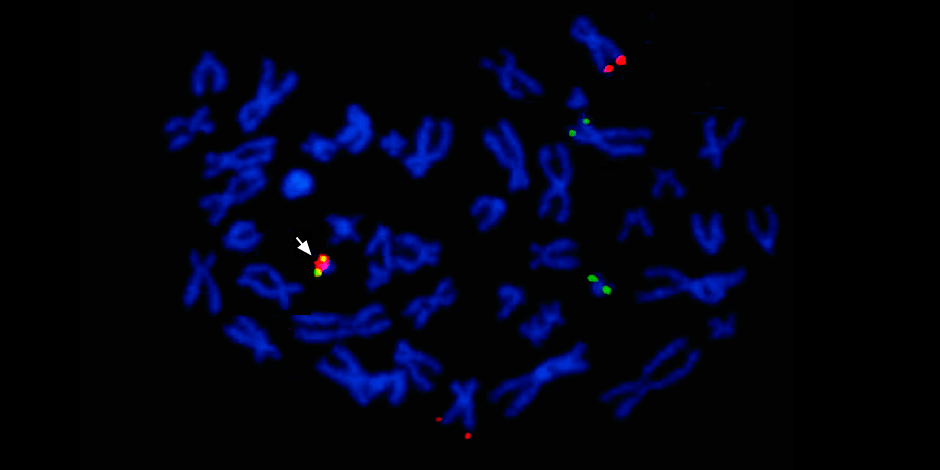
Под стрелкой слева – слияние красного и зеленого сигнала – свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Читайте также:

