Рефрактерная лимфома что это такое


Успех лечения пациентов с лимфомой Ходжкина (ЛХ) зависит от ряда факторов, которые четко определены для больных с впервые установленным диагнозом, таких как: стадия и объем опухоли, наличие или отсутствие В-симптомов и экстралимфатических очагов, а также параметры крови (СОЭ) [1]. Для пациентов со стадиями 1А или 2А без факторов риска прогноз заболевания настолько хорош, что в настоящее время обсуждается возможность минимизировать химиотерапию, при этом поддерживая высокий процент излечения, так как вероятность смерти больных с наилучшим прогнозом выше от последствий терапии, чем от лимфомы. Согласно данным публикаций, около 10% пациентов с распространенными стадиями заболевания не достигают полной ремиссии в ходе терапии первой линии и от 20 до 30% ответивших больных будут иметь рецидив [2, 3]. Неудача первичной терапии значительно ухудшает прогноз. Выбор последующей терапии должен осуществляться с учетом прогностических факторов.
Прогностические факторы
Первично рефрактерные больные
Пациенты с первично рефрактерным течением, определяемым как отсутствие ответа, прогрессирование на фоне первичной терапии или в течение 90 дней после ее завершения и/или персистенция ПЭТ 1 -позитивной резидуальной массы (с использованием 5-балльной шкалы Deauville для интерпретации результатов ПЭТ-КТ 2 ), составляют приблизительно 5% при локализованной опухоли и около 10% – при диссеминированной [4]. Прогноз у этих больных крайне неблагоприятный. При применении стандартной терапии шансы выжить составляют от 0 до 8% [5, 6]. Выживаемость чаще зависит от того, сможет ли пациент перенести интенсивную химиотерапию (ХТ) и аутологичную или аллогенную трансплантацию стволовых гемопоэтических клеток. По данным ретроспективного анализа базы данных Немецкой группы по изучению ЛХ (GHSG), проведенного для определения прогностических факторов и оценки результатов терапии у пациентов с первично прогрессирующим заболеванием, только в 34% (70 из 206) проанализированных случаев больные смогли получить высокодозовую химиотерапию (ВДХТ) с аутологичной трансплантацией стволовых гемопоэтических клеток (АТСГК) [7]. Пятилетняя выживаемость без прогрессирования (ВБП) у пациентов, перенесших ВДХТ с АТСГК, составила 31%, и общая выживаемость (ОВ) – 43%. При этом 5-летняя ВБП в группе в целом (у получивших и не получивших ВДХТ) была только 17%, а ОВ – 26%.
По результатам мультивариантного анализа низкий статус по шкале Карновского на момент прогрессирования, возраст >50 лет и невозможность достичь временной ремиссии в ходе сальвадж-терапии были значимыми прогностическими факторами для ОВ. При отсутствии этих факторов риска 5-летняя выживаемость составила 55% по сравнению с 0 при наличии всех трех прогностически неблагоприятных факторов. Плохое общее состояние, быстрое прогрессирование ЛХ, связанная с лечением токсичность, невозможность выполнить коллекцию стволовых гемопоэтических клеток (СГК) не позволяют большинству больных проходить ВДХТ.
Рецидивы ЛХ
Пациенты с рецидивом классической ЛХ имеют несколько лучший прогноз. До эры интенсивных реиндукционных режимов прогнозируемая 20-летняя выживаемость пациентов с ранним рецидивом ( 12 мес после первичной терапии) – 22% [5]. Только 80% пациентов с поздним рецидивом достигнут второй ремиссии [5]. В большом ретроспективном анализе 422 пациентов с рецидивом ЛХ, проведенном GHSG, клиническими факторами плохой 5-летней выживаемости были: время до рецидива (3‑12 мес после завершения первичной терапии), стадия в рецидиве (III или IV) и анемия в рецидиве ( Подходы к лечению
Роль стандартной терапии. Обычная ХТ практически не обладает куративным потенциалом при рефрактерном течении или раннем рецидиве ЛХ [5, 27]. Ее роль сводится к решению двух основных задач: достигнуть максимальной редукции опухоли перед ВДХТ/АТСГК и эффективно мобилизовать стволовые кроветворные клетки в периферическую кровь для их дальнейшей коллекции и использования после ВДХТ. Более того, обычная ХТ используется в лечении больных, которым не рекомендуется проведение ВДХТ ввиду возраста или наличия противопоказаний. В некоторых случаях очень позднего локализованного рецидива при условии отсутствия негативных факторов прогноза лечение может быть ограничено проведением стандартной химио- и/или лучевой терапии.
Так как состояние больного перед ВДХТ с АТСГК служит наиболее важным фактором конечного результата терапии, целью предтрансплантационной терапии является достижение ремиссионного статуса заболевания или минимально детектируемой опухоли без избыточной токсичности.
Сальвадж-терапия
Сальвадж-терапия с последующей ВДХТ и аутологичной трансплантацией СГК на данный момент является стандартом терапии и может излечить около 50% пациентов [41].
Цель проведения терапии 2-й линии – максимальная редукция опухоли перед ВДХТ при отсутствии значимой органной токсичности, а также хорошая мобилизационная способность – возможность выполнения адекватной коллекции стволовых гемопоэтических клеток после курса терапии, то есть минимальная токсичность для стволовых кроветворных клеток.
На сегодняшний день существует ряд апробированных химиотерапевтических режимов, используемых для терапии пациентов с рецидивом или рефрактерным течением лимфомы Ходжкина [42, 43]. Основные из них суммированы в таблице 2. Общий ответ (полный и частичный ответ), ранее оцениваемый прежде всего по КТ, составляет от 70 (n=54) до 90% (n=88), из них полный ответ, по данным разных авторов, достигается у 20-55% больных. Так как рандомизированных исследований, сравнивающих эффективность режимов сальвадж-терапии, не проводилось, выбор терапии 2-й линии должен основываться на особенностях пациента (нарушение почечной функции, наличие нейропатии, риск развития энцефалопатии и т.д.), предшествовавшей терапии и возможностях отделений, где проводится терапия. Общепринятым является проведение 2-3 циклов сальвадж-режимов до оценки ответа на лечение. Учитывая соотношение риск/польза, проведение 4-го цикла может быть оправданным, если откладывается проведение ВДХТ.

Учитывая, что большинство пациентов получали ранее доксорубицин, использование потенциально кардиотоксичных препаратов группы антрациклинов невозможно, если уже достигнута кумулятивная доза 400 мг/м 2 . Особенно это актуально, если проводилась лучевая терапия на средостение. Химиотерапевтические сальвадж-режимы могут условно быть поделены на содержащие стандартные комбинации химиопрепаратов (mini-BEAM и dexa-BEAM) [28, 29, 44, 45], платиносодержащие комбинации (ESHAP, DHAP, ASHAP, DHAOx) 48, режимы на основе ифосфамида и этопозида (MINE, ICE, IVE) [10, 14, 50, 51] и гемцитабина (GVD, GDP и IGEV) [52, 53, 54].
В случае недостаточного ответа на первую сальвадж-терапию (не достигнут хотя бы частичный ответ) пациенту может быть предложено проведение второго курса с использованием препаратов, не обладающих перекрестной резистентностью. Так, по данным британских авторов, 19 пациентам с недостаточным ответом на первый сальвадж-режим – ESHAP (15, т.е. 79%, имели прогрессирование заболевания и 4, т.е. 21%, – стабильное заболевание) был проведен второй сальвадж-режим – mini-BEAM. Из них 12 (63%) достигли ответа: полного – 47% и частичного – 16%. Из этих 12 больных 10 была проведена трансплантация: восьмерым – аллогенная, двум – аутологичная. Один пациент из этой группы, не ответивший на mini-BEAM, ответил в дальнейшем на монотерапию гемцитабином [57].
Однако интенсивная ХТ перед ВДХТ cвязана со значительной токсичностью, прежде всего иммуносупрессией; возможными повторными эпизодами фебрильной нейтропении; необходимостью трансфузий продуктов крови, введения колониестимулирующих факторов, колонизации пациентов рефрактерной микрофлорой, а также избыточной органной токсичностью, что может стать причиной развития в посттрансплантационном периоде большего числа осложнений, а в некоторых случаях может препятствовать проведению ВДХТ. С другой стороны, интенсивное химиотерапевтическое лечение может не позволить провести адекватную коллекцию гемопоэтических стволовых клеток для ВДХТ/АТСГК. Процент неудачных коллекций после проведения сальвадж-терапии составляет около 15% при отсутствии плериксафора [58].
Доказанным является факт, что лучшие результаты ВДХТ и АТСГК наблюдаются у пациентов с полным анатомическим и/или метаболическим ответом на сальвадж-терапию.

Опыт Киевского центра трансплантации костного мозга
С 30 сентября 2000 г. по 1 октября 2016 г. в Киевском центре трансплантации костного мозга выполнено 305 трансплантаций гемопоэтических клеток 290 пациентам с рецидивом или рефрактерным течением ЛХ. Из них 290 первичных аутологичных трансплантаций, 9 тандемных, 3 повторных и одна аллогенная (после аутологичной). Характеристика пациентов представлена в таблице 4.

На 1 октября 2016 г. живы 198 пациентов, умерли 76, 16 потеряны для наблюдения. Пятилетняя бессобытийная выживаемость составила 65% и ОВ – 74%. Статистическая обработка данных при подсчете показателей не проводилась, не учтены пациенты, вышедшие из-под наблюдения. Анализ по подгруппам не проводился. Основная причина смерти – рецидив/прогрессирование основного заболевания.
Заключение
Стандартным лечением пациентов с рецидивом или рефрактерным течением ЛХ является проведение сальвадж-терапии с последующей ВДХТ и АТСГК. Достижение и поддержание полной ремиссии до трансплантации является основным фактором благоприятного прогноза и длительной выживаемости. Использование новых препаратов в предтрансплантационной сальвадж-терапии, особенно в группе высокого риска, позволяет значительно уменьшить токсичность проводимого лечения и увеличить шансы больных на выздоровление.
1 ПЭТ – позитронно-эмиссионная томография.
2 КТ – компьютерная томография.
3 В Украине брентуксимаб ведотин (ИНН) зарегистрирован для лечения взрослых пациентов с рецидивирующей или рефрактерной формой CD30-положительной ЛХ: после АТСГК; после хотя бы 2 предшествующих линий терапии, если АТСГК или полихимиотерапия не являются целесообразными; а также для лечения взрослых пациентов с рецидивирующей или рефрактерной системной анапластической крупноклеточной лимфомой в рекомендуемой дозе 1,8 мг/кг массы тела в виде внутривенной инфузии по 30 мин каждые 3 недели (в случае стабилизации заболевания или улучшения состояния проходят от 8 до 16 циклов лечения). Для более детальной информации см. инструкцию по медицинскому применению.
4 Препараты ниволумаб и пембролизумаб не зарегистрированы в Украине для терапии ЛХ.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Здебільшого коронавірусна хвороба – 2019 (COVID‑19) зумовлює інфекційне ураження дихальних шляхів. Однак у частини пацієнтів захворювання прогресує та має тяжчий перебіг, що характеризується лихоманкою, стійкою до протизапальної терапії, гострим ушкодженням легень із розвитком гострого респіраторного дистрес-синдрому, шоковим станом і мультиорганною дисфункцією, котра асоціюється зі значним ризиком смерті [1]. У багатьох пацієнтів із тяжким перебігом COVID‑19 присутні порушення коагуляції, що імітують інші системні коагулопатії, пов’язані з тяжкими інфекціями, такі як синдром дисемінованого внутрішньосудинного згортання (ДВЗ‑синдром) або тромботична мікроангіопатія, але COVID‑19 має відмінні риси [2].
Лимфома Ходжкина (болезнь Ходжкина, лимфогранулематоз) является разновидностью рака лимфатической системы, которая характеризуется наличием клеток Рида–Штернберга. Причина возникновения лимфомы Ходжкина в настоящее время не выяснена, однако существуют весьма убедительные свидетельства того, что по крайней мере некоторые случаи возникновения данного заболевания связаны с конкретными вирусными инфекциями: в частности, вирус Эпштейна–Барр появляется примерно в 40–50% случаев лимфомы Ходжкина, также наблюдается связь между лимфогранулематозом и вирусом кори. Лечение лимфомы Ходжкина основано на сочетании химиотерапии и лучевой терапии. Выбор конкретного лечения зависит от варианта болезни, возраста пациента, стадии (локальное или распространенное поражение организма), сопутствующих заболеваний и других факторов.
В сложных случаях, при рецидивирующем течении болезни или резистентности к терапии, может применяться высокодозная терапия с аутологичной трансплантацией костного мозга, а также аллогенная трансплантация. Недавно на фармацевтическом рынке появился новый препарат брентуксимаб ведотин, который позиционируется как первое таргетное лекарственное средство для лечения пациентов с рецидивирующей и резистентной лимфомой Ходжкина, а также специфично применяющееся для лечения одной из редких форм Т-клеточной неходжкинской лимфомы – системной анапластической крупноклеточной лимфомы. О новом препарате и методах лечения лимфомы Ходжкина на Съезде онкологов, состоявшемся 29–30 апреля в г. Алматы, рассказал Marcus Hanrich, профессор отделения пересадки стволовых клеток академической клиники университета Мюнхена.
– В нашей клинике было проведено исследование больных лимфомой Ходжкина, которое показало, что после терапии первой линии (ABVD, BEACOPP) в 10–30% случаев наблюдаются рецидивы заболевания. При рецидивирующем или устойчивом к терапии заболевании применяется терапия второй линии, так называемая терапия спасения – высокодозная химиотерапия c последующей аутологичной трансплантацией гемопоэтических стволовых клеток. Согласно клиническим руководствам по лечению лимфомы Ходжкина, трансплантацию стволовых клеток можно рассматривать как терапию выбора для большинства пациентов с рефрактерной или рецидивирующей лимфомой.
Однако примерно у 30% пациентов имеются противопоказания к проведению терапии спасения (пожилой возраст, сочетанные заболевания, тяжелое состояние и пр.). Кроме того, проведение аллогенной трансплантации стволовых клеток не всегда возможно в связи с отсутствием донора для конкретного пациента. Недавно на фармацевтическом рынке появился новый препарат, продемонстрировавший в ходе исследований свою эффективность в лечении пациентов с лимфомой Ходжкина. Брентуксимаб ведотин представляет собой конъюгат моноклонального антитела, состоящий из трех компонентов: антитела cAC10, специфичного к CD30, агента, встраивающегося в систему микротрубочек (монометил ауристатин E ММАЕ), расщепляемого протеазой линкера, ковалентно связывающего MMAE с cAC10. Антитело связывается с CD30+ (антиген, который относится к семейству факторов некроза опухолей), а ММАЕ воздействует на внутриклеточные структуры, приводя к гибели клеток лимфомы. Препарат применяется в случае прогрессирования заболевания после аутологичной трансплантации стволовых гемопоэтических клеток или как минимум 2 курсов полихимиотерапии, а также при неэффективности 1 курса полихимиотерапии у пациентов с системной анапластической крупноклеточной лимфомой.
Исследование брентуксимаба ведотина I фазы включало в себя 45 пациентов с рецидивирующей или рефрактерной лимфомой Ходжкина CD30+. Были отмечены хорошая переносимость препарата (среди наиболее частых побочных эффектов – слабость, тошнота, диарея) и хороший ответ на терапию у большинства пациентов. Полученные результаты стали поводом для проведения более масштабного исследования препарата в более многочисленной группе пациентов.
В исследовании II фазы принимали участие 102 пациента с лимфомой Ходжкина (размер опухоли ≥1,5 см) после аллогенной трансплантации стволовых клеток. У 71% больных, включенных в исследование, наблюдалась первичная рефрактерность, у 42% – рефрактерность к последней проведенной терапии. У большинства пациентов рецидив заболевания отмечался в течение 1 года после проведенной аллогенной трансплантации стволовых клеток.
Брентуксимаб ведотин назначался в дозе 1,8 мг/кг 1 раз в 3 недели. На фоне проводимой терапии было от- мечено уменьшение размера опухоли у 94% пациентов (увеличение размера опухоли было отмечено только у 2 участников), объективный ответ на терапию – у 75%. Полной ремиссии удалось достичь у 34% пациентов. Общая выживаемость составила свыше 40 мес, выживаемость без прогрессирования – 5,6 мес. Результаты данного исследования представлены в таблице 1.
Следует отметить, что большая часть нежелательных явлений, из которых наиболее клинически значимой была периферическая нейропатия, при проводимом лечении поддавалась контролю стандартной поддерживающей терапией. Периферическая нейропатия наблюдалась, как правило, на фоне длительного лечения; в большинстве случаев после завершения терапии или снижения дозы препарата наблюдалось ее разрешение. Данный побочный эффект связан также с предрасположенностью к ней пациентов, ранее получавших химиотерапию.
Были проведены также исследования данного препарата при системной анапластической крупноклеточной лимфоме. Полный ответ на лечение был отмечен у 59%, уменьшение опухоли – у 97% пациентов (табл. 2).
В настоящее время исследования эффективности и безопасности брентуксимаба ведотина продолжаются. В частности, проводится изучение комбинации брентуксимаба ведотина и многокомпонентной химиотерапии при впервые выявленной лимфоме Ходжкина у пациентов, ранее не получавших лечение.
Фолликулярная лимфома - вид рака крови. Это наиболее распространённая из безболезненных (медленно растущих) неходжкинских лимфом и вторая наиболее распространённая форма неходжкинских лимфом в целом. Лимфоциты с аномальным ростом клеток могут перемещаться по всему телу и образовывать опухоли, известные как лимфомы, в лимфатических узлах, селезенке, костном мозге, крови или других органах. Обычно она растет медленно, но в большинстве случаев имеет неблагоприятный прогноз.

Рецидивирующая, или рефрактерная фолликулярная, лимфома возникает, когда рак не поддается первичному лечению или возвращается после периода ремиссии. Пациенты могут заметить следующие признаки: усталость, потерю аппетита или увеличение лимфатических узлов.
Рецидив фолликулярного рака
"Рецидив" - это термин, используемый для описания возврата заболевания после лечения. При раке фолликула это означает, что ненормальный рост клеток сначала улучшается, но затем возвращается после лечения. В результате вторичные методы лечения могут быть необходимы для лечения заболевания.
Рефрактерный фолликулярный рак
"Невосприимчивый" - это термин, используемый для описания заболевания, которое не поддается лечению. При раке фолликула это означает, что ненормальный рост клеток не улучшается в достаточной степени при начальном лечении ремиссии. В результате, вторичные методы лечения могут быть необходимы для лечения заболевания.
Факторы для принятия решения о лечении
Существует несколько факторов, которые будут влиять на решения о лечении пациента с рецидивирующим раком. Они включают:
Предыдущую схему лечения.
Продолжительность ремиссии от последнего лечения.
В большинстве случаев вторичное лечение должно отличаться от первоначального метода терапии, чтобы повысить вероятность успешной ремиссии.
Варианты лечения
Существует несколько способов лечения рефрактерной фолликулярной лимфомы, включая химиотерапию, облучение, моноклональные антитела и радиоиммунотерапию.
Высокодозная химиотерапия с трансплантацией аллогенных (полученных из донорского материала) стволовых клеток может быть эффективной при лечении для продления периода ремиссии.
Лучевая терапия включает использование радиационных волн, направленных на лимфому, чтобы разрушить раковые клетки и вызвать ремиссию.
Моноклональные антитела (антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, то есть произошедшими из одной плазматической клетки-предшественницы), такие как ритуксимаб (ритуксан), используемые отдельно или в комбинации с другими методами лечения, также могут быть эффективными.
Радиоиммунотерапия (одна или в сочетании с химиотерапией): включает облучение и иммунную систему для разрушения раковых клеток путем присоединения радиоактивного соединения к лекарству моноклональных антител, доставляя излучение непосредственно к клеткам лимфомы. Это происходит потому, что моноклональное антитело связывается с антигенным белком CD20 на поверхности клеток лимфоцитов.
Радиоиммунотерапевтические препараты эффективны для вызывания ремиссии, которая длится при правильном использовании. Коммерчески доступные препараты для радиоиммунотерапии включают в себя:
Йод 131 тозитумомаб (Бексар).
Y90 ибритумомабтиуксетан (Зевалин).
Трансформированная лимфома
Приблизительно у одной трети пациентов с фолликулярной лимфомой будет гистологическая трансформация, также известная как трансформированная лимфома. Этот тип лимфомы обычно более агрессивный и требует более активного подхода к лечению. Лечение может включать химиотерапию в высоких дозах в сочетании с лекарственными средствами с моноклональными антителами, такими как ритуксимаб. Альтернативные варианты лечения включают лучевую терапию и радиоиммунотерапию.
Читайте также:
Встройте "Правду.Ру" в свой информационный поток, если хотите получать оперативные комментарии и новости:
Подпишитесь на наш канал в Яндекс.Дзен или в Яндекс.Чат
Добавьте "Правду.Ру" в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.
Лимфома / Фото: sosud-ok.ru
Лимфомами называют целую группу заболеваний лимфатической ткани. Это злокачественные патологии, при которых лимфоциты, клетки крови, начинают бесконтрольно делиться и накапливаться в лимфатических узлах и внутренних органах, патологически нарушая их работу. Да, к сожалению, лимфома – это злокачественное новообразование со всеми вытекающими отсюда последствиями.
Есть два типа заболевания: лимфогранулематоз, его еще называют лимфомой Ходжкина, и так называемые неходжкинские лимфомы.
Для лимфомы Ходжкина характерно появление в лимфатических тканях специфических патологически крупных (до 20 микрон) клеток. Это довольно редкий тип, чаще им заболевают мужчины. Пиковые значения приходятся на возраст от 25 до 30 лет и от 50 до 55 лет. Но выживаемость у лимфомы Ходжкина высокая, особенно на I и II стадии.
Неходжкинские лимфомы делятся на множество подтипов. Прежде всего их разделяют по типу лимфоцитов, из которых возникла опухоль: В-клеточные или Т-клеточные.
Еще одна классификация – по особенностям течения процесса. Индолентные опухоли развиваются медленно и относительно спокойно, например, это фолликулярные лимфомы, лимфомы маргинальной зоны. А вот агрессивные лимфомы отличаются быстрым, прогрессирующим течением и крайне неблагоприятным прогнозом. К ним относятся, например, лимфома Беркита или В-клеточные крупноклеточные лимфомы.
Лимфома долго маскируется. В 45-55% случаев у пациентов увеличиваются лимфоузлы разных групп, чаще – шейно-надключичных, подмышечных, паховых. При этом они остаются безболезненными, и их размеры не уменьшаются со временем.
При прогрессировании могут появиться симптомы интоксикации:
- значительная беспричинная потеря веса (до 10% массы тела за полгода);
- нарастающая слабость;
- сильная потливость по ночам;
- неожиданные скачки температуры до 38 градусов и выше без явной причины;
- кожный зуд;
- тошнота, рвота, одышка в течение длительного времени.
"К сожалению, часто пациенты обращаются в поликлинику, когда процесс зашел уже слишком далеко и помочь им становится очень сложно. Нужно учиться понимать свой организм и не игнорировать его "жалобы". Чем раньше поставлен диагноз, тем больше шансов на успешное лечение", – подчеркнула Елена Россоха.

Врачи долгие годы пытаются понять, откуда вообще берется рак. Причины лимфомы тоже пока неизвестны. Существуют только теории и предположения.
Например, принято считать, что появление заболевания могут спровоцировать некоторые инфекции и вирусы (вирус Эпштейна-Барра, герпес 8 типа, инфекционный мононуклеоз). Определенную роль могут играть первичный и вторичный иммунодефицит. Именно поэтому лимфома часто встречается у больных туберкулезом и ВИЧ-инфицированных пациентов.
Важны и факторы внешней среды, например, работа с тяжелыми химическими соединениями, пестицидами.
Из-за отсутствия симптомов в начале заболевания и многоликости проявлений болезни на поздних стадиях, лимфому бывает непросто диагностировать. Основной анализ – это микроскопическое исследование образца лимфоидной ткани, полученной при биопсии. С помощью лучевой диагностики определяют стадию процесса. УЗИ необходимо для исследования размеров лимфатических узлов, определения степени поражения, наличия или отсутствия метастазов в органах. Компьютерная томография и ПЭТ КТ позволяют детально изучить место, где расположилась опухоль, ее состав, а также оценить состояние организма в целом. Фиброгастродоуденоскопия (ФГДС) и пункция костного мозга проводятся для определения распространенности лимфомы.
"Иногда пациенты возмущаются, если им назначают дополнительные методы исследования, считая их лишними. Но ведь детальная диагностика необходима врачам для выбора правильной тактики дальнейшего лечения. Чем лучше мы знаем "врага", тем более эффективно можем планировать борьбу с ним", – пояснила собеседница.
Как и всем пациентам с любыми онкологическими заболеваниями им противопоказано длительное пребывание на солнце, загар, физиолечение, общее воздействие высоких температур, например, баня, а также массаж в период лечения.

У пациентов с лимфомами однозначно должно корректироваться питание. Нужно исключить жирное красное мясо, консерванты, продукты с химическими добавками, копчености, газированные напитки, алкоголь.
Во время лекарственной терапии и сразу после нее, так как лечение подразумевает прием агрессивных препаратов, нужно стараться употреблять свежеприготовленную пищу и пить больше жидкости. При этом калорийность еды должна покрывать, но не превышать энергозатраты организма. Наиболее полезны свежие фрукты, овощи и зелень, богатые витамином C, диетическое мясо, злаки, кисломолочные продукты и продукты с высоким содержанием фосфора и железа.
Здоровому-то человеку нужны, а уж больному тем более, прогулки на свежем воздухе и посильные физические нагрузки. Но самое главное, пациент должен стараться получать положительные эмоции. Кто-то любит читать, кто-то смотреть фильмы, а для кого-то большое удовольствие состоит в общении с родными и близкими людьми.
По словам врача, основной метод лечения лимфом всех видов – это лекарственная терапия. В большинстве случаев с помощью препаратов достигается стойкая ремиссия, когда опухоль никак себя не проявляет.
В дополнение к лекарственной терапии и как закрепление ее результатов применяется лучевое лечение. В некоторых случаях может потребоваться трансплантация костного мозга, собственного, очищенного и подготовленного, или донорского.
В план лечения лимфом входит и таргетно-целевая терапия, направленная на опухолевые мишени. В последние годы появились высокоэффективные препараты, которые перепрограммируют собственную иммунную систему человека на поиск и уничтожение опухоли. В онкологическом диспансере эти препараты есть и по показаниям пациенты их получают, сказала Елена Россоха.
Современные возможности диагностики (иммунофенотипирование, МРТ, ПЭТ КТ диагностика), огромное количество новых лекарственных молекул дает возможность онкологам в Алтайском крае лечить таких больных на уровне современных мировых стандартов.
"Большинство специалистов сходятся во мнении, что в ближайшем будущем лимфомы, в том числе и агрессивные, перестанут считаться неизлечимым заболеванием. Когда наши пациенты создают свои семьи и рожают совершенно здоровых малышей – это ли не счастье?! И с каждым годом таких пациентов становится больше", – резюмирует врач.
За помощь в подготовке материале благодарим пресс-секретаря онкоцентра Юлию Корчагину.
Что такое лимфома Беркитта?
Лимфома Беркитта — это рак лимфатической системы. Она развивается из B-лимфоцитов (белых кровяных клеток, которые борются с инфекцией) и обычно растет очень быстро. Она часто хорошо поддается лечению и во многих случаях может быть вылечена интенсивной химио-иммунотерапией.
Лимфомы могут развиваться, когда лимфоцит (тип лейкоцитов) выходит из-под контроля. Существуют две основные группы лимфом: лимфома Ходжкина и неходжкинские лимфомы (НХЛ). Лимфома Беркитта является очень быстрорастущим типом высококачественной неходжкинской лимфомы.
Симптомы часто развиваются быстро, в течение нескольких дней или недель. Лимфома Беркитта обычно вызывает увеличение множества лимфатических узлов во многих различных частях тела и часто затрагивает шею, брюшную полость (живот) и кишечник. Могут быть затронуты другие органы, такие как селезенка и печень.
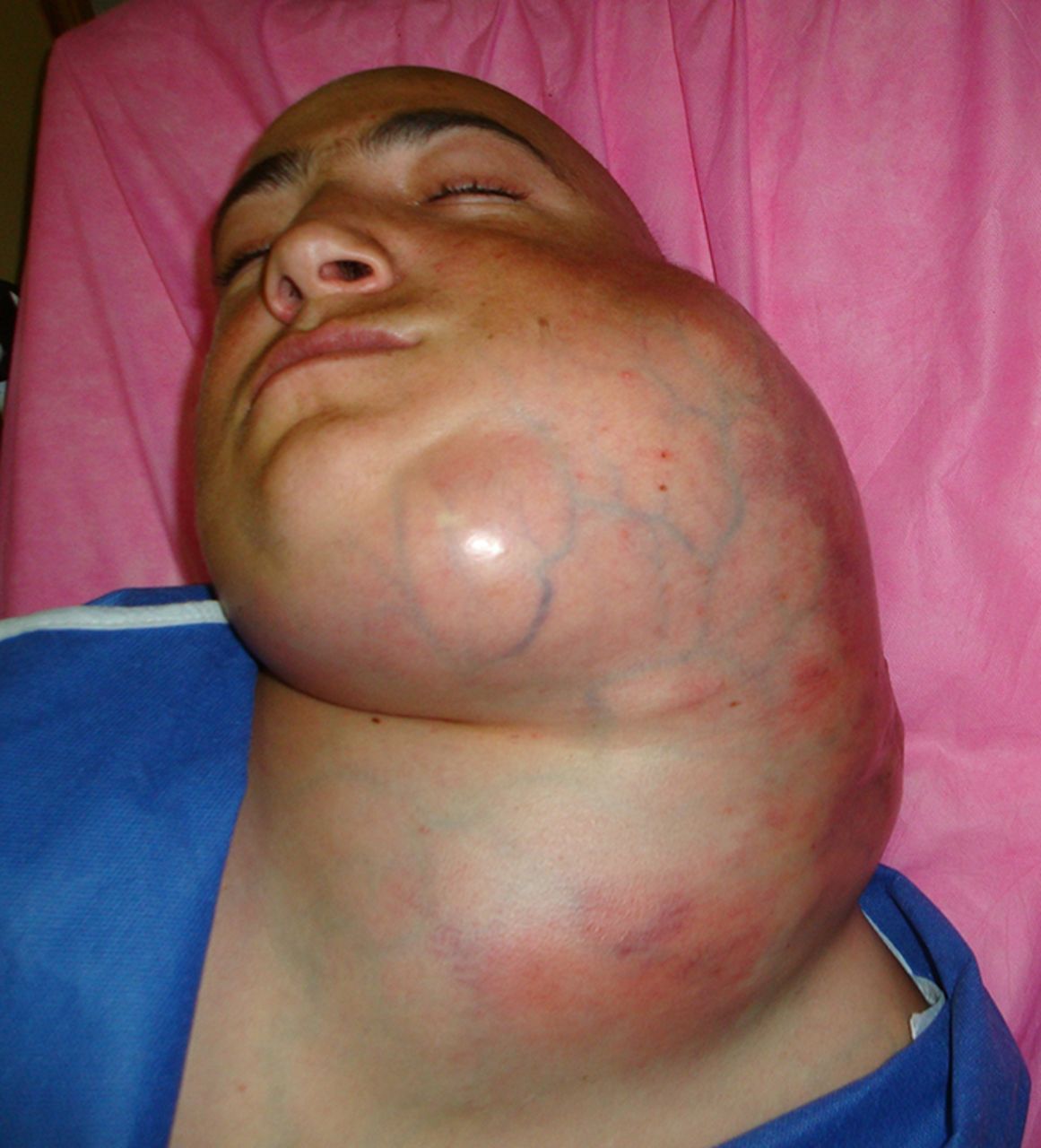
Лимфома также может находиться в костном мозге и может распространяться на центральную нервную систему (ЦНС; головной и спинной мозг).
Лечение обычно начинается очень скоро после постановки диагноза. Если вы в хорошей форме, это комбинация сильнодействующих химиотерапевтических препаратов и ритуксимаба.
Лечение обычно проводится в специальном центре, и большинство людей остаются в больнице в течение всего или большей части курса лечения, который может занять несколько месяцев.
Типы лимфомы Беркитта
Существуют различные типы лимфомы Беркитта, однако основные это:
- эндемическая форма, которая встречается в основном у детей в Африке.
- спорадическая форма, которая является наиболее распространенной формой лимфомы Беркитта
- Лимфома Беркитта, связанная с иммунодефицитом, обычно развивающееся у людей с вирусом иммунодефицита человека (ВИЧ) или перенесших пересадку органов.
Насколько распространена лимфома Беркитта?
Лимфома Беркитта встречается редко — у около 3000 человек ежегодно диагностируют этот тип лимфомы. Хотя это самый распространенный тип неходжкинской лимфомы у детей, она может возникнуть в любом возрасте.
Лимфома Беркитта поражает примерно в три раза больше мужчин, чем женщин.
Причины лимфомы Беркитта
Эндемическая форма связана с малярией и вирусом Эпштейна-Барра, общими вирусами, также вызывающими воспаление гланд.
Причина спорадической формы менее ясна, хотя иногда и она связана вирусом Эпштейна-Барра. Важно отметить, что подавляющее большинство людей, у которых есть данный вирус, не развивают лимфому.
У людей с вирусом иммунодефицита человека чаще развивается лимфома Беркитта, чем у людей без вируса иммунодефицита человека, однако большинство людей с лимфомой Беркитта также и не имеют ВИЧ.
Симптомы лимфомы Беркитта
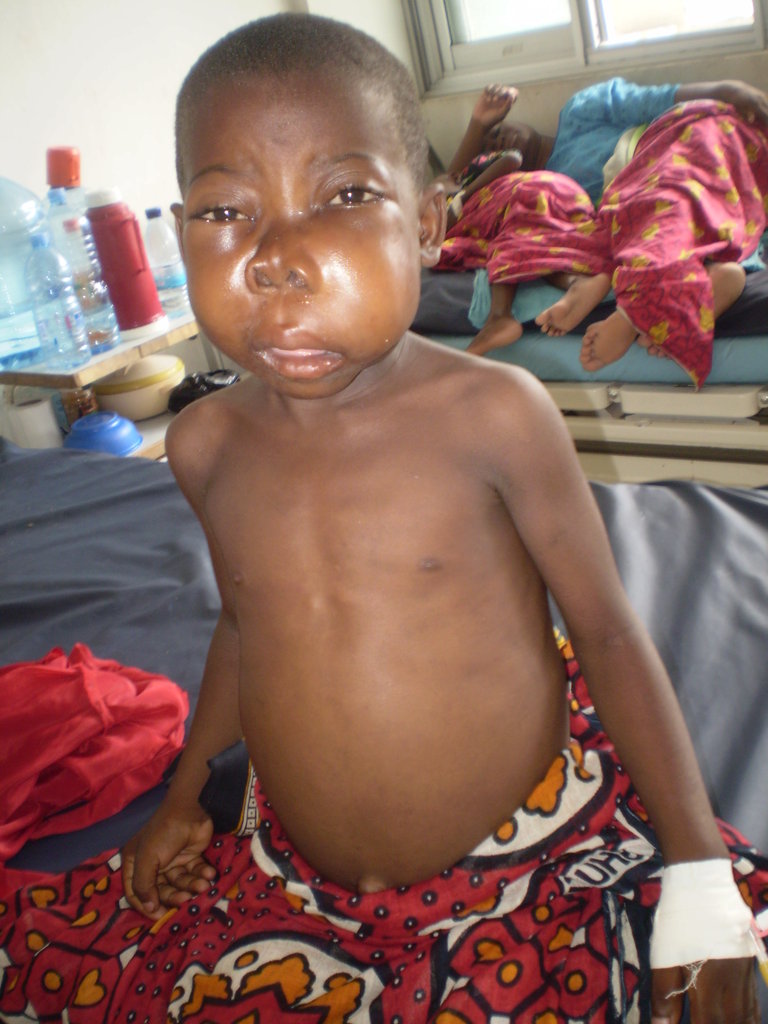
Симптомы лимфомы Беркитта обычно развиваются быстро, всего за несколько дней или недель.
Наиболее распространенным симптомом является один или несколько комков, которые часто развиваются в нескольких частях тела (см. фото). Они вызваны клетками лимфомы, которые накапливаются в лимфатических узлах (железах), вызывая их увеличение (опухание).
Лимфома Беркитта часто встречается в брюшной полости (животе) и кишечнике. Лимфома может вызывать различные симптомы и признаки в зависимости от того, где она растет. Например, если лимфома растет в брюшной полости или кишечнике, у вас может быть:
- боль в животе;
- тошнота и диарея;
- отек живота из-за скопления жидкости;
- кровотечение из кишечника или боль от непроходимости кишечника (закупорки).
Лимфома может повлиять также на другие части тела, например:
- такие органы, как селезенка, печень, яичники, почки и грудь;
- костный мозг (губчатый центр некоторых костей);
- центральная нервная система (ЦНС; головной и спинной мозг).
Лимфома Беркитта в костном мозге может вызывать низкие показатели крови, так как клетки лимфомы занимают пространство нормальных клеток, в результате чего может возникнуть:
- анемия (низкий уровень эритроцитов), которая может вызвать усталость и одышку;
- тромбоцитопения (низкий уровень тромбоцитов), которая повышает вероятность возникновения ушибов и кровотечений.
Люди с лимфомой Беркитта часто имеют крупные опухоли (большие комочки), так как этот тип лимфомы растет очень быстро.
Диагностика и стадирование
Лимфома Беркитта диагностируется с помощью небольшой процедуры, называемой биопсией. Сперва под местной анестезией удаляется образец ткани, пораженной лимфомой, например, опухший лимфатический узел. Далее образец обследуется экспертом-патологом в лаборатории. Затем если диагноз подтверждается патологоанатом проводит дополнительные тесты ткани, чтобы выяснить, что это за тип лимфомы.
Иногда клетки лимфомы Беркитта обнаруживаются первыми в костном мозге или в тканях, удаленных по другим причинам.
Дополнительные методы обследования:
- физическое обследование;
- анализы крови, чтобы оценить общее состояние здоровья, включая количество клеток крови
- сканирования, как правило, в сочетании ПЭТ/КТ
- обследование костного мозга
- люмбальная пункция, чтобы проверить не распространилась ли лимфома на центральную нервную систему.
Проводимые обследования являются частью процесса “стадирования” лимфомы — выяснения того, насколько далеко она распространилась и как сильно поражено тело.
Выделяют 4 стадии развития лимфомы Беркитта.
- Стадия 1. Онкологический процесс локализован в одной области лимфатических узлов. Данная стадия заболевания длится недолго. Оно быстро переходит на следующий этап своего развития.
- Стадия 2. Опухоль распространяется на близлежащие лимфоузлы, расположенные по одну сторону с уже пораженными лимфомой лимфатическими узлами относительно диафрагмы.
- Стадия 3. Поражаются лимфатические узлы по другую сторону диафрагмы.
- Стадия 4. Опухолевый процесс выходит за границы лимфатической системы и распространяется на внутренние органы.
Кроме того, в ходе диагностики заболевания принято разделять лимфому Беркитта на категорию А или В.
- Категория А — бессимптомное течение болезни.
- Категория В — на фоне развития лимфоопухолевого процесса возникает истощение, усиливается потоотделение, повышается температура тела.
Лечение лимфомы Беркитта
Лимфома Беркитта быстро растет, и поэтому лечение обычно начинается как можно скорее. Химиотерапия с антителами ритуксимаба рекомендуется для лечения лимфомы Беркитта, даже если заболевание локализованное (обнаруживается только в одном месте), так как растет она быстра. Тем не менее, некоторым людям также может быть проведена операция по удалению крупных опухолей или непроходимости кишечника.
При химиотерапии используется комбинация лекарств — каждый препарат убивает клетки лимфомы по-своему. Лечение проводится циклически, лекарства назначаются в определенные дни, после чего следует период отдыха перед началом следующего цикла.
Лечение лимфомы Беркитта интенсивно. Скорее всего, вам придется оставаться в больнице в течение нескольких месяцев, пока будете проходить лечение. На это есть несколько причин:
- каждая процедура занимает несколько дней, чтобы ее можно было провести;
- вам нужны процедуры для поддержания тела во время лечения, например, жидкости для поддержания нормальной работы почек;
- нужно много тестов после лечения, чтобы проверить, хорошо ли работают органы, и проверить показатели крови.
Поскольку лимфома Беркитта может распространиться на центральную нервную систему, большинству людей также проводиться химиотерапия, которая может достичь их ЦНС. Это может включать интратекальную химиотерапию, то есть химиотерапию, проводимую с помощью люмбальной пункции в жидкости вокруг спинного мозга. Таким способом можно давать только определенные лекарства, например метотрексат и цитарабин. Иногда лекарства, которые попадают в ЦНС, можно вводить внутривенно (в вену).
Умирающие клетки выделяют химические вещества по мере их разрушения. Если много клеток разрушаются одновременно, тело может бороться, чтобы избавиться от лишних химикатов. Это может вызвать серьезные проблемы с почками и сердцем.
Существуют эффективные методы лечения синдрома лизиса опухоли. Если специалист считает, что вы подвержены риску синдрома лизиса опухоли, вам могут назначить такие препараты, как аллопуринол и расбуриказа, чтобы предотвратить синдром.
Рецидивирующая или рефрактерная лимфома Беркитта
Рецидивирующая или рефрактерная лимфома Беркитта может трудно поддаватся лечению. В обеих ситуациях специалист может предложить вам более сильное лечение или экспериментальное лечение в рамках клинического испытания. Если вы решите отказаться от дальнейшего лечения, вы можете получить паллиативную помощь для контроля своих симптомов. Ваш специалист обсудит с вами все варианты.
Прогноз
Лечение лимфомы Беркитта является достаточно трудоемким и долгим процессом, но многие люди вылечиваются.
Большинство детей лечатся с помощью современных стандартных методов терапии, и результаты лечения часто очень хороши у молодых людей. Лимфому Беркитта может быть сложнее лечить у пожилых людей, которые, как правило, менее способны переносить интенсивное и долгое лечение.
Статистика выживания может сбивать с толку, так как она не говорит, каков индивидуальный прогноз, — она только говорит лишь о том, как группа людей с одинаковым диагнозом выживала в течение определенного периода времени.
Ваша медицинская команда будет рада проконсультировать вас относительно ваших перспектив, основываясь на ваших индивидуальных обстоятельствах. Они могут использовать результаты анализов и принимать во внимание другие “факторы риска”, такие как возраст, симптомы и другие состояния. С их помощью они могут предсказать, какова вероятность того, что вы отреагируете на конкретное лечение.
Читайте также:

