Реестр клинических исследований по онкологии в россии
Существует несколько вариантов поиска клинических исследований противоопухолевых препаратов, проходящих в настоящий момент в России:
В реестре разрешенных клинических исследований содержится список медицинских центров в России, в которых проводится исследование каждого нового противоопухолевого препарата.

Основные параметры поиска - "Наименование лекарственного препарата" или "Наименование протокола". Это удобно, если вы знаете, что вам показано лечение конкретным новейшим дорогостоящим препаратом - если по нему проводится клиническое исследование, у вас будет шанс получить лечение бесплатно. Если вы не знаете ни название препарата, ни протокол, то посмотрите все клинические исследования за последний год. Для этого введите нужные даты в графу "Дата создания РКИ".
Если вы нашли подходящее исследование, то всю необходимую информацию вы получите по телефону центра, в котором оно проходит, или фармацевтической компании, организующей исследование.
Исследования разбиты по нозологиям и по критериям включения, что делает поиск подходящего исследования легким и удобным.
3. Чаще всего пациенты узнают о подходящем исследовании от лечащего врача. Поэтому спросите своего врача-онколога, известно ли ему о клинических исследованиях, которые подходят для вас. Не поленитесь и спросите об исследованиях, которые могут быть доступны в других крупных федеральных онкологических центрах, куда вы могли бы ездить, а лучше составьте список федеральных онкоцентров Москвы и Санкт-Петербурга и обзвоните их.
4. Свяжитесь сами с представителями фармацевтических компаний. Обратите внимание, что фармацевтические компании могут только предложить вам информацию о тех клинических исследованиях, которые они проводят.
5. Для удобства поиска мы будем публиковать на этой странице информацию о текущих клинических исследованиях в области онкологии, проходящих в России. Если вы владеете актуальной информацией о клиническом исследовании противоопухолевых препаратов, пожалуйста, присылайте нам описание исследования на электронную почту info@worldofoncology.com
В описании укажите основные данные - изучаемое заболевание, тип исследования, цель, место и сроки проведения, основные критерии включения и основные оцениваемые факторы, а также контактную информацию.
2.Больные ранее получали химиотерапию по поводу метастатической меланомы
3.Наличие в опухоли мутации V600 в гене BRAF
Возраст ≥18 лет
Гистологически и/или цитологически подтвержденная метастатическая (IV стадия по классификации TNM) или рецидивирующая аденокарцинома легкого, либо крупноклеточная карцинома легкого, либо НМРЛ без дополнительных уточнений (БДУ)
Статус функционального состояния по шкале ECOG на момент проведения скрининга – от 0 до 1
Наличие подтвержденного диагноза НМРЛ IV стадии
Наличие адекватного опухолевого материала FFPE (опухолевый блок или микропрепараты), полученного в результате биопсии, хирургической резекции или тонкоигольной аспирационной биопсии, для определения статуса мутации KRAS
Прогрессирование заболевания после химиотерапии на основе производных платины и получение 1 другого режима предшествующей химиотерапии по поводу местнораспространенного и/или метастатического заболевания ИЛИ невозможность получения последующей стандартной химиотерапии второй линии, по оценке лечащего врача.
2. Пациенту ранее не проводилось лечение плококлеточного НМРЛ IV стадии. У пациентов с сенсибилизирующими мутациями гена РЭФФР должно наблюдаться прогрессирование заболевания (во время или после лечения) или непереносимость к эрлотинибу, гефитинибу или другим ингибиторам тирозинкиназ (ИТК) рецептора РЭФР, подходящим для лечения НМРЛ с мутациями гена РЭФР. У пациентов с установленным химерным онкогеном ALK должно наблюдаться прогрессирование заболевания (во время или после лечения) или непереносимость лечения одним или несколькими ингибиторами ALK (т. е. кризотинибом), подходящих для лечения НМРЛ у пациентов с химерным онкогеном ALK.
2. Пациентам должна быть выполнена полная резекция НМРЛ за 4-12 недель (≥28 дней и ≤84 дней) до включения в исследование при обязательном соответствующем восстановлении после хирургической операции.
3. Допускается любой из следующих типов резекции: лобэктомия, циркулярная лобэктомия, билобэктомия или пульмонэктомия.
Немелкоклеточный рак легкого IIIB или IV стадии, ALK-позитивный
Проведенные 2 линии системной терапии: платиносодержащая химиотерапия и терапия кризотинибом по поводу местнораспространенного или метастатического немелкоклеточного рака легкого
Наличие измеряемых очагов
При наличии метастазов ЦНС и показанной радиотерапии последняя должна быть завершена за 14 дней до включения пациента
АДАУРА
Двойное слепое, рандомизированное, плацебо контролируемое, многоцентровое исследование 3-й фазы для изучения эффективности и безопасности препарата AZD9291 в сравнении с плацебо у пациентов с немелкоклеточной карциномой легкого стадии IB-IIIA с положительной мутацией рецептора эпидермального фактора роста после полной резекции опухоли с наличием или без предшествующей адъювантой химиотерапии
Немелкоклеточный рак легкого IB-IIIA ст., состояние после радикального хирургического лечения
Включение пациента в исследование возможно, если после хирургического лечения прошло не более 10 недель (в случае проведения адъювантной химиотерапии – не более 26 недель)
Исключение – гепатиты, ВИЧ инфекция
2. Немелкоклеточный рак легкого IIIb или IV стадии
3. Возраст не менее 18 лет (включительно)
4.Ожидаемая продолжительность жизни 12 недель и более
5.Функциональный статус по шкале ВОЗ 0-2 балла
6.Предшествующая терапия кризотинибом по поводу местнораспространенного или метастатического немелкоклеточного рака легкого
Многоцентровое, рандомизированное, открытое исследование для оценки системных уровней, эффективности и безопасности серитиниба в дозах 450 мг и 600 мг при приеме с пищей, содержащей небольшое количество жира, по сравнению с приемом серитиниба в дозе 750 мг натощак у взрослых пациентов с метастатическим немелкоклеточным раком легкого при наличии реаранжировки ALK (с ALK-позитивным статусом)
2.Документация экспрессии HER2 или амплификации гена HER2 в инвазивном компоненте первичной опухли или метастатической локализации, что определяется как: 3+ по результатам иммуногистохимического анализа и/или амплификация гена HER2/neu по результатам флуоресцентной, хромогенной или усиленной серебром гибридизации in situ [FISH, CISH или SISH; ≥6 копий гена HER2/neu на 1 ядро или отношение по результатам FISH, CISH или SISH (количество копий гена HER2 к сигналам Хромосомы 17) ≥2,0 ИЛИ отношение HER2/Хромосома 17 ≤2,0 со средним количеством копий HER2 ≥6 сигналов/ядро клетки].
Мужчины и женщины старше 18 лет
Гистологически или цитологически подтвержденный рак молочной железы, местнорецидивирующий или метастатический
Местнорецидивирующее заболевание не должно поддаваться радикальной хирургической резекции или лучевой терапии
С документально подтвержденной мутацией генов BRCA1 или BRCA2
Пациенты с HER2-положительным статусом должны получить в прошлом хотя бы одну стандартную HER2-направленную терапию с прогрессированием заболевания на ее фоне или быть неподходящими кандидатами для анти-HER2 терапии
Наличие измеримого или неизмеримого (но поддающегося радиологической оценке) очага (по критериям RECIST версия 1.1)
Пациенты с гистологическим диагнозом локализованная первичная стромальная опухоль желудочно-кишечного тракта (GIST)
Пациенты с первичным опухолевым очагом, измеримым с помощью традиционных методов или спиральной КТ, оцененным до резекции опухоли
Не получавшие терапию иматинибом пациенты, либо прекратившие прием иматиниба в качестве адъювантной терапии по другим причинам, кроме прогрессии (т. е., нежелательные явления, решение пациента, пациенты, получившие полный курс терапии иматинибом в качестве адъюватной терапии)
Многоцентровое рандомизированное клиническое исследование 2 фазы по оценке эффективности и безопасности неоадъювантной химиолучевой терапии
(СОД 46 Гр CAPOX)
с последующей гастрэктомией D2 и адъювантной химиотерапией (CAPOX/FOLFOX) у больных местно-распространенным раком желудка.
Первичный, морфологически подтвержденный местно-распространенный рак желудка (сT3-4N0-3М0).
Отсутствие распространения опухоли на пищевод и двенадцатиперстную кишку.
Возраст больных от 18 до 75 лет.
Статус активности по ВОЗ (ECOG) – 0-2.
Адекватные показатели кроветворения, функции почек и печени.
Адекватные показатели деятельности сердечно-сосудистой и дыхательной систем.
Отсутствие активных инфекционных, психических заболеваний, выраженных аллергических состояний, а также другой патологии, которая может помешать проведению предусмотренных протоколом лечебных и диагностических мероприятий.
Отсутствие вторых, синхронных и метахронных, злокачественных опухолей.
Метастатическая аденокарцинома поджелудочной железы
Гистологическое/цитологическое подтверждение очагов метастатического характера
Отсутсвие в анамнезе терапии метастатического рака поджелудочной железы
Адекватная функция костного мозга (нейтрофилы более 1500, тромбоциты более 100, гемоглобин более 100)
Без метастатического поражения головного мозга
Пациенты с ВИЧ инфекцией не допускаются к исследованию
Не допускаются пациенты с микст-гепатитами (В С, B D)
Пациенты с хроническими гепатитами В включаются в исследование после эффективной противовирусной терапии (обнаружение в крови ДНК вируса гепатита В
В НМИЦ онкологии им. Н.Н. Петрова проводится более ста клинических исследований лекарственных препаратов разных фаз. Инициаторами клинических испытаний противоопухолевых препаратов являются их разработчики — зарубежные и российские фармкомпании. Также ведутся собственные инновационные разработки различных препаратов.
- Совместное составление
программы испытания
медицинских изделий - Своевременный результат
- Соответствие требованиям национальных стандартов
- Высокоточное современное оборудование
В НМИЦ онкологии им. Н.Н. Петрова изучается действие современных лекарственных препаратов, применяемых в терапии злокачественных новообразований легких, молочной железы, кишечника, меланомы и других.
Контроль за соблюдением прав пациента осуществляется Минздравом РФ и этическим комитетом центра. Желающих принять участие в клинических исследованиях информируют обо всех планируемых в рамках исследования диагностических и лечебных процедурах и предупреждают о том, что данный препарат для них может оказаться неэффективным. Пациенту необходимо досконально познакомиться с особенностями исследования и подписать информационный лист и форму информированного согласия. Участники обязаны четко соблюдать требования протокола исследования и график визитов в центр.
Получить новый современный противоопухолевый препарат - это шанс остановить развитие болезни, улучшить качество жизни
Участие в клинических исследованиях во многих отношениях привлекательно для онкологических больных.
В сравнительных исследованиях новый препарат сравнивается с существующим, стандартным способом лечения. То есть контрольная группа тоже получает качественное, строго контролируемое лечение, но ни в коем случае не пустышку-плацебо. Кроме того, в рамках протокола исследования пациенту выполняется обследование за счет спонсора - фармацевтической компании.
Некоторые лекарственные препараты, уже зарегистрированные за границей, проходят фазу клинических исследований у нас, так как по закону регистрация любого препарата в России возможна только, если его клинические испытания проводились с участием российских пациентов. Возможность получить лечение такими препаратами в рамках клинических исследований – еще один аргумент в пользу участия в исследовании.
В настоящее время в НМИЦ онкологии им. Н.Н. Петрова проводятся испытания:
- Противоопухолевых препаратов, воздействующих на распространенные формы опухолевого процесса;
- Противоопухолевых препаратов, повышающих эффективность хирургического лечения;
- Препаратов, снижающих побочные действия от противоопухолевой терапии;
- Препаратов для симптоматической терапии.
Заполните, пожалуйста, анкету, и наши специалисты будут искать подходящее для Вас клиническое исследование.

Руководитель отдела: Полторацкий Артем Николаевич

вместе создадим единую базу клинических исследований в онкологии
- Руководства ESMO
- Помощь пациентам в период пандемии COVID-19
- Руководства RUSSCO
- Школа жизни онкологического пациента во время коронавируса (интервью члена Правления RUSSCO, проф. Н.В. Жукова)
Клинические исследования, которые проходят в данный момент
Многоцентровое, рандомизированное, открытое клиническое исследование фазы 3 в трех группах применения препаратов энкорафениб, цетуксимаб совместно с биниметинибом или без него, по сравнению с применением препаратов иринотекан/цетуксимаб или инфузионной терапии с применением 5-фторурацила (5-ФУ)/ фолиновой кислоты (ФК)/ иринотекана (FOLFIRI)/ цетуксимаба с определением безопасной дозы введения комбинации препаратов энкорафениб, бениметиниб, цетуксимаб для лечения пациентов с метастатическим коларектальным раком с мутацией BRAF V600E
Рандомизированное двойное слепое плацебо-контролируемое исследование для сравнения двух гуманизированных моноклональных антител направленного специфического действия против фактора роста эндотелия сосудов, применяемых в сочетании с химиотерапией по модифицированной схеме FOLFOX6 у пациентов с нерезектабельной метастатической колоректальной опухолью
TASCO1
Открытое рандомизированное исследование II фазы по оценке эффективности комбинации препарата TAS-102 с бевацизумабом и комбинации капецитабина с бевацизумабом у пациентов с метастатическим колоректальным раком, ранее не получавших лечение по поводу распространенного опухолевого процесса и которым не показано проведение интенсивной химиотерапии
Двойное слепое рандомизированное плацебо-контролируемое исследование III фазы препарата нинтеданиб в комбинации с оптимальной поддерживающий терапией (ОПТ), по сравнению с плацебо в комбинации с ОПТ, у пациентов с колоректальным раком, устойчивым к стандартному лечению
Рандомизированное двойное слепое плацебо-контролируемое многоцентровое международное исследование III фазы дурвалумаба или комбинации дурвалумаба с тремелимумабом в качестве консолидирующей терапии у пациентов с локализованным мелкоклеточным раком легкого I-III стадии, у которых не произошло прогрессирование после одновременной химиолучевой терапии (ADRIATIC)
Рандомизированное двойное слепое плацебо-контролируемое многоцентровое международное исследование III фазы дурвалумаба или комбинации дурвалумаба с тремелимумабом в качестве консолидирующей терапии у пациентов с локализованным мелкоклеточным раком легкого I-III стадии, у которых не произошло прогрессирование после одновременной химиолучевой терапии (ADRIATIC)
База, на которой проводится исследование:
Международное, рандомизированное, открытое исследование 3 фазы препарата REGN2810 (анти-PD 1 антитело) по сравнению с химиотерапией препаратами платины в качестве первой линии терапии у пациентов с распространенным или метастатическим PD-L1-положительным немелкоклеточным раком легких
Рандомизированное, открытое исследование 3 фазы комбинации препарата REGN2810 (анти-PD 1 антитело), ипилимумаба и двухкомпонентной схемы химиотерапии производными платины в терапии первой линии пациентам с распространенным или метастатическим немелкоклеточным раком легкого и уровнем экспрессии в опухоли PD-L1 менее или равно 50%
Открытое многоцентровое исследование III фазы, проводимое для сравнения действия препарата авелумаб с действием двухкомпонентной химиотерапией препаратами платины при их применением в качестве первой линией терапии рецидивирующего или PD-L1-положительного немелкоклеточного рака легкого IV стадии
Протокол № EMR 100070-005
Многоцентровое исследование 2 фазы с целью изучения пероральной терапии ингибитором cMET, препаратом INC280 у взрослых пациентов с распространенным немелкоклеточным раком легкого при немутантном статусе EGFR (WT)
2) Аболмасов Александр Евгеньевич
+7 (925) 928-51-59
Открытое многоцентровое рандомизированное исследование 3 фазы по изучению эффективности и безопасности препарата BGB-A317 (анти-PD1 антитела) по сравнению с доцетакселом у пациентов с немелкоклеточным раком легкого и прогрессированием заболевания после курса платиносодержащей химиотерапии
Рандомизированное открытое исследование фазы 3 применения Бригатиниба (Алунбриг™) в сравнении с Алектинибом (Алеценса ® ) у пациентов с распространенным ALK-позитивным немелкоклеточным раком легких, у которых возникла прогрессия заболевания на фоне применения Кризотиниба (Ксалкори ® )
Многоцентровое рандомизированное, двойное слепое, плацебо-контролируемое исследование III фазы, проводимое с целью оценки эффективности и безопасности анаморелина гидрохлорида, применяемого для восполнения дефицита массы тела и лечения анорексии, развившихся на фоне распространенного немелкоклеточного рака легкого у взрослых пациентов
Двойное слепое, рандомизированное, проводимое в параллельных группах исследование 3-й фазы с использованием активного препарата в качестве контроля с целью сравнения эффективности и безопасности препарата CT-P16 и разрешенного в ЕС препарата Авастин, применяемых в качестве первой линии терапии метастатического или рецидивирующего неплоскоклеточного немелкоклеточного рака легкого
Протокол № CT-P16 3.1
Рандомизированное, двойное слепое, многоцентровое исследование III фазы для оценки эффективности, безопасности, фармакокинетики и иммуногенности исследуемого препарата SB8 (предлагаемого биоаналога бевацизумаба) в сравнении с препаратом Авастин ® у пациентов с метастатическим или рецидивирующим неплоскоклеточным немелкоклеточным раком легкого
2) Козлов Вадим Викторович
+7 (913) 463-828-6
2) Бабина Ксения Геннадьевна
+7 (968) 267-77-76
Открытое исследование препарата афатиниб у пациентов с местнораспространенным или метастатическим немелкоклеточным раком легкого с мутацией рецептора эпидермального фактора роста, ранее не получавших лечение или предварительно получавших химиотерапию
Рандомизированное, двойное-слепое, плацебо-контролируемое исследование III фазы по изучению ARQ 197 плюс эрлотиниб vs эрлотиниб у ранее леченых пациентов с местно-распространенным или метастатическим неплоскоклеточным немелкоклеточным раком легкого
Программа расширенного доступа к ИПИЛИМУМАБУ для больных глиобластомой и глиомой
Mногоцентровое, рандомизированное, открытое исследование III фазы Атезолизумаба (антитело к PD-L1) в комбинации с адъювантной химиотерапией на основе антрациклина/таксана в сравнении только с химиотерапией у пациентов с операбельным трижды негативным раком молочной железы
Двойное слепое рандомизированное исследование III фазы, проводимое в параллельных группах, по сравнению эффективности, безопасности и иммуногенности TX05 и препарата Герцептин ® у пациентов с ранней стадией HER2-положительного рака молочной железы
Двойное слепое продолженное исследование для проведения адъювантной монотерапии препаратом Герцептин ® или препаратом TX05 для продолжения оценки безопасности и иммуногенности у пациентов с ранней стадией HER2-положительного рака молочной железы после проведения неоадъювантной терапии и хирургической резекции в рамках протокола TX05-03
Рандомизированное открытое исследование 3 фазы по оценке препарата абемациклиб в комбинации со стандартной адъювантной эндокринной терапией по сравнению с применением только стандартной адъювантной эндокринной терапии у больных раком молочной железы на ранней стадии, с высоким риском развития рецидива, поражением регионарных лимфатических узлов, с положительным статусом гормональных рецепторов и отрицательным статусом рецептора эпидермального фактора роста человека 2-го типа
Рандомизированное, многоцентровое, открытое, III фазы исследование лапатиниба плюс капецитабин или трастузумаб плюс капецитабин упациенток с Her2/neu позитивным метастатическим раком молочной железы ранее получавших антрациклины и таксаны
Международное проспективное открытое многоцентровое неинтервенционное исследование OPTIMIS.
Изучение результатов лечения больных гепатоцеллюлярным раком, получавших или не получавших сорафениб после трансартериальной химиоэмболизации (ТАХЭ), и влияние времени начала терапии сорафенибом
Многоцентровое открытое исследование 1b фазы с эскалацией дозы по изучению безопасности и переносимости препарата квинакрин у пациентов с опухолевыми заболеваниями печени различного происхождения
Многоцентровое рандомизированное открытое исследование (3 фаза) эффективности и безопасности Ленватиниба (E7080) в сравнении с Сорафенибом в первой линии лечения больных неоперабельным печеночно-клеточным раком
Рандомизированное многоцентровое двойное слепое исследование III фазы препарата регорафениб у больных ГЦР, ранее получавших сорафениб
Рандомизированное, двойное-слепое исследование II фазы по сравнительной оценке режимов рамуцирумаба в комбинации с цисплатином и гемцитабином; мерестиниба в комбинации с цисплатином и гемцитабином или плацебо в комбинации с цисплатином и гемцитабином в качестве первой линии терапии у пациентов с распространенным или метастатическим раком желчевыводящих путей
JAVELIN BLADDER 100
Многоцентровое, международное, открытое, рандомизированное, проводимое в параллельных группах исследование 3-й фазы, в котором Авелумаб (MSB0010718C) в комбинации с наилучшей симптоматической терапией сравнивается с наилучшей симптоматической терапией в качестве поддерживающего лечения у пациентов с местно-распространённым или метастатическим уротелиальным раком, который не прогрессировал после завершения первой линии химиотерапии на основе препаратов платины
2) Аболмасов Александр Евгеньевич
+7 (925) 928-51-59
Многоцентровое, рандомизированное, двойное слепое исследование III фазы для оценки эффективности и безопасности препарата BIBIF 1120 в комбинации с карбоплатином и паклитакселом в сравнении сплацебо в комбинации с карбопалином и паклитакселом у пациентов с распространенным раком яичников
Многоцентровое, двойное слепое, плацебо-контролируемое, рандомизированное исследование II фазы по изучению омрабулина у больных с чувствительным к препаратом платины рецидивирующим раком яичников, получающих карбоплатин/паклитаксел
MK1775 в сочетании с карбоплатином и паклитакселом при платиночувствительном раке яичников
Эффективность и безопасность Пембролизумаба у пациентов с прогрессией распространенного рака яичников (KEYNOTE 100)
Рандомизированное двойное слепое плацебо-контролируемое исследование III фазы эффективности и безопасности копанлесиба в комбинации с ритуксимабом у пациентов с рецедивами индолетных В-клеточных лимфом (иНХЛ) – CHRONOS-3
Исследование II/III фазы по оценке продолжительности тяжелой нейтропении при лечении плинабулином в сравнении с пэгфилграстимом у пациентов с солидными опухолями, получающих миелосупрессивную химиотерапию доцетакселом
Мультинозологичное исследование: анализ предиктивных биомаркеров для применения пембролизумаба при распространенных солидных опухолях (KEYNOTE 158)
* Критерии включения и исключения представлены не в полном объёме
Для многих пациентов с ХЦР и другими видами онкологии, исчерпавшими стандартные схемы лечения, остро встаёт вопрос поиска клинических исследований (КИ).⠀
Пока я оставлю в стороне аргументы в пользу КИ, фазы КИ и озвучу несколько практических моментов, которые могут помочь в поиске КИ.⠀
Основная проблема поиска — в России НЕТ единой базы КИ.⠀
Вопрос о наличии КИ для вашего диагноза стоит задавать всем врачам, связанным с онкологией, на вашем пути.⠀
Однако полную картину вам даст только международная база CLINICALTRIALS. GOV.⠀

Как пользоваться базой:⠀
Заходите на сайт и открываете расширенный поиск Advanced Search.⠀

В открывшейся форме поиска для начала выбираете:⠀"Condition or disease" — диагноз, например, cholangiocarcinoma.⠀
Выпадающий список позволит вам по первым буквам попробовать разные возможно также подходящие варианты, например, в случае ХЦР — Bile duct cancer и т. д.⠀
Также обязательно смотрите общие варианты типа Solid tumor — наличие опухолевого образования (т.е. НЕ "жидкие" формы, как рак крови).⠀
Далее в разделе "Recruitment" отмечаете галочкой Recruiting (т.е. КИ, в которые ведётся набор в данный момент).⠀
В разделе "Locations" — выбираете Russian Federation.⠀Жмём внизу Search и детально изучаем результаты поиска.⠀
Для ХЦР сейчас в России очень мало КИ, поэтому пробуйте менять поиск:⠀
Жмём вверху уже сделанного поиска Modify Search, затем снова Advanced Search и пробуем, например, изменить географию: убрать Russian Federation, поставить какую-либо другую страну или вообще убрать все и смотреть по всему миру.⠀
Нередко пациенту из России можно попасть в КИ за рубежом (например, в случае недобора собственных граждан).⠀
Это необходимо отдельно уточнять с контактами.⠀
Я знаю примеры, когда пациенты из России уехали/им одобрили участие в КИ в Германии, США. Но в то же время в отдельных странах участие иностранцев может быть ограничено местным законодательством (требуется местная медстраховка, которую не получить, если вы не гражданин этой страны).⠀
Условия участия в КИ тоже могут быть разные — от внесения залоговой суммы до полной компенсации транспортных расходов, проживания и т. п. Это все зависит от условий каждого конкретного КИ.⠀Все очень индивидуально — отфильтровываете, изучаете максимально описание КИ и связываетесь с контактами, если КИ вас заинтересовало.⠀
Не стесняйтесь писать/звонить по контактам, указанным в разделе Contacts and Locations (включая общие для КИ Contacts, так и контакты в интересующих Locations), а также непосредственно самому спонсору КИ, указанному в разделе Sponsor. Как правило, спонсором выступает фармкомпания. По названию спонсора ищете в интернете контакты его представительства в России или центрального офиса. Но лучше начать с российского офиса.
Из своего опыта скажу, фармкомпании не раз помогали с информацией по КИ. Если будете звонить в российские представительства фармкомпаний, просите соединить вас с сотрудниками, занимающимися КИ.⠀

Обязательно запомните номер КИ, указанный вверху в описании каждого КИ. Это поможет в разговорах с фармкомпаниями и врачами сразу четко идентифицировать КИ, по которому у вас вопросы.⠀

Зачастую в разделе Contacts and locations КИ, ведущихся в том числе и в России, указано только — Russian Federation и нет подробной расшифровки, в каких медицинских учреждениях и в каких городах России ведётся данное КИ. Тогда связывайтесь для уточнения со спонсором или пробуйте искать данное КИ в реестре разрешений на проведение КИ (РКИ) Минздрава РФ (см ссылку: grls.rosminzdrav.ru/CIPermitionReg.aspx).⠀

Искать интересующее КИ из международной базы уже в реестре РКИ Минздрава можно опять же через поиск по ключевому слову.⠀Например, название исследуемого препарата (в интересующем найденном КИ в международной базе) вводите в поле "Наименование протокола" в российском реестре РКИ и жмёте "Найти".⠀Далее вам вывалится список КИ, просматриваете. В случае обнаружения искомого нажимаете на всю строку, и вам открывается перечень медицинских учреждений(. ), включая Москву, СПб и регионы, где проводится данное КИ.⠀
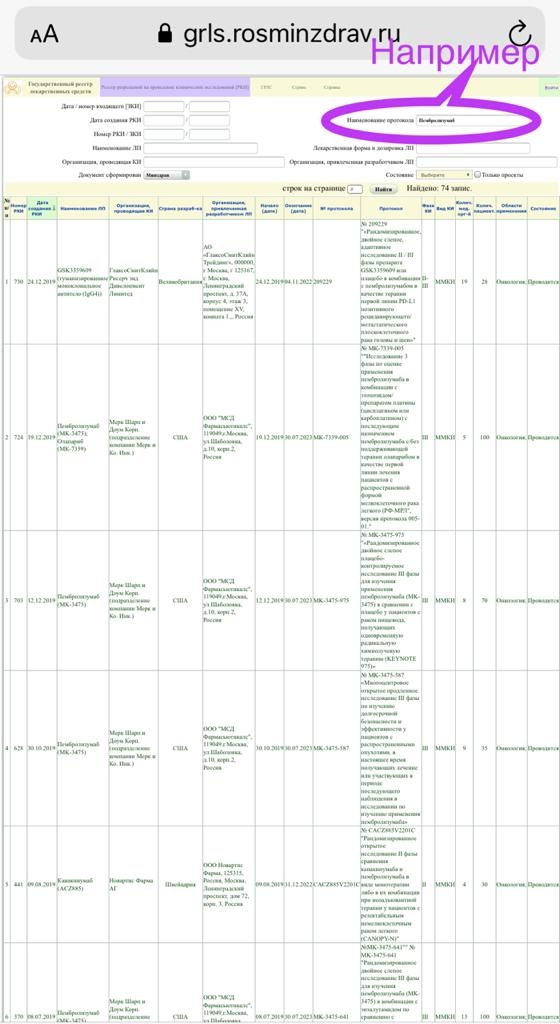

В описании КИ в международной базе вам критично просмотреть хотя бы следующие разделы:
- Study description (хотя бы brief summary)
- Arms and interventions
- Eligibility criteria (хотя бы inclusion criteria)⠀


Поверьте, вам не потребуется глубоких медицинских знаний и глубокого знания английского, чтобы хотя бы в первом приближении понять, подходит ли КИ по возрасту пациента, предыдущей истории лечения, по сути самого КИ.⠀
Далее вы начинаете искать врачей, ведущих данное заинтересовавшее вас КИ, для дальнейшего разговора либо ищете дальше другие КИ.⠀
Участие в КИ часто ваш шанс на доступ к самым современным технологиям и препаратам, к самым последним научным разработкам в онкологии, а значит, шанс на выживание.⠀
Используйте этот шанс, ищите в базе!
Источник: Facebook Oncoliver
Встройте "Правду.Ру" в свой информационный поток, если хотите получать оперативные комментарии и новости:
Подпишитесь на наш канал в Яндекс.Дзен или в Яндекс.Чат
Добавьте "Правду.Ру" в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.
Читайте также:
- Методы обследования при раке яичника
- Киста давит на мочеточнике
- Можно ли принимать менорил при онкологии
- Надежда кадышева больна раком чего
- Т я свищева профилактика рака возможна возбудитель рака открыт

