Рецидив после химиотерапии при колоректальном раке
5-летняя выживаемость для рака ободочной и прямой кишки могла бы достигать примерно 90 и 80 % соответственно, если диагностику и лечение осуществлять до распространения опухоли за пределы кишки и до начала метастазирования в регионарные лимфоузлы и отдаленные органы.
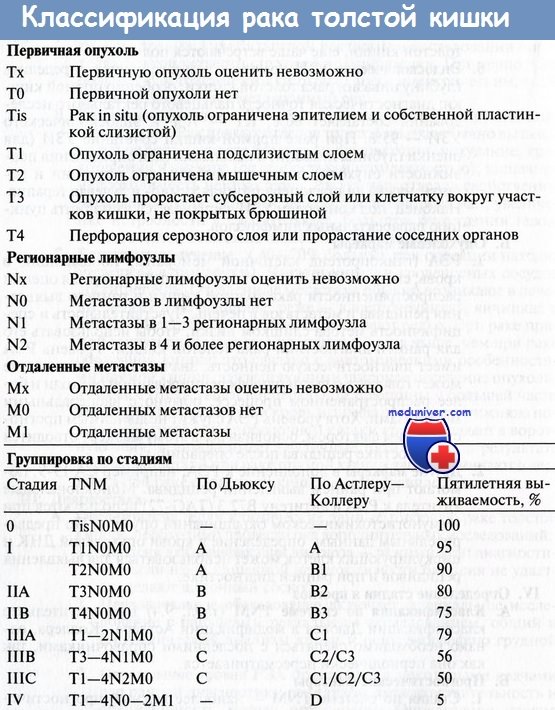
В достижении этой цели большая роль принадлежит не только ранней диагностике, но и точному установлению стадии колоректального рака во время операции. Однако в 65 % случаев выявляют распространенные стадии заболевания, что ведет к снижению показателя общей 5-летней выживаемости до 50 %.
Рецидивирование при колоректальном раке происходит за счет местного распространения, или имплантации опухоли, а также лимфогенной и/или гематогенной диссеминации. Характерны местные и регионарные рецидивы, а также метастазы в легких и печени.
Рецидивирование колоректального рака практически никогда не начинается с развития отдаленных метастазов. Аутопсийные исследования подтверждают, что причиной смерти 75 % больных служат рецидивы и метастазы, локализующиеся в пределах брюшной полости. На долю типичных метастазов в легких и печени приходится менее 25 % всех летальных исходов.
Изолированные метастазы в печени, один или несколько в одной доле, наблюдаемые в немногочисленных случаях, представляют большой интерес и остаются предметом активного изучения. Раннее их выявление с помощью КТ позволяет достичь выживаемости на уровне 18—24 мес. У некоторых пациентов после инфузии 5-ФУ непосредственно в портальную вену отмечалась впечатляющая регрессия, хотя период наблюдения за ними непродолжительный. Этот метод представляется эффективным для данной категории больных.
5-летняя выживаемость таких пациентов составляет около 30 % при условии выполнения повторной радикальной операции. Однако к настоящему времени не проведены контрольные исследования эффективности повторной хирургической ревизии (second-look) с радикальной резекцией (при необходимости), поводом для выполнения которых послужил бы повышенный уровень РЭА у пациентов с КРР после первичного лечения.
Приблизительно у 35 % больных раком толстой кишки на момент операции поражены регионарные лимфоузлы; 25—35 % из них достигнут 5-летней выживаемости. Через 2 года после операции по поводу колоректального рака рецидивы появляются приблизительно у 60 % пациентов, а через 5 лет — у 90 %. Несмотря на такой высокий показатель рецидивирования после первичной радикальной операции, вероятность излечения отдельных больных все же остается.
Например, рецидив аденокарциномы ободочной или прямой кишки на месте анастомоза после первичного хирургического вмешательства у многих пациентов может быть успешно устранен во время повторных операций. Эта особая группа больных характеризуется удивительно высокими показателями выживаемости.
Первоочередной задачей считается тщательное наблюдение и обследование пациентов с колоректальным раком. Знание о характере распространения этого опухолевого процесса позволяет сформулировать ряд клинических рекомендаций. Можно выделить области, характеризующиеся высоким риском рецидивов, что обусловит их раннюю диагностику с последующим выполнением паллиативного или радикального хирургического лечения. Исчерпывающий сбор анамнеза заболевания и полное физикальное исследование — важные этапы оценки состояния больного.
Большую роль при выявлении рецидивов играет пальцевое ректальное исследование и гваяковая проба на скрытую кровь в кале.
Необходимо помнить об условиях, которые могут приводить к ложному результату теста на скрытую кровь. Врач должен убедиться, что пациент в течение последних 48 ч не употреблял в пищу полусырое мясо, турнепс (репу) или хрен. Не следует принимать аспирин или пищевые добавки с витамином С в дозе более 250 мг/сут. При наличии жалоб на кровотечение из прямой кишки или положительного результата анализа кала на скрытую кровь необходимо выполнить ректороманоскопию. Если при эндоскопии патологии не выявлено, пациенту следует назначить ирригоскопию с двойным контрастированием или колоноскопию.
Колоноскопия играет важную роль в скрининге рака у пациентов из группы риска. Многие врачи рекомендуют выполнять колоноскопию каждые 6 мес. в течение первого года или двух, а затем 1 раз в год.
Если у человека с онкологическим заболеванием после лечения не находят признаков рака, врачи обычно говорят о ремиссии (исчезновении симптомов), а не излечении. Почему? К сожалению, при онкологических заболеваниях никогда с уверенностью нельзя сказать, что в организме не осталось раковых клеток: на исследованиях их может быть не видно, но потом они разрастутся и нужно будет снова проходить лечение. Так бывает, например, если остались неиссеченными края опухоли или по организму распространились метастазы, которые на момент постановки диагноза ещё не были заметны. То есть рак может рецидивировать в другом месте. Поэтому после операции нередко врач назначает химиотерапию или лучевую терапию, чтобы уничтожить оставшиеся раковые клетки.
Если рак возвращается, то обычно это происходит в первые два года. Если рецидив не случился в первые пять лет, скорее всего, он уже не произойдёт. Но нужно сказать, что риск повторного развития рака выше, чем первичного, так как химиотерапия и лучевая терапия сами по себе повышают риск развития онкологических заболеваний.

Как предотвратить рецидив?
Случится ли рецидив после ремиссии, зависит от разных факторов. И поведение бывшего пациента также может влиять на это.
Если рак предстательной железы (РПЖ) рецидивирует, то чаще всего это происходит в первые пять лет. Поэтому после окончания лечения важно каждые полгода проводить тесты на онкомаркер ПСА (простат-специфический антиген). Также необходимо ежегодно проводить пальцевое ректальное исследование, если во время лечения применялась лучевая терапия. Кроме того, рекомендуется через год после окончания лечения сделать биопсию простаты. Дальнейшая тактика наблюдения определяется врачом.
Нужна ли какая-то особая диета, чтобы снизить риск рецидива? По всей видимости, потребление жиров, особенно насыщенных, влияет на возвращение рака простаты. Другими словами, многие сыры, необезжиренное молоко, сливочное масло, сосиски, бекон, говядина, пицца, — это то, что стоит исключить из рациона.
Что касается физической активности, есть данные, указывающие на её помощь в снижении риска рецидива рака предстательной железы.
Известно, что ожирение при диагностике рака простаты ухудшает прогноз: в частности, обычно опухоль в этом случае более агрессивна, склонна к более широкому распространению. Однако непонятно, улучшит ли перспективы похудение после постановки диагноза и снизит ли это риск рецидива.
Риск рецидива онкологии молочной железы во многом зависит от степени поражения до начала лечения, наличия гормональных рецепторов у опухоли, возраста пациентки и т. д. При раке молочной железы есть несколько больше способов профилактики, чем при других видах онкологических заболеваний. Например, известно, что удаление молочных желёз (и поражённой, и здоровой) снижает риск рецидива. Если опухоль имеет гормональные рецепторы, женщине уже во время лечения могут назначить гормональную терапию, которая продолжится даже при ремиссии (до 5 лет). В дальнейшем рекомендуется проходить обычные для женщин этого возраста исследования (то есть УЗИ молочных желёз до 45 лет и маммографию — после), а также осмотры у врача с той частотой, с которой рекомендует доктор.

Стоит ли после выхода в ремиссию как-то менять свой образ жизни? Установлено, что умеренная физическая нагрузка (не менее 9 часов в неделю, эквивалентные по энергозатратам трём часам ходьбы в среднем темпе) способствует лучшему прогнозу. Однако рекомендаций по наиболее подходящему виду активности нет.
Если у женщины на момент обнаружения рака молочной железы диагностировано ожирение, то при последующей ремиссии риск рецидива оказывается больше. Набор веса после выздоровления также может способствовать повторному развитию заболевания. При этом остаётся неясным, можно ли снизить риск рецидива, похудев после постановки диагноза. Другими словами, при раке молочной железы помочь себе во многом можно до обнаружения РМЖ — поддержание нормального веса скажется на дальнейшем состоянии здоровья.
Что касается рациона, то неясно, влияет ли он на рецидив рака молочной железы. Но врачи рекомендуют употреблять больше фруктов и овощей.

После окончания лечения колоректального рака II или III стадии необходимо с частотой, рекомендуемой врачом, проходить медицинский осмотр, и анализы на раково-эмбриональный антиген (РЭА), а также ежегодно компьютерную томографию (КТ) и колоноскопию. Спустя 5 лет после окончания лечения можно перестать делать анализ на РЭА и КТ. Если лечение включало лучевую терапию, то возможно образование новых опухолей в области живота, хотя это бывает нечасто.
Нужно ли менять образ жизни, чтобы снизить риск рецидива колоректального рака? Серьёзных данных по вторичной профилактике (то есть профилактике рецидива) этого онкологического заболевания нет. Но врачебные ассоциации рекомендуют придерживаться тех же правил, что при первичной профилактике.
На основе имеющихся результатов исследований Американское онкологическое общество (The American Cancer Society) разработало рекомендации для людей, вышедших в ремиссию:
- Постарайтесь сохранять нормальный вес или похудейте, если имеются лишние килограммы. Здоровым считается индекс массы тела до 25 кг/м2 (то есть свой вес в килограммах нужно разделить на свой рост в метрах, возведённый в квадрат).
- Занимайтесь физическими упражнениями. Как минимум 30 минут в день, не меньше 5 дней в неделю.
- Питайтесь правильно, ешьте как минимум 5 порций фруктов и овощей в день. Сколько это? Одной порцией считается 2 мелких плода (например, 2 сливы), 1 средний плод (например, яблоко), половина большого плода (например, пол грейпфрута). Если речь идёт о приготовленных овощах, то 3 столовые ложки с горкой — это и есть одна порция. Картофель не учитывается, так как содержит очень много крахмала. Рекомендуется исключить из рациона красное мясо.
- Ограничьте потребление алкоголя до 1 порции в день для женщин и двух для мужчин. Одна порция — это 14 г чистого спирта, то есть 150 мл вина или 350 мл пива.
Считается также, что солнечное излучение негативно сказывается на риске рецидива. Поэтому не рекомендуется посещать солярии, а за 20 минут до выхода на яркое солнце пользоваться солнцезащитным средством.
Также важно помнить, что витамины и пищевые добавки не имеют доказанной эффективности в предотвращении рецидива, а некоторые даже небезопасны. Например, большие дозы витамина A, принимаемого в таблетках, повышают риск развития рака лёгкого у курильщиков, а витамин E увеличивает вероятность возникновения рака простаты.
Если говорить о других заблуждениях, то женщинам не стоит бояться беременеть: это никак не влияет на риск рецидива.
К сожалению, соблюдая все эти рекомендации, вы не можете точно знать, что рецидив не случится: изменение образа жизни лишь немного снижает риски. Поэтому если болезнь всё же вернулась, не стоит винить в этом себя.
Вероятность рецидива после радикальных резекций, выполненных по поводу рака в стадии II и III без признаков резидуальной опухоли (R0 резекция), составляет 40-50% случаев.
Углубление знаний о патофизиологии опухоли, доступность различных химиопрепаратов, более совершенные схемы адъювантной и неоадъювантной химиотерапии привели к признанию ее роли, продемонстрировав преимущество комбинированного подхода над хирургическим лечением в отношении ответа опухоли и выживаемости в больших группах больных раком.
Выбор конкретного препарата, схемы, пути введения, времени и продолжительности зависит от нескольких факторов: гистопатологических особенностей, стадии, первичных и вторичных очагов опухоли, общего состояния больного, ответа на лечение, побочных эффектов и выполненной или планируемой операции.
Доказательства преимуществ постоянно изменяются и обновляются по мере получения данных новых исследований.
Показания для химиотерапии:
• Рак толстой кишки, стадия III (TxN1-2).
• Рак толстой кишки, стадия IIВ (T4N0), в частности при перфорации.
• Рак толстой кишки, стадия IIА (ТЗ) с неблагоприятными особенностями: пери-туморальной лимфоваскулярной инвазией, неадекватным количеством исследованных лимфоузлов, низкой дифференцировкой.
• Рак прямой кишки, стадия II (u/T3-4N0) и III (u/pTxN1-2).
• Рак прямой кишки, стадия Т2 после трансанального местного иссечения.
Сумма доказательств эффективности химиотерапии рака толстой кишки
1. Стадия III колоректального рака:
• Послеоперационная химиотерапия в течение 6 месяцев является достаточной (у более длительного курса преимуществ нет).
• Непрерывное введение 5-FU/LV лучше, чем болюсное.
• Необходимость в левамизоле отсутствует.
• Комбинация 5-FU/LV и оксалиплатина лучше, чем 5-FU/LV.
• Капецитабин также эффективен и даже несколько лучше, чем 5-FU/LV.
• Эффективность адъювантной химиотерапии не зависит от возраста больного.
• Роль в адъювантном режиме таких препаратов, как иринотекан, цетуксимаб или бевацизумаб не документирована, но они являются предметом текущих исследований.
2. Стадия II колоректального рака:
• Не документированы преимущества в выживаемости при адъювантной терапии у больных со II стадией заболевания при стандартном риске.
• Химиотерапия при II стадии заболевания высокого риска выглядит логически оправданной, но спорной из-за отсутствия объективной проверки достоверности => необходимость в дальнейших исследованиях.
Альтернативы химиотерапии рака толстой кишки:
• Только операция: рак толстой кишки — стадия I (pT1-2N0), стадия IIА (pT3N0); у сохранных больных со II стадией рака толстой кишки при отсутствии неблагоприятных прогностических факторов рутинное применение адъювантной химиотерапии не рекомендуется.
• Радиотерапия или радиотерапия + операция: все реже применяемые методы при опухолях ЖКТ/аноректальной области.
Схемы адъювантной химиотерапии рака толстой кишки (колоректального рака)
1. Еженедельный болюс 5-FU+ лейковорин (Розвел Парк):
Болюсное введение 5-FU + лейковорин еженедельно в течение 6 недель, 2 недели перерыв => 3 цикла каждые 8 недель.
Показания. Стандартная схема, если имеются противопоказания или непереносимость оксали-платина.
Противопоказания. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты. Степень III и IV: диарея (40%), стоматит (1%), нейтропения (4%).
2. Ежемесячный болюс 5-FU+ лейковорин (Мэйо):
Болюсное введение 5-FU+ лейковорин с 1 по 5 день с последующим 3-х недельным перерывом => 6 циклов каждые 4 недели.
Показания. Стандартная схема при противопоказаниях или непереносимости оксалиплатина.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Более токсичная, по сравнению с другими 5-FU/LV схемами => степень III и IV: диарея (13-21%), стоматит (14-18%), нейтропения (16-55%).
3. Капецитабии (Кселода):
Капецитабин: перорально два раза в день ежедневно в течение 14 дней + перерыв 7 дней => всего 8 циклов каждые 3 недели.
Показания. Альтернативная/новая схема, если имеются противопоказания или непереносимость оксалиплатина.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Переносимость лучше, чем при внутривенном введении 5-FU/LV.
4. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX4):
Оксалиплатин в/в в первый день; лейковорин в/в в первый и второй дни; 5-FU в/в болюсно с последующей непрерывной инфузией в течение первого и второго дня => всего 12 циклов каждые 14 дней.
Показания. При переносимости - стандартная интенсивная схема выбора, в частности при агрессивных опухолях и у молодых больных; риск редукции дозы 18-25% по сравнению с болюсным введением 5-FU/LV (безрецидивная выживаемость - 78% и 73% соответственно).
Противопоказания. Аллергические реакции. Предшествующая нейропатия.
Токсичность и побочные эффекты. Нейтропения (>40%), фебрильная нейтропения, периферическая нейропатия (острая 3 степени - 12%, отдаленная персистирующая - 1%).
5. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 6):
Оксалиплатин в/в в первый день; лейковорин в/в только в первый день; 5-FU в/в болюсно с последующей непрерывной инфузией (более высокая доза, чем при FOLFOX4) в течение первого и второго дня => всего 12 циклов каждые 14 дней.
Показания. Те же, что и при FOLFOX4, но доза оксалиплатнна выше, а назначение более удобно для больного: необходимость госпитализации только в первый день каждого цикла.
Противопоказания. Аллергические реакции. Предшествующая нейропатия.
Токсичность и побочные эффекты. Нейтропения (>40%), фебрильная нейтропения, периферическая нейропатия (острая III степени - 12%, отдаленная персистирующая - 1%).
6. КАПЕцитабин (КСЕЛода) + ОКСалиплатин (САРЕОХ, XELOX):
Оксалиплатин в/в в первый день; капецитабин нерорально два раза в день ежедневно с 1 по 14 дни + 7 дней перерыв => каждый 21 день 2 раза в день.
Показания. Альтернативная схема FOLFOX с удобным режимом приема.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Сравнимый с FOLFOX или несколько лучший профиль токсичности.
Толстая кишка – это конечная часть пищеварительного тракта. В ней выделяют два отдела: ободочную (colon) и прямую кишку (rectum). Все злокачественные опухоли толстой кишки называют еще колоректальным раком (КР).
Карцинома толстой кишки уверенно выходит на лидирующие позиции в структуре онкологической заболеваемости. За десять лет частота выявления выросла на 20% и в настоящий момент данная патология занимает третье место среди всех злокачественных новообразований.
Основным методом лечения рака кишечника остается операция. Однако более половины впервые выявленных опухолей толстой кишки – это злокачественные новообразования 3-й или 4-й стадии, при которых одна операция неэффективна. Необходимо еще воздействие на опухолевые клетки, которые уже успели распространиться по организму.
Химиотерапия – важный компонент комбинированного лечения КР. Статистика убедительно показывает, что применение химиопрепаратов увеличивает пятилетнюю выживаемость на 5-10%. Кажется, что цифры небольшие, однако в абсолютных значениях это выливается в сотни и тысячи человеческих жизней.
Химиотерапия — цели и точки приложения
Раковая опухоль представляет собой автономную колонию клеток, утратившие все свои функции кроме размножения и не подчиняющиеся регуляторным сигналам организма. В результате мутации клетка начинает бесконтрольно делиться. Опухоль растет, увеличиваясь в размерах. Но основное ее коварство в том, что раковые клетки способны распространяться по лимфатическим, кровеносным сосудам далеко за пределы первичной локализации и формировать новые колонии.

Задачи химиотерапии – уничтожить или хотя бы замедлить рост новообразования, предотвратить распространение оставшихся после операции злокачественных клеток, уменьшить или стабилизировать опухолевые очаги для их дальнейшего удаления.
Для этих целей применяются препараты цитотоксины и цитостатики. Первые вызывают непосредственно некроз клеток, воздействуя токсически на их мембрану и ядро. Вторые – блокируют механизм деления.
Химиопрепараты действуют негативно на все клетки, но в первую очередь на те, которые обладают высоким метаболизмом и способностью к быстрому делению. Поэтому при химиотерапии токсические эффекты препаратов неизбежны. Задача онкологов – подобрать такой режим, при котором польза от лечения будет превалировать над вредом. Задача пациента – настроиться на длительную борьбу и иметь мотивацию перетерпеть все возможные побочные эффекты.
Химиотерапия назначается курсами, между которыми должно пройти время для восстановления поврежденных клеток. Перерыв между циклами обычно составляет 2-3 недели.
Необходимый объём обследований
Лекарственное лечение планирует и назначает врач-химиотерапевт. Для принятия решения он должен иметь перед собой полную информацию о самой опухоли, и о состоянии пациента:
- данные колоноскопии;
- КТ легких, органов брюшной полости, МРТ малого таза;
- заключение о гистологической структуре опухоли (данные нативной биопсии или уже удаленного в ходе хирургического вмешательства макропрепарата);
- протокол операции;
- общий анализ крови и мочи;
- биохимические показатели;
- коагулограмма;
- ЭКГ;
- данные молекулярно-генетического исследования биоптата (7 мутаций в гене KRAS);
- уровень онкологических маркеров КР (РЭА, СА19.9);
- заключения врачей-специалистов при наличии у больного сопутствующих заболеваний.
При необходимости могут быть назначены дополнительные обследования: ПЭТ-КТ, сцинтиграфия костей скелета, МРТ головного мозга и др.
Противопоказания к химиотерапии
- Нейтропения (снижение количества лейкоцитов в крови).
- Текущие инфекционные заболевания.
- Выраженная кахексия.
- Печеночная или почечная недостаточность.
- Тяжелая нейропатия.
- Возраст старше 75 лет (относительное противопоказание).
Показания
Химиотерапия при раке кишечника назначается в случае 3-й стадии (с наличием злокачественных клеток в регионарных лимфоузлах), 4-й стадии (с отдаленными метастазами), а также 2-й ст. при наличии некоторых неблагоприятных факторов прогноза, а именно:
- прорастание опухолью серозной оболочки кишки (Т4);
- низкая дифференцировка по данным гистологического исследования;
- поражение краев резекции, сомнения в радикальности хирургического вмешательства;
- экстрамуральное прорастание сосудов;
- операция, выполненная в условиях осложнения (кишечная непроходимость, перитонит, перфорация кишки);
- повышение уровня РЭА (раково-эмбрионального антигена) через 4 недели после оперативного лечения;
- при высоких показателях микросателлитной нестабильности (MSI).
Виды химиотерапии при колоректальном раке
- Адъювантная (послеоперационная).
- Неоадъювантная (предоперационная).
- Паллиативная.
При 2-й и 3-й стадиях КР дополнительное лечение должно быть назначено как можно раньше после хирургического (оптимально – в течение 4-х недель).
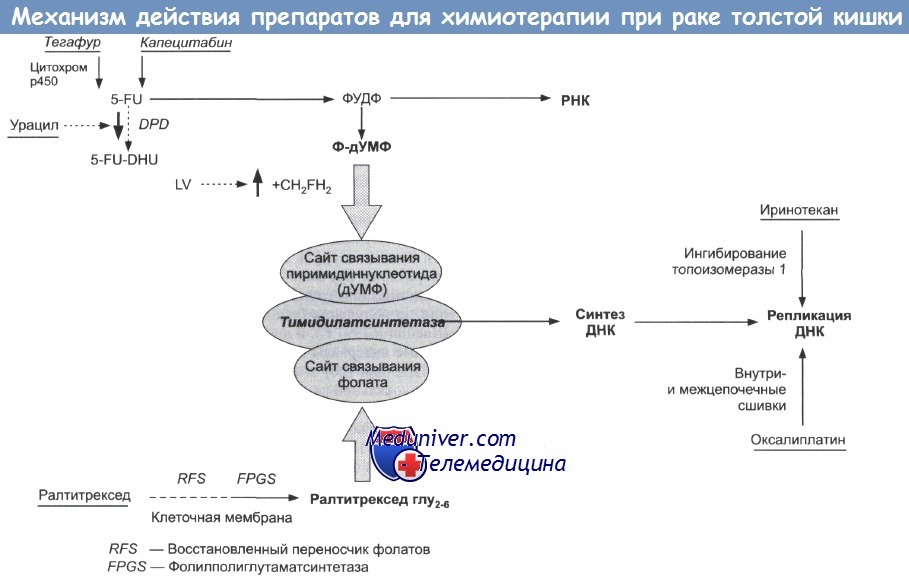
Основные препараты, применяемые при лечении рака кишечника уже достаточно длительное время – это фторпиримидины Фторурацил(5-ФУ) (с его усилителем Лейковорином (ЛВ) — вводится инфузионно; а также капецитабин — принимается внутрь в виде таблеток.
Фторпиримидины применяются или самостоятельно, или в сочетании с другими цитостатиками:
- 5-ФУ+ЛВ+Оксалиплатин (схемы FLOX, FOLFOX).
- Схема XELOX (Оксалиплатин + Капецитабин).
- Схема FOLFIRI (5-ФУ+ЛВ+иринотекан).
Комбинации введения, продолжительность курса, дозы препаратов подбираются индивидуально. Они зависят от опыта применяемых схем в каждой конкретной клинике, а также от наличия тех или других препаратов. Наиболее распространенные режимы: 5 дней подряд каждого месяца или 1-2 дня каждые 2 недели.
Обычная длительность химиотерапии – 6 месяцев, имеются данные исследований, что 3-х месячный курс по схеме XELOX обладает не меньшей эффективностью.
По поводу продолжительности поддерживающего лечения после основного курса ХТ у онкологов пока нет единого мнения.
Наблюдение при проведении адъювантной химиотерапии:
- Перед каждым курсом ХТ сдаются анализы крови, мочи, биохимические показатели.
- 1 раз в 2-3 месяца – УЗИ брюшной полости.
- Через 6 месяцев –КТ органов брюшной полости и грудной клетки.
- Исследование на онкомаркеры – 1 раз в 3 месяца. Во время проведения курса лечения значения показателей могут повышаться, важна оценка их концентрации в динамике. Существенный критерий эффективности – снижение онкомаркеров после окончания курса.
Наиболее часто такое лечение в комбинации с лучевым (химиолучевая терапия) проводится при местнораспространенном раке прямой кишки 2-3 стадии, расположенном в нижнеампулярном отделе. Применяются фторпиримидины одновременно с лучевым воздействием. Курс – около 4-х недель.
Следующим этапом выполняется контрольное обследование, обязательно включающее в себе МРТ малого таза и, если это возможно, хирургическое вмешательство , затем после небольшого перерыва химиолучевое лечение продолжается.
4 стадия КР характеризуется метастазированием в другие органы. Наиболее часто отсевы идут в печень, легкие, а также распространяются по брюшине, реже – в другие органы (кости, головной мозг).
При раке кишечника 4 стадии химиотерапия – основной метод лечения. Выделяют следующие группы таких пациентов:
- Имеются изолированные резектабельные метастазы в печени или легкое. Удаляется первичная опухоль и одновременно или несколько отсрочено резецируются метастазы. После операции проводится химиотерапия схемами FOLFOX или XELOX.
- Потенциально резектабельные метастазы. Применяются схемы FOLFOX, XELOX, FOLFIRI 4-6 курсов, затем – операция и продолжение ХТ после вмешательства.
- Множественные нерезектабельные метастазы. Проводится паллиативная химиотерапия фторпиримидинами или вышеуказанными схемами в зависимости от переносимости. Паллиативная ХТ призвана замедлить рост опухоли и метастазов, увеличить продолжительность и улучшить качество жизни пациента.
Проводится она непрерывно до конца жизни, или же в течение полугода с последующим наблюдением (четких рекомендаций по этому поводу нет). При прогрессировании процесса или выраженном токсическом эффекте ХТ прекращается.
Таргетная терапия при колоректальном раке
Химиотерапию рекомендуется дополнять таргетными препаратами. Это различные биологические вещества, которые блокируют сложную схему митотической активности опухолевых клеток. Они направлены против конкретных молекул, которые стимулируют бесконтрольное их деление. Этот механизм связан с определенными генными мутациями, которые выявляются не у всех опухолей даже одинакового гистологического типа

Поэтому для назначения таргетных препаратов необходим сложный молекулярно-генетический анализ карциномы.
- Антитела к EGFR – Цетуксимаб и Панитумумаб.
- Моноклональное антитело к VEGF- Бевацизумаб.
Исследования показали, что монотерапия только МКА при аденокарциноме кишечника неэффективна. Такие препараты добавляются к стандартным схемам ПХТ у пациентов с 4-й стадией колоректального рака. Комбинация ХТ с моноклональными антителами достоверно увеличивает период безрецидивного течения на 10-15%.
Для определения прогноза и отбора пациентов на лечение таргетными препаратами анализируют патологические изменения в генах KRAS(7 мутаций) и BRAF. Опухоли с мутациями в гене KRAS плохо отвечают на терапию анти- EGFR-антителами, но при этом не исключается применение Бевацизумаба.
Осложнения и методы их предотвращения
Химиотерапия при аденокарциноме кишечника так же, как и любое лечение, сопряжена с неизбежными побочными эффектами.
- Угнетение костного мозга, снижение количества лейкоцитов, тромбоцитов в крови.
- Поражение слизистой полости рта – образование язв, стоматит.
- Тошнота, диарея.
- Выраженная слабость, утомляемость.
- Выпадение волос.
- Носовые кровотечения.
- Сухость кожи и различные высыпания, эритема ладоней и подошв.
- Нарушение чувствительности конечностей.
- Повышение температуры.
- Инфекционные осложнения вследствие снижения иммунитета.
Чтобы несколько нивелировать неприятные последствия ХТ рекомендуется питание с повышенным содержанием белковосодержащих продуктов и овощей, применение гепатопротекторов, противорвотных препаратов. Пищу следует принимать небольшими порциями, питье не ограничивать.
При выраженных симптомах рекомендуется снизить дозу химиопрепарата на 50% или временно отменить один из них.
Критерии эффективности химиотерапии
- положительным ответом опухоли на лекарственную терапию является уменьшение суммы всех наибольших диаметров оцениваемых очагов новообразования на 30% и более;
- прогрессией считается увеличение этого показателя на 20% и выше;
- стабилизация — все промежуточные значения.
Заключение
Более половины пациентов с колоректальным раком нуждаются в проведении химиотерапии.
Такое лечение достоверно увеличивает продолжительность жизни, уменьшает вероятность рецидивов, иногда может привести к полному регрессу заболевания.
Препараты, применяемые при ХТ – токсичны. Лечение неизбежно сопряжено с побочными эффектами.
Неблагоприятное действие цитостатиков на организм – не повод для отказа от лечения. Почти все эффекты можно облегчить с помощью нелекарственных и лекарственных методов.
Читайте также:

