Рецидив и метастазы злокачественной опухоли
Окончание курса лечения рака может принести как облегчение, так и беспокойство. Ведь наконец-то изнурительная терапия позади и достигнута ремиссия рака. Но наряду с такими радостными эмоциями вы можете заметить за собой какое-то беспокойство или тревогу, связанную с возможностью возобновления болезни. Рецидив рака означает его возврат после периода, в течение которого невозможно было обнаружить ни одну раковую клетку в организме. Действительно, некоторые виды раков могут возникнуть вновь, поэтому чувство страха вполне естественно и обоснованно. Его часто испытывают больные, перенесшие рак, особенно в течение первых нескольких лет после прохождения лечения. Очень важно осознавать и помнить, что не в вашей власти противодействовать возобновлению рака, но именно от вас зависит то, насколько страх рецидива рака будет отравлять вашу жизнь.
Метастазы злокачественной опухоли чаще осложняют это заболевание в поздних стадиях. Но в отдельных случаях опухоли и в ранней стадии уже образуют микроскопические метастазы в ближайших или отдаленных лимфатических узлах или органах. Реализация этих микроскопических очажков в клинически определяемый метастаз происходит не всегда или может произойти спустя длительное время после радикального лечения.
Исследования показывают, что занос в ближайшие или отдаленные органы злокачественных клеток не обязательно ведет к развитию метастатической опухоли. В отдаленных органах и тканях обнаруживались вполне жизнеспособные опухолевые клетки без роста. Развитие метастаза может не произойти из-за общей или местной сопротивляемости тканей, иммунозащитных свойств их.
Рецидивы и метастазы злокачественной опухоли - тяжелое осложнение, более опасное для жизни больного, чем первичная опухоль. Раннее выявление этих осложнений и специализированное лечение являются основным путем борьбы за продолжительность жизни онкологических больных.
Экспериментальные исследования, клинические наблюдения и статистические данные обнаруживают, что частота и особенности рецидивирования и метастазирования у больных злокачественными опухолями, определяющие прогноз болезни, зависят от ряда достоверных фактов.
Современная онкология располагает достаточно мощными механизмами для лечения метастазов и рецидива рака, в том числе, это - новейшие схемы и препараты для химиотерапии, таргетная терапия, лечение стволовыми клетками, пересадка костного мозга, радиотерапия на линейных ускорителях последнего поколения, радиоэмболизация и радиочастотная абляция, а также такие передовые высокотехнологичные методы лечения рака, как Робот Да Винчи, Нано-нож, Кибер-нож. Все это и многое другое мы ежедневно применяем для лечения рака, его метастазов и рецидивов, в Онкологическом Центре MEMORIAL.
Раннее обнаружение данных осложнений рака и их новейшие методы лечения, требуют высокой профессиональной квалификации и специальных знаний от врачей-онкологов. Данные методы лечения рака успешно и безопасно применимы только в высокопрофессиональных онкологических центрах, имеющих новейшее лечебное оборудование и обученный штат врачей- специалистов.
Во всем в мире найдется не так уж много клиник, где для борьбы с раком и метастазами рака успешно применяются практически все известные новейшие высокотехнологичные методы лечения. В Онкологическом центре MEMORIAL получают специализированные программы лечения пациенты с теми видами рака, при которых быстро развивается метастазирование и часто возникают рецидивы: рак легких, рак яичников, рак поджелудочной железы, рак молочной железы, рак пищевода, рак желудка, пациенты с метастазами рака в кости, печень, легкие.
Рецидивы и метастазы раковой опухоли — серьезное осложнение, иногда гораздо более опасное для жизни больного, чем первичная опухоль. Наличие метастазов или рецидива рака определяет прогноз онкологической болезни и весь дальнейший лечебный процесс. Раннее обнаружение данных осложнений и их специализированное лечение являются главными факторами борьбы за увеличение продолжительности жизни больных в онкологическом центре MEMORIAL.
Выбранная нами тактика лечения конкретного онкологического заболевания всегда направлена на предотвращение появления метастазов и учитывает весь ход развития болезни. Мы считаем, что очень важно оказать своевременную помощь тем пациентам, у которых онкологическое заболевание обнаружено в запущенной стадии, уже с наличием единичных или множественных метастазов; или тем, у кого в результате неэффективного предыдущего лечения развился рецидив рака.
Метастазы - это отдаленные очаги злокачественных опухолей, которые возникают при перемещении опухолевых клеток с током крови или лимфы. Определенный вид рака или злокачественной опухоли метастазирует в определенные органы. Степень и скорость появления метастазов - важные характеристики опухоли и показатель прогрессирования онкологического заболевания. Метастазы злокачественных опухолей могут образовываться, практически, в любом органе.
- метастазы в печень
- метастазы в легкие
- метастазы в кости скелета
- метастазы в брюшину
- метастазы в головной мозг
- метастазы в надпочечники
- метатазы в отдаленные лимфоузлы
От стадии опухолевого процесса к моменту начала специализированного лечения. У больных раком, получившим радикальное лечение в начальной (I) стадии болезни, при которой злокачественные клетки еще не преодолели защитный тканевой барьер и не проникли в лимфатический либо кровеносный сосуд, возможность появления рецидива и метастазов минимальна - менее 1%. Именно поэтому в онкологии первоначально выбранная тактика и объем лечения являются критически важными – лечение изначально должно быть радикальным. Кроме того, следует учесть, что такие виды лечения, как радиотерапия, химиотерапия, а также оперативное вмешательство, в большинстве случаев не могут быть проведены вторично.
От гистологического строения опухоли и формы опухолевого роста. Наибольшей агрессивностью обладают низкодифференцированные (анапластические) варианты опухолей. Чем ниже степень зрелости клеток опухоли — тем она более злокачественна, тем быстрее она растет и раньше метастазирует. Форма рака также имеет значение, например, поверхностные формы рака кожи развиваются очень медленно, метастазы при них могут не появляться долгие годы. Опухоли диффузно-инфильтративного типа растут быстро и рано дают метастазы. Быстрое метастазирование и бурный рост происходит при меланоме. Экзофитные опухоли желудочно-кишечного тракта (полипообразный, грибовидный рак) менее злокачественны, чем инфильтративные формы рака желудка или кишечника.
От возраста пациентов. В большинстве случаев, чем моложе пациент, тем более агрессивен рак. Известно также, что в молодом возрасте рецидивы раковых опухолей развиваются раньше и протекают тяжелее, чем у пожилых.
Лимфогенный путь метастазирования наиболее часто дает регионарные метастазы, а гематогенный ведет к появлению отдаленных очагов в других органах. Пути лимфогенного метастазирования большинства раковых новообразований неплохо изучены. Это облегчает их раннее обнаружение и своевременное лечение пациентов. Часто метастазы возникают в области шеи, где лимфатические узлы представляют собой коллектор, собирающий лимфу не только от органов головы, груди и верхних конечностей, но и органов брюшной полости.
Другим местом сосредоточения лимфатических узлов, в которых часто возникают метастазы, является подмышечная область. Подмышечные лимфоузлы детально исследуются при раковых опухолях молочной железы, раковых опухолях кожи верхних конечностей и туловища. В паховых лимфатических узлах локализуются метастазы при раковых опухолях нижних конечностей, крестцово-ягодичной области, области малого таза и наружных половых органов. Они также требуют детального исследования.
Гематогенные метастазы в отличие от лимфогенных, как правило, отдаленные и множественные, и это затрудняеет их лечение. Гематогенные метастазы чаще выявляются в легких у больных раковыми опухолями молочной железы, почек, яичника, саркомы костей и мягких тканей. Печень представляет собой место, где образуются метастазы как лимфогенного, так и гематогенного происхождения. Особенно часто печень поражается при раке желудка, прямой кишки, почки, легкого.
Нередко гематогенные метастазы развиваются в костях. Чаще других это отмечается при опухолях молочной железы, при раке простаты и раке щитовидной железы. В большинстве случаев костные метастазы локализуются в центре тела (позвоночный столб, ребра, таз, кости в области бедер и плеч).
При росте не подвергшейся достаточному или своевременному лечению опухоли у значительного числа больных появляются вторичные опухолевые узлы в близлежащих и удаленных органах - метастазы .
Метастазы злокачественной опухоли чаще осложняют это заболевание в поздних стадиях. Но в отдельных случаях опухоли и в ранней стадии уже образуют метастазы в ближайших или отдаленных лимфатических узлах или органах. Реализация этих микроскопических очажков в клинически определяемый метастаз происходит не всегда или может произойти спустя длительное время после радикального лечения.
Исследования показывают, что занос в ближайшие или отдаленные органы злокачественных клеток не обязательно ведет к развитию метастатической опухоли. В отдаленных органах и тканях обнаруживались вполне жизнеспособные опухолевые клетки без роста. Развитие метастаза может не произойти из-за общей или местной сопротивляемости тканей, иммунозащитных свойств их.
Рецидивы и метастазы злокачественной опухоли - тяжелое осложнение, более опасное для жизни больного, чем первичная опухоль . Раннее выявление этих осложнений и специализированное лечение являются основным путем борьбы за продолжительность жизни онкологических больных.
Исследования, клинические наблюдения и статистические данные обнаруживают, что частота и особенности рецидивирования и метастазирования у больных злокачественными опухолями, определяющие прогноз болезни, зависят от ряда достоверных фактов:
Чтобы решить эту задачу обеспечения раннего выявления возможных рецидивов и метастазов,- надо иметь достоверные сведения по перечисленным выше моментам, определяющим прогноз заболевания.
Различают следующие пути метастазирования злокачественных опухолей: лимфогенный, гематогенный и смешанный.
При злокачественных опухолях брюшной полости (желудка) и полости малого таза (яичника) происходит диссеминация процесса по брюшине в виде мелких "пылевых" метастазов с развитием геморрагического выпота - асцита.
Лимфогенный путь метастазирования чаще дает регионарные метастазы, гематогенный путь ведет к образованию отдаленных метастазов в отдаленные органы. Пути лимфогенного метастазирования большинства злокачественных новообразований хорошо изучены. Известны и поддаются обследованию области скопления лимфогенных метастазов большинства злокачественных опухолей. Это облегчает их раннее распознавание и своевременное лечение больных.
Область шеи, ее лимфатические узлы являются коллектором, собирающим лимфу не только от органов головы, груди и верхних конечностей, но через грудной проток и от органов брюшной полости, туловища и нижних конечностей. Имеется определенная закономерность, обусловленная топографией (ходом) лимфатических путей. Злокачественные опухоли нижней губы, передних отделов языка и полости рта, верхней челюсти метастазируют, прежде всего, в подбородочные и подчелюстные лимфатические узлы. Опухоли задних отделов языка, дна полости рта, глотки, гортани, щитовидной железы - в лимфатические узлы по ходу сосудисто-нервного пучка шеи. Опухоли молочной железы, легких метастазируют в надключичную область, в лимфоузлы, расположенные снаружи от грудино-ключично-сосцевидной мышцы. Опухоли брюшной полости метастазируют в надключичную область, в лимфатические узлы, расположенные кнутри от грудино-ключично-сосцевидной мышцы, между и позади ее ножек. Закономерность метастазов рака желудка в определенные локализации лимфатических узлов привела к появлению специальных терминов. Например: метастазы в лимфатические узлы левой надключичной области называются "вирховскими", метастаз в яичники - "крукенберговским", метастаз в дугласовом пространстве "шницлеровским".
Тщательное обследование состояния лимфатических узлов является обязательным при каждом осмотре онкологического больного.
Вторым местом сосредоточения лимфатических узлов, в которых образуются метастазы, является подмышечная область. Подмышечные лимфоузлы тщательно исследуются при злокачественных опухолях молочной железы, злокачественных опухолях кожи верхних конечностей и туловища.
В паховых лимфатических узлах локализуются метастазы при злокачественных опухолях нижних конечностей, крестцово-ягодичной области, наружных половых органов. Они также подлежат тщательному исследованию.
Гематогенные метастазы в отличие от лимфогенных обычно отдаленные и множественные. Гематогенные метастазы чаще обнаруживаются в легких у больных злокачественными опухолями молочной железы, почек, яичника, саркомы костей и мягких тканей. Рентгеноскопия легких так же обязательна при обследовании онкологического больного, как и ревизия состояния лимфатических узлов.
Печень является местом образования метастазов как лимфогенных, так и гематогенных, особенно при злокачественных опухолях желудка, прямой кишки, почки, легкого.
Рецидив злокачественной опухоли - это возобновление злокачественного роста на прежнем месте из оставшихся после лечения опухолевых клеток.
Рецидивы злокачественной опухоли возникают из отдельных, даже одиночных опухолевых клеток, не удаленных во время операции или не разрушенных при лучевой терапии. В определенной степени они свидетельствуют о несовершенстве проводившегося радикального лечения, но не всегда, так как рост злокачественной опухоли в редких случаях начинается из нескольких первичных очагов, расположенных в разных отделах одного органа (первичная множественность).
Рецидивы выявляются при тщательном исследовании области оперативного вмешательства или лучевого лечения (места локализации опухоли). При визуальных локализациях это осуществляется осмотром, иногда с помощью лупы, пальцевым исследованием, диагностической пункцией подозрительного участка или исследованием отпечатка. При внутренних локализациях производят лабораторное, рентгенологическое и эндоскопическое исследования. Современные фиброэндоскопические аппараты позволяют осмотреть всю слизистую оболочку желудка, толстой кишки, взять с подозрительного участка мазок для цитологического исследования или кусочек ткани для гистологического изучения. В неясных случаях больного госпитализируют в специализированный стационар для уточнения вопроса о рецидиве.
Появление рецидива злокачественной опухоли или метастатического узла не всегда бессимптомно.
Больные нередко замечают образование узла в необычном месте или возобновление бывшей ранее симптоматики, но часто стараются уйти от тревожных подозрений и мыслей, откладывают посещение онколога. Не только онкологи, но и родственники, близкие больного могут заметить изменения в нем, требующие непланового осмотра онколога: появление слабости, анемизации или психическая беспричинная депрессия. Рецидивы опухоли отдельных локализаций или появление метастатических узлов в некоторых областях сопровождаются рядом характерных признаков, требующих срочной консультации онколога. Например: рецидив опухоли средостения или глубокий метастатический узел шеи у больного злокачественной опухолью легкого, средостения вызывает сдавление шейного участка симпатического ствола, что ведет к сужению глазной щели, западению глазного яблока, сужению зрачка соответствующей стороны (синдром Бернара-Горнера).
- 25218
- 20,5
- 0
- 11
Метастазы в цельном мозге мыши, обработанном по специальной методике. Красный — MDA-231-D клетки, экспрессирующие mCherry; зеленый — сосуды, помеченные антителами к α-SMA, альфа-актинам гладких мышц [1].
![]()
Мария Рафаева
![]()
Светлана Ястребова![]()
Андрей Панов




Революция в понимании природы метастазирования
Усилия многих онкологов на протяжении последних десятилетий были направлены на установление деталей возникновения и развития рака — механизмов зарождения опухоли и регуляции ее активного роста, формирования благоприятного микроокружения из клеток стромы [2]. Эти знания несомненно привели к разработке новых подходов в терапии онкозаболеваний. Со временем стало понятно, что основная угроза рака заключена в способности к распространению по организму. Так, некоторые раковые клетки первичной опухоли (то есть развившейся изначально) отделяются от нее за счет эпителиально-мезенхимального перехода или других механизмов [3] и, попадая в кровоток или лимфоток, по маленьким капиллярам путешествуют в главные магистрали сосудистой системы. Они покидают ее за счет задержки в узких капиллярах органов, адгезии к их эндотелиальной стенке и выхода из просвета сосуда в строму органа (рис. 1). Лишь небольшой процент раковых клеток, покинувших первичную опухоль, преуспевает в этом процессе и выживает в новой среде. Эти клетки формируют будущие очаги роста опухоли в новых органах — метастазы.
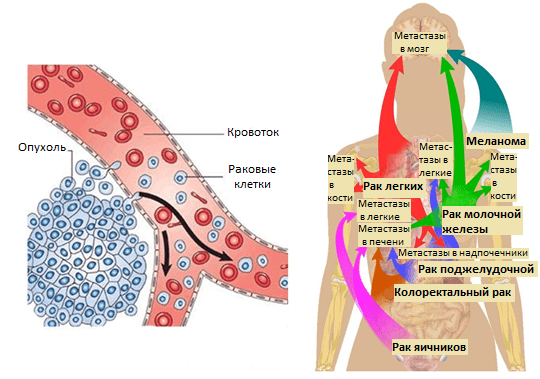
Рисунок 1. Метастазирование и пути рассеивания раковых клеток.
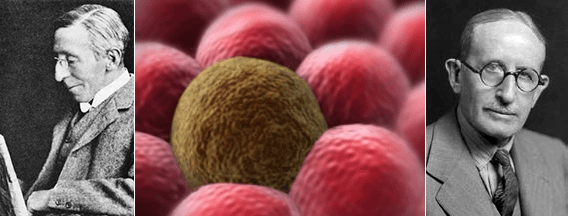
Рисунок 2. Основоположники учений о метастазировании: английский хирург Стивен Педжет (слева) и американский патолог Джеймс Юинг (справа).
Наконец в 1970-е годы в ходе нескольких экспериментов по инъекции радиоактивно меченных раковых клеток мышам Исаак Фидлер смог доказать, что результат метастазирования также зависит от природы раковых клеток. В этом случае клетки меланомы развивали метастазы только в легких, но не в печени, в сосудах которой они также задерживались, но позже не выживали [5].
Позднее было установлено еще больше фактов, подтверждающих, что раковые клетки разной природы метастазируют преимущественно в определенные органы и иногда даже в заданной последовательности. Например, клетки рака молочной железы — сначала в кости, печень, лимфатические узлы, легкие, а потом уже в мозг; клетки рака желудочно-кишечного тракта и яичников — в печень и легкие; рака простаты — в основном, в кости (рис. 1). Явление специфичного распределения метастазов по организму назвали органотропией метастазирования. Чаще всего метастазы встречаются в легких, печени и костях.
Несмотря на активные исследования, в онкологии все еще остается много вопросов без ответа. Отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? Как метастазам удается выжить после удаления первичной опухоли и проведенной химиотерапии?
Генетическая и эпигенетическая гетерогенность при метастазировании
Генетическая информация лежит в основе программирования поведения клетки. Перерождение нормальных клеток организма в раковые (злокачественная трансформация) обусловлено мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Помимо таких выгодных для опухолевых клеток мутаций, также происходят мутации в генах-пассажирах, то есть тех, что изначально не имеют влияния на рост опухоли. С каждым поколением, новым клоном внутри опухоли, накапливаются эти генетические изменения, и некоторые клоны преуспевают больше остальных, что стало основой для формирования представления об эволюции внутри опухоли. Одна из предложенных гипотез, почему некоторые клетки опухоли приобретают способность к метастазированию, основана на схожем со злокачественной трансформацией принципе. По всей видимости, у них тоже накапливаются мутации в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения она так и не нашла, ученые сходятся во мнении, что большинство клеток первичной опухоли способны метастазировать. А вот что происходит позже с геномами метастазных клеток?
В результате сравнения геномов клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов (в печени, легких, дальних лимфатических узлах) было установлено, что геномы метастазов продолжают эволюционировать в своих очагах роста независимо от первичной опухоли [6]. Интересно, что паттерн мутаций схож между метастазами в одном органе, но различен между метастазами в разных органах. Это означает, что раковые клетки на самом глубоком уровне адаптируются к новому микроокружению в зависимости от занятой ими ниши. Изучение генетических изменений при метастазировании рака поджелудочной железы выявило наличие разных субклонов (новых поколений клона), которые формируют метастазы. Однако различия между ними оказались не больше, чем между двумя случайно взятыми клетками одного организма [7].
Интересно, что обнаружили как минимум один ген, FBXW7, мутации в котором противодействуют метастазированию [8]. Происходит это за счет усиления провоспалительной реакции, пролиферации и активности T-лимфоцитов, которые стимулируют формирование адаптивного иммунитета к опухолевым клеткам. Таким образом, мутации в гене FBXW7 противодействуют опухолевой иммунносупрессии. Ее проявления, такие как уменьшение количества лимфатических сосудов и эффекторных T-лимфоцитов в первичной опухоли, связаны с лицензированием метастазирования [8].
Следующую ступень в регуляции экспрессии генов после непосредственных изменений в ДНК (мутаций, вариаций числа копий и т.д.) занимают эпигенетические изменения (метилирование гистонов, ДНК и др.) (рис. 3). По своей природе они более пластичны, более переменчивы по сравнению с генетическими изменениями и подвластны влиянию клеточной сигнализации, которая подстраивается под воздействие внешних факторов. Оказалось, что эпигенетический код значительно отличается в клетках метастазов по сравнению с первичной опухолью. При раке поджелудочной железы потеря большого количества меток неактивного хроматина (гетерохроматина) — метилирования гистонов (H3K9, H4K20) — и ослабление метилирования ДНК связаны с метастазированием. Эти модификации в раковых клетках переводят участки гетерохроматина в активное состояние, доступное для транскрипционных факторов, и в результате усиливают экспрессию генов онкогенеза, таких как регуляторы мезенхимального фенотипа, KRAS-сигнализации и метаболизма [9].
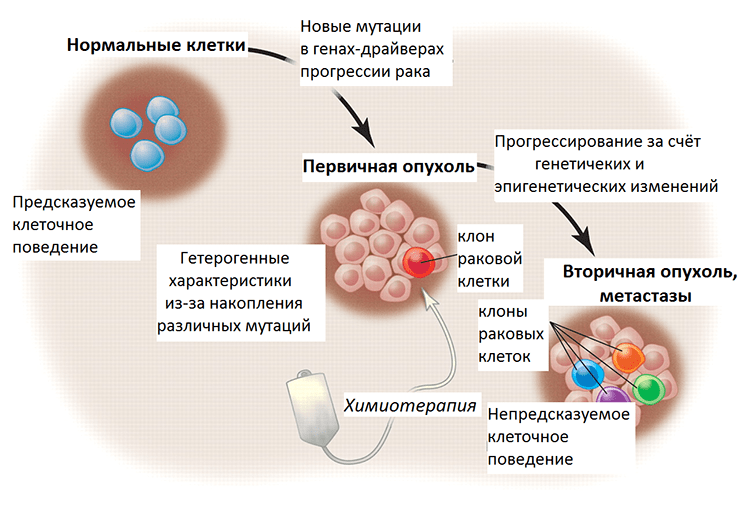
Рисунок 3. Злокачественная трансформация и прогрессирование рака в перспективе генетических и эпигенетических изменений. Нормальные клетки ткани имеют предсказуемое поведение — темпы пролиферации, срок жизни, характер взаимодействия с другими клетками. При злокачественной трансформации накапливаются мутации, и постепенно опухоль становится генетически гетерогенной (состоит из нескольких клонов, поколений раковых клеток). Химиотерапия уничтожает некоторые клоны, тогда как другие, с выгодными в новых условиях мутациями, выживают и создают новых клонов. Их поведение уже непредсказуемо, так как генетические и эпигенетические изменения этих раковых клеток привели к приобретению ими новых свойств.
Метаболическая пластичность при метастазировании
Эпигенетическая регуляция является одним из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области с недостаточным снабжением кислородом (гипоксией), так как до них не доходят кровеносные сосуды. Это вызывает в раковых клетках активацию гена фактора, индуцируемого гипоксией (HIF-1α). Происходит это за счет эпигенетического освобождения, деметилирования промотора гена, который становится доступным для транскрипционных факторов. Усиленное образование и активность белка HIF-1α, в свою очередь, регулирует экспрессию генов множества метаболических ферментов и транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток и поддерживает их потребности.
Клеточный метаболизм разделен на процессы расщепления с выделением энергии (катаболизм) и образования соединений с использованием энергии (анаболизм). Энергетический обмен клетки протекает за счет этапов клеточного дыхания — гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования. Раковые клетки по-своему приспосабливаются к сохранению продуктивности энергетического обмена в условиях недостатка кислорода. В первичной опухоли они, в основном, используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение глюкозы с преобразованием до лактата, выделяемого раковыми клетками, названо эффектом Варбурга. Он позволяет им выжить при гипоксии и активно пролиферировать за счет использования промежуточных соединений для биосинтеза и выделения энергии [10].
Преимущественный способ генерирования энергии у метастазов, однако, до сих пор мало изучен. Используя клетки рака молочной железы, обладающие широкой или специфической органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, активировали использование окислительного фосфорилирования, колонизировавшие печень — гликолиз. Когда раковые клетки колонизировали все вышеперечисленные очаги, они активировали сразу оба метаболических пути (рис. 4) [11]. Похоже, что такая пластичность помогает раковым клеткам освоить новые ниши для колонизации. Например, в печени гликолитический фенотип поддерживается при росте метастазов за счет активности упомянутого ранее фактора HIF-1α, а также повышенной экспрессии белка PDK1. Это фермент, который ингибирует формирование соединения ацетил-КоА. И так как его поток на развилке с гликолитическим путем в цикл трикарбоновых кислот уменьшается, усиливается образование конечного продукта гликолиза — лактата [12].
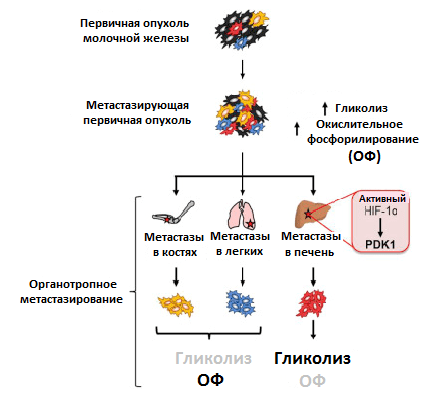
Рисунок 4. Различия в метаболизме первичной опухоли и метастазов в разных органах. Условные обозначения: ОФ — окислительное фосфорилирование; HIF-1α — индуцируемый гипоксией фактор 1; PDK1 — пируватдегидрогеназный комплекс 1.
Почему же для метастазов в одном органе выгоднее использовать преимущественно один вид метаболизма, чем другой? Ответ на этот вопрос и роль различных факторов в регуляции метаболической пластичности раковых клеток еще только предстоит узнать.
Понятие о преметастазных нишах
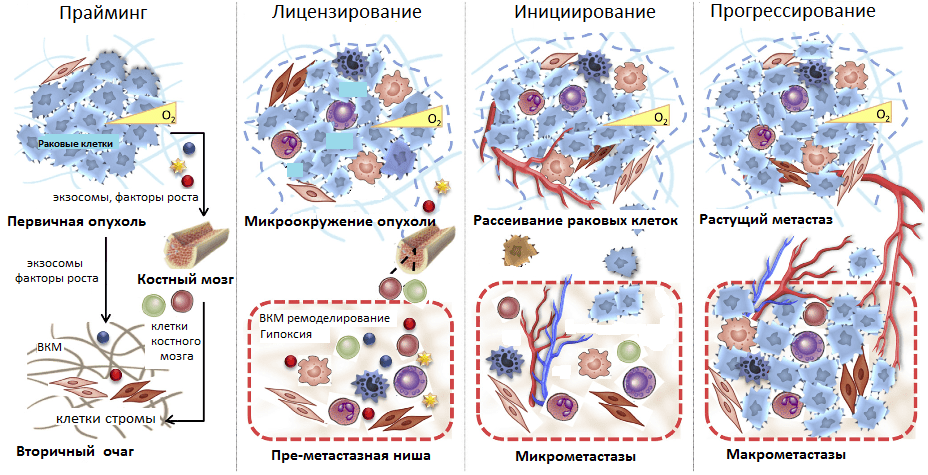
Рисунок 5. Стадии развития метастазов. Прайминг, или обучение, будущего вторичного очага роста первичной опухолью; лицензирование — иммуносупрессия первичной опухоли, создание благоприятного микроокружения в преметастазных нишах; инициирование — начало метастазирования и освоения преметастазной ниши; прогрессирование — рост метастазов во вторичном очаге.
Таким образом, в текущем представлении формирование метастазов происходит в несколько стадий. Начиная с раннего роста первичной опухоли происходит прайминг — обучение будущих ниш развития метастазов с помощью выделения различных факторов раковыми клетками, привлечения клеток из костного мозга. Затем клетки стромы первичной опухоли и преметастазных ниш (фибробласты, клетки миелоидного ряда, T-лимфоциты) формируют благоприятное микроокружение, лицензируя дальнейшее расселение метастазов. Фаза инициирования метастазирования заключается в росте сосудов, ангиогенезе, по которым метастазные клетки покидают первичную опухоль и приходят в преметастазные ниши. Прогрессирование — это финальный этап перехода микрометастазов в макрометастазы — вторичные сформированные опухоли. Он может занять от нескольких месяцев до нескольких лет (рис. 5).
Гетерогенность в механизмах формирования преметастазных ниш
При некоторых типах рака, таких как меланома, для успешного метастазирования в лимфатические узлы и органы необходимо формирование новых лимфатических сосудов в их преметастазной нише. Недавно ученые установили, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, и медиатором его запуска является фактор роста мидкин, секретируемый клетками меланомы в составе экзосом или в свободном виде [19].
Безусловно, механизмы формирования преметастазных ниш в комплексе позволяют лучше понять развитие рака и не перестают удивлять своей сложностью.
Причины органотропии
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропному метастазированию, но как раковые клетки, которые могут метастазировать сразу в несколько органов, выбирают только один из них?
Именно они адресуют доставку экзосом в определенный орган, который преимущественно имеет этот специфический ВКМ-белок в составе стромы. Сливаясь с мембранами клеток стромы того или иного органа, экзосомы доставляют содержимое и запускают свою программу: в фибробластах легких — через экспрессию одних генов S100, в клетках Купфера в печени — через экспрессию других. Активность этих генов стимулирует клеточную сигнализацию и воспалительные реакции, которые занимаются обучением преметастазной ниши (рис. 6) [21].
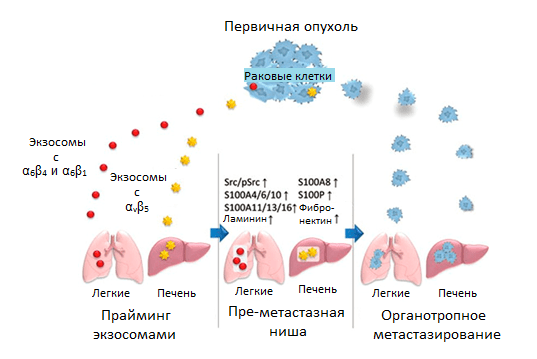
Рисунок 6. Регуляция органотропного метастазирования с помощью прайминга преметастазной ниши экзосомами со специфическими рецепторами интегринами. Условные обозначения: α6β4 и α6β1 — гетеродимеры интегринового рецептора; Src/pSrc — пропорция неактивной/активной форм киназы.
Перспективы в терапии метастазирования
Подведем итог: описанные здесь механизмы, очевидно, усложняют картину течения онкозаболеваний и развития тактик их лечения. Важно подчеркнуть, что гетерогенность первичной опухоли и метастазов по ряду рассмотренных здесь признаков (генетическая, метаболическая, нишевая) дает понимание того, что следует использовать комбинированное и таргетное лечение на разных стадиях течения болезни. Как подтверждение тому — результаты одного из последних исследований, проведенных на материалах пациента с рецидивами между курсами длительной иммунотерапии. Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны [22] и, следовательно, первичная, вторичные и т.д. опухоли по-разному отвечали на лечение.
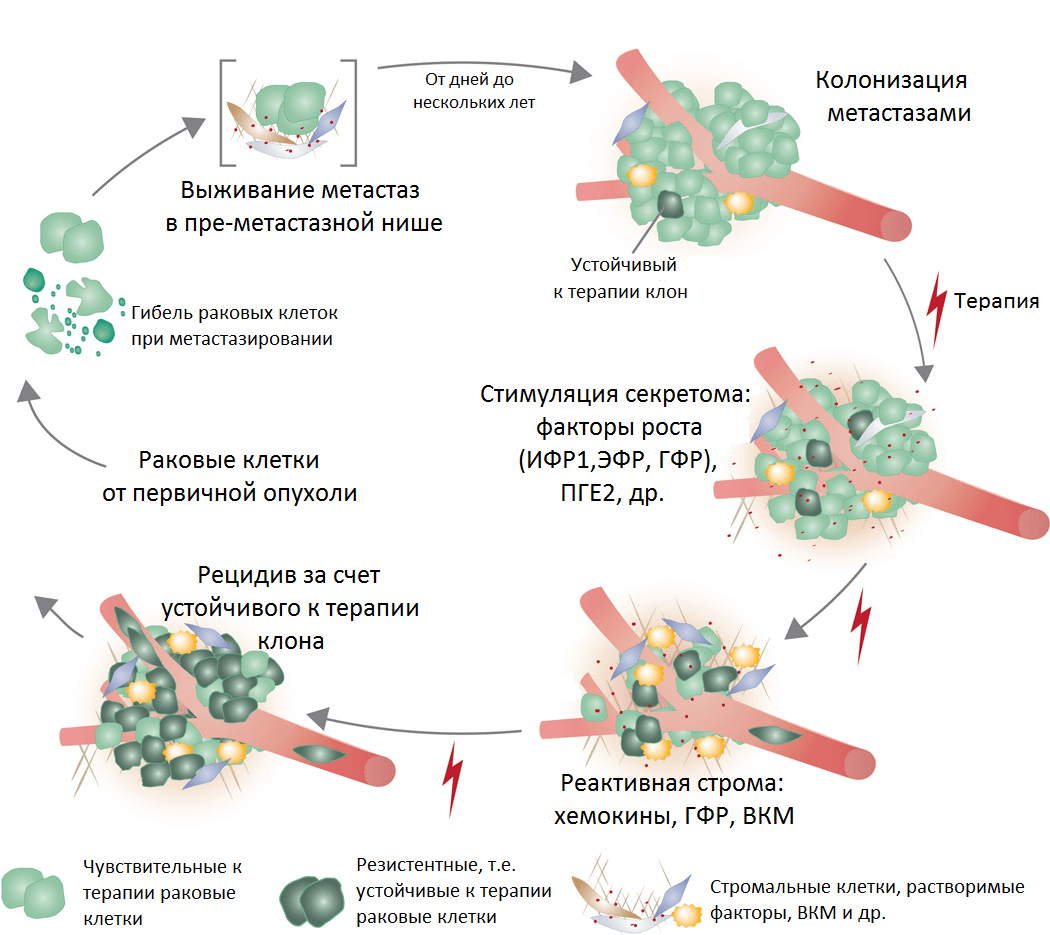
Рисунок 7. Реакция метастазов на терапию, образование резистентности и развитие рецидива. Условные обозначения: ИФР1 — инсулиноподобный фактор роста; ЭФР — эпидермальный фактор роста; ГФР — фактор роста гепатоцитов; ПГЕ2 — простагландин 2; ВКМ — внеклеточный матрикс.
Обнаружение преметастазных ниш и понимание их устройства предложили по-новому взглянуть на развитие подходов в терапии. Если бы стало возможным предотвратить формирование преметастазных ниш, то с большой вероятностью было бы остановлено метастазирование, а значит, и возможность ремиссии. Будем и дальше следить за прорывами в этой области.
Читайте также:




