Рецепторы рака предстательной железы
Рак предстательной железы
Рак предстательной железы (РПЖ) в РФ составил в 2011 г. – 11,9% (второе место после рака легкого), прирост в год – 8%, 4 место в структуре онкологической смертности – умерло 10 555 больных РПЖ в США с 2007 г. РПЖ – стоит на первом месте.
РПЖ более чем в 80% случаев развивается на фоне доброкачественной гиперплазии предстательной железы (ДГПЖ). В 3% случаев РПЖ находят при операции ДГПЖ. В то же время установлено, что ДГПЖ не повышает риск РПЖ.
Диагностика РПЖ – значение ПСА
ПСА – простат — специфический антиген – секретируется простатой, протеаза.
- 40% с нормальным уровнем ПСА (
- 65% лиц с повышенным уровнем ПСА – не имеют РПЖ, а страдают другими заболеваниями ПЖ.
- 35-45% пациентов с уровнем ПСА > 10 нг/мл – имеют отрицательный баланс биопсии ПЖ.
Известно более 220 биохимических маркёров РПЖ (Аннексии III, РСА 3, про ПСА и др.). В настоящее время достоверного метода серологической диагностики РПЖ – НЕТ.
Факторы риска РПЖ
Возраст: частота РПЖ увеличивается с возрастом на 15-20 лет позже ДГПЖ.
Раса: у мужчин черной расы больше объем простаты и выше риск ДГПЖ и РПЖ.
Генетика: известны специфические мутации, связанные с риском РПЖ.
Питание:
- Ожирение, избыточное потребление жира, насыщенных жирных кислот, мяса, молока, кальция, дефицит овощей и фруктов.
- Продукты животноводства и глюкоза. Потребление мяса вызывает экспрессию ИФР (инсулиноподобного фактора роста).
- Избыточное потребление углеводов вызывает увеличение секреции инсулина, который стимулирует пролиферативную активность клеток предстательной железы.
- Андрогены – высокий уровень тестостерона.
- Линолевая омега-6 ПНЖК.
- Витамин D. Увеличивает риск РПЖ: низкий ( 80 нмоль/л) уровень витамина D в крови.
- Курение – повышает риск ДГПЖ и смертность от РПЖ.
Рак простаты: что делать?
Лекарственные препараты
Торможение образования 5 а–дигидротестостерона (ДТС) из тестостерона (ТС)
Ингибиторы 5а-редуктазы – блокируют фермент I типа – дугастерид, II типа – финастерид.
Результаты применения ингибиторов
- Снижают содержание ДТС, активируют апоптоз в простате, уменьшают ее объем.
- Снижают задержку мочи на 57-59%, уменьшают прогрессирование ДГПЖ.
- Финастерид снижал риск РПЖ на 25%.
- Финастерид предупреждал индуцированный РПЖ у крыс.
- Дугастерид в исследовании REDUCE вызывал регресс ДГПЖ и снижал риск РПЖ.
Побочные эффекты: эректильная дисфункция, увеличение ЛГ (лютинезирующих гормонов), гинекомастия.
АЛЬФА-АДРЕНОБЛОКАТОРЫ блокируют адренорецепторы простаты, что расслабляет мышцы и уменьшают обструкцию (закупорку каналов) – феноксибензамин , альфузозин , доксозазин , индорамин .
АЛЬФА-АДРЕНОБЛОКАТОРЫ оказывают симптоматическое действие.
- тамсулозин снижал частоту предраковых изменений.
Эффективно совместное применение ингибиторов 5а-редуктазы и а-адреноблокаторов.
Фитопрепараты и БАДы
Наиболее изучены экстракты плодов Serenoa repens (сереноа) Со Пальметто и Pygeum africanum (пиджеум) – Африканская слива . Данные препараты продемонстрировали эффективность, аналогичные ингибиторам 5а-редуктазы и а1 – адреноблокаторам.
- Экстракт сереноа и экстракт пиджеум предупреждали развитие РПЖ у тирансгенных мышей TRAMP.
- Экстракт сереноа снижал частоту предраковых изменений в предстательной железе, индуцированную фенилэфрином у крыс.
- В обзоре 18 рандомизированных исследований установлено, что экстракт сереноа улучшал мочевую и эректильную функцию.
- Назначение 320 мг экстракта экстракт сереноа в течение 6 месяцев достоверно улучшал функцию мочеотделения и показатели теста IPPS (состояние предстательной железы).
- Назначение 320 мг экстракта экстракт сереноа в течение 3 месяцев достоверно улучшал скорость мочеиспускания, индекс теста IPPS, уменьшался размер простаты.

Ликопин оказывает лечебное действие на ДГПЖ в экспериментальных и клинических исследованиях.
- Ликопин ( содержится в красных овощах, фруктах ) снижал уровень ПСА и патологическую симптоматику ДГПЖ, тормозил увеличение простаты.
- У мужчин, потребляющих ежедневно томатный сок или соус (ликопин), риск РПЖ снижается на 50%.
Полифенолы
Препараты
ДГПЖ
РПЖ
Ингибиторы 5 альфаредуктазы
Рак простаты (карцинома) – одно из частых причин смерти среди мужского населения не только Российской Федерации, но и многих развитых стран мира.
СОДЕРЖАНИЕ (нажмите на кнопку справа):
Факторы риска
Карцинома простаты может развиваться годами, хотя некоторые ее разновидности развиваются стремительно.
Генез карциномы неизбежно приводит к формированию метастаз, которые иногда достигают дистальных отделов костной ткани конечностей.
К моменту достижения пенсионного возраста уже 1% мужчин страдают этим заболеванием.
К 75 годам, уже у 13% представителей мужской половины при прочих соматических болезнях прибавляется еще и рак предстательной железы.
После 40 лет регулярное ежегодное обследование у уролога должен проходить каждый мужчина.
После 50 лет — это обследование нужно для себя включить как обязательное.
Источники рака простаты
Причин карциномы простаты на сегодняшний день можно насчитать более десятка.
С одними из них обнаружена достоверная связь заболевания, другие находятся в стадии доказательства, но отмечены уже, как провоцирующие факторы.
Наиболее вероятен риск возникновения злокачественной опухоли простаты при:
- Отклонениях от нормального гормонального фона. Имеются прямые доказательства влияния высокой концентрации мужских половых гормонов на зарождение злокачественного узелка в железистой ткани простаты. Остальные причины выявляются высокого гормонального фона тестостерона и его аналога, поэтому концентрация этого гормона – основная причина заболевания. Как правило, болезнь поражает простату при естественном возрастном изменении уровня гормонов, т.е. встречается чаще в преклонном возрасте.
- Наследственной предрасположенности к патологии. Если в генеалогическом древе у мужчин встречался рак предстательной железы, молодому человеку, начиная с 35 лет, нужно ежегодно проходить анализы крови, УЗИ и посещать уролога.
- Недостаточном употреблении в пищу клетчатки, пектинов, содержащихся в овощах и фруктах и предпочтении в пище животных жиров.
- Хроническом простатите, не подвергавшемуся лечению.
- Тучности тела и сахарном диабете.
- Курении и злоупотреблении спиртными напитками.
- Проживании в районе с загрязненной окружающей средой.
- Недостаточным поступлением в организм или плохой всасываемостью витамина Д.
- Длительном контакте с солями кадмия (типографские работники, работы, связанные с производством резиновых изделий и сваркой).
- Стерилизации мужчины при помощи вазэктомии (перевязывании семенных канальцев, несущих сперматозоиды). Напрямую такая связь не доказана в качестве провоцирующего фактора для возникновения злокачественного новообразования простаты, но опытные врачи подмечают во врачебной практике и такие случаи.
ВАЖНО : Запущенная форма инфекционного простатита так же может привести к раку простаты.
Клиническая картина патологии
Ранние стадии карциномы выявляются только анализом крови на специфический антиген простаты, уровень которого при злокачественной опухоли стремительно повышается.
Никаких симптомов и признаков карциномы на этом этапе не выявляется. Жалобы начинаются гораздо позже, когда опухоль оказывает сдавливающее действие на мочевой пузырь или прямую кишку, или пускает метастазы в эти органы.
Появление симптомов начинается постепенно, к первоначальным признакам болезни начинают добавляться новые. Процесс развития опухоли может занимать несколько лет.
Взятый в отдельности признак не указывает прямо на карциному простаты, но обследованием уролога пренебрегать не стоит.
Сначала наблюдается увеличение размеров предстательной железы. Увеличенный орган оказывает сдавливающий эффект на стенки мочевого пузыря.
Раздражение рецепторов стенки мочевого органа вызывает ряд симптомов со стороны мочевыделительной системы:
- если в норме мужчина может ночью встать 1 раз для опорожнения наполненного пузыря, то при гиперплазии ночные визиты в туалет для мочеиспускания становятся более частыми (2 и более раза);
- в дневное время мочеиспускание осуществляется почти каждый час с малыми порциями выделяемой мочи;
- позывы к мочеиспусканию становятся очень сильными, их сдерживание приносит большие усилия;
- при опорожнении мочевого пузыря в мочеиспускательном канале отмечаются рези и жжение;
- ощущения дискомфорта и ноющих болей в лобковой области и промежности;
- недержание мочи.
При более сильном воздействии увеличенной простаты на мочеиспускательный канал возникают препятствия перед нормальным выведением мочи, проявляющиеся следующими признаками:
- сложности с процессом мочеиспускания в самом его начале;
- струя мочи несколько раз прерывается;
- капельное выделение мочи в конце мочеиспускания;
- ощущения полного опорожнения мочевого пузыря отсутствует.
При дальнейшем развитии карциномы простаты нарастает интенсивность нижеуказанных симптомов:
- Вялость струи во время мочеиспускания, для более быстрого выведения мочи приходится напрягать мышцы брюшного пресса, так как тонус гладкомышечной ткани мочевого пузыря снижен.
- Неполное выведение мочи приводит к ее движению в обратном направлении и возникновению болей в пояснице, нередко связанной с образованием камней в почках при застое мочи. Обратный ток мочи может также оказывать распирающее действие на лоханки почек и мочеточники.
- Особенно тяжелые случаи выведения мочи связаны с ее полной задержкой. В этом случае нужны экстренные меры по введению катетера через просвет мочеиспускательного канала и сфинктер мочевого пузыря в его полость. Иначе начнется интоксикация организма, прогнозы которой имеют неблагоприятный характер. Вводить катетер может медицинский специалист или обученный этой процедуре член семьи.
- Если в сперме или моче обнаруживаются кровяные выделения, делают вывод о повреждении увеличенной простатой сосудов мочевого пузыря, предстательной железы или мочеиспускательного канала.
- Появление отеков в ногах, мошонке и наружных половых органах обычно свидетельствует о поражении злокачественными клетками лимфатических узлов паха (образовании в них метастазов).
- Нарушение дефекации и возникновение сложностей в виде запоров и ощутимых болей указывает на проникновение метастазов в область прямой кишки.
- Обнаружение эректильной дисфункции при карциноме простаты указывает на поражение чувствительного нерва, имеющего рецепторные окончания в наружных половых органах.
- На последней стадии развития рака простаты метастазы проникают в кости таза и позвоночника, вызывая нестерпимые боли.
- Метастазированию могут подвергаться органы брюшной и грудной полости. Если возникает кашель при карциноме предстательной железы, это указывает на поражение легких злокачественными клетками. При метастазировании в печень обнаруживается желтуха (печень перестает справляться с функциями) и сильные боли в правом подреберье.
Степени и стадии рака предстательной железы
При биопсии удается точно установить диагноз карциномы, начиная с 1 степени морфологических изменений.
При подозрении на рак простаты важно определить не только степень, чтобы удостовериться в правильности диагноза и характере морфологических изменений клеток, но и стадии, что важно при выявлении метастазов.
Выделяют 5 степеней рака простаты:
- Начальная (G1), отличающаяся очень медленным морфологическим преобразованием клеток. Не всегда удается рассмотреть трансформации клеток.
- Во второй степени (G2) измененные клетки уже заметно отличаются от здоровых, при этом обнаруживается небольшая скученность их в одном очаге (формирование узла). Лечение карциномы простаты 2 степени проходит быстрее и с минимальным вредом для организма.
- Третья степень онкологии (G3) характеризуется наличием клеток с разной морфологией и структурой. В отсутствии лечения опухоль увеличивается в размерах через верхнюю часть простаты, представляя злокачественные клетки соседним тканям и органам.
- В четвертой степени карциномы простаты (G4) большинство клеток сложно дифференцировать, они атипичны для простаты.
- Заключительная степень формирования опухоли (G5) характеризуется абсолютной не дифференциацией клеточной массы, являющейся полностью атипичной.
В отличие от степеней злокачественного новообразования простаты выделяют 4 стадии развития болезни:
- УЗИ или пальпационное обследование железы пациента не дает никакого результата. Изменения обнаруживаются только на микроскопическом уровне при биопсии органа. Подобное состояние железы характерно для первой стадии патологии.
- На второй стадии узловое образование уже становится заметным в ходе обследования УЗИ. Размеры патологического образования пока не позволяют выходить за пределы простаты и узел ограничивается капсулой экзокринного органа.
- Третья стадия характеризуется выходом опухоли за границы железы в соседние органы. Метастазы обнаруживаются в мочевом пузыре, тканях прямой кишки.
- Последняя стадия рака, четвертая, наиболее опасна для дальнейшего здоровья мужчины, так как метастазы распространяются на отдаленные органы: легкие, печень, кости, лимфоузлы. Больной чувствует истощение сил, мочеиспускание редко проходит без катетера, отмечаются интенсивные боли не только во время опорожнения мочевого пузыря.
Чаще всего поражаются метастазами лимфатические узлы и костная ткань.
Злокачественные клетки легко проникают в эти органы, формируя в них специфическую для разновидности рака ткань.
Разрастание метастазов – самое опасное явление в онкологической практике. Если до их появления консервативное или оперативное лечение приносит положительный эффект для здоровья пациента, то с началом их формирования лечение и прогноз болезни лишь в отдельных случаях возвращают пациенту здоровье.
Полностью избавиться от метастазов оперативным путем не под силу любому, даже очень знаменитому и опытному хирургу-онкологу.
Диагностическое определение болезни
При малейших подозрениях на нарушение функций предстательной железы пациент должен сразу обратиться к урологу.
Обследование начинается со сбора анамнеза и ректальной пальпации простаты.
Уролог пальцевой пальпацией может обнаружить гиперплазию железы, вариантов которой может быть несколько:
- карцинома простаты;
- аденома железы (доброкачественная гиперплазия);
- появление камней в экзокринном органе.
При нормальных размерах железы назначается дополнительное обследование – измерение концентрации в крови специфического антигена простаты.
Это самая верная диагностическая методика при определении наличия злокачественной опухоли или отдельных ее формирующихся клеток.
BJU, volume 89, number3, february 2002,230-240
Growth factors and teir receptors in prostate cancer
G.O. Hellawell and S.F. Brewster
Departament of Urology, The Churchill Hospital, Oxford, UK
Рак предстательной железы нарастающими темпами становится самым распространённым злокачественным новообразованием среди населения развитых стран. В Европе это заболевание является второй по степени распространённости причиной смерти мужчин, страдающих каким-либо онкологическим заболеванием (1). В отсутствие скрининг программ и программ по раннему выявлению рака предстательной железы у многих мужчин заболевание принимает неизлечимую метастатическую форму. Гормональная терапия является самым эффективным способом лечения нелокализованной формы рака, но оно позволяет контролировать заболевание только на ограниченном промежутке времени, поскольку неизбежно развивается андрогенная независимость (2). При лечении некоторых пациентов химиотерапия вызывает кратковременный эффект и поэтому возникает острая необходимость разрабатывать новые стратегии лечения. Для этого нужно понимать, как клетки поражённой раком предстательной железы становятся нечувствительными к андрогенам - обретают андрогенную независимость. Идёт накопление данных, подтверждающих участие факторов роста в развитии и прогрессировании рака предстательной железы.
Было обнаружено, что несколько онкогенных продуктов, способствующих разрастанию опухоли, гомологичных факторам роста, рецепторам факторов роста или молекулам в проводящих импульсы путях этих рецепторов. Несколько семейств факторов роста участвуют в росте клеток здоровой и поражённой раком предстательной железы (3-32).
IGF семейство, EGF, TGF-a, семейство факторов роста фибробластов (FGF), эндотелиальные факторы роста (тромбоцитарный фактор роста, PDGF, и сосудистый эндотелиальный фактор роста, VEGF) являются главными стимулирующими регуляторами пролиферации клеток предстательной железы. TGF-b семейство представляет главную группу факторов, подавляющих рост клеток. Факторы роста оказывают аутокринное и паракринное воздействие на стромальные и эпителиальные клетки, а также они взаимодействуют с другими факторами и связующими белками, чтобы контролировать рост клеток предстательной железы (рисунок 1) (33).
Факторы роста и их рецепторы, принимающие участие в развитии нормальной предстательной железы
Имеющиеся сегодня сведения о роли факторов роста в развитии клеток предстательной железы были получены из исследований человеческой ткани, а также из исследовательских моделей, авторы которых попытались имитировать рост простатических клеток в модели клеточных линий (in vitro) и в модели на грызунах (in vivo). В результате измерения факторов роста и их рецепторов в человеческой ткани предстательной железы были получены противоречивые результаты. Гистологическая гетерогенность человеческого рака предстательной железы означает, что попытки соотнести уровни факторов роста со стадией заболевания следует интерпретировать с осторожностью.
Клетки рака предстательной железы обычно медленно растут, что затрудняет разработку новых клеточных линий на основе материала первоначальной биопсии (34). Таким образом, авторы многих исследований используют общепринятые клеточные линии человеческого рака предстательной железы, такие как PC-3 (35), DU-145 (36) и LNCaP (37). Эти клеточные линии были получены на основе метастатических тканей. LNCaP является андрогеннозависимой клеточной линией и имеет один андрогенный рецептор, тогда как у PC-3 и DU-145 нет андрогенных рецепторов и нет андрогенной зависимости. Данные клеточные линии адаптировались к росту в модели клеточных линий (in vitro), и они все плохо отличаются от нескольких морфологических характеристик железистого рака. Пытаясь доказать, что использование общепринятых клеточных линий клинически ограничено, авторы нескольких последних исследований использовали кратковременную культуру первоначальных клеток рака предстательной железы (38). Клеточные линии являются ценными моделями для исследования влияния факторов роста, но при узком спектре клеточных линий результаты подобного исследования могут оказаться нехарактерными для опухолей предстательной железы в целом.
Хороших моделей на животных для изучения рака предстательной железы недостаточно, особенно не хватает моделей, которые имитируют все стадии болезни. Ксенографтные модели (человеческая ткань трансплантируется реципиенту с иммунодефицитом), в которых используются либо клеточные линии, либо трансплантируемые опухоли, полезны, но они по существу обходят раннее развитие опухоли, поскольку опухоль трансплантируется на поздней стадии рака. PC-82 и PC-EW являются андрогеннозависимыми ксенографтными линиями рака предстательной железы. Они полезны для изучения регуляции андрогенных рецепторов (39). Прогрессирование CWR22 ксенографтной линии до андрогенной независимости in vivo делает эту модель полезной для изучения прогрессирования человеческого рака предстательной железы (40). Существуют многочисленные модели на грызунах для рака предстательной железы. Самой известной является Dunning R-3327 модель простатической аденокарциномы на крысах, опухоль, полученная из Copenhagen крысиной предстательной железы (41). Из этой клеточной модели были развиты вторичные клеточные линии, имитирующие болезнь с андрогенной зависимостью, без андрогенной зависимости и метастатическую форму заболевания. Недавно была разработана трансгенная мышиная модель, которая направляет экспрессию SV40 раннего гена (Tag) в эпителий предстательной железы (42). Из-за изменчивого поведения рака предстательной железы будет всегда трудно добиться точного соответствия заболевания в моделях на животных тому, как оно развивается у человека. Имеющиеся сегодня модели далеки от того, как рак развивается у человека, но благодаря им возможно исследование последовательных этапов развития рака предстательной железы у человека.
IGF ось состоит из лигандов (IGF-I и IGF-II), рецепторов (IGF-1R и IGF-2R), по крайней мере из шести связующих протеинов (IGFBP-1-6) и протеазов связующих протеинов (рисунок 2).
Стромальные клетки, вероятно, являются главным источником инсулиноподобных факторов роста in vivo. Они усиливают рост эпителиальных клеток посредством паракринного эффекта. Выработка инсулиноподобных факторов роста эпителиальными клетками предстательной железы является одним из изменений, происходящих одновременно с развитием железистого рака (47). IGF-1R экспрессируется в эпителиальных клетках, выращенных из нормальной предстательной железы, доброкачественной гиперплазии предстательной железы и ткани поражённого раком органа (3, 4, 48). Изучение клеточных линий рака предстательной железы у человека показало, что уровни IGF-1R выше в андрогеннозависимых клетках, чем в клетках, которые нечувствительны к андрогенам (4). Снижение IGF-1R при помощи пептидных аналогов подавляло рост клеточных линий рака предстательной железы (49).
Важность инсулиноподобных факторов роста в биологии рака предстательной железы была выдвинута на первый план в последних исследованиях, авторы которых связывали высокие уровни плазмы IGF-I со значительно большим риском развития рака предстательной железы (5, 50). Сообщения относительно уровней IGF-1R в ткани предстательной железы человека очень противоречивы, и в то время как некоторые учёные обнаружили повышение регуляции рецепторных уровней, более распространено мнение о снижении уровней в злокачественных тканях in vivo (53, 54).
Нормальные и злокачественные эпителиальные клетки предстательной железы вырабатывают связующие протеины инсулиноподобных факторов роста (IGFBPs), которые могут модулировать митогенную активность инсулиноподобных факторов роста (55). IGFBP-3 связывает >90% циркулирующих инсулиноподобных факторов роста, и в целом ў1% инсулиноподобных факторов роста циркулируют в свободной форме (56). Была показано, что чрезмерная экспрессия подавляющего IGFBP-4 препятствует началу образования/формирования опухоли предстательной железы (57). Хорошо охарактеризованный сывороточный ген-маркёр рака предстательной железы, PSA, является протеазом для IGFBP-3 (7). PSA расщепляет главный сывороточный IGFBP-3, сокращая аффинность IGFBP-3 для связывания инсулиноподобных факторов роста и создавая благоприятные условия для взаимодействия IGF-1 с IGFR-1. Клетки рака предстательной железы также выделяют катепсин D и плазминогенный активатор класса урокиназ, которые ведут себя так же, как и протеазы связующих протеинов (BP) (58, 59). Это увеличивает биоактивность инсулиноподобных факторов роста в местах выработки IGFBP и, возможно, объясняет склонность к костным метастазам при прогрессировании рака предстательной железы.
EGF оказывает своё воздействие через разделённый рецептор с TGF-a (60); EGF и TGF-a сходны по структуре и, таким образом, они подобны друг другу способностью связывать и регулировать ЕGFR (рецептор инсулиноподобного фактора роста) (61). Здоровая предстательная железа включает огромное количество EGF, вырабатываемого эпителиальными клетками (62). Первоначальным тканевым культурам нормальных человеческих эпителиальных клеток EGF требуется как средство для нормального роста (63). Учёные, проводившие иммуногистохимические исследования, главным образом определяли стромальные клетки нормальной ткани предстательной железы как место выработки TGF- a . Избирательность реакции эпителиальных клеток на паракринный стромальный TGF-a и на не аутокринный EGF привели к предположению, что ЕGFR расположено на базолатеральной поверхности клеток, при этом прочные соединения эпителиальных клеток не позволяют люминальному ЕGF достичь рецепторов (9).
Экспрессия ЕGF в предстательной железе контролируется андрогенами. В моделях на грызунах в результате кастрации уровни ЕGF снижаются, а уровни ЕGFR увеличиваются (16); противоположные последствия кастрации наблюдаются при повторном введении тестостерона (64). При проведении кастрации понижаются уровни ЕGF и увеличиваются уровни TGF- b , в результате чего происходит инволюция предстательной железы. Таким образом, противоположное действие этих двух пептидных факторов роста полностью регулирует рост здоровой предстательной железы (64, 65).
Рак предстательной железы — это проблема, с которой может столкнуться, пожалуй, каждый мужчина. К настоящему моменту не существует ни надежных методов профилактики этого заболевания, ни достоверных способов заранее узнать, каков риск столкнуться с бедой в каждом конкретном случае. Однако медики уже научились распознавать рак простаты на самых ранних стадиях, а также успешно лечить опухоли. Поэтому если онколог предполагает наличие рака простаты — не спешите впадать в отчаяние, ведь шансы на выздоровление высоки.
Стадии и особенности протекания рака предстательной железы
Предстательная железа — небольшой орган (размером с шарик для пинг-понга), расположенный у основания мочевого пузыря. Ее основная функция — синтез секрета, входящего в состав спермы, и участие в процессе семяизвержения.
Рак предстательной железы подразумевает появление и увеличение в размерах опухоли, способной к быстрому росту и метастазированию (переносу злокачественных клеток в другие органы и ткани). Это заболевание может возникнуть в любом возрасте, но в подавляющем большинстве случаев диагностируется у мужчин старше 60 лет.
Рак простаты — третье по распространенности онкологическое заболевание у представителей сильного пола в России после рака легких и рака желудка. Он обнаруживается у одного из пятнадцати мужчин старше 40 лет. Каждый год в мире злокачественные опухоли предстательной железы диагностируют у миллиона человек, и примерно каждый третий из них умирает вследствие данной патологии.
Почему развивается рак предстательной железы? Известно, что это сопряжено с изменениями гормонального фона, генетической предрасположенностью, неправильным питанием и воздействием некоторых других факторов, роль которых до сих пор окончательно не установлена.
От момента появления первой раковой клетки до развития симптомов, которые приводят мужчину на консультацию к врачу, обычно проходит несколько лет. По этой причине часто пациент оказывается на приеме у онколога с запущенной, разросшейся опухолью, которую сложно вылечить.
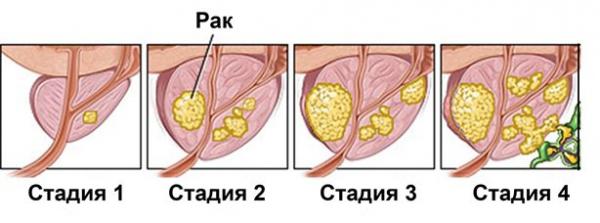
Всего принято выделять четыре стадии рака простаты:
- 1 стадия характеризуется маленькими размерами опухоли, отсутствием вовлечения в патологический процесс лимфатических узлов (туда раковые клетки могут попасть с током лимфы) и хорошим самочувствием больного. Как правило, на этой стадии рак простаты выявляется случайно — в ходе лечения другого заболевания железы. Прогноз для жизни пациента — благоприятный, терапия не занимает много времени.
- 2 стадия рака простаты означает, что новообразование увеличилось в размерах. Его можно прощупать — в ходе ректального осмотра (простата прилегает к передней стенке прямой кишки, поэтому врач способен дотянуться до нее пальцем). При этом симптомы заболевания зачастую по-прежнему не проявляются. Поэтому так важно регулярно проходить профилактическое обследование у уролога. Около 80% больных, у которых рак простаты был диагностирован на 2 стадии, выздоравливают.
- 3 стадия заболевания характеризуется разрастанием опухоли за пределы оболочки простаты. Раковые клетки обнаруживаются в лимфоузлах малого таза и в некоторых соседних органах. К этому моменту больной обычно ощущает дискомфорт: из-за деформации железы нарушается мочеиспускание, появляется боль в промежности. Чтобы победить опухоль, уже недостаточно сделать операцию, поэтому часто онкологи используют комбинированную тактику, сочетая различные подходы к уничтожению раковых клеток. Выживаемость на этой стадии рака простаты составляет менее 40%.
- 4 стадия подразумевает, что, помимо простаты, рак затронул отдаленные органы или лимфоузлы. Метастазы могут обнаруживаться в костях, легких, печени и т. д. Если пациент — пожилой человек с тяжелыми хроническими заболеваниями, врачи примут решение отказаться от операции в пользу щадящих методов терапии, которые продлят жизнь и облегчат страдания больного, хотя и не помогут победить рак.
Как будет проходить лечение рака простаты, зависит не только от стадии болезни. Важное значение имеет тип опухоли — его определяют при биопсии, взяв несколько образцов ткани и изучив их под микроскопом. Некоторые разновидности рака — например полиморфноклеточный рак предстательной железы — склонны к быстрому агрессивному росту, развитие других подвержено влиянию гормонов. Опытный онколог учитывает все эти обстоятельства, а также мнение самого больного, прежде чем принять решение о лечебной тактике.
Немаловажную роль играет и техническая оснащенность клиники. Не секрет, что многие современные технологии и лекарства попросту не доступны в отечественных онкологических центрах или находятся на стадии внедрения. И даже такие классические подходы, как хирургическое удаление простаты, могут значительно отличаться, что сказывается не только на успехе лечения, но и на качестве жизни пациента.
Предстательная железа — орган важный, но взрослый мужчина вполне способен прожить и без него. Поэтому, если рак не перекинулся на соседние органы и ткани, а состояние больного допускает проведение операции, онколог порекомендует мужчине радикальную простатэктомию — удаление простаты. На начальных стадиях болезни такой подход позволяет полностью вылечиться в короткий срок (пребывание в больнице занимает около 7 дней).
Между тем важно помнить, что речь идет о серьезном вмешательстве в работу организма, которое сопряжено с риском для жизни, а также приводит к некоторым неприятным последствиям. Так, больные нередко испытывают проблемы с мочеиспусканием на протяжении многих месяцев после операции, более половины мужчин — жалуются на исчезновение эрекции.
Щадящим вариантом хирургического лечения рака простаты является лапароскопическое вмешательство, при котором удаление простаты осуществляется через небольшие разрезы — всего несколько миллиметров длиной. В результате снижается риск послеоперационных осложнений, а сама процедура переносится пациентом гораздо легче.
Альтернативой традиционному хирургическому вмешательству может стать криохирургия опухоли простаты. Данный метод применим на ранних стадиях заболевания, когда рак еще не вышел за пределы органа. В ходе манипуляции пациенту в простату вводятся специальные иглы, через которые поступает жидкие аргон или азот. Низкие температуры разрушают ткани железы, а врач при помощи УЗИ контролирует, чтобы воздействие не повредило соседние органы. Как результат — железу не приходится удалять (хотя функции ее необратимо нарушаются). В последние годы криохирургию все чаще предлагают в качестве основного способа лечения рака простаты, который подходит больным всех возрастов.
Лучевая терапия назначается как отдельный метод лечения, так и в качестве дополнения к операции: до вмешательства или после него. Речь может идти как о внешней радиотерапии (когда пациент лежит под излучателем), так и о внутренней лучевой терапии, когда в тело больного вводят особые радиоактивные гранулы.
Внешняя лучевая терапия также имеет свои разновидности. Онкологи стремятся минимизировать губительное воздействие радиации на ткани тела, поэтому стараются как можно точнее направить пучок радиации на опухоль. В этом им помогают такие методы, как 3D-конформная лучевая терапия, лучевая терапия модулированной интенсивности (IMRT), стереотоксичечская лучевая терапия (SBRT) и протонная лучевая терапия. Каждый из этих подходов имеет достоинства и недостатки. Часто радиотерапия приводит к устойчивым расстройствам мочеиспускания и к эректильной дисфункции.
Внутренняя лучевая терапия (брахитерапия) значительно увеличивает эффект радиации за счет сокращения расстояния от ее источника до раковых клеток. Радиоактивные гранулы, используемые для процедуры, содержат радиоактивный йод, палладий и другие химические вещества, способные в течение длительного времени воздействовать на окружающие ткани. В зависимости от метода, эти гранулы могут находиться в организме многие месяцы (постоянная брахитерапия) или только во время лечебных сеансов (временная брахитерапия).
Химиотерапия применяется, как правило, в ситуациях, когда рак распространился по организму, поэтому воздействовать на болезнь нужно глобально. Препараты, используемые для лечения злокачественных опухолей простаты, назначают курсами, следя за результатами терапии и развитием побочных эффектов. Химиотерапевтические средства плохо влияют не только на рак, но и на здоровые ткани. Поэтому больные, проходящие такое лечение, часто страдают от расстройств пищеварения, слабости, потери волос и инфекционных заболеваний.
Данный вид лечения направлен на активацию иммунитета пациента. Раковые клетки чужеродны нашему телу, однако благодаря особым приспособительным механизмам они способны уклоняться от иммунного ответа.
Поскольку зачастую рост опухоли провоцируется действием мужских половых гормонов, на поздних стадиях рака простаты врачи могут назначать пациенту препараты, блокирующие синтез этих веществ. Обычно речь идет о пожизненном приеме фармацевтических средств. Такое лечение означает медикаментозную кастрацию: на его фоне затухает сексуальная функция. В сочетании с другими методами — например радиотерапией — прием гормонов способен привести к полному излечению пациентов, которым противопоказана радикальная простатэктомия. При этом медикаментозная кастрация обратима — после отмены лекарств.
Методы лечения рака простаты разнообразны, и каждый год появляется информация о новых эффективных подходах. Другими словами, безнадежных случаев, когда медицина оказывается бессильна помочь пациенту, уже почти не осталось. Важно найти врача, который подберет эффективную лечебную тактику. Не стоит отчаиваться — победа над раком во многом зависит от вас.
Читайте также:
- Жировая опухоль у мужчин
- Как сказать брату что он рак
- Что такое мелкоклеточный нейроэндокринный рак легкого
- Хентай раком в школьной форме
- Что можно есть при раке предстательной железы последствия

