Растворимые рецепторы фактора некроза опухолей
ФНО-а является прототипом семейства сигнальных молекул, проявляющих свое биологическое действие через семейство соответствующих рецепторных молекул. ФНО-а был первоначально выделен на основании его двух интересных биологических эффектов: (1) геморрагического некроза злокачественных опухолей и (2) ассоциированной с воспалением кахексии.
Хотя ФНО-а осуществляет многие из своих важных биологических эффектов в качестве растворимой молекулы, заново синтезированный ФНО-а существует на клеточной поверхности в форме трансмембранного белка. Специфическая металлопротеиназа, известная как конвертирующий ФНО-а фермент (ТАСЕ), ответственна за большую часть ФНО-а, секретированного Т-клетками и миелоидными клетками. Ближайшим родственником ФНО-а является ФНО-β, известный также как лимфо-токсин-а (LT-а).
К другим родственным молекулам в семействе ФНО относятся лимфотоксин β (LT-β), который связывается с LT-a, образуя гетеродимер LT-a1β1, Fas-лиганд (FasL) родственного ФНО и вызывающего апоптоз лиганда (TRAIL), а также индуцированный активацией родственный ФНО цитокин (TRANCE) и лиганд CD40 (CD 154). Хотя некоторые из этих членов семейства ФНО традиционно не считаются цитокинами, их структура (все они являются мембранными протеинами типа II с внутриклеточным N-концевым и внеклеточным С-концевым элементами) и сигнальные механизмы схожи с аналогичными для ФНО.
Растворимые формы ФНО-а, LT-а и Fas-лиганда являются гомодимерами, а доминирующая форма LT-β представляет собой мембранный гетеродимер LT-а1β1. Тримеризация членов семейства ФНО их тримерными лигандами необходима для инициации сигнала и экспрессии биологической активности.
TNFR1 и TNFR2 имеют достаточно протяженные участки близкой гомологии, и оба присутствуют в большинстве типов клеток. Тем не менее между ними имеются значительные различия.
В отличие от цитокиновых рецепторов для некоторых других крупных семейств, в сигнализации ФНО не участвует путь Jak/STAT. В клетках ФНО-а вызывает два типа реакций: (1) провоспалительные и (2) вызывающие индукцию апоптотической гибели клеток. Провоспалительное действие ФНО-а, которое включает стимуляцию экспрессии молекул адгезии и индукцию вторичных цитокинов и хемокинов, происходит в большей степени благодаря активации NF-кВ и может передаваться как через TNFR1, так и через THFR2.
Индукция апоптоза посредством сигнала через TNFR1 зависит от региона, известного как домен смерти, который отсутствует у TNFR2, а также от взаимодействий с дополнительными белками доменов смерти в пределах сигнального комплекса TNFR1. Сигнал, инициированный связыванием лиганда с TNFR1, Fas или другими рецепторами семейства ФНО, содержащими домен смерти, в итоге приводит к активизации каспазы 8 или 10 и изменениям ядра и фрагментации ДНК, характерным для апоптоза.
Как минимум два из семейства рецепторов TNFR (TFNR1 и LT-TFNR1) также содействуют нормальному анатомическому развитию лимфоидной системы. У мышей с дефицитом ФНО-а отсутствуют зародышевые центры и фолликулярные дендритные клетки. Мыши с мутацией TFNR1 имеют те же аномалии, кроме того, у них отсутствуют пейеровы бляшки. При нулевых мутациях в LT-a и LT-β выявляются и другие аномалии в лимфоидном органогенезе, а также неспособность к развитию периферических лимфоузлов.
ФНО-a является важным медиатором кожного воспаления, и его экспрессия индуцируется в ходе почти всех воспалительных реакций в коже. Нормальные ке-ратиноциты человека и линии кератотических клеток синтезируют достаточные количества ФНО-a после стимуляции липополисахаридами или УФ-светом. Кожное воспаление, стимулированное ирритантами и контактными сенсибилизаторами, ассоциируется с активной индукцией производства ФНО-a в кератиноцитах. Воздействие ФНО-a заставляет клетки Лангерганса мигрировать к дренирующим лимфоузлам, что дает возможность сенсибилизировать наивные Т-клетки.
Одним из молекулярных механизмов, который может способствовать вызванной ФНО-a миграции клеток Лангерганса в лимфоузлы, является уменьшение экспрессии молекул адгезии Е-катедрина после воздействия ФНО-a. Индукция рецептора 7 хемокина СС на эпидермальных и дермальных антиген-презентирующих клетках зависит от их перемещения в дренирующую лимфосистему. Из рецепторов TNFR кератины экспрессируют преимущественно TNFR1. Аутокринные сигнальные петли с участием ФНО-a и TNFR1 приводят к производству в кератиноцитах различных, индуцируемых ФНО, вторичных цитокинов.
Центральная роль ФНО-a в воспалительных заболеваниях, включая ревматоидный артрит и псориаз, стала очевидной в результате клинических исследований. Лекарства, действующие на патогенетические механизмы, вовлекающие ФНО, включают гуманизированные анти-ФНО-a антитела (инфликсимаб-infliximab), полностью человеческие анти-ФНО-а антитела (адалумимаб — adalumimab) и растворимый рецептор ФНО (этанерцепт — etanercept). Лекарства этого класса одобрены FDA для терапии многих воспалительных и аутоиммунных заболеваний, таких как болезнь Крона и ревматоидный артрит. Все эти анти-ФНО-препараты одобрены FDA для лечения псориатического артрита, а этанерцепт утвержден для лечения хронического бляшечного псориаза.
Этот класс лекарственных препаратов является потенциально важным и для лечения других воспалительных дерматозов. Парадокс состоит в том, что такие препараты эффективны не во всех случаях аутоиммунных заболеваний — множественный склероз после лечения этими препаратами незначительно ухудшается. Антагонисты ФНО являются сильнодействующими иммуномодулирующими лекарственными средствами, поэтому при их применении требуется соответствующая осторожность. При лечении антагонистами ФНО случаи кожной Т-клеточной лимфомы, вначале считавшиеся случаями псориаза, быстро прогрессировали в фульминантное заболевание. Антагонисты ФНО также способствуют выходу латентных микобактериальных инфекций из-под контроля иммунной системы с угрозой летального исхода заболевания.
- Рекомендуем далее ознакомиться со статьей "Цитокины семейства ИЛ-17"
Фактор некроза опухоли-альфа (ФНО-α) является пептидом, осуществляющий свои эффекты через растворимые рецепторы фактора некроза опухоли-альфа типа I и II. В жировой ткани фактор экспрессируется как адипоцитами, так и преадипоцитами.
По данным ряда исследований, его секреция не зависит от топографических особенностей жировой ткани, хотя в то же время имеются работы, свидетельствующие о преимущественной секреции фактора некроза опухоли-ФНО-αлибо висцеральной, либо подкожной жировой тканью.
Свои эффекты ФНО-α осуществляет через взаимодействие с растворимыми рецепторами типа I и II, а также мембранными рецепторами. Эти рецепторы дифференцированы по распределению в клетках и тканях, а также экспрессии, регулируемой различными механизмами.
На сегодняшний день взаимодействие и значение различных типов рецепторов ФНО-α точно не установлены. Предполагается, что оба растворимых рецептора служат для нейтрализации фактора, непосредственно не связанного с мембранными рецепторами.
Как показано in vitro, растворимые рецепторы связывают ФНО-α и тормозят его биологическую активность, конкурируя с рецепторами ФНО-α, связанными с мембраной. Имеются сообщения о том, что растворимые рецепторы способствуют стабилизации пептида. Что касается связанных с мембраной рецепторов фактора, то предполагается, что они необходимы для реализации эффектов ФНО-α и имеют значение в развитии обусловленной ФНО-α инсулинорезистентности, причем посредством разных механизмов. Однако относительный вклад как растворимых, так и мембранных рецепторов в реализацию эффектов ФНО-α и механизмы их взаимодействия пока остаются неясными. Адипоциты экспрессируют оба типа рецепторов ФНО-α.
Эффекты ФНО-α. Содержание ФНО-α в общей циркуляции ниже его концентрации в жировой ткани, что свидетельствует скорее об ауто- и паракринных, чем эндокринных свойствах ФНО-α.
В жировой ткани ФНО-α влияет на дифференцировку адипоцитов, оказывая тормозящее воздействие на экспрессию транскрипционных факторов, вовлеченных в адипо- и липогенез. Предполагается также, что ФНО-α может влиять на апоптоз пре- и адипоцитов.
Полагают, что ФНО-α оказывает в основном ауто- и паракринное действие и имеет большое значение для развития инсулинорезистентности преимущественно в жировой ткани. Под его влиянием снижается активность тирозинкиназы инсулинового рецептора, усиливается фосфорилирование серина субстрата инсулинового рецептора 1; уменьшается экспрессия ГЛЮТ-4 в жировой и мышечной тканях. Через активацию гормон-чувствительной липазы в адипоцитах ФНО-α стимулирует липолиз, а также тормозит активность липопротеиновой липазы. Через влияние на скорость липолиза в адипоцитах этот цитокин также может способствовать развитию инсулинорезистентности.
ФНО-α изменяет экспрессию ряда секретируемых адипоцитами факторов, таких как адипонектин, интерлейкин-6 (ИЛ-6), лептин и ингибитор активатора плазминогена-1 (ИАП-1).
В печени ФНО-α подавляет экспрессию генов, участвующих в поглощении и метаболизме глюкозы, окислении жирных кислот; увеличивает экспрессию генов, вовлеченных в синтез de novo холестерина и жирных кислот.
ФНО-α оказывает прямое тормозящее воздействие на секрецию тиреоидных гормонов и дейодиназную активность в щитовидной железе. Экспрессия ФНО-α увеличивается при ожирении и положительно коррелирует с массой жировой ткани и инсулинорезистентностью.
В этой статье мы попытаемся разобраться, что это такое — фактор некроза опухоли, который у ученых вызывает больше вопросов, чем ответов. Итак, фактор некроза опухоли (ФНО, Tumor necrosis factor, TNF), именуемый также кахектин, представляет собой белок, вырабатываемый так называемыми макрофагами и лимфоцитами, который обладает рядом жизненно важных свойств.
Он способен подавлять злокачественные клетки, обладает противовоспалительным действием, а также улучшает ответную реакцию иммунной системы на внешние раздражители. ФНО влияет на процесс кроветворения, подавляя рост количества лимфоцитов при лейкозах, также выполняет защитную функцию при радиации. Участвует в процессах эндокринной и нервной систем.
При возникновении в организме неблагоприятных процессов, таких как раковые клетки, например, концентрация данного белка в организме резко возрастает. Это явление впервые было выявлено в ходе экспериментов над мышами.
На сегодняшний день учеными создано целое направление по борьбе с раковыми и другими видами смертельных заболеваний, именуемое иммуноонкология. В основе ее изучения лежит стимуляция собственных защитных механизмов организма, коим и является один из разновидностей таких клеток – фактор некроза опухолей.
- Свойства и механизмы
- ФНО в фармогологии
- Цена анализа
- Видео: ФНО (с 39:07)
Свойства и механизмы
Нередки случаи, когда ФНО переходит на сторону зловредных клеток и способствует их росту. При большой концентрации данного вида белка в организме, у человека наблюдается депрессия, происходит нарушение иммунной системы, что приводит к псориазу, красной волчанке. Активизируются воспалительные процессы. Фактор некроза опухоли может даже стать причиной хронического нефрита. Несмотря на массу исследований и научных статей, посвященных фактору некроза опухоли, истинная сущность и действия белка в той или иной ситуации, до конца не изучены.
Ведущие клиники в Израиле



Но проведя массу экспериментов и лабораторных исследований, ученые определили ряд свойств, присущих ФНО:
- При существующих злокачественных образованиях под действием ФНО, наблюдается некроз (гибель) раковых клеток. Уникальность ФНО в том, что здоровые клетки не подвергаются никаким изменениям;
- Активизируется иммунитет. Это достигается за счет того, что ФНО задействован в процессе кроветворения и противовоспалительных процессах;
- При прогрессировании болезни, ФНО способствует дифференциации и миграции иммунных клеток.
Механизм действия ФНО таков, что при образовании злокачественных клеток, микробов, вирусов, число лимфоцитов резко растет, происходит миграция нейтрофилов в очаг воспаления. Нейтрофилы и лимфоциты внедряются во внутреннюю оболочку сосудов, где есть воспаление. Было установлено, что белки ФНО способны подавлять действие радиации. Уничтожение опухолевых клеток достигается путем выделения активных форм оксида азота, кислорода и свободных радикалов. У здоровых людей при анализах ФНО обычно не обнаруживается, но на протяжении жизни раковые клетки имеют тенденцию к появлению в организме. Именно в такой момент подключаются клетки ФНО, которые нейтрализуют их.
Часто, при бактериальном инфицировании происходит септическое состояние. При этом состоянии ФНО вырабатывает так называемый цитокин, который резко угнетает иммунитет. Возникает тяжелый шок, сопровождающийся сердечной, почечной недостаточностью.
Раковая кахексия
У больных с тяжелыми инфекционными заболеваниями может возникнуть так называемая раковая кахексия, которая провоцируется ФНО. Это обусловлено тем, что ФНО способен расщеплять жир и уничтожать фермент, который участвует в накоплении липидов.
Обнаружение в крови беременной женщины вещества кахектин говорит о каких-либо воспалительных механизмах, обусловленных бактериальными компонентами. В этом случае жизненно важно своевременное обнаружение повышенной концентрации кахектина в организме, так как причиной могут быть инфицирование околоплодных вод, нарушение внутриутробного развития плода. Есть и другие случаи, при которых анализ на обнаружение ФНО жизненно важен. Рассмотрим их.
* Получив данные о заболевании пациента, представитель клиники сможет рассчитать точную цену на лечение.
ФНО в фармогологии
Огромная роль ФНО в человеческом организме при борьбе с тяжелыми заболеваниями неоспорима. Ученые долго работали и работают над тем, чтобы разработать человеческий ФНО и его ингибиторы. На сегодняшний день ученые-фармацевты в этом очень преуспели. В медицинской практике используются синтетические аналоги ФНО, которые применяются при онкологии. Также разработаны антитела, которые уменьшают количество ФНО при некоторых тяжелых заболеваниях.
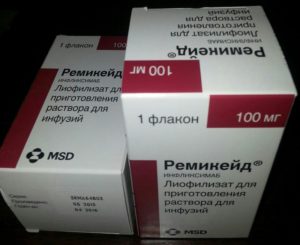
Ремикейд, Энбрел – ингибиторы ФНО. Их применение целесообразно при псориазе, болезни Крона, артрите. Применяются только в том случае, когда традиционное лечение гормонами, цитосатиками не эффективно.
Инфликсимаб, Ритуксимаб – антитела к ФНО. Показаны в тех случаях, когда инфекция сопровождается кахексией, так как подавляет концентрацию ФНО.
Тимозин-альфа (тимактид) — иммуномодулирующее средство. Применяют при ВИЧ-инфекциях, сепсисе и других заболеваниях, требующих повышение иммунитета.
Цитостатики (цтокины) – используют при перенесенной химиотерапии, после чего, как известно, иммунитет подавлен. Данный класс препаратов снижает риск инфекционных осложнений. Цитостатики как самостоятельное лекарство обычно не используют. Их сочетают с химиотерапией и другими препаратами, используемыми при борьбе с раком.
В России широко используются Рефнот и Ингарон. Они зарегистрированы в России. Они менее токсичны Цитокина, но обладают большей эффективностью в борьбе с раковыми образованиями.
Эффективность данного класса лекарств не дает повода употреблять их бесконтрольно на свое усмотрение. Прием их строго должен контролироваться врачом и только при крайней необходимости, когда организм не в состоянии бороться с болезнью самостоятельно.
Цена анализа
Не во всех лабораториях клиник имеется данный вид анализа. Цена зависит от региона и от того, частная это клиника или государственная и составляет от 700 до 3500 рублей. Заграницей стоимость анализа варьируется от ста до двухсот долларов.
Видео: ФНО (с 39:07)
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Алекперов Р. Т., Тимченко А. В., Самсонов М. Ю. и др. Уровень растворимых рецепторов 1типа фактора некроза опухоли а у больных системной склеродермией. Тер. архив, 2004, 5, 11-15.
Бородин А. Г. Клинико-патогенетическое значение спектра аутоантител и содержания фактора некроза опухоли- альфа при системной красной волчанке и некоторых ревматических заболеваниях. Авт. дисс. д. м. н., Ярославль, 2000.
Кричевская О.А., Клюквина Н.Г., Александрова Е.Н. и др. Клиническое значение растворимых рецепторов фактора некроза опухоли а у больных системной красной волчанкой. Клин, мед., 2004, 10, 51-55.
Насонов Е.Л. ФНОа - новая мишень для противовоспалительной терапии ревматоидного артрита. РМЖ, 2000, 17, 718-722.
Насонов ЕЛ., Чичасова Н.В., Самсонов М.Ю. и др. Растворимые рецепторы фактора некроза опухоли при ревматоидном артрите. Клин, мед., 2001, 8, 33-36.
Насонова В.А., Астапенко М.Г. Клиническая ревматология. М., Медицина, 1989, 143-175.
Степанец О.В. Клиническое значение растворимых рецепторов фактора некроза опухоли а 55 kDa при ревматоидном артрите. Авт.дисс.к.м.н, М., 2001.
Ярилин А.А. Система цитокинов и принципы ее функционирования в норме и патологии. Иммунол., 1997, 5, 714.
Aderka D., Wysenbeek A., Engelman Н. et al. Correlation between serum levels of soluble tumor necrosis factor receptor and disease activity in systemic lupus erythematosus. Arthr. Rheum., 1993,36. 1111-1120.
al-Janadi М., al-Balt S., al-Dalaan A. et al. Cytokine profile in systemic lupus erythematosus, rheumatoid arthritis and other rheumatic diseases. J. Clin. Immunol., 1993, 13, 58-67.
Aringcr М., Graninger W., Steiner G. at al. Safety and efficacy ofTNF-a blockade in SLE. Arthr. Rheum., 2004, 10, 3161-3169.
Aringer М., Smolen J. Complex cytokine effects in a complex autoimmune disease: tumor necrosis factor in systemic lupus erythematosus. Arthr. Res. Then, 2003, 5(4), 172-177.
Aukrust P., Liabak N.B., Miiller F. et al. Serum levels of tumor necrosis factor-a (TNF-a) and soluble TNF receptors in human immunodeficiency virus type I infection: Correlations to clinical immunologic and virologic parameters. J. Infect. Dis., 1994, 169,420424.
Bargetzi M.J., Lantz М., Smit C.G.etal. Interleukin-I beta induces interleukin-1 receptor antagonist and tumor necrosis factor binding protein in humans. Cancer Res., 1993, 53, 4010-4013.
Barrera P., Boerbooms A.M. Janssen E.M. et al. Circulating soluble tumor necrosis factor receptors, interleukin-2 receptors, tumor necrosis factor alpha, and interleukin-6 levels in rheumatoid arthritis: Longitudinal evaluation during methotrexate and azathioprine therapy. Arthr. Rheum., 1993, 36(8), 1070-1079.
Baud L., Ardaillou R. Tumor necrosis factor alpha in glomerular injury. Kidney Int., 1994, 45, 32-36.
Bazzoni F., Beutler B. The tumor necrosis factor ligand and receptor families. N. Engl. J. Med., 1996, 334, 1717-1725.
Bertolaccini M.L., Atsumi Т., Lanchbury J.S. et al. Plasma tumor necrosis factor alpha level and 238-A promoter polymorphism in patients with antophospholipid syndrome. Thromb. Haemost., 2001,85, 193-194.
Bolster M.B., Ludwicka A, Sutherland S.E. et al. Cytokine concentrations in bronchoalveolar lavage fluid of patients wiih systemic sclerosis. Arthr. Rheum., 1997, 40(4), 743-751.
Brouckaert P., Fiers W. Tumor necrosis factor and the systemic inflammatory response syndrome. Curr. Top. Microbiol. Immunol., 1996, 216, 167-187.
Chu C.Q., Field М., Feldman M. et al. Localisation of tumor necrosis factor ? in synovial tissues and at cartilage-pannus junction in patients with rheumatoid arthritis, Arthr. Rheum., 1991, 34, 1125-1132.
Davas E.M., Tsirogianni A., Kappou I. et al. Serum IL-6, TNFalpha, p55 srTNFalpha, p75srTNFalpha, srlL-2alpha levels and disease activity in systemic lupus erythematosus. Clin. Rheum., 1999, 18, 17-22.
Dayer J.M., Beutler B., Cerami A. Cachectintumor necrosis factor stimulate collagenase and prostaglandin E production by human synovial cells and dermal fibroblast. J. Exp. Med., 1985, 162, 2163-2168.
Engelberts I., Moeller A., Schoen G.J.M. et al. Evaluation of measurement of human TNF in plasma by ELISA. Lymphokine Cytokine, 1991, 10, 69-75.
Espersen G.T., Vfestergaard М., Ernst E. et al. Tumor necrosis factor alpha and interleukin-2 in plasma from rheumatoid arthritis patients in relation with disease activity. Clin. Rheum., 1991, 10, 374-376.
Fei G. Z., Svenungsson E., Padyukov L. et al. The A - 1087 ILI0 allele is associated with cardiovascular disease in SLE. Atheroscleros., 2004, 177(2), 409-414.
Frostegard J„ Svenungsson E., Gunnarsson I. Elevated triglycerides and low levels of high-density lipoprotein as markers of disease activity in association with up-regulation of TNF / tumor necrosis factor receptor system in SLE. Arthr. Rheum., 2003, 48(9), 2533-2540.
Gabay C., Cakir N., Moral F. et al. Circulating levels of tumor necrosis factor soluble receptors in systemic lupus erythematosus are significantly higher than in other rheumatic diseases and correlate with disease activity. J. Rheumatol., 1997, 24(2), 303-308.
Galtomo М., Picco P., Barbano G. et al. Differences in tumor necrosis factor-alpha soluble receptor serum concentrations between patients with Henoch-Schonlein purpura and pediatric systemic lupus erythematosus: pathogenetic implications. J. Rheum., 1998,25, 361-365.
Gattorno М., Picco P., Buoncompagni A. et at. Serum p55 and p75 tumour necrosis factor receptors as markers of disease activity in juvenile chronic arthritis. Ann. Rheum. Dis., 1996, 55(4), 243247.
Georgopoulos S., Plows D., Kollias G. Transmembrane TNF is sufficient to induce localized tissue toxicity and chronic inflammatory arthritis in transgenic mice. J. Inflamm., 1996, 46, 8697.
Gruschwitz M.S, Albrecht М., Vieth G. et al. In situ expression and serum levels of tumor necrosis factor-alpha receptors in patients with early stages of systemic sclerosis. J Rheumatol., 1997, 24(10), 1936-1943.
Gruschwitz M.S, Vieth G. Up-regulation of class II major histocompatibility complex and intercellular adhesion molecule 1 expression on scleroderma fibroblasts and endothelial cells by interfer- on-gamma and tumor necrosis factor alpha in the early disease stage. Arthr. Rheum., 1997,40(3), 540-550.
Hasegawa М., Fujimoto М., Kikuchi K. et al. Elevated serum tumor necrosis factor-alpha levels in patients with systemic sclerosis: association with pulmonary fibrosis. J Rheumatol., 1997, 24(4), 663-665.
Hasegawa Y., Sawada М., Ozaki N. et al. Increased soluble tumor necrosis factor receptor levels in the serum of elderly people. Gerontol., 2000, 46(4), 185-188.
Heilig B., Fiehn C., Brockhaus M. et al. Evaluation of soluble tumor necrosis factor (TNF) receptors and TNF receptor antibodies in patients with systemic lupus erythematosus, progressive systemic sclerosis, and mixed connective tissue disease. J. Clin. Immunol., 1993, 13, 321-328.
Herrera-Esparza R., Barbosa-Cisneros O., Villalobos- Hurtado R-. et al. Renal expression of IL-6 and TNFalpha genes in lupus nephritis. Lupus, 1998, 7, 154-158.
Kalechman Y., Gafler U., Da J.P. et al. Delay in the onset of systemic lupus erythematosus following treatment with the immunomodulator AS101: association with IL-10 inhibition and increase inTNF-alpha levels. J. Immunol., 1997, 159, 2658-2667.
Kantor T.V. Friberg D., Medsger T.A. Jr. et al. Cytokine production and serum levels in systemic sclerosis. Clin. Immunol. Immunopathol., 1992, 65(3), 278-285.
Lacki J.K., Leszczynski P., Kelemen J. et al. Cytokine concentration in serum of lupus erythematosus patients: the effect on acute phase response. J. Med., 1997, 28, 99-107.
Lantz М., Bjomberg F., Olsson I. et al. Adherence of neutrophils induces release of soluble tumor necrosis factor receptor forms. J. Immunol., 1994, 152, 1362-1369.
Majewski S., Wfojas-Pelc A., Malejczyk M. et al. Serum levels of soluble TNF alpha receptor type I and the severity of systemic sclerosis. Acta Derm, fenerol., 1999, 79(3), 207-210.
Riche F., Panis Y., Laisne M.J. et al. High tumor necrosis factor serum level is associated with increased survival in patients with abdominal septic shock: A prospective study in 59 patients. Surgery, 1996, 120, 801-807.
Robak E., Sysa-Jedrzejewska A., Dziankowska B. et al. Association of interferon gamma, tumor necrosis factor alpha and interleukin 6 serum levels with systemic lupus erythematosus activity. Arch. Immunol. Ther. Exp., 1998, 46, 375-380.
Steiner G., Studnicka-Benke A., Witzmann G. et al. Soluble receptor for tumor necrosis factor and interleukin-2 in serum and synovial fluid of patients with rheumatoid arthritis, reactive arthritis and osteoarthritis. J. Rheumatol., 1995, 22, 406-412.
Studnicka-Benke A., Steiner G., Petera P. et al. Tumour necrosis factor alpha and its soluble receptors parallel clinical disease and autoimmune activity in systemic lupus erythematosus. Brit. J. Rheum., 1996, 35, 1067-1074.
Suranyi M.G., Guasch A., Hall B.M. et al. Elevated levels of tumor necrosis factor-alpha in the nephrotic syndrome in humans. Amer. J. Kidney Dis., 1993, 21, 251-259.
Swaak A.J., van den Brink H.G., Aarden L.A. Cytokine production (IL-6 and TNF alpha) in whole blood cell cultures of patients with systemic lupus erythematosus. Scand. J. Rheum., 1996, 25, 233-238.
Tilz G.R., Diez-Ruiz A., Baier-Bitterlich G. et al. Soluble receptor for tumor necrosis factor and neopterin as parameters of cell- mediated immune activation. ACI International., 1997, 9, 110-118.
Man der Poll Т., van Deventer S.J.H., Hack C.E. et al. Effects on leukocytes following injection of tumor necrosis factor into healthy humans. Blood, 1992, 79. 693-699.
van Zee K.J., Kohno Т., Fischer E. et al. Tumor necrosis factor soluble receptors circulate during experimental and clinical inflammation and can protect against excessive tumor necrosis factor alpha in vitro and in vivo. Proc. Natl. Acad. Sci. U. S. A., 1992, 89, 4845-4851.
Wfeckmann A.L., Acocer-Varela J. Cytokine inhibitors in autoimmune disease. Semin. Arthr. Rheum., 1996, 26, 539-557.
Wilson A.G., Symons J.A., McDowell T.L. et al. Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation. Proc. Natl. Acad. Sci. U. S. A., 1997,94, 3195-3199.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
История TNF началась более 150 лет назад, в 1868 году, когда немецкий доктор P. Brunes отметил факт спонтанной регрессии опухолей у пациентов с острыми бактериальными инфекциями. [1] [2] В дальнейшем, исследования по влиянию супернатантов культур стрептококков и других бактерий на опухоли человека показали, что в большинстве случаев размер опухоли уменьшался. [3] Такая терапия опухолей впоследствии была отклонена из-за ее высокой токсичности, но отдельные успешные случаи вызывали интерес и послужили дальнейшему изучению этого явления.
К 1944 году был выделен и охарактеризован полисахарид грамотрицательных бактерий — эндотоксин - один из главных индукторов TNF (Murray Shear et al.). Этот полисахарид вызывал геморрагический некроз опухолей. В 1952 году стало известно, что механизмом такого некроза являлась системная гипотензия, ведущая к коллапсу сосудов опухоли, гипоксии и клеточной гибели (Glenn Algire et al.). Впоследствии, в 1962 появилось сообщение об обнаружении в сыворотке крови здоровых мышей, стимулированных эндотоксином, фактора, который делал такую сыворотку способной индуцировать некроз при введении животным с опухолью. Она получила название сыворотки некроза опухолей (Tumor necrosis serum, TNS) (O’Malley et al.). Подтвердив эндотоксин-индуцированную активность сывороток мышей, обусловливающий её фактор получил название фактора некроза опухоли. [4]
Позднее, из клеточной линии В-лимфобластов человека RPMI-1788 был выделен цитотоксический фактор, названный лимфотоксином (LT-α, TNF-β). [5] [6] Вскоре был выделен еще один цитотоксический фактор из промиеломоноцитарной клеточной линии HL-60 и названный TNF (TNF-α). [7] Анализ аминокислотных последовательностей [6] [7] и кДНК TNF-α и TNF-β выявили их большую структурную гомологию. Кроме того, была обнаружена их способность индуцировать регрессию Meth A саркомы мышей, что служило анализом для их идентификации. [8] [9] Вскоре было показано, что и TNF и LT-α связываются с общим рецептором. [10] Хотя изначально TNF был идентифицирован по своей способности к противоопухолевой активности, широкий спектр биологических эффектов TNF привели к фактам его многочисленного переоткрытия на мышах, что и послужило причиной его многочисленных названий. В 1985 году B. Beutler and A. Cerami сообщили о выделенном белке, названного кахектином, так как он был ответственен за эндотоксин-индуцированную кахексию у мышей. [11] Анализ аминокислотной последовательности мышиного кахектина показал его высокую гомологию с последовательностью ранее описанного человеческого TNF. Т-клеточный индуктор дифференцировки (differentiation-inducing factor, DIF) открытый в 1986 году также имел сходную с TNF структуру. [12]
Ген и регуляция его экспрессии
Фактор некроза опухоли человека кодируется единственным геном (
3.6 kb), который локализован в 6 хромосоме в ее коротком плече (6p21.1-p21.3) и включает в себя 4 экзона. [13] Ген TNF располагается на расстоянии 210 kb от HLA-B локуса и тесно связан с геном LT-α. Оба эти гена имеют различную тканевую специфичность и их экспрессия регулируется двумя собственными независимыми промоторами. [13] [14]
Длина мРНК фактора некроза опухоли человека составляет
1.7 kb, уровень экспрессии зависит от типа клеток. 5’-область, помимо TATA-бокса и GC-бокса, содержит сайт связывания различных транскрипционных факторов, включая NF-κB, PU.1 (purine-rich box), cAMP response element (CRE), ATF-2, c-jun/AP-I, AP-2, SP-1, Krox-24 и NF-AT (nuclear factor-activated T cells). Исследования показали, что CRE- связывающий сайт промотора гена TNF человека связывает ATF2/Jun белки и, таким образом, чрезвычайно важен в регуляции экспрессии гена во многих типах клеток, индуцированной разнообразными клеточными стимулами, в том числе и от самого TNF. [15] [16] Продукция TNF макрофагами показана зависисимой от активации NF-κB. [17] Последние исследования показали, что способность большинства клеток продуцировать TNF регулируется 3’ AU-богатым районом гена этого цитокина (3’ AU-rich elements region, ARE). Этот регион ответственен за регуляцию экспрессии гена TNF на уровне трансляции. [18] Некоторые агенты, такие как ЛПС, индуцируют экспрессию через факторы, которые связываются с другими сайтами промотора гена TNF. [19] Помимо транскрипционных факторов, продукцию TNF регулируют и различные киназы, включая протеинкиназу C, Cot-киназу, p38 MAP-киназу и p42 MAP-киназу.
Белок
Трансляция мРНК TNF происходит с образованием трансмембранного белка II типа (26 kDa), состоящего из 233 аминокислотных остатков. [9] Растворимая форма TNF (17 kDa, 157 аминокислотных остатков, pI 5.6) образуется в результате протеолитического отщепления 76-членного C-концевого сигнального пептида специфической мембраносвязанной металлопротеазой TACE (TNF-α-converting enzyme, ADAM17). [20] В отличие от мышиного, TNF человека не гликозилирован.
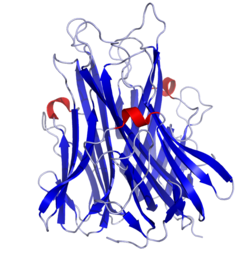
Активная форма TNF – гомотример. Каждый протомер содержит две антипараллельных β-складчатости. Тримеризация осуществляется взаимодействием протомеров друг с другом по принципу голова-к-хвосту. [21] [22]
Рецепторы
Известно два типа рецепторов к TNF, относящихся к суперсемейству TNF-рецепторов. Рецептор I типа (TNFRI, p60, p55, CD120a; 12p13.2), белок с молекулярной массой около 55-60 kDa и рецептор II типа (TNFRII, p80, p75, CD120b; 1p36.3-p36.2) с молекулярной массой 75-80 kDa. Оба рецептора гликозилированы. Внеклеточные части обоих рецепторов содержат четыре высококонсервативных цистеин-богатых домена, внутриклеточные аминокислотные последовательности этих рецепторов совершенно различны и лишены какой-либо ферментативной активности.
Растворимые формы TNFRs были впервые получены 1989 году. [28] [29] [30] [31] [32] [33] Они обнаруживаются в сыворотках здоровых лиц, причем p80 в более высокой концентрации, чем p60 рецептор. Концентрации обоих имеют тенденцию к увеличению у лиц с различными патологическими состояниями [34] [35] и обнаруживаются in vivo в сыворотке, синовиальной и спинномозговой жидкостях, асците яичников и моче. [36] [28]
Сигнальные пути
Сигнальные пути обоих рецепторов могут вести как к антиапоптозному, так и к провоспалительным эффектам. Наиболее полно изучены сигнальные пути от p60 рецептора. Главным образом, они включают в себя активацию NF-κB, JNK и сигнальных путей, приводящих к апоптозу (Tewari and Dixit, 1996; Darnay and Aggarwal, 1997; Singh and Aggarwal, 1998; Nishitoh et al., 1998, Baud and Karin, 2001). Кроме того, p60 способен активировать семейство MAPK протеинкиназ и другие ферменты (Pombo et al., 1995; Nishitoh et al., 1998; Kim et al., 1991). Некоторые исследования показывают, что и p80 рецептор может также активировать апоптоз, JNK и NF–κB. TNFRII не имеет death домена, потому остается пока неясным, каким образом он может активировать эти пути, хотя его внутриклеточная часть может непосредственно связывать TRAF2, который активирует JNK и NF–κB таким же образом как и в случае p60 рецептора (Haridas et al., 1998).
- ↑ Old LJ (1985). "Tumor necrosis factor (TNF)". Science230 (4726): 630-2. PMID 2413547.
- ↑ Aggarwal BB, Aiyer RA, Pennica D, Gray PW, Goeddel DV (1987). "Human tumour necrosis factors: structure and receptor interactions". Ciba Found Symp31: 39-51. PMID 2836139.
- ↑ Coley WB et al., 1894
- ↑ Carswell EA, Old LJ, Kassel RL, Green S, Fiore N, Williamson B. (1975). "An endotoxin-induced serum factor that causes necrosis of tumors.". Proc. Natl Acad. Sci. USA72: 3666–3670. PMID 1103152.
- ↑ Aggarwal BB, Moffat B, Harkins RN. (1984). "Human lymphotoxin: Production by a lymphoblastoid cell line, purification and initial characterization.". J. Biol. Chem.259: 686–691. PMID 6608523.
- ↑ 12 Aggarwal BB, Henzel WJ, Moffat B, Kohr WJ, Harkins RN. (1985). "Primary structure of human lymphotoxin derived from 1788 lymphoblastoid cell line.". J. Biol. Chem.260: 2334–2344. PMID 3882692.
- ↑ 12 Aggarwal BB, Khor WJ, Hass PE, Moffat B, Spencer SA, Henzel WJ, Bringman TS, Nedwin GE, Goeddel DV, Harkins RN (1985). "Human tumor necrosis factors: production, purification and characterization.". J. Biol. Chem.260: 2345-54. PMID 3871770.
- ↑ Gray PW, Aggarwal BB, Benton CV, Bringman TS, Henzel WJ, Jarrett JA, Leung, DW, Moffat B, Ng P, Svedersky LP, Palladino MA, Nedwin GA. (1984). "Cloning and expression of cDNA for human lymphotoxin, a lymphokine with tumor necrosis activity.". Nature312: 721–724. PMID 6334807.
- ↑ 12 Pennica D, Nedwin GE, Hayflick JF, Seeburg PH, Palladino MA, Kohr WJ, Aggarwal BB, Goeddel DV. (1984). "Human tumor necrosis factor: precursor structure, expression and homology to lymphotoxin.". Nature312: 724–729. PMID 6392892.
- ↑ Aggarwal BB, Eessalu TE, Hass PE. (1985). "Characterization of receptor for human tumor necrosis factor and their regulation by γ-interferon.". Nature318: 665–667. PMID 3001529.
- ↑ Beutler B, Greenwald D, Hulmes JD, Chang M, Pan YC, Mathison J, Ulevitch R, Cerami A. (1985). "Identity of tumour necrosis factor and the macrophage-secreted factor cachectin.". Nature316: 552–554. PMID 2993897.
- ↑ Takeda K, Iwamoto S, Sugimoto H, Takuma T, Kawatani N, Noda M, Masaki A, Morise H, Arimura H, Konno K. (1986). "Identity of differentiation inducing factor and tumour necrosis factor.". Nature323: 338–340. PMID 3463866.
- ↑ 12 Nedwin GE, Naylor SL, Sakaguchi AY, Smith D, Jarrett-Nedwin J, Pennica D, Goeddel DV, Gray PW (1985). "Human lymphotoxin and tumor necrosis factor genes: structure, homology and chromosomal localization.". Nucleic Acids Res.13: 6361–6373. PMID 2995927.
- ↑ Nedospasov SA, Shakhov AN, Turetskaya RL, Mett VA, Azizov MM, Georgiev GP, Korobko VG, Dobrynin VN, Filippov SA, Bystrov NS, Boldyreve VG, Chuvpilo SA, Chumakov AM, Shingarova LN, Ovchinnikov YA (1986). "Tandem arrangement of genes coding for tumor necrosis factor (TNF-alpha) and lymphotoxin (TNF-beta) in the human genome.". Cold Spring Harbor Symp. Quant. Biol.51: 611–624. PMID 3555974.
- ↑ Tsai EY, Yie J, Thanos D, Goldfeld AE. (1996). "Cell-type-specific regulation of the human tumor necrosis factor alpha gene in B cells and T cells by NFATp and ATF-2/JUN.". Mol. Cell. Biol.16: 5232–5244. PMID 8816436.
- ↑ Tsai EY, Jain J, Pesavento PA, Rao A, Goldfeld AE. (1996). "Tumor necrosis factor alpha gene regulation in activated T cells involves ATF-2/Jun and NFATp.". Mol. Cell. Biol.16: 459–467. PMID 8552071.
- ↑ Foxwell B, Browne K, Bondeson J, Clarke C, de Martin R, Brennan F, Feldmann M. (1998). "Efficient adenoviral infection with IkappaB alpha reveals that macrophage tumor necrosis factor alpha production in rheumatoid arthritis is NF-kappaB dependent.". Proc. Natl Acad. Sci. USA95: 8211-8215. PMID 9653166.
- ↑ Carballo E, Lai WS, Blackshear PJ. (1998). "Feedback inhibition of macrophage tumor necrosis factor-alpha production by tristetraprolin.". Science281: 1001–1005. PMID 9703499.
- ↑ Myokai F, Takashiba S, Lebo R, Amar S. (1999). "A novel lipopolysaccharide-induced transcription factor regulating tumor necrosis factor alpha gene expression: molecular cloning, sequencing, characterization, and chromosomal assignment.". Proc. Natl Acad. Sci. USA96: 4518–4523. PMID 10200294.
- ↑ Black RA, White JM (1998). "ADAMs: focus on the protease domain.". Curr Opin. Cell Biol.10: 654–659. PMID 9818177.
- ↑ Eck MJ, Sprang SR. (1989). "The structure of tumor necrosis factor-alpha at 2.6 A resolution. Implications for receptor binding.". J. Biol. Chem.264: 17595–17605. PMID 2551905.
- ↑ Jones EY, Stuart DI, Walker NP. (1989). "Structure of tumour necrosis factor.". Nature338: 225–228. PMID 2922050.
- ↑ Tartaglia LA, Ayres TM, Wong GH, Goeddel DV. (1993). "A novel domain within the 55 kd TNF receptor signals cell death.". Cell74: 845–853. PMID 8397073.
- ↑ Banner DW, D'Arcy A, Janes W, Gentz R, Schoenfeld HJ, Broger C, Loetscher H, Lesslauer W. (1993). "Crystal structure of the soluble human 55 kd TNF receptor-human TNF beta complex: implications for TNF receptor activation.". Cell73: 431–445. PMID 8387891.
- ↑ Bazzoni F, Beutler B. (1995). "How do tumor necrosis factor receptors work?". J. Inflamm.45: 221-38. PMID 8867667.
- ↑ Tartaglia LA, Goeddel DV. (1992). "Two TNF receptors.". Immunol. Today13: 151–153. PMID 1322675.
- ↑ Vandenabeele P, Declercq W, Beyaert R, Fiers W. (1995). "Two tumour necrosis factor receptors: structure and function.". Trends Cell Biol.5: 392-9. PMID 14732063.
- ↑ 12 Seckinger P, Isaaz S, Dayer JM. (1989). "Purification and biologic characterization of a specific tumor necrosis factor alpha inhibitor.". J. Biol. Chem.264: 11966–11973. PMID 2545692.
- ↑ Seckinger P, Zhang JH, Hauptmann B, Dayer JM. (1990). "Characterization of a tumor necrosis factor alpha (TNF-alpha) inhibitor: evidence of immunological cross-reactivity with the TNF receptor.". Proc. Natl Acad. Sci. USA87: 5188–5192. PMID 2164226.
- ↑ Kohno T, Brewer MT, Baker SL, Schwaltz PE, King MW, Hale KK, Squires CH, Thompson RC, Vannice JL (1990). "Second tumor necrosis factor receptor gene product can shed a naturally occurring tumor necrosis factor inhibitor.". Proc. Natl Acad. Sci. USA87: 8331-5. PMID 2172983.
- ↑ Nophar Y, Kemper O, Brakebusch C, Englemann H, Zwang R, Aderka D, Holtmann H, Wallach D. (1990). "Soluble forms of tumor necrosis factor receptors (TNF-Rs). The cDNA for the type I TNF-R, cloned using amino acid sequence data of its soluble form, encodes both the cell surface and a soluble form of the receptor.". EMBO J.9: 3269–3278. PMID 1698610.
- ↑ Gatanaga T, Hwang CD, Kohr W, Cappuccini F, Lucci JA 3rd, Jeffes EW, Lentz R, Tomich J, Yamamoto RS, Granger GA. (1990). "Purification and characterization of an inhibitor (soluble tumor necrosis factor receptor) for tumor necrosis factor and lymphotoxin obtained from the serum ultrafiltrates of human cancer patients.". Proc. Natl Acad. Sci. USA87: 8781–8784. PMID 2174164.
- ↑ Lantz M, Gullberg U, Nilsson E, Olsson I. (1990). "Characterization in vitro of a human tumor necrosis factor-binding protein. A soluble form of a tumor necrosis factor receptor.". J. Clin. Invest.86: 1396–1342. PMID 2173717.
- ↑ Aderka D, Wysenbeek A, Engelmann H, Cope AP, Brennan F, Molad Y, Hornick V, Levo Y, Maini RN, Feldmann M, Wallach D. (1993). "Correlation between serum levels of soluble tumour necrosis factor receptor and disease activity in systemic lupus erythematosus.". Arthritis Rheum.36: 1111–1120. PMID 8393677.
- ↑ Deloron P, Roux Lombard P, Ringwald P, Wallon M, Niyongabo T, Aubry P, Dayer JM, Peyron F. (1994). "Plasma levels of TNF-alpha soluble receptors correlate with outcome in human falciparum malaria.". Eur. Cytokine Netw.5: 331–336. PMID 7948768.
- ↑ Engelmann H, Aderka D, Rubinstein M, Rotman D, Wallach D. (1989). "A tumor necrosis factor-binding protein purified to homogeneity from human urine protects cells from tumor necrosis factor toxicity.". J. Biol. Chem.,264: 11974-11980. PMID 2545693.
Читайте также:

