Расширитель при раке пищевода

Достаточно часто при лечении доброкачественных и злокачественных поражений пищевода врач сталкивается с необходимостью выполнения стентирования. Если не провести данную операцию, то пациент не сможет нормально питаться, что неминуемо отразиться на дальнейшем прогнозе. Установка жесткого каркаса в виде стента позволяет восстановить просвет пищевода и обеспечить нормальное продвижение пищи.
- Суть процедуры стентирования
- Показания и противопоказания к стентированию пищевода
- Как проводят стентирование пищевода
- Осложнения и реабилитация после стентирования
Суть процедуры стентирования
Восстановление пищевода может осуществляться различными методами, но наибольшую популярность приобрело именно стентирование. Эта эндоскопическая операция зачастую носит паллиативный характер, позволяет добиться хороших результатов и является безопасной для пациента. Стент представляет собой специально изготовленную саморасправляющуюся пластиковую или металлическую конструкцию, которая обладает хорошей жесткостью. При размещении ее в просвет пищевода создается дополнительная опора для его стенок, расширяется просвет и снижается вероятность обструкции. Стентирование пищевода выполняется эндоскопическим способом, за счет чего сокращается период реабилитации и снижается вероятность развития осложнений. Кроме того, такую процедуру пациенты переносят намного лучше и поэтому охотнее соглашаются на ее проведение.
Существует несколько видов стентов. Наиболее современными считаются саморасправляющиеся металлические конструкции. Они отличаются долговечностью и надежностью. Выбор точного вида стента осуществляется исходя из особенностей каждого клинического случая.
Показания и противопоказания к стентированию пищевода
Процедура проводится в тех случаях, когда нарушается проходимость пищевода. Это состояние может быть следствием других заболеваний. Наиболее часто необходимость в проведении стентирования возникает в следующих случаях:
- Сужение просвета пищевода вследствие растущей доброкачественной или злокачественной опухоли.
- Опухоли грудной клетки и средостения, которые могут сдавливать пищевод извне.
- Неопухолевые стриктуры пищевода (в результате полученных химических, термических ожогов).
- Сужение просвета пищевода в результате других оперативных вмешательств на данном органе.
Необходимость в стентировании пищевода определяется индивидуально. Зачастую у пациентов с показаниями к данной манипуляции имеются и другие сопутствующие заболевания, которые необходимо учитывать. Вместе с тем, стентирование позволяет значительно улучшить качество жизни, поэтому список противопоказаний к процедуре минимален.
Как проводят стентирование пищевода
На подготовительном этапе назначается комплексное обследование, в которое включаются фиброгастроскопия, рентгенодиагностика, КТ, МРТ и др. Данные методы позволяют выявить показания и противопоказания к процедуре, составить план ее проведения, а также подобрать правильный стент.
Стентирование пищевода может выполняться следующими способами:
- Без применения эндоскопических инструментов под прямым рентгеноскопическим контролем.
- С применением эндоскопических инструментов под прямым рентгеноскопическим контролем.
- Эндоскопическое стентирование без рентгеноскопического контроля.
- Интраоперационная установка стента.
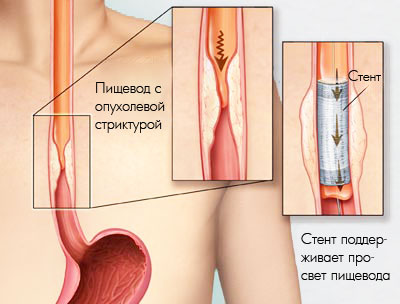
Наиболее популярным является эндоскопическое стентирование пищевода без рентгеноскопического контроля. Предварительно пациенту проводится реканализация, баллонная дилатация или бужирование пищевода. После этого на специальном проводнике врач вводит стент, раскрывает его и затем извлекает проводник.
Сразу же после проведения процедуры стентирования, проводится рентгеноконтрастное исследование. Это необходимо для быстрого выявления возможных осложнений вмешательства. На следующий день после процедуры показано проведение фиброэзофагоскопии.
Осложнения и реабилитация после стентирования
Как и любая другая медицинская процедура, стентирование сопровождается определенными рисками. При правильной подготовке и применении современного оборудования их можно снизить до минимума, но не исключить полностью. Наиболее распространенными осложнениями, которые развиваются в разный промежуток времени после стентирования, являются:
- Перфорация стенок пищевода.
- Кровотечение (особенно вследствие травмирования распадающегося рака желудка или пищевода).
- Миграция стента (особенно при несоответствии размеров конструкции и опухоли).
- Пищеводно-респираторные свищи, при которых происходит сообщение пищевода с трахеей или бронхами.
- Дисфагия и гастроэзофагеальная рефлюксная болезнь.
В редких случаях приходится удалять стент из-за выраженного болевого синдрома.
После процедуры, пациенту рекомендуется употреблять жидкую и полужидкую пищу с постепенным переходом на привычное питание. Следует ограничить прием алкоголя и курение. Для облегчения прохождения пищи по пищеводу, ее следует принимать строго в вертикальном (сидячем) положении небольшими порциями. Для профилактики развития рефлюкс-эзофагита нужно оставаться в сидячем положении не менее 2 часов после трапезы, а также спать с приподнятым на 30-40 градусов головным концом кровати.
Расширение пищевода – цилиндрическое либо веретенообразное увеличение просвета пищевода (диффузное или местное) с нарушением эвакуации пищи в желудок. Клинически проявляется дисфагией, болями за грудиной, регургитацией пищи в ротовую полость, исхуданием, ночным кашлем. Для постановки диагноза проводят эзофагоскопию, рентгенографию пищевода, эзофагеальную манометрию; по показаниям УЗИ или МСКТ органов брюшной полости, сцинтиграфию пищевода. Лечение направлено на устранение причины заболевания, может потребоваться оперативное вмешательство (баллонная дилятация кардиального сфинктера, иссечение дивертикула пищевода, резекция пищевода при раке).
- Причины
- Симптомы расширения пищевода
- Диагностика
- Лечение расширения пищевода
- Прогноз
- Цены на лечение
Общие сведения
Расширение пищевода является достаточно редким состоянием, возникающим на фоне другой патологии. Наиболее значимой причиной диффузного расширения пищевода является ахалазия кардии. Гораздо реже к увеличению просвета пищевода приводят дивертикулы, воспалительный и спаечный процесс в средостении. У части пациентов не удается установить точную причину развития данной патологии. В основе формирования расширения пищевода лежит затруднение эвакуации пищевых масс в желудок из-за препятствия, расположенного обычно в нижних отделах пищевода или при входе в желудок (кардиоспазм, ахалазия кардии; рак пищевода; спайка, перекидывающаяся через пищевод и перетягивающая его). Постепенно скапливающиеся пищевые массы растягивают стенки пищевода, возникают нарушения его моторики, формируются органические изменения в тканях со стойкой деформацией пищевода.

Причины
Расширение пищевода формируется на фоне кардиоспазма, ахалазии кардии, рака пищевода; воспалительных процессов в средостении, приводящих к рубцеванию и формированию тракционных дивертикулов; спаек, перетягивающих просвет пищевода. Исходя из механизма возникновения расширения пищевода, выделяют следующие формы заболевания: диффузное расширение (цилиндрическое, веретенообразное, S-образная деформация с расширением пищевода) и местное (дивертикулы пищевода). Общим механизмом формирования диффузного расширения пищевода является наличие препятствия для прохождения пищи в желудок с постепенным растягиванием стенок пищевода скапливающимися пищевыми массами.
Чаще всего расширение пищевода диагностируется у пациентов, страдающих кардиоспазмом или ахалазией кардии. Два этих состояния являются этапами одного заболевания, при котором в начале формируется функциональное расстройство в виде преходящего спазма нижнего сфинктера пищевода, а в результате прогрессирования патологических процессов в дистальных отделах пищеводной трубки начинаются органические изменения с развитием постоянной ахалазии (отсутствие расслабления) кардии.
В патогенезе расширения пищевода при ахалазии кардии выделяют три механизма: нарушение вегетативной регуляции расслабления кардиального сфинктера, френоспазм и непосредственно ахалазия кардии. Вегетативные расстройства могут возникать на фоне тяжелых эмоциональных потрясений, приводя к изменениям тонуса, моторики пищевода, к сбою механизма открытия и закрытия кардии. Кроме того, нарушения вегетативной регуляции работы пищевода могут возникнуть на фоне другой патологии органов брюшной полости (мочекаменная и желчнокаменная болезнь, панкреатит, хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки, опухоли печени и др.) по типу висцеро-висцеральных рефлексов.
Сложный механизм эвакуации пищи из пищевода в желудок включает в себя и сокращение мышечных волокон диафрагмы. Исследования в области гастроэнтерологии показали, что перистальтика пищевода начинается в его верхних отелах и оканчивается перед пищеводным отверстием диафрагмы. После этого срабатывает диафрагмальный затвор, проталкивающий пищевой комок в желудок. Спазм мышечных волокон диафрагмы (френоспазм) может приводить к перекрытию просвета пищевода и последующему его расширению.
Сочетание функционального кардиоспазма на фоне вегетативной дисфункции и френоспазма рано или поздно приводит к формированию органических рубцовых изменений в дистальных отделах пищевода и кардиальном сфинктере с развитием ахалазии кардии. Прохождение пищевых масс через нижний сфинктер пищевода значительно затрудняется, они скапливаются в просвете пищевода, растягивая его стенки. Мышечный тонус пищевода постепенно снижается, что сначала приводит к расширению его просвета, а в будущем формируется S-образная деформация из-за удлинения пищеводной трубки. На этом этапе заболевания образуется расширение верхних отделов пищевода, происходит регургитация пищи и жидкости в ротовую полость, особенно выраженная в вертикальном положении. Попадание пищевых масс в дыхательные пути при регургитации приводит к развитию бронхита, пневмонии. Застойные явления в пищеводе также оканчиваются воспалительным процессом (эзофагитом), появлением язвы пищевода.
Симптомы расширения пищевода
Клиника расширения пищевода развивается постепенно. В начале симптомы имеют преходящий характер, однако с течением времени на фоне органических изменений в пищеводе интенсивность симптомов нарастает, развиваются сопутствующие заболевания и осложнения, которые при отсутствии лечения могут приводить к смерти пациента.
На начальных этапах заболевания пациента беспокоят дисфагия и боль за грудиной. При наличии кардиоспазма первые проявления могут быть внезапными: на фоне испуга или сильного эмоционального потрясения возникает ощущение комка в горле, боль в области мечевидного отростка или за грудиной. Эти симптомы вскоре проходят, однако вновь возникают через некоторое время. Постепенно эпизоды дисфагии учащаются и уже не проходят самостоятельно. Для улучшения продвижения пищи в желудок пациент может прилагать определенные усилия: сдавливать нижние отделы грудной клетки, постоянно запивать пищу водой, заглатывать воздух и так далее. Боли за грудиной также усиливаются, иррадиируют в эпигастрий, лопатки, левую руку (могут напоминать боль при стенокардии). Формируется чувство страха перед приемом пищи.
Симптоматика непроходимости на фоне расширения пищевода нарастает. Больной часто жалуется на некупируемые приступы икоты, срыгивание съеденной пищей. Эпизодически возникает обильная рвота непереваренными пищевыми массами без примеси соляной кислоты и желчи, приносящая значительное облегчение, иногда рвота даже приводит к временному исчезновению симптомов.
Из-за того, что пищевод постоянно переполнен, расширение распространяется и на его верхние отделы, из-за чего ночью, в горизонтальном положении, жидкие пищевые массы вытекают и попадают на голосовые связки и в дыхательные пути. Появляется патогномоничный для расширения пищевода симптом – ночной кашель. Развивается бронхит, а затем и аспирационная пневмония, бронхоэктатическая болезнь. Вследствие того, что пища практически не попадает в желудок, а больные часто вынуждены вызывать у себя рвоту для облегчения состояния, развивается истощение, которое в сочетании с сопутствующими тяжелыми заболеваниями может даже приводить к смерти пациента.
Расширение пищевода следует дифференцировать с гастроэзофагеальным рефлюксом, опухолью средостения, бронхоэктатической болезнью, туберкулезом, ишемической болезнью сердца, неврогенной дисфагией, поражением пищевода при амилоидозе и склеродермии.
Диагностика
При появлении первых симптомов расширения пищевода следует обратиться к гастроэнтерологу. При осмотре и обследовании пациента выявляется расширение границ притупления над средостением, иногда пальпируется мягкоэластичное выпячивание на шее слева, содержащее пищевые массы и жидкость.
Наиболее информативными для диагностики расширения пищевода являются осмотр врача-эндоскописта с проведением эзофагоскопии и рентгенография пищевода. Эзофагоскопия возможна только после эвакуации жидких масс из его просвета – визуализируются явления эзофагита, изъязвления. С помощью этого исследования можно выявить причину расширения пищевода (ахалазия кардии, опухоль, рубцы и спаечные перетяжки, дивертикулы).
При рентгенографии с контрастированием просвет пищевода расширен, заполнен пищевыми массами. Контрастное вещество оседает длительно, в виде хлопьев снега. Эвакуация контраста из пищевода значительно замедлена (более нескольких часов). Эзофагеальная манометрия позволяет вывить нарушения моторики пищевода. Для дифференциальной диагностики проводится УЗИ и МСКТ органов брюшной полости, сцинтиграфия пищевода.
Лечение расширения пищевода
Основным направлением лечения при расширении пищевода является устранение причины этого состояния. Если расширение пищевода сформировалось на фоне ахалазии кардии, пациенту следует объяснить важность соблюдения режима дня и питания. Большое значение для восстановления нормальной вегетативной регуляции, устранения френоспазма имеет психологическое состояние больного, поэтому в задачу лечащего врача входит успокоить пациента и внушить ему веру в благополучный исход заболевания.
Назначается специальная диета и противовоспалительное лечение. Пища должна быть щадящей химически, механически и термически. Для исключения застоя перед сном следует освобождать пищевод от содержимого. Рекомендуется питье щелочных вод, отваров трав с целью промывания пищевода. Из медикаментозных средств проводят вагосимпатические блокады, назначают витамины группы В, спазмолитики.
При неэффективности консервативной терапии проводится балонная дилатация кардиального сфинктера, бужирование пищевода для восстановления его проходимости. Баллонная дилатация противопоказана на фоне эзофагита, трещин и язв в области стеноза, так как может приводить к разрыву пищевода. При значительных органических изменениях кардиального сфинктера может потребоваться операция кардиомиотомии. Ослабленным больным и при наличии противопоказаний к оперативному восстановлению проходимости пищевода может проводиться гастростомия до стабилизации состояния. При наличии дивертикулов осуществляется их иссечение. Если у пациента диагностирован рак пищевода на ранних стадиях, осуществляется резекция пищевода с последующей пластикой.
Прогноз
Прогноз при расширении пищевода благоприятный, однако эффективность лечения тем выше, чем раньше оно начато (на ранних стадиях заболевания эффективность оперативного вмешательства более 90%). Специфическая профилактика расширения пищевода не разработана. Следует своевременно выявлять и лечить заболевания, которые могут привести к этому состоянию.
В последние годы врачи Юсуповской больницы большое внимание уделяют малоинвазивной хирургии рака пищевода. Это связано с тем, что большинство пациентов, поступающих в онкологические учреждения, страдают далеко зашедшей дисфагией (нарушением глотания). Более 70 % больных, поступающих в клинику онкологии, по поводу рака пищевода, не подлежат хирургическому лечению. Часто онкологи не имеют возможности выполнить радикальную операцию по причине распространённости опухолевого процесса – обширного лимфогенного и гематогенного метастазирования и сопутствующих заболеваний. Хирурги формируют больным раком пищевода питательные гастростомы или еюностомы, что в значительной степени подрывает социальный статус людей, создаёт физический и психологический дискомфорт.
Стентирование пищевода при раке пищевода позволяет улучшить качество жизни пациента и увеличить её продолжительность. В Юсуповской больнице созданы все условия для лечения больных раком пищевода:
- комфортные палаты;
- современное диагностическое оборудование ведущих фирм мира;
- квалифицированный персонал, знающий особенности пациентов со злокачественными новообразованиями;
- инновационные методы лечения, в том числе и эндопротезирование пищевода.
Это позволило улучшить результаты лечения больных раком пищевода. У пациентов, которым выполнено стентирование пищевода при раке пищевода, продолжительность жизни увеличивается.
Показания к стентированию пищевода
Врачи пациентам, у которых выявлено злокачественное новообразование на поздней стадии, устанавливают стент для пищевода. Цена зависит от вида импланта и фирмы-производителя. Стентирование пищевода является бескровной, щадящей операцией, позволяющей восстановить проходимость пищевода на более или менее протяжённом участке. Пищевод – орган, представляющий из себя полую трубку. Ввиду различных причин он может утратить свою проходимость. Это приводит к нарушению продвижения пищи к желудку. При локальном сужении пищевода врачи для восстановления его проходимости используют специальное приспособление – стент.
Установка стента в пищевод производится при наличии следующих показаний:
- химический, лучевой или термический ожог пищевода;
- сдавливание пищевода извне новообразованиями грудой клетки;
- сужение пищевода, вызванное неоперабельными злокачественными опухолями, расположенными в органе;
- рецидив рака пищевода или злокачественного новообразования верхней части желудка.
Стентирование также производится после хирургического лечения с последующим сужением просвета пищевода в области операции.
Методика стентирования пищевода при раке
Для стентирования пищевода врачи используют стенты, изготовленные из никелевых или титановых сплавов. Протез с внутренней или наружной стороны покрывают биологически инертной плёнкой. Она может быть силиконовой, полиэтиленовой, полиэстерной или фторопластной. Длина стента от 6 до 17 см, его диаметр в расправленном виде может варьировать от 18 до 25см.
Онкологи Юсуповской больницы используют разные виды имплантов для стентирования при раке пищевода:
- протез с противорефлюксным клапаном;
- имплант максимально возможной гибкости;
- стент, оснащённый нитью для извлечения приспособления.
Установку стента производят либо с предварительным расширением пищевода, либо без дилатации. Если установку импланта производят без предварительного расширения поражённого участка пищевода с помощью баллона и после него во время рентгенологического исследования, доставочное устройство стента не применяют. Следующий метод эндопротезирования пищевода основан на стентировании с помощью эндоскопа под рентгенологическим контролем. Показанием к применению этого метода является неправильная форма поражённого опухолью участка пищевода. Врачи редко выполняют стентирование под мануальным контролем.
Прежде чем установить в пищевод стент, врач проводит разметку участка, где он должен раскрыться. Для этого используют несколько методов:
- инъекция рентгеноконтрастного вещества под слизистую оболочку участка, на котором планируется стентирование;
- крепление под слизистую оболочку танталовых клип;
- фиксация контрастных меток, которые видны во время рентгенологического исследования, на коже грудной клетки в области проекции планируемой установки стента;
- контроль ближнего конца импланта с помощью эндоскопа.
Стент при помощи специального проводника в сложенном состоянии подводят к месту сужения пищевода. Используя специальное устройство, конструкцию расправляют, проводник извлекают. Полное расправление стента происходит через 2-5 дней после установки.
Осложнения после стентирования пищевода
Установка стента в пищевод возвращает пациента к нормальной жизни, позволяет полностью восстановить процесс приёма пищи естественным путём. Иногда это способствует полному выздоровлению пациента от основного заболевания. После стентирования пищевода по поводу запущенной стадии рака, операция существенно уменьшает страдания пациента и родственников, которые ухаживают за ним.
В послеоперационном периоде большинство пациентов после эндопротезирования пищевода чувствуют себя хорошо. При выраженном болевом синдроме врачи назначают анальгетики. Если после установки стента в пищевод он смещается, имплант подтягивают за нитку и устанавливают в проекции сужения. При значительной миграции стента его устанавливают повторно.
Если рост опухоли продолжается выше места установки стента, у пациентов может развиться повторная дисфагия. Им устанавливают второй покрытый стент с частичным наложением на первый. В позднем послеоперационном периоде существует риск обрыва и миграции в желудок отдалённого сегмента стента. Причиной нарушения целостности импланта является агрессивное воздействие соляной кислоты. В этом случаи врачи с помощью эндоскопа удаляют фрагменты стента биопсийными щипцами и устанавливают новый имплант.
При эндопротезировании нижнегрудного и абдоминального отделов пищевода у пациентов развивается рефлюкс-эзофагит. Тогда пациентам устанавливают протез с антирефлюксным карманом. В месте расширения пищевода перед областью стеноза может образоваться карман с застоем пищи. Онкологи в этом случае производят повторную замену стента с конусовидным расширением приближенного к опухоли конца. К редким осложнениям стентирования относится пищеводное кровотечение, пневмония.
Получите консультацию позвонив по телефону Юсуповской больницы, где врачи применяют различные методики стентирования пищевода.
В последние годы большое внимание уделяется малоинвазивной хирургии рака пищевода. Это связано в первую очередь с тем, что большинство пациентов данной патологии, поступающих в онкологические учреждения, страдают далеко зашедшей дисфагией.
Более 70 % больных, поступающих в стационар по поводу рака пищевода и кардии, не подлежат хирургическому лечению. Основной причиной отказа пациенту в операции является распространенность опухолевого процесса – обширное лимфогенное и гематогенное метастазирование, а также выраженные сопутствующие заболевания.
Пациенты с неоперабельными опухолями, как правило, обречены на вынужденное формирование питательных гастро- или еюностом, что в значительной степени подрывает их социальный статус, создает психологический и физический дискомфорт. При этом медиана жизни после формирования гастростом, как правило, не превышает полугода.
С внедрением в клиническую практику эндоскопических и рентгенохирургических методов лечения, появлением саморасправляющихся пищеводных стентов, малоинвазивные вмешательства для ликвидации дисфагии стали операциями выбора.
В Городском клиническом онкологическом диспансере г. Санкт-Петербурга было произведено стентирование 114 больным раком пищевода. При этом было выполнено 125 стентирований. У 11 больных стентирование выполнялось многократно. Стентирование осуществляли нитиноловыми полностью и частично покрытыми стентами М. I. Teach (Корея). Диаметр стента колебался от 18 до 22 мм. Его длина составляла от 6 до 17 см.
Средний возраст пациентов, которым выполнялось стентирование пищевода, составил 72±7,5 лет и колебался от 45 до 89 лет. Все случаи рака пищевода были признаны неоперабельными. Инвазия опухоли в соседние органы наблюдалась у 30 (26,3 %) больных; старческий возраст и/или наличие сопутствующей патологии со стороны жизненно важных органов и систем организма при операбельной опухоли – у 47 (41,2 %) больных; отдаленные метастазы – у 11 (9,7 %) больных; эзофагореспираторные свищи – у 8 (7,0 %) больны; несостоятельность эзофагогастроанастомоза после операции по Льюису – у 2 (1,8 %) больных; у одного (0,9 %) больного имела место ранняя стриктура толстокишечножелудочного анастомоза после резекции пищевода с одномоментной толстокишечной пластикой; еще у одного (0,9 %) – возникла несостоятельность эзофагоеюнального анастомоза.
По локализации опухоли больные распределились на 6 групп (табл. 1). Основную группу составили пациенты с локализацией опухоли в среднегрудном отделе – 46(40,4 %) больных. Нижнегрудной отдел пищевода был поражен у 22 больных. Верхнегрудной отдел – у 9 больных. У 37 (32,5 %) больных опухоль распространялась на два отдела пищевода или находилась на их границе. Кроме того, у 4 больных стенты были установлены в раннем послеоперационном периоде вследствие возникших осложнений в виде несостоятельности анастомоза или возникновения его стриктуры.
Таблица 1. Распределение больных по локализации опухоли
| Локализация опухолевой стриктуры | Количество больных | % |
| Верхнегрудной отдел | 9 | 7,9 |
| Среднегрудной отдел | 46 | 40,4 |
| Нижнегрудной отдел | 22 | 19,3 |
| Верхнегрудной с захватом среднегрудного отдела | 9 | 7,9 |
| Среднегрудной с захватом нижнегрудного отдела | 16 | 14,0 |
| Нижнегрудной с захватом абдоминального отдела | 12 | 10,5 |
| Всего | 114 | 100 |
По нашим данным, все стенты, установленные как эндоскопически, так и под рентгенконтролем, полностью раскрывались в течение первых 2-3 дней после установки и не требовали проведения дополнительных вспомогательных мероприятий. Во всех случаях устранялась или значительно уменьшалась дисфагия, восстанавливался прием пищи.
В раннем послеоперационном периоде различного рода осложнения были отмечены у 10 (8,8 %) больных. 7 больным потребовалась коррекция положения стента. Стент был подтянут за фиксирующую нить и позиционирован в проекции стриктуры. Значительная миграция стента выявлена у 2 пациентов, что потребовало перестановки стентов. Так, у одного больного с опухолью среднегрудного отдела пищевода на 4-е сутки после установки стента вследствие употребления твердой пищи выявлена миграция стента. Стент под рентгенконтролем был извлечен посредством подтягивания фиксирующей нити. Вновь заправлен в систему доставки и установлен в зоне стриктуры. У пациентки с опухолью верхнегрудного отдела пищевода на 6-е сутки после установки выявлена миграция полностью покрытого стента. Последний удален и установлен частичный покрытый стент.
Среди поздних осложнений следует отметить обрыв и миграцию в желудок дистального сегмента стента. Наиболее вероятная причина разрушения стента – воздействие на него соляной кислоты желудка. На выполненных рентгенограммах живота дистальный сегмент располагался в просвете желудка. Больному была произведена фиброгастроскопия. Развалившийся стент в виде фрагментов был захвачен и удален биопсийными щипцами.
Рефлюкс-эзофагит сопровождает все случаи установки стента в нижнегрудном и абдоминальном отделах пищевода. У одного больного образовался карман с застоем пищи в престонотическом расширении пищевода. Была произведена повторная замена стента с конусовидным расширением проксимального конца.
У 28 (24,6 %) больных в срок от 8 до 26 месяцев возникли разной степени интенсивности эзофагальные кровотечения. У 9 больных они носили профузный характер и явились причиной смерти. У одного больного раком верхнегрудного отдела пищевода, осложненного эзофаготрахеальным свищем, через 5 дней после стентирования возникла тяжелая пневмония, явившаяся причиной смерти. У одной пациентки в раннем периоде развилась клиническая картина острой коронарной недостаточности. В остальных 34 (29,8 %) случаях причиной смерти явилось прогрессирование основного заболевания. При этом в 13 (11,4 %) случаях имело место прорастание стенки стента опухолью.
Таким образом, в сроки от 2 до 24 месяцев умерли 45 (39,5 %) больных. Более двух лет после установки стента прожили 9 (7,9 %) больных (табл. 2). Установка стента у ряда больных с ранними послеоперационными осложнениями дала возможность избежать повторного хирургического вмешательства. Это относится к случаям несостоятельности эзофагогастро- и эзофагоеюнальных анастомозов, стриктуры толстокишечно-желудочного анастомоза. Все пациенты были выписаны из стационара в удовлетворительном состоянии.
Таблица 2. Продолжительность жизни больных (наблюдение за 56 больными)
| Продолжительность жизни | Количество больных | % |
| До 3 месяцев | 14 | 25,0 |
| От 3 до 6 месяцев | 9 | 16,1 |
| От 6 до 9 месяцев | 7 | 12,5 |
| От 9 до 12 месяцев | 6 | 10,7 |
| От 12 до 18 месяцев | 5 | 8,9 |
| От 18 до 24 месяцев | 6 | 10,7 |
| Более 24 месяцев | 9 | 16,1 |
| Всего | 56 | 100 |
Таким образом, лишь 20 (35,7 %) больных со стентированным пищеводом прожили больше года и лишь 9 (16,1 %) — более двух лет. Основной причиной летальных исходов явилось прогрессирование опухолевого процесса. Тем не менее, качество последнего периода жизни пациентов и их социальная адаптация значительно улучшились. Дисфагия, как основной клинический симптом, была ликвидирована у всех больных, которым применялось стентирование.
Читайте также:

