Ранний и малый рак что это такое
Отличительные признаки доброкачественных и злокачественных опухолей.
ОПУХОЛЬ – патологическое образование, самопроизвольно возникающее в различных органах, отличающееся полиморфизмом строения, обособленностью, прогрессиру-ющим неограниченным ростом.
Признаки доброкачественных опухолей
Экспансивный медленный рост;
Не прорастают в окружающие ткани;
Имеют капсулу, отграничивающую опухоль от окружающих тканей;
По гистологическому строению мало отличаются от тканей, из которых они произошли;
Не дают метастазов;
Не рецидивируют после радикального удаления;
Не влияют на общее состояние организма.
Признаки злокачественных опухолей
Быстрый инфильтративный рост с прорастанием в окружающие ткани;
Метастазируют (переносятся, распространяются лимфо - и гематогенным путем в различные органы человека);
Рецидивируют (вновь возникают) после удаления;
Вызывают раковую интоксикацию.
Аномалии первичной закладки органов, врожденные кисты, невусы;
Хронические воспалительные заболевания (неспецифические и специфические), эрозии, изъязвления, хронические трещины губ, свищи;
Дистрофические изменения в органах;
Дискератозы, хронические язвы желудка, язвенный колит;
Доброкачественные опухоли – папилломы, одиночные полипы, липомы, фибромы.
К предраку относят предраковые состояния — факультативное предраковое заболевание (факультативный предрак) и предраковые условия — облигатное предраковое заболевание (облигатный предрак). К раннему раку относят прединвазивный рак (carcinoma in situ), и ранний инвазивный рак — микрокарциному. Таким образом, при ранней онкологической патологии можно выделить 4 последовательные фазы морфогенеза рака:
I — предраковые состояния — факультативные предраковые заболевания;
II — предраковые условия — облигатные предраковые заболевания;
III — прединвазивный рак — carcinoma in situ;
IV — ранний инвазивный рак.
К I фазе предрака — факультативному предраку следует отнести различные хронические заболевания, сопровождающиеся дистрофическими и атрофическими изменениями тканей с включением регенераторных механизмов, дисрегенераторные процессы и метаплазию приводящих к возникновению очагов пролиферации клеток, среди которых может возникнуть очаг опухолевого роста. Факультативные предраковые заболевания трансформируются в злокачественные новообразования относительно редко. К факультативному предраку относят дисгормональную гиперплазию с пролиферацией эпителия протоков молочной железы, атрофический гастрит с глубокой перестройкой слизистой оболочки, неспецифический язвенный колит, эрозию шейки матки, кожный рог, кератоакантому, папиллому и др.
II фаза предрака — облигатный предрак. Облигатные предраковые заболевания, как правило, обусловлены генетическими или врождёнными факторами и рано или поздно перерождаются в рак. К этой фазе относят дисплазию (dys — нарушение, plasis — образование), которая всегда возникает в недрах дисрегенераторного процесса и сопровождается недостаточной и неполной дифференцировкои стволовых элементов ткани, нарушениями координации между процессами пролиферации и созревания клеток.
Дисплазия эпителия определяется следующей триадой:
1) клеточная атипия (изменение размеров и формы клеток);
2) нарушенная дифференцировка клеток (нет четкой дифференцировки клеток, преобладание молодых недифференцированных форм клеток в слоях эпителия);
3) нарушение архитектоники ткани (нет четкой стратификации слоев эпителия).
В большинстве органов диспластический процесс развивается на фоне предшествующей гиперплазии (увеличения количества клеток), связанной с хроническим воспалением и дисрегенерацией. Чаще всего используется трехстепенная градация дисплазии: слабо выраженная (Д I), умеренно выраженная (Д II) и выраженная (Д III). При этом определяющим критерием степени дисплазии служит выраженность клеточной атипии. С течением времени дисплазия может регрессировать, носить стабильный характер или прогрессировать. Слабая степень дисплазии практически не имеет отношения к раку, и обратное развитие слабой и умеренной дисплазии наблюдается повсеместно. Чем выраженнее дисплазия, тем меньше вероятность обратного ее развития. Возможность перехода дисплазии в cancer in situ (которую можно рассматривать как крайнюю степень дисплазии) и, следовательно, в раковое заболевание возрастает по мере усиления ее выраженности. Морфологические проявления выраженной дисплазии очень напоминают рак, который не обладает инвазивными свойствами, что, в основном, соответствует молекулярно-генетическим изменениям в клетках. Поэтому облигатный предрак требует обязательного проведения комплекса профилактических мероприятий и даже радикального лечения, а больные облигатным предраком должны состоять на учете у онколога. Облигатные предраковые заболевания относятся семейный полипоз толстой кишки, пигментная ксеродерма, дерматоз Боуэна, аденоматозный полип желудка. Истинно доброкачественные опухоли, в основном, не малигнизируются.
Прединвазивный рак (carcinoma in situ, внутриэпителиальный рак) является III фазой морфогенеза опухоли. При этом опухолевый процесс ограничен лишь эпителиальным пластом при сохраненной целостности базальной мембраны, в пределах которого клетки имеют все признаки катаплазии, свойственные раку. Внутриэпителиальный рак выделяется в самостоятельную морфогенетическую форму опухоли, которую еще называют компенсированным раком. Как правило, 5-летняя выживаемость пациентов с прединвазивным раком составляет 100 %. Окончательное подтверждение диагноза внутриэпителиального рака производится на основании тщательного гистологического исследования пораженной ткани и, нередко, при использовании серийных срезов для полного исключения возможности инвазивного роста. Длительность данной фазы может быть достаточно продолжительной — достигать 10 лет и более. Критическим моментом при формировании злокачественной опухоли и перехода из внутриэпителиального рака является начало инвазивного роста.
Ранний инвазивный рак
Опыт раннего выявления рака большинства локализаций (шейка матки, губа, кожа), соответствуя экспериментальным данным, подтверждает, что злокачественная опухоль возникает преимущественно на фоне предраковых заболеваний. Возникновение эпителиальных опухолей de novo, то есть в здоровых тканях, которое описано в литературе, едва ли возможно, так как многие переходные этапы становления опухоли могут протекать латентно и быстротечно, сопровождаясь слабыми морфологическими и клиническими проявлениями.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Малый периферический рак
На обычном обзорном снимке лёгких наиболее важные признаки малого периферического рака обнаруживаются далеко не всегда. Более отчётливо симптомы рака обнаруживаются только при томографии. Томография в 2 проекциях при периферическом раке обязательна – это главное!
Дело в том, что опухоль диаметром 1 – 2 см на обычном снимке имеет искажённое отображение – вид тяжистого нечёткого затемнения, похожего на участок пневмосклероза (что объясняется суммацией всех теней на пути лучей к опухоли).
На томограммах определяются следующие основные симптомы малого периферического рака: форма тени диаметром до 1,5 см приближается к многоугольной, при размерах 2,0 – 2,5 см её форма становится неправильно-овоидной, грушевидной, бобовидной. Иногда определяются 2 – 3 отдельных узелка, которые в дальнейшем сливаются в единую опухоль с бугристой поверхностью. Правильная округлая или овальная форма тени встречается редко.
Структура тени в большинстве случаев неоднородна, иногда многоузловатость. Распад нечасто. Типичен также симптом лучистости, зубчатости на периферии опухоли. Почти в 1/4 случаев – увеличение лимфоузлов корня лёгкого, в 5 % случаев отмечено поражение лимфоузлов средостения.
Этим термином обозначают опухоль, диаметр которой превышает 10 см. Таких больших размеров чаще достигает высокодифференцированный периферический рак, который возникает в участках лёгких, удалённых от крупных бронхов, и относительно поздно даёт отдалённые mts. Он имеет ряд отличительных особенностей. При Rg-исследовании обнаруживаются симптомы не только инфильтративного, но и экспансивного роста опухоли. Это выражается в чётких очертаниях округлой тени почти на всём её протяжении, а также раздвигание, оттеснение, смещение прилегающих бронхиальных ветвей, что видно на томограммах. Такая картина имеет сходство с гигантскими внутрилёгочными кистами (например, эхинококк и др.) и доброкачественными опухолями, и подчас дифференциальная диагностика трудна.
В современном понимании – это субплевральный рак I сегмента лёгкого, проросший грудную стенку, плечевое сплетение, иногда с разрушением рёбер и позвонков.
Клиническая картина ярко выражена, но вначале какое-то время эта форма рака протекает бессимптомно. На ранних стадиях опухоль трудно выявить не только клинически, но и рентгенологически, так как она инфильтрирует грудную стенку в области верхней апертуры грудной клетки, т.е. больше распространяется не в лёгком, а в грудной стенке. Опухоль очень быстро прорастает плечевое сплетение, симпатическую цепочку, верхние рёбра, поперечные отростки и тела позвонков, внедряется в канал спинного мозга и инфильтрирует оболочки мозга. Так как при обычном стандартном просвечивании долго не выявляются рентгенологические симптомы, то больных обычно безуспешно лечат невропатологи с использованием физиотерапевтических процедур. Это длится до тех пор, пока не обнаруживается тень в области верхушки лёгкого.
Считается, что для опухоли Пэнкоста характерны 8 клинических и рентгенологических симптомов:
1. Рентгенологически тень в области верхушки лёгкого.
2. Стойкие боли в плечевом поясе.
3. Нарушение чувствительности кожи.
4. Атрофия мышц верхней конечности.
5. Синдром Горнера (птоз верхнего века, энофтальм, сужение зрачка, нарушение слезоотделения).
6. Уплотнение в надключичной зоне.
7. Рентгенологически определяется разрушение верхних рёбер.
8. Разрушениепоперечных отростков и тел позвонков.
Как минимум, должны определяться 2 первых признака.
Рентгенологическая картина опухоли Пэнкоста. Затемнение в области верхушки лёгкого. Нижняя граница опухоли обычно дугообразная, волнистая, выпуклостью направлена книзу. Верхние очертания тени не прослеживаются. На фоне затемнения часто удаётся увидеть разрушение задних отрезков I, II, а иногда и III ребра. Необходимо хорошо посмотреть и нижние шейные, а также верхние грудные позвонки, так как возможно разрушение поперечных отростков или узуры боковых поверхностей тел позвонков.
На снимке нижняя граница опухоли поднимается по мере приближения к средостению, поэтому, максимальный размер тени располагается в лёгком. Сохраняется прослойка воздушного лёгкого между тенью опухоли и позвоночником. Это отличие от опухолей, исходящих из средостения. При них тень опухоли широко прилежит к средостению.

Рак желудка - злокачественная опухоль, которая развивается из клеток слизистой оболочки желудка. По распространенности он занимает пятое место среди всех видов рака. Как правило, болеют люди старше 40 лет. Основной метод лечения - хирургический, удаление всего желудка или его пораженной части.
- Причины рака желудка
- Классификация рака желудка: каким он бывает?
- Симптомы: как проявляется рак желудка?
- Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
- Какие методы диагностики может назначить врач?
- Современные принципы лечения рака желудка
- Какой прогноз при раке желудка?
- Цены на лечение рака желудка на 1-4 стадиях в Европейской онкологической клинике
Причины рака желудка
Роль питания в возникновении злокачественных опухолей желудка изучена хорошо. Риски повышает большое количество соли, крахмала, нитратов, некоторых углеводов. Чаще болеют люди, которые едят много соленых, копченых, маринованных продуктов, мало овощей и фруктов.

Курение повышает риск рака желудка примерно вдвое. Ученые в Великобритании считают, что примерно каждый пятый случай связан именно с курением. Когда человек вдыхает табачный дым, часть его попадает в желудок, и содержащиеся в нем вредные вещества повреждают клетки слизистой оболочки. Риски тем выше, чем больше стаж курильщика и ежедневное количество сигарет. Алкоголь тоже в списке подозреваемых, но прямых доказательств пока нет.
H. Pylori — бактерия, которая способна вызывать язвенную болезнь и хронический атрофический гастрит. В настоящее время она считается важным фактором развития рака желудка. При хеликобактерной инфекции вероятность возникновения злокачественной опухоли в желудке повышается в 4 раза. В половине удаленных опухолей обнаруживают этого возбудителя.
- Язвенная болезнь. Данные исследований по этому поводу противоречивы. Если язва находится в теле желудка, риск рака повышается почти в 2 раза. При язве нижнего отдела риски, видимо, не повышаются.
- Аденоматозные полипы слизистой оболочки.
- Семейный аденоматозный полипоз - заболевание, вызванное мутацией в гене APC и приводящее к возникновению множества полипов в желудке, кишечнике. При этом незначительно повышается риск рака.
- Перенесенные на желудке операции повышают риск рака в 2,5 раза. Это происходит из-за того, что желудок производит меньше соляной кислоты, и в нем активнее размножаются бактерии, продуцирующие нитриты, происходит обратный заброс желчи из тонкой кишки. Обычно злокачественные опухоли возникают спустя 10-15 лет после хирургического вмешательства.
- Социальное и материальное положение: риск увеличивается при низком уровне доходов, проживании в перенаселенной квартире, без удобств, в неблагоприятном районе.
- Другие онкологические заболевания: рак пищевода, простаты, мочевого пузыря, молочных желез, яичников, яичек.
- Болезнь Менетрие (гипертрофическая гастропатия) характеризуется разрастанием слизистой оболочки желудка, появлением в ней складок и снижением продукции соляной кислоты. Патология встречается редко, поэтому неизвестно, как часто она приводит к раку желудка.
- В группе повышенного риска работники угольной, металлургической и резиновой промышленности.
- Иммунодефицит повышает вероятность развития рака, лимфомы желудка.
Классификация рака желудка: каким он бывает?
Злокачественные опухоли желудка, согласно Международной гистологической классификации ВОЗ, делят на 11 типов, в зависимости от того, из каких клеток они происходят. Преобладает рак из железистых клеток, которые выстилают слизистую оболочку и вырабатывают слизь — аденокарцинома. Он составляет 90-95% всех случаев. Также встречаются опухоли из иммунных (лимфома), гормонпродуцирующих (карциноид) клеток, из нервной ткани.
Одна из старейших классификаций делит злокачественные опухоли желудка на 3 типа:
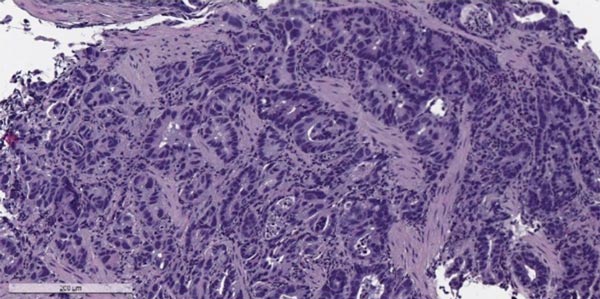
Рак желудка делят на ранний (начальный) и распространенный. При раннем опухоль не прорастает глубже слизистой оболочки и подслизистой основы. Такие опухоли проще удалить (в том числе эндоскопическим путем), при них лучше прогноз. Также используют классификацию TNM, которая учитывает размеры и прорастание в разные ткани первичной опухоли (T), метастазы в регионарных (близлежащих) лимфатических узлах (N), отдаленные метастазы (M).
Классификация в зависимости от состояния первичной опухоли (T):
- Tx - первичную опухоль невозможно оценить;
- T0 - первичная опухоль не обнаруживается;
- T1 - тяжелая дисплазия клеток слизистой оболочки, опухоль находится в поверхностном слое слизистой оболочки ("рак на месте");
- T2 - опухоль проросла в мышечный слой стенки органа;
- T3 - рак достиг серозной (наружной) оболочки желудка, но не пророс в нее;
- T4 - опухоль проросла в серозную оболочку (T4a), в соседние структуры (T4b).
Классификация в зависимости от наличия поражения в регионарных лимфатических узлах:
- Nx - невозможно оценить метастазы в лимфатических узлах;
- N0 - метастазы в регионарных лимфоузлах не обнаружены;
- N1 - поражены 1-2 лимфоузла;
- N2 - опухолевые клетки распространились в 3-6 лимфоузлов;
- N3 - метастазы в 7-15 (N3a) или в 16 и более (N3b) лимфоузлах.
Классификация в зависимости от наличия отдаленных метастазов:
- M0 - отдаленные метастазы не обнаружены;
- M1 - обнаружены отдаленные метастазы.
Аденокарциному делят на 4 стадии:
- I стадия (T1M0N0 - стадия Ia; T1N1M0, T2N0M0 - стадия Ib). Опухоль находится в пределах слизистой оболочки и подслизистой основы, не прорастает вглубь стенки желудка. Иногда раковые клетки обнаруживают в близлежащих лимфатических узлах.
- II стадия (T1N2M0, T2N1M0, T3N0M0 - стадия IIa; T1N3aM0, T2N2M0, T3N1M0, T4aN0M0 - стадия IIb). Опухоль прорастает в мышечный слой стенки желудка и распространяется в лимфатические узлы.
- III стадия (T2N3aN0, T3N2M0, T4aN1M0, T4aN2M0 - стадия IIIa; T1N3bM0, T2N3bM0, T3N3aM0, T4aN3aM0, T4bN1M0 - стадия IIIb; T3N3bM0, T4aN3bM0, T4bN3aM0 - стадия IIIc). Рак пророс через всю стенку желудка и, возможно, распространился на соседние органы, успел сильнее поразить близлежащие лимфатические узлы.
- IV стадия (любые T и N, M1). Есть отдаленные метастазы.
Метастазы рака желудка
Раковые клетки могут отрываться от материнской опухоли и мигрировать в другие части тела различными путями:
- С током лимфы они могут попасть в лимфатические узлы брюшной полости, а из них — в лимфоузлы надключичной области — метастаз Вирхова. Метастаз в лимфоузлы, окружающие прямую кишку, называют метастазом Шницлера.
- С током крови раковые клетки чаще всего распространяются в печень, реже — в легкие.
- Также раковые клетки могут рассеиваться по брюшной полости. Если они оседают на яичниках, образуется метастаз Крукенберга, в пупке — метастаз сестры Марии Джозеф.Редко при раке желудка обнаруживают метастазы в головном мозге, костях.
Симптомы: как проявляется рак желудка?
- Дисфагия. Возникает, если новообразование сдавливает место перехода желудка в пищевод. Сначала становится сложно глотать твердую пищу, затем и жидкую.
- Рвота недавно съеденной пищей. Характерна для опухолей в нижней части желудка, в месте перехода в двенадцатиперстную кишку.
- Стойкая изжога.
- Постоянные боли в области желудка, которые отдают в спину. Они не проходят ни днем, ни ночью.
- Потеря веса.
- Увеличение живота. Возникает из-за асцита — скопления жидкости в брюшной полости.
- Под ложечкой можно почувствовать и нащупать жесткое выпирающее образование. Это — опухоль, которая срослась с передней брюшной стенкой.
Как вовремя диагностировать заболевание? Что такое скрининг, и почему он важен?
Статистика говорит о том, что в 75% случаев рак желудка диагностируют уже на распространенной стадии, когда опухоль успевает прорасти в соседние ткани, дать метастазы. Лечить таких больных сложно, прогноз, как правило, неблагоприятный. Обычно выраженные симптомы говорят о том, что рак уже успел распространиться по организму.
Как проверить желудок на рак: на ранних стадиях помогает скрининг — регулярные обследования людей, которые не испытывают никаких симптомов. В качестве скринингового исследования применяют гастроскопию — эндоскопическое исследование, во время которого в желудок вводят гибкую трубку с миниатюрной видеокамерой и лампочкой на конце. Насколько эффективна гастроскопия? Лучше всего это демонстрирует японский опыт. Распространенность рака желудка в Японии очень высока, а смертность от него одна из самых низких в мире. Достичь этого удалось благодаря внедрению массового скрининга.
В Европейской онкологической клинике существуют специальные скрининговые программы, которые помогают вовремя диагностировать разные онкологические заболевания. Посетите врача, узнайте о своих рисках и получите индивидуальные рекомендации по поводу скрининга.
Какие методы диагностики может назначить врач?
Помимо гастроскопии, программа диагностики рака желудка может включать:
- Рентгенографию, перед которой пациенту дают выпить контрастный раствор. При этом контуры желудка хорошо видны на снимках.
- Компьютерную томографию, позитронно-эмиссионную томографию.
- Диагностическую лапароскопию. Это операция, во время которой в живот пациента через отверстия вводят лапароскоп с миниатюрной видеокамерой и специальные инструменты. Процедура помогает оценить, как далеко за пределы желудка успел распространиться процесс.
- Биопсию. Врач получает образец подозрительной ткани и отправляет в лабораторию для изучения под микроскопом. Этот метод диагностики помогает максимально точно диагностировать онкологическое заболевание и установить тип рака. Биопсию можно провести во время гастроскопии, хирургического вмешательства.

Современные принципы лечения рака желудка
Основной метод лечения рака желудка — хирургический. Объем операции зависит от того, на какой стадии обнаружена опухоль. Если она не успела распространиться вглубь стенки органа, проводят эндоскопическую резекцию — удаление пораженного участка при помощи инструмента, введенного через рот, как во время гастроскопии.
При субтотальной гастрэктомии удаляют часть органа, пораженную опухолевым процессом. На более поздних стадиях орган приходится удалять целиком вместе с окружающими тканями. При этом пищевод соединяют с тонкой кишкой. Если лимфатические узлы в брюшной полости поражены метастазами, их также нужно удалить.
В запущенных случаях, когда излечение невозможно, проводят паллиативную операцию. Хирург удаляет пораженную часть желудка, чтобы облегчить состояние пациента.
Лучевая терапия при раке желудка бывает:
- неоадъювантной — проводится перед операцией, чтобы уменьшить размеры опухоли и облегчить её удаление;
- адъювантной — чтобы уничтожить раковые клетки, которые остались в организме после операции.
Наиболее распространенные побочные эффекты лучевой терапии при облучении области живота: тошнота, нарушение пищеварения, диарея.
Химиотерапия также бывает адъювантной и неоадъювантной. Часто её сочетают с лучевой терапией. Химиолучевая терапия может стать основным методом лечения при метастатическом раке на поздних стадиях, когда прогноз неблагоприятный, но есть возможность облегчить симптомы и продлить жизнь больного.
В некоторых случаях эффективны таргетные препараты: трастузумаб, рамуцирумаб, иматиниб, сунитиниб, регорафениб. Но они подходят лишь в тех случаях, когда опухолевые клетки обладают определенными молекулярно-генетическими свойствами.
Какой прогноз при раке желудка?
Прогноз при раке желудка зависит от стадии опухоли, на которой был установлен диагноз и начато лечение. Шансы на стойкую ремиссию наиболее высоки, если опухоль не проросла за пределы слизистой оболочки и подслизистой основы. При метастазах прогноз, как правило, неблагоприятен.
В онкологии существует такой показатель, как пятилетняя выживаемость. Он показывает, какой процент больных остаются живы в течение 5-ти лет. Срок достаточно большой, в определенном смысле его можно приравнять к выздоровлению. Пятилетняя выживаемость при разных стадиях рака желудка составляет:
- I стадия — 57-71%;
- II стадия — 33-46%;
- III стадия — 9-20%;
- IV стадия — 4%.
Некоторые цифры и факты:
- Эксперты Всемирной организации здравоохранения (ВОЗ) утверждают, что ежегодно от рака желудка во всем мире погибают 754 000 людей.
- В XXI веке распространенность заболевания снижается, но в разных странах неодинаково. Так, на одного больного из Великобритании приходится двое из России и трое из Японии.
- По распространенности среди прочих онкозаболеваний рак желудка занимает пятое место, но среди причин смерти — третье.
- Одна из лидирующих стран по распространенности рака - Япония, во многом за счет характера питания.
В Европейской онкологической клинике применяются наиболее современные методы лечения рака желудка и других онкологических заболеваний. Даже если прогноз неблагоприятен, это не означает, что больному ничем нельзя помочь. Наши врачи знают, как облегчить симптомы, обеспечить приемлемое качество жизни, продлить жизнь
IX РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
В.Ю. Скоропад, Б.А. Бердов
Медицинский Радиологический Научный Центр РАМН, Обнинск
Отдаленные результаты хирургического лечения раннего рака желудка, по данным различных авторов, варьируют весьма широко: 5-летняя выживаемость колеблется от 64% до 100%, 10-летняя выживаемость - от 62% до 98%. Причины столь значительных различий связаны, в первую очередь, с неоднородностью групп, то есть различным в каждой авторской серии соотношением больных в зависимости от глубины опухолевой инвазии, состояния регионарных лимфатических узлов и других клинико-морфологических факторов. Насколько часто встречается ранний рак желудка и является ли эта проблема действительно актуальной? Если в 50–80-е годы ХХ века в США, Австралии и Европейских странах доля раннего рака желудка среди радикально оперированных больных измерялась несколькими процентами, то к началу ХХI века она вплотную приблизилась или даже превысила 20%.
Частота метастазирования в лимфатические узлы при раннем раке желудка варьирует весьма широко - от 5,5% до 43%, но по данным абсолютного большинства авторов находится в пределах 10-20% . Это означает, что более чем у 80% больных объем операции - гастрэктомия и субтотальная резекция желудка со стандартной либо расширенной лимфаденэктомией - превышает достаточный с точки зрения достижения радикальности. У больных ранним раком желудка без метастазов в регионарные лимфатические узлы адекватным лечением может быть выполнение органосберегающих операций либо эндоскопических вмешательств.
Пристальное внимание к концепции раннего рака желудка связано также с попыткой достижения второй важнейшей цели лечения онкологических больных - более высокого качества жизни. В связи с этим выбор адекватного метода лечения является предметом активной дискуссии в мировой литературе.
Мы располагаем опытом хирургического лечения 920 больных раком желудка, среди них у 149 (16,2%) больных опухоль была ограниченна пределами слизистого или подслизистого слоев стенки желудка (Т1 в соответствии с 5-ым изданием классификации TNM и 2-ым английским изданием Японской классификации рака желудка).
Гастрэктомия была выполнена у 23 (15%) больных, дистальная субтотальная резекция желудка - у 98 (66%) больных, проксимальная субтотальная резекция желудка - у 3 (2%) больных. Во всех эти случаях единым блоком с желудком удалялись оба сальника, а также клетчатка вдоль левой желудочной артерии. У 21 (14%) больного была выполнена дистальная резекция желудка с неполным удалением перигастральных лимфатических узлов. Такой объем оперативного вмешательства использовали при наличии небольшого размера поверхностных опухолей пилорического отдела желудка.
Мы наблюдали статистически значимый рост частоты раннего рака желудка среди радикально оперированных больных с 7,7% в 70-е годы до 22,2% в 90-е годы и в настоящее время. Среди 149 больных было 87 мужчин и 62 женщины. Возраст больных колебался от 29 до 78 лет, составив в среднем 55 лет. Преобладающей локализацией опухоли были нижняя (61%) и средняя (26%) трети желудка. У половины больных опухоли имели размеры до 2 см, в том числе у 34 (23%) пациентов - менее 1 см. В то же время, у каждого десятого больного максимальный размер новообразования превышал 6 см, а у 9 (6%) больных - превышал 10 см. Среди макроскопических форм роста возвышающиеся и плоские опухоли встречались с одинаковой частотой (24% и 23%); углубленные или изъязвленные - почти в два раза чаще (44%). Инфильтративный рост (4 тип по классификации Borrmann) имел место у 14 больных и наблюдался статистически значимо чаще при прорастании опухолью подслизистого слоя: 13% и 3% соответственно (р=0,0456). Изучение морфологического строения показало, что в 56% наблюдений опухоли были представлены высоко- и умеренно дифференцированной аденокарциномой; в 44% - низкодифференцированной аденокарциномой, перстневидно-клеточным и недифференцированным раком. Мультицентрический рост опухоли является одним из основных аргументов противников выполнения экономных резекций и эндоскопического лечения раннего рака желудка. По данным различных авторов два и более очага опухолевого поражения наблюдаются у 4-17% больных (в среднем – у 7-8%), причем, как правило, в пределах одной анатомической области. В нашем исследовании у 5 (3%) больных были выявлены две опухоли в одном (4 случая) и различных (1 случай) отделах желудка.
Среди 149 больных в 60 (40%) случаях опухоль располагалась на уровне слизистого слоя стенки желудка, а в 89 (60%) случаях - прорастала подслизистый слой. Среди больных с инвазией только слизистой оболочки ни в одном случае не были обнаружены метастазы в лимфатические узлы; при прорастании опухолью подслизистого слоя регионарные метастазы были выявлены у 18 (20%) больных. Частота метастатического поражения регионарных лимфатических узлов при раннем раке желудка (рТ1) по данным различных авторов варьирует от 5,5% до 43%; при прорастании слизистого слоя - от 0% до 5%, при прорастании подслизистого слоя - от 9,6% до 26%. Количество пораженных лимфатических узлов в нашем исследовании варьировало от 1 до 7, и в среднем составило 2,7. Метастазы обнаруживали в следующих группах лимфатических узлов: малого сальника (11 больных), большого сальника (4), вдоль левой желудочной артерии (4), надпривратниковых (1), подпривратниковых (1). Таким образом, у большинства больных (п=14, 78%) метастазы локализовались только в перигастральных лимфатических узлах (N1 в соответствии с Японской классификацией рака желудка); в 4 случаях - в лимфатических узлах второго коллектора (N2). По данным различных авторов, метастазы в перигастральные лимфатические узлы обнаруживаются в 75-80% случаев и более; во втором лимфатическом коллекторе - в 20-25%; в более отдаленных (N3-4) - в единичных наблюдениях.
Из 148 оперированных и выписанных из стационара больных умерли 47; 26 больных умерли от причин, не связанных с основным заболеванием; 5 больных умерли от метахронных злокачественных новообразований (рака легкого, рака яичников, рака ободочной кишки, рака мочевого пузыря и острого лейкоза). У 7 больных причина смерти не известна; 14 больных умерли от рецидива рака желудка; у большинства из них (12 больных) имели место гематогенные метастазы. Локо-регионарный рецидив был выявлен у 6 больных и только в 2 случаях - изолированный (оба больных были радикально оперированы, произведена экстирпация культи желудка). Длительность безрецидивного периода варьировала значительно: от 2-6 месяцев (4 больных) до 109-112 месяцев (2 больных).
Показатели общей 5-, 10- и 15-летней выживаемости всей исследуемой группы больных составили 78%, 64% and 48% соответственно; медиана выживаемости - 15 лет. Скорректированная по причине смерти выживаемость была статистически значимо выше (χ2=8,196; df=l; р=0,0042). Выявлены два фактора, статистически значимо снижающих оба вида выживаемости: прорастание опухолью подслизистого слоя стенки желудка и метастатическое поражение регионарных лимфатических узлов. По данным различных авторов, 5-летняя выживаемость при прорастании опухолью слизистого слоя составляет 91-94%, подслизистого слоя - 78-83%, при отсутствии метастазов в регионарные лимфатические узлы - 85-100%, при наличии метастазов в регионарные лимфатические узлы - 64-81%. Поскольку метастазы в лимфатические узлы наблюдались только при поражении опухолью подслизистого слоя, мы сравнили выживаемость больных в зависимости от глубины инвазии опухолью стенки желудка при отсутствии регионарных метастазов. Оказалось, что статистически значимые различия (в пользу опухолей в пределах слизистого слоя) сохраняются по критерию общей выживаемости (χ2=8,834; df=l; р=0,003) и отсутствуют по критерию скорректированной выживаемости (χ2=2,775; df=1; р=0,0958).
Нами не выявлено статистически значимых отличий в результатах лечения в зависимости от локализации, морфологического строения, размера и макроскопического типа роста опухоли, а также вида оперативного вмешательства. При прорастании опухоли в пределах слизистого слоя только один больной умер от морфологически подтвержденного рецидива - множественных гематогенных и перитонеальных метастазов через 112 месяцев после оперативного лечения. Принимая во внимание очень низкую вероятность лимфогенного метастазирования и хорошие отдаленные результаты (15-летняя общая выживаемость - 80%, скорректированная выживаемость - 93%) мы считаем, что субтотальная резекция с ограниченной (D1) лимфаденэктомией является адекватным хирургическим вмешательством. Определенные подгруппы больных (небольшие по размеру опухоли при отсутствии мультицентрического роста) могут рассматриваться как кандидаты для более консервативного лечения - выполнения сегментарных операций, а также эндоскопического удаления опухоли. Преимущество органосберегающего лечения очевидно - улучшение качества жизни, более полная медицинская, социальная и трудовая реабилитация больных.
Отдаленные результаты лечения больных при прорастании опухоли в подслизистый слой были значительно хуже, и связано это, в первую очередь, с метастатическим поражением лимфатических узлов. 5 из 18 (28%) больных, имевших регионарные метастазы, умерли от рецидива заболевания. Принимая во внимание больший размер, чаще выявляемую мультицентричность поражения, более высокую частоту лимфогенного метастазирования, включая поражение лимфатических узлов второго и даже третьего коллектора, мы считаем, что лечение опухолей с распространением на подслизистый слой должно быть таким же, как и более распространенных форм рака желудка. Небольшой размер и экзофитный рост опухоли не могут быть основанием для ограничения объема вмешательства, поскольку напрямую не коррелируют с глубиной инвазии и наличием метастазов в лимфатические узлы. Однако, остается неясным, способно ли расширение объема оперативного вмешательства улучшить отдаленные результаты лечения, поскольку причиной смерти большинства больных были отдаленные метастазы. Более того, мы наблюдали 5 больных, умерших от множественных гематогенных метастазов в течение первого года (через 2,3,4, 6 и 10 месяцев) после операции. Полученные нами данные о преобладании гематогенного пути метастазирования раннего рака желудка, а также о высокой частоте развития рецидивов после хирургического лечения опухолей с инвазией подслизистого слоя и наличием метастазов в регионарные лимфатические узлы соответствуют данным других исследователей. Это означает, что даже ранние опухоли желудка могут иметь высокую биологическую агрессивность, и отдаленные метастазы могут быть уже к моменту выполнения операции. Частота развития рецидивов у больных раком желудка рТ1N+ в нашем исследовании (5 из 18 больных) соответствует аналогичному показателю в работах Abe S. и соавт. и Kitamura К. и соавт., хотя японские авторы рутинно использовали расширенную лимфодиссекцию. В двух крупных европейских рандомизированных исследованиях также не было показано преимуществ расширенной (D2) лимфаденэктомии по сравнению с ограниченной (D1) при опухолях Т1.
В заключение следует отметить, что практически все аспекты проблемы раннего рака желудка (определение, клинико-морфологические характеристики, выбор адекватного метода лечения и его результаты, факторы прогноза) продолжают оставаться предметом полемики. Полученные нами данные убедительно демонстрируют, что так называемый "ранний", "поверхностный", "начальный" или "малый" рак желудка с распространением только в пределах слизистого или подслизистого слоев представляет собой весьма разнородную группу опухолей. Они значительно отличаются по морфологической форме, особенностям роста в пределах стенки желудка, потенции давать лимфогенные и гематогенные метастазы, и, соответственно, по прогнозу. Так, опухоли с поражением подслизистого слоя, по сравнению с расположенными только в пределах слизистого слоя, статистически значимо больше по размеру, чаще имеют низкую степень дифференцировки, мультицентрический рост, и, главное, значительно чаще метастазируют в регионарные лимфатические узлы. Очевидно, что закономерности лимфогенного метастазирования являются краеугольным камнем в дискуссии о выборе адекватного лечения раннего рака желудка. Опухоли, расположенные на уровне слизистой оболочки стенки желудка, наиболее полно отвечают понятию раннего рака, поскольку практически не метастазируют в лимфатические узлы. Поэтому органосохраняющее лечение у данной категории больных может рассматриваться как адекватное с онкологических позиций. При прорастании опухолью подслизистого слоя, частота лимфогенных метастазов достигает 20-25%, а с учетом наличия микрометастазов повышается еще более. Дальнейший прогресс в лечении больных ранним раком желудка связан с индивидуализацией объема оперативного вмешательства на пораженном органе и лимфатическом аппарате. В последние годы появились позитивные результаты исследований, посвященных применению концепции сторожевых лимфатических узлов у больных раком желудка, что впервые открывает возможность индивидуальной оценки состояния регионарных лимфатических узлов. Проведенные исследования показали, что общая диагностическая точность оценки статуса регионарных лимфатических узлов на основании биопсии сторожевых лимфатических узлов весьма высока и составляет 90-98%. Интраоперационное (в том числе во время лапароскопического вмешательства) морфологическое исследование сторожевых лимфатических узлов может позволить обоснованно отобрать группу больных ранним раком желудка, у которых отсутствуют регионарные метастазы, для выполнения органосберегающих оперативных вмешательств. По нашему мнению, в настоящее время методом оперативного лечения рака желудка с распространением на подслизистый слой должна быть гастрэктомия либо дистальная субтотальная резекция желудка с модифицированной D2 лимфодиссекцией - удалением лимфатических узлов вдоль чревной, левой желудочной, общей печеночной и проксимальной части селезеночной артерии, и сохранением селезенки и поджелудочной железы.
Читайте также:

