Раковые стволовые клетки при колоректальном раке

Изучение механизмов и закономерностей метастазирования злокачественных опухолей, несмотря на достаточно длительную историю, представляет собой важную задачу современной медицинской науки, поскольку даже при своевременном и эффективном излечении первичного очага большинство больных погибает от развивающихся впоследствии метастазов, клетки которых приобретают повышенную агрессивность и резистентность к лекарственным препаратам [1; 2]. При исследовании этих вопросов в последнее время придается большое значение раковым стволовым клеткам (РСК, cancer stem cells - CSC), обладающим некоторыми общими свойствами со стволовыми клетками, по некоторым данным, именно они считаются источником развития и генерализации злокачественного процесса [3]. В норме во многих тканях присутствуют стволовые клетки, обеспечивающие их регенерацию, особенно интенсивную в клетках кишечного эпителия.
Исследование этой особой популяции РСК предполагает решение ряда сложных проблем, связанных с небольшим числом данных клеток, отсутствием однозначных идентификационных характеристик, на фоне повышенной генетической и фенотипической нестабильности, являющихся основой обратимых переходов в другие популяции клеток. Следует отметить, что именно РСК сейчас рассматриваются как причина устойчивости опухолей к радио- и химиотерапии, возникновения рецидивов и метастазов. Поэтому изучение РСК может принципиально изменить подходы к лечению онкологических пациентов, в частности КРР.
В литературе приводится ряд иммунофенотипических характеристик РСК различных опухолей, однако принадлежность маркеров к рассматриваемому типу клеток нередко является спорной в силу неоднозначности их функции. Кроме того, более полную картину может дать не один маркер, а их совокупность; не исключена также гетерогенность РСК, даже внутри одной ткани.
Одним из маркеров РСК ряда солидных опухолей считается CD44 (рака молочной железы, поджелудочной железы, опухолей головы и шеи и др.) [5]. Данная молекула, являясь адгезивным белком, определяет межклеточные взаимодействия, контакты клетки с элементами экстрацеллюлярного матрикса. CD44 участвует в процессах рециркуляции и активации лимфоцитов, играет определенную роль в таких процессах, как миелопоэз, лимфопоэз, ангиогенез. В клетке могут существовать множественные изоформы CD44: стандартная изоформа CD44s, а также несколько вариантов CD44v, из которых лучше изучена CD44v6. Тканевая организация, особенности микроокружения клетки, активность онкогенных сигнальных путей (например, Ras-MAPK) влияют на образование соответствующего типа CD44, хотя механизмы воздействия указанных факторов на выбор образуемой изоформы данной молекулы до конца не выяснены [6].
Во внеклеточном пространстве лигандами CD44, помимо гиалуроновой кислоты, являются: коллаген, ламинин, фибронектин, остеопонтин и некоторые гликозаминогликаны. Показаны антиапоптотические и прометастатические эффекты активации СD44. Влияя на интенсивность деградации гиалуроновой кислоты и определяя расположение на мембране матрикс-модифицирующих ферментов, СD44 может участвовать в моделировании опухолевого микроокружения, а расщепление самого CD44, которое отмечалось в ткани опухоли, способствовало увеличению миграционной активности клеток.
Показано, что комплекс лиганд-СD44 вовлечен в регуляцию эпителиально-мезенхимального перехода и стволовости в клетках РМЖ, рака головы и шеи, яичников; взаимодействуя с рецепторами факторов роста (EGFR- и HER2), изменяет активность ряда транскрипционных факторов и их комплексов с дальнейшей экспрессией генов, определяющих стволовость, торможение апоптоза и лекарственную устойчивость [6].
Следствием указанных особенностей РСК, у CD44+ опухолевых клеток описана более высокая способность к образованию опухолей, устойчивость к лекарственному воздействию, меньшая склонность к апоптозу по сравнению с CD44- клетками [7]. Однако роль CD44 в прогрессии опухоли и образовании метастазов при КРР неоднозначна [8].
Еще одним поверхностным маркером, используемым для идентификации РСК, является CD133 (АС133, проминин-1), особенностями структурной организации которого является наличие пяти трансмембранных доменов, обуславливающих взаимодействие с холестеролом плазматических мембран. Эта структура ассоциирована с мембранными выпячиваниями, но функция её точно не известна [6]. Определяются три изоформы данного гликопротеина.
Экспрессия CD133 снижается при увеличении степени дифференцировки клеток, что позволяет идентифицировать РСК. CD133 определяется на ряде клеток, не связанных с опухолевым ростом: в гемопоэтических и нейрональных стволовых клетках, клетках-предшественницах, в эмбриональных эпителиях [6].
В эксперименте L. Ricci-Vitiani et al. (2007) продемонстрировали, что CD133+ раковые клетки, введенные иммунодефицитным мышам, формировали опухоли, а CD133- нет [9]. Низкая пролиферативная активность CD133+ клеток КРР способствует их высокой химио- и радиорезистентности [10], вследствие чего его экспрессия CD133 обратно коррелирует с выживаемостью пациентов, получавших 5-фторпиримидины [11].
К настоящему времени, таким образом, накоплен определенный опыт изучения особенностей фенотипической характеристики РСК, но уровень экспрессии этих молекул при различной распространенности процесса не изучен в полной мере.
Материалы и методы исследования
При проведении работы были исследованы образцы опухолевой ткани КРР 60 больных: 31 женщины и 29 мужчин в возрасте от 37 до 78 лет. Первая группа обследованных включала 30 больных без отдаленного метастазирования: T2-4N0M0 (n=21), T3-4N1M0 (n=9). Вторая группа – 30 пациентов с метастазами в печень: T3-4aN0M1 (n=8) и T3-4аN1-2M1 (n=22). По гистологическому строению все опухоли были аденокарциномами.
В работе использован иммуногистохимический метод определение экспрессии CD44 и CD133 на опухолевых клетках, с использованием мышиных моноклональных антител к CD44 клона 156-3С11 (ThermoScientific) в разведении 1:100 и поликлональных кроличьих антител к CD133 (MyBioSource) в разведении 1:200 с использованием автостейнера Thermo Scientific 480S. Экспрессия белка CD44 имеет мембранную локализацию и определялась как положительная, когда окрашивание было выявлено в 10% (cut-off) и более всех опухолевых клеток. Белок CD133 также имеет мембранную локализацию; его экспрессию считали положительной, когда окрашивание было выявлено в более 5% всей опухоли. Кроме того, характеризовали интенсивность окрашивания клеточной мембраны: 0, 1+ слабое, 2+ умеренное, 3+ сильное окрашивание. При наличии интенсивности окрашивания 2+ и 3+ случай рассматривался как позитивный.
Оценку достоверности отличий результатов исследования осуществляли с помощью программы STATISTICA 7.0 (StatSoftInc., США) с применением t-критерия Стьюдента.
Результаты исследования и их обсуждение
Результаты исследования представлены на рисунках 1-3. Позитивная экспрессия CD44 на опухолевых клетках при отсутствии метастазов в печень и при их наличии выявлена в 40% (12 из 30) и 30% (9 из 30) опухолей, в то время как для CD133 эти показатели составили 60% (18 из 30) и 83,3% (25 из 30) соответственно (рис. 1).
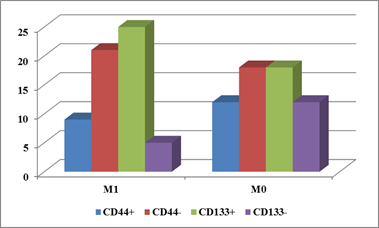
Рис. 1. Доля опухолей с позитивной и негативной экспрессией маркеров РСК при наличии и отсутствии отдаленных метастазов
Как видно из рисунка 1, при метастазирующем и при неметастазирующем КРР среди первичных опухолей превалируют экспрессирующие CD133, но не CD44; различие особенно наглядно проявляется в опухолях с метастазами в печень.
В опухолях больных 1-й группы разброс количества CD44+ клеток составлял от единичных до 25% всей площади опухоли (в среднем 9,8±3,1%), во 2-й группе – от единичных до 15% (в среднем 6,6±2,9%); различия статистически недостоверны (p≥0,05). Для CD133+ клеток соответствующие показатели составили: в группе больных без отдаленного метастазирования от единичных до 15% всей площади опухоли (в среднем 8,6±3,1%), в группе с отдаленными метастазами – от единичных до 25% (в среднем 13,8±2,4%); различия также статистически недостоверны (p≥0,05).
Хотя статистически значимых различий количества клеток, позитивных по экспрессии маркеров РСК, в зависимости от распространенности процесса и не установлено, следует отметить, что при наличии метастазирования в печень в первичной опухоли нарастает количество CD133+ и снижается количество CD44+ (рис. 2).
Более детальный анализ данных внутри каждой группы подтверждает разнонаправленный характер экспрессии CD44 и CD133: отмечено нарастание как доли CD133+ опухолей, так и экспрессии этого маркера их клетками по мере увеличения распространенности КРР (рис. 3), в частности, регистрируется статистически достоверное повышение количества CD133+ клеток в опухолях T3-4aN1-2M1 по сравнению с T2-4N0M0 (16,7±3,4 против 6,3±3,6%, p
Кандидат биологических наук Илья Щеглов.
Модель раковых стволовых клеток (РСК) подразумевает, что любое злокачественное новообразование (неоплазия) развивается из одной клетки. В результате неких событий генетический аппарат некогда нормальной клетки трансформируется настолько, что происходит её перерождение в инициирующую раковую клетку. В результате последующей пролиферации (деления) этой клетки формируется злокачественная опухоль. Согласно концепции РСК, эта опухоль устроена иерархически, то есть разные типы раковых клеток обладают разной способностью к делению.
Раковые стволовые клетки составляют лишь небольшую популяцию опухолевых клеток. Однако, будучи истинно стволовыми клетками, они (и только они) способны к неограниченному числу делений и постоянному самовоспроизведению. Число делений остальных клеток, если они способны к пролиферации (то есть формально обладают неким стволовым потенциалом), строго ограничено.
В основе процесса самовоспроизведения РСК лежит так называемый асимметричный тип деления стволовых клеток, который заключается в том, что родительская стволовая клетка даёт начало двум клеткам. Одна из них — с такими же стволовыми свойствами, что и материнская, другая же способна к ограниченному числу делений и поэтому называется частично дифференцированной, временно пролиферирующей раковой клеткой. Конечные потомки таких клеток — раковые клетки, не способные к делению. Их называют терминально дифференцированными. Соответственно иерархия опухолевой ткани выглядит так: раковые стволовые клетки → временно пролиферирующие раковые клетки → терминально дифференцированные раковые клетки. Два последних типа клеток образуют при этом основную массу опухоли.
Точно такая же иерархия имеет место и в нормальных тканях, стволовые клетки которых, способные к самовоспроизведению и поддержанию собственной популяции, также дают начало ограниченно пролиферирующим клеткам — предшественникам зрелых клеток. Эти зрелые тканевые клетки не способны к делению вовсе и погибают через какое-то время после выполнения свойственных им функций.
Итак, согласно модели раковых стволовых клеток, не все опухолевые клетки обладают равной способностью к делению и самовоспроизведению. И несмотря на то что основная масса опухоли состоит из злокачественных клеток той или иной степени дифференцировки, её рост и развитие определяются небольшой по численности, но наивысшей в иерархии популяцией раковых стволовых клеток.
Упреждая аргументы критиков РСК-модели, следует отметить, что некоторые злокачественные новообразования не вписываются в эту модель, а, скорее, соответствуют модели клональной эволюции. Есть виды неоплазий, при которых могут встречаться разные популяции раковых стволовых клеток, имеющих разные хромосомные нарушения. Хрестоматийные примеры таких новообразований — хроническая миелоидная лейкемия и колоректальный рак. В этих случаях РСК-модель не может полностью описать развитие опухоли, так как в соответствии с ней все клетки опухоли — потомки одной инициирующей РСК. Здесь же возможна либо инициация опухоли сразу из нескольких злокачественных стволовых клеток, формирующих несколько генетически различающихся клонов, либо эволюция одного клона из другого за счёт последовательного накопления генетических нарушений. Разные клоны могут обладать разной злокачественностью и соответственно могут конкурировать за ресурсы. Иными словами, будет проходить эволюция опухолевых клонов.
Некоторые новообразования, отличающиеся экстремальной злокачественностью, также больше соответствуют модели клональной эволюции, нежели иерархической модели РСК. К ним относятся, например, различные злокачественные меланомы, при которых доля активно делящихся раковых клеток составляет чуть ли не более половины опухолевой массы. При этом в пределах одной опухоли сосуществуют РСК с различными фенотипами, которые при различных воздействиях на опухоль могут легко превращаться один в другой. Очевидно, что и для этих случаев РСК-модель не вполне подходит.
Однако, как можно заметить, в современной интерпретации модели клональной эволюции центральная роль инициирующих раковых стволовых клеток в запуске развития злокачественного новообразования ни в коей мере не оспаривается. Дискуссии продолжаются лишь относительно тех или иных сценариев развития опухоли*. А коли так, мы со спокойной совестью можем говорить о раковых стволовых клетках.
Более полувека спустя, в 1930-х годах, теория зародышевого остатка получила новый импульс. Гистологические наблюдения одной из опухолей мозга — медуллобластомы — показали, что её клетки морфологически очень напоминают клетки эмбрионального мозжечка, на основании чего было выдвинуто предположение, что эта форма опухолей мозга развивается из зародышевого остатка, состоящего из медуллобластов, утративших способность к дифференцировке.
Очередной значительный шаг на пути к концепции раковых стволовых клеток сделан в середине прошлого века. Исследования различных миелопролиферативных заболеваний (особой группы злокачественных новообразований, развившихся из клеток крови**) показали, что в развитие данной группы заболеваний могут быть вовлечены все ветви гемопоэза, за исключением лимфоидных ростков. Это послужило основанием для предположения, что все указанные патологии связаны со злокачественным перерождением клеток — предшественников всех остальных клеток миелоидного ряда, теперь известных как миелоидные cтволовые клетки.
А уже в 1960 году Питер Ноуэл (Peter Nowell) и Дэвид Хангерфорд (David Hungerford) открыли уникальную взаимосвязь так называемой филадельфийской хромосомы с одним из миелопролиферативных заболеваний — хронической миелоидной лейкемией. Филадельфийская хромосома — следствие хромосомной аномалии, которая приводит к образованию мутантного белка BCR-ABL1. К несчастью, этот мутантный белок сохраняет способность одного из своих родительских белков (ABL) к передаче пролиферативного (стимулирующего деление клетки) сигнала внутрь клетки. Более того, он передаёт сигналы гораздо интенсивнее и при этом делится вне зависимости от внешних сигналов. В результате клетки, несущие такую мутацию, начинают быстро и неконтролируемо делиться. В дальнейшем наличие филадельфийской хромосомы при этом заболевании было подтверждено во всех клетках, не относящихся к лимфоидному ряду, на основании чего выдвинули гипотезу о происхождении всех клонов лейкемических клеток от одного предшественника.
Как видно, модель клональной эволюции подразумевает, что одни раковые клоны отличаются большей злокачественностью, другие — меньшей, но в целом все они обладают сопоставимой способностью к делению. И в этом заключается принципиальное отличие стохастической теории канцерогенеза от иерархической теории, которая базируется на модели раковых стволовых клеток.
Тем не менее, как уже было упомянуто выше, модель клональной эволюции до сих пор не потеряла своей актуальности, поскольку в несколько большей степени, нежели модель РСК, объясняет развитие нескольких типов новообразований.
Долгое время концепция РСК находилась на вторых ролях. Однако в 1997 году Доминик Бонне (Dominique Bonnet, London Research Institute) и Джон Дик (John Dick, Toronto General Research Institute) продемонстрировали, что единичные лейкемические стволовые клетки, взятые у пациентов с острой миелоидной лейкемией, при трансплантации мышам дают начало полному спектру клеток с различными злокачественными фенотипами, наблюдаемыми при этом заболевании у человека. После этой работы число исследований, посвящённых РСК, стало лавинообразно нарастать.
В начале 2000-х годов раковые стволовые клетки были идентифицированы и в солидных опухолях (при одной из форм рака молочной железы). На сегодняшний день РСК описаны для абсолютного большинства форм онкологических заболеваний, и с этими клетками связывают все основные клинические проблемы в онкологии.
Поскольку любое новообразование может развиться только из активно делящейся клетки, наиболее подходящие кандидаты для злокачественной трансформации — нормальные тканевые стволовые клетки (дающие начало полностью дифференцированным клеткам, выполняющим свои узкоспецифические задачи в том или ином типе тканей), так как они обладают длительным сроком жизни и высокой скоростью деления. В соответствии с этим концепция РСК подразумевает, что инициирующее событие в канцерогенезе — злокачественное перерождение нормальных тканевых стволовых клеток***, которые становятся инициирующими РСК.
Ещё одна неприятная особенность раковых стволовых клеток — их чрезвычайная устойчивость ко всем известным видам лечения. Какой бы вид противоопухолевой терапии ни применялся (радио-, химио-, иммунотерапия, таргетная), РСК будут погибать последними, когда все дифференцированные раковые клетки уже успешно побеждены.
Известно несколько механизмов терапевтической устойчивости РСК. Во-первых, РСК характеризуются повышенной экспрессией транспортных белков семейства ABC (ATP-binding cassette). Это эволюционно консервативные белки, присутствующие у всех организмов — от бактерий до человека. В норме они локализуются преимущественно в плазматической мембране клеток и отвечают за транспорт полезных веществ (например, витаминов) в клетку и выведение из неё вредных токсинов и ксенобиотиков. В РСК эти белки экспрессируются на особенно высоком уровне и отвечают за выведение из них различных химиотерапевтических препаратов.
Во-вторых, РСК, как никакие другие клетки, отличаются обилием фермента альдегид-дегидрогеназы (ALDH). В норме функция этого белка — окисление токсичных для организма альдегидов до карбоновых кислот. В РСК же он отвечает за инактивацию многих химиотерапевтических препаратов.
Это основные, но далеко не все механизмы устойчивости РСК. В тех же случаях, когда системы резистентности РСК к терапии дают сбой, раковые стволовые клетки впадают в дормантность (состояние покоя), в которой они могут пребывать несколько десятилетий, после чего активируются и обусловливают скоротечный фатальный рецидив. Дормантные РСК отличаются очень низким уровнем метаболизма, экстремальной устойчивостью к повреждающим воздействиям и практически не экспрессируют поверхностные белки, которые могли бы послужить мишенями для создания таргетных препаратов. На сегодняшний день дормантные РСК представляют собой наибольшую трудность для лечения. Однако надежда на успех есть. Во-первых, испытываются и неплохо себя проявляют различные сложные комбинации уже существующих таргетных препаратов. Во-вторых, удалось вплотную приблизиться к получению препаратов, воздействующих на процессы, лежащие в основе образования вторичных метастатических РСК. В-третьих, обнаружены белки, отвечающие за дормантность РСК и обеспечение их жизнеспособности в состоянии покоя. Наконец, разрабатываются препараты, способствующие выходу РСК из дормантности, что делает их более чувствительными к существующим формам терапии.
Cловарик к статье
Клеточная дифференцировка — процесс клеточной дифференцировки заключается в так называемом созревании стволовой клетки-предшественника в клетку со строго определённым фенотипом (например, кардиомиоцит или пирамидный нейрон), называемую дифференцированной.
Пролиферация (от лат. proles — отпрыск, потомство и fero — несу) — разрастание ткани организма путём размножения клеток делением.
Репарация ДНК — внутриклеточная молекулярная система восстановления исходной последовательности ДНК после её повреждений.
Стохастический (от греч. στοχαστικός — умеющий угадывать) означает неопределённость, случайность чего-либо.
Фенотип (от греческого слова phainotip — являю, обнаруживаю) — совокупность характеристик, присущих индивиду на определённой стадии развития (особенности строения и жизнедеятельности).
Комментарии к статье
* Большинство ведущих специалистов сегодня склоняются к мнению, что универсального сценария развития опухоли не существует. Возможна реализация обеих моделей.
*** Само злокачественное перерождение может быть результатом одного или нескольких канцерогенных событий (например, мутаций, но не только их).
Колоректальный рак представляет собой важную причину смертности и заболеваемости. К сожалению, физиопатология все еще изучается. Существуют теории канцерогенеза, и известно, что за развитие опухоли отвечает не только один фактор, но и несколько состояний. Стволовые клетки являются многообещающей мишенью для лечения колоректального рака наряду с окружающей средой, которая играет важную роль.
Было высказано предположение, что мутации в стволовых клетках взрослого толстого кишечника могут вызывать неопластические изменения. Эта теория основана на наблюдении, что в раке толстой кишки менее 1% неопластических клеток обладают способностью регенерировать опухоль и, следовательно, ответственны за рецидив. Важно знать, что необходимо найти новый способ лечения, поскольку эти клетки устойчивы к химиотерапии и лучевой терапии.
Гематологи первыми узнали и использовали взрослые стволовые клетки [28,29].
Раковые стволовые клетки были впервые обнаружены при остром миелоидном лейкозе как небольшое подмножество опухолевых клеток, способных к самообновлению, инициации и поддержанию заболевания [26].
В нормальных гематопоэтических стволовых клетках накоплены мутации, ответственные за превращение в раковые стволовые клетки [37]. Кроме того, нормальные гемопоэтические стволовые клетки широко использовались для терапевтической трансплантации костного мозга [37]. Сходство между колоректальным онтогенезом и канцерогенезом побудило некоторых исследователей полагать, что раковые стволовые клетки возникают как из нормальных взрослых толстой кишки, так и из остаточных стволовых клеток плода [10,22].
Во-первых, оба процесса производят морфологически сходные архитектурные структуры, такие как железы. Во-вторых, маркеры онтогенеза кишечника встречаются в канцерогенезе, но не в нормальном кишечнике (например, цитокератин 7, ядерный β-катенин) [10].
В-третьих, регуляторы онтогенеза кишки сверхэкспрессируются при колоректальном раке (например, Sonic Hedgehog, Notch 1-3 и ядерный β-catenin) [10,11].
Подводя итог, нормальная стволовая клетка толстой кишки, по-видимому, является логическим источником рака; однако это невозможно было однозначно определить.
Нормальные взрослые стволовые клетки специфичны для тканей и органов. Они составляют лишь небольшую часть общей популяции клеток и могут размножаться в течение всего жизненного цикла организма. Эти относительно недифференцированные и медленно делящиеся клетки отвечают за поддержание целостности тканей и обеспечение непрерывного снабжения новыми клетками [6,23]. Их потомство более дифференцировано, и они делятся более быстрыми темпами [23,29]. Взрослые стволовые клетки имеют несколько ключевых особенностей. К ним относятся (i) самообновление; (ii) пластичность; (iii) потенциал для многолинейной дифференциации; и (iv) регенерация ткани [6,31]. Именно эти функциональные свойства, а не их морфологические особенности, имеют наибольшее значение для идентификации взрослых стволовых клеток [29]. Пластичность является основной особенностью стволовых клеток. Взрослые стволовые клетки из одной ткани (например, костного мозга) обладают способностью проникать в разные типы тканей (например, толстой кишки) [10, 22]. Например, гемопоэтические стволовые клетки могут дифференцироваться в широкий диапазон типов клеток из всех трех зародышевых слоев [24]. Кроме того, понятие пластичности может даже поставить под вопрос происхождение раковых клеток. В мышиной модели инфекция Helicobacter pylori стимулировала приток стволовых клеток костного мозга, что впоследствии вызвало рак желудка [11]. Именно эта гибкость в поведении клеток может затруднить их описание.
Дифференцированные клетки слизистой оболочки толстой кишки имеют короткий срок службы (дней), тогда как нормальные стволовые клетки кишечника имеют длительный срок службы и, следовательно, больше возможностей для накопления мутаций [23]. Последовательность аденомы-карциномы Фогельштейна утверждает, что мутации накапливаются в клетке, что приводит к злокачественной трансформации. Эти мутации сопровождаются фенотипическим изменением слизистой оболочки. В настоящее время появляются свидетельства того, что долгоживущие взрослые толстые стволовые клетки могут накапливать мутации в течение длительного периода времени, прежде чем фенотипические изменения станут очевидными [10,21].
Теория соматической мутации рака утверждает, что мутации накапливаются в клетке до тех пор, пока не произойдет неконтролируемая клеточная пролиферация, что приведет к возникновению рака [24]. Кроме того, есть веские доказательства того, что взаимодействие клетки с окружающей средой столь же важно. Поэтому важно понимать концепции ниши стволовых клеток, влияние микросреды и их роль в причинах возникновения рака. Ниша стволовых клеток — это микроокружение, в котором находится стволовая клетка, и контролирует ее активность самообновления и генерации тканей [39]. В нормально функционирующих тканях клетки не являются самоопределяющимися. Их активность жестко регулируется смежными клетками, внеклеточным матриксом и растворимыми факторами [31]. Фактически, если клетки отделены от их нормальной среды, например, в культуре, они теряют функцию и дифференцировку [31]. Показано, что ниша стволовых клеток оказывает глубокое влияние на дифференциацию стволовых клеток из-за их присущей пластичности. Например, при культивировании с миобластами нейронные стволовые клетки дифференцируются в мышечные клетки [11].
В толстой кишке стволовые клетки находятся в основании склепа. Каждый склеп заключен в кишечные субэпителиальные миофибробласты (ISEMF), разделенные только базальной пластинкой. ISEMF образует синцитий в пределах lamina propria, который простирается вдоль длины кишечного тракта [23,28]. Этот синцитий получает холинергический вход и закрывает окружающие кровеносные сосуды [29]. Миофибробласты удлиняют клеточные процессы через фенотипы в базальной пластине для достижения прямого контакта с эпителиальными клетками [29]. Синтез ISEMF выделяет множество цитокинов, которые важны для заживления ран и функции иммунных клеток [29]. Имеются данные, свидетельствующие о том, что они контролируют пролиферацию и дифференцировку эпителиальных клеток. Кроме того, они играют определенную роль в электролите и водопоглощении. В патологических состояниях ISEMFs способствуют фиброзу, десмопластическим реакциям и неоплазии [29].
Манипуляция микроокружением через генетическую модификацию матриксной металлопротеиназы и стромальных клеток может привести к развитию рака [31]. Стромальные клетки, которые не реагируют на трансформацию фактора роста (TGF) -β, способствуют росту и инвазии эпителиальных клеток [31]. Раки, возникающие в условиях хронического воспаления, иллюстрируют влияние дефектной среды. И наоборот, здоровое микроокружение может предотвратить рост опухоли даже в присутствии стволовых клеток, несущих онкогенные мутации [31]. Считается, что микроокружение оказывает свое действие через эпигенетические механизмы, которые ингибируют или усиливают экспрессию различных генов без изменения последовательности ДНК. Существует только небольшая субпопуляция клеток, которые способны генерировать новые первичные опухоли в пределах любого рака. Эти клетки называются раковыми стволовыми клетками прежде всего из-за их способности к самообновлению и регенерации опухолевой ткани. Происхождение этих клеток неизвестно. Они могут возникать из нормальных стволовых клеток толстой кишки, частично дифференцированных клеток-предшественников [24] или полностью дифференцированных клеток [10]. Последние имеют относительно короткий срок службы и, следовательно, имеют мало возможностей для накопления мутаций, которые вызывают злокачественный фенотип.
Было показано, что CD133 является важным маркером для идентификации популяции клеток, обогащенных стволовыми клетками колоректального рака. В эксперименте О’Брайена и др. CD133 + колоректальные раковые клетки более чем в 200 раз чаще могли инициировать рост опухоли, чем CD133-клетки [19]. Когда CD133 + клетки вводили под почечную капсулу иммунодефицитных мышей, результирующие опухоли напоминали родительские опухоли. Нормальная слизистая оболочка толстой кишки содержит относительно небольшое количество CD133 + клеток по сравнению со злокачественной слизистой оболочкой. В аналогичном исследовании Риччи-Витиани и др. Было обнаружено, что CD133 + подгруппа колоректальных раковых клеток была опухолегенной [5]. Опять же, эти клетки были недифференцированными, редко встречались при нормальной слизистой оболочке толстой кишки и могли проходить серийные трансплантации с неограниченным потенциалом роста [32]. Важно отметить, что клетки CD133 + вызывали опухоли, похожие на родительскую опухоль [5]. Другие маркеры клеточной поверхности, которые могут помочь в идентификации клеточных субпопуляций, которые содержат более высокую плотность стволовых клеток колоректального рака, включают CD166 и фенотип EpCAMHIGH / CD44 + [25]. CD166 также является маркером мезенхимальных стволовых клеток, но был связан с плохим прогнозом при колоректальном раке [25]. EpCAM и CD44 были впервые идентифицированы как маркеры стволовых клеток при раке молочной железы.
Помимо операции, основой противоопухолевой терапии является быстрое нацеливание на делящиеся клетки. Что касается модели стволовых клеток для рака, эти методы лечения будут нацелены на клетки, усиливающие транзит, и дифференцированные клетки, которые образуют более 99% опухоли. Раковые стволовые клетки, которые могут инициировать новые опухоли, являются относительно медленными циклами и поэтому менее подвержены влиянию этих методов лечения. Кроме того, разработка белков с множественной лекарственной устойчивостью с помощью стволовых клеток добавляет еще один уровень защиты [23]. Эти белки могут помочь в транспортировке химиотерапевтических агентов из цитозоля и в повышении устойчивости к апоптозу [24]. Поэтому, вместо того, чтобы нацеливать на быстрое разделение клеток, препараты, которые способствуют терминальному разделению, могут истощить компонент стволовых клеток опухоли и привести к возможной эрадикации опухоли. Пример этого наблюдается при гематологических злокачественных новообразованиях, где ретиноевая кислота может дифференцировать стволовые клетки и, следовательно, улучшать выживаемость [10,24].
В дополнение к устойчивости к химиотерапии, раковые стволовые клетки часто устойчивы к стандартным режимам лучевой терапии. В глиобластоме мультиформной (GBM) клетки CD133 + идентифицированы как потенциальные стволовые клетки. В этой установке Bao et al. продемонстрировал, что клетки CD133 + устойчивы к лучевой терапии из-за улучшенных механизмов репарации ДНК [18]. Это радиорезистентность может быть уменьшена препаратами, которые сокращают паузу в клеточном цикле, тем самым предотвращая восстановление ДНК [18]. Радиотерапия для GBM связана с увеличением доли CD133 + клеток [18]. Это может помочь объяснить их неизбежный рецидив и соответствующую 2% 5-летнюю выживаемость для GBM [13]. Точно так же при постановке рака прямой кишки лучевая терапия может часто уменьшать размер опухоли или даже приводить к полному патологическому ответу, но без операции риск рецидива приближается к 80% [16]. Таким образом, возникает соблазн сделать вывод о том, что остаточные стволовые клетки прямой кишки ответственны за локальный рецидив. В подтверждение этой идеи было показано, что экспрессия CD44v6 (маркер стволовых клеток) связана с более высокими показателями локального рецидива рака прямой кишки [41].
Благодаря нашему развивающемуся пониманию стволовых клеток колоректального рака, теперь легче понять, почему нынешние системные терапии только вызывают частичную или неполную ремиссию. В настоящее время хирургическое удаление является единственной эффективной стратегией управления, которую мы имеем против этой группы клеток. Поэтому существует настоятельная необходимость в разработке новых методов лечения, которые могут ориентироваться на эту уникальную субпопуляцию раковых клеток. Такое лечение будет способствовать как искоренению заболеваний, так и поддержанию более продолжительной ремиссии. К сожалению, стволовые клетки образуют сердечник в организме человека, и попытка выборочно нацелить их в настоящее время чрезвычайно сложна. Точно так же, как и эти теории, они все равно должны быть научно обоснованы в моделях человека.
Считается, что стволовые клетки при колоректальном раке уникально наделены способностью к обновлению [7,26,30,36,37]. По определению, одиночные колоректальные раковые стволовые клетки могут размещаться в разрешительном участке, таком как печень, и производить метастазы. В настоящее время невозможно выделить отдельные стволовые клетки колоректального рака, хотя некоторые белки клеточной поверхности (например, CD133, CD44, CD166 и альдегиддегидрогеназа1) являются перспективными маркерами. Нормальные стволовые клетки, которые находятся в толстой кишке, полагаются на адгезивные и растворимые стромально-эпителиальные взаимодействия для поддержания деления и дифференцировки. Степень изменений в этих регуляторных механизмах в стволовых клетках колоректального рака является многообещающей областью исследований, так как агенты, которые контролируют рост клеток колоректального рака, теоретически могут быть использованы для профилактики и лечения рака. Семейство факторов роста и событий, таких как регулирование ядерной локализации бета-катенина, по-видимому, является центральным для нормального гомеостаза в кишечных стволовых клетках; мутаций в компонентах этих путей, ведущих к развитию колоректального рака. Парадигма аномальной биологии стволовых клеток проиллюстрирована пациентами с FAP, которые имеют мутации в гене аденоматозного полипоза (APC). Белок дикого типа, кодируемый этим геном, важен для предотвращения массового накопления бета-катенина в ядре и последующей транскрипции белков клеточного цикла; они являются основными механизмами регуляции стволовых клеток в кишечнике и их ролью в естественной истории прогрессирования опухоли.
Читайте также:

