Раковая клетка в пробирке
Новое открытие поможет бороться с раком лёгких, который плохо подаётся терапии.
Иллюстрация Global Look Press.
Специалисты из России обнаружили вещества, препятствующие росту самых опасных злокачественных опухолей. Важное открытие может стать основой для новых стратегий лечения этой смертоносной болезни.
Достижение описано в научной статье, опубликованной в журнале Bioscience Reports учёными из Центра высокоточного редактирования и генетических технологий для биомедицины, в который входят Институт молекулярной биологии им. В.А. Энгельгардта РАН, Институт биологии гена РАН, РНИМУ им. Пирогова Минздрава России и Федеральный научно-клинический центр физико-химической медицины ФМБА России.
Известно великое множество видов рака. Однако большинство смертей от онкологических заболеваний приходится на рак лёгких, если же говорить точнее, то на немелкоклеточный рак лёгкого. Злокачественные опухоли этого типа очень агрессивны и с трудом поддаются терапии.
Теперь исследователи обнаружили группу белков, участвующих в естественной защите организма от этого зла. Подробнее изучив функционирование этих белков, учёные смогут создать новые стратегии лечения рака.
Речь идёт о фосфатазах CТDSP1, CTDSP2 и CTDSPL. Они участвуют во многих жизненно важных для клетки процессах. Но лишь недавно российские специалисты обнаружили у этих белков новую функцию: противодействие раку.
Отметим, что это не первые известные белки, препятствующие развитию онкологических заболеваний. Но каждое такое открытие бесценно для человечества, потому что дарит надежду на спасение многочисленным пациентам, которым угрожает смерть от опасного недуга.
Исследователи из нескольких российских НИИ обнаружили, что фосфатазы замедляют рост аденокарциномы лёгкого (это один из типов злокачественной опухоли при немелкоклеточном раке лёгкого) и вызывает старение раковых клеток. Подчеркнём, что эксперименты проводились на культурах тканей, то есть "в пробирке".
В чём может быть секрет "целебного" действия этих фосфатаз? Специалисты полагают, что они помогают другому нашему естественному защитнику – белку Rb. Фосфатазы способствуют выработке активных форм этого белка, способных противостоять опухоли.
Более того, учёные обнаружили, что нехватка упомянутых фосфатаз может способствовать развитию онкологического заболевания. Эксперимент показал, что активация хорошо известной группы онкогенов miR-96/182/183 ведёт к уменьшению количества спасительных ферментов. Естественно предположить, что с этим и связано зловредное действие опасных генов.
Пока ещё рано говорить о том, какие лекарства можно создать благодаря этим новым знаниям. Это дело будущих исследований, но вряд ли они заставят себя долго ждать.
К слову, ранее Вести.Ru рассказывали о том, что в России успешно опробовали новый метод диагностики рака. Также учёные нашей страны нашли белок, делающий клетки рака более чувствительными к химиотерапии.


Генриетта Лакс
Генриетта Лакс была красивой чернокожей американкой. Она жила в небольшом городке Тернер в Южной Виргинии вместе с мужем и пятью детьми. 1 февраля 1951 года Генриетта обратилась в госпиталь Джонса Хопкинса — ее беспокоили странные выделения, которые она периодически обнаруживала на своем нижнем белье. Медицинский диагноз был страшен и беспощаден — рак шейки матки. Восемь месяцев спустя, несмотря на хирургию и радиотерапию, она умерла. Ей был 31 год.

Невольный вклад Генриетты Лакс в медицину неоценим: клетки, оставшиеся после ее смерти, уже более полувека спасают человеческие жизни.
Пока Генриетта лежала в госпитале Хопкинса, лечащий врач отправил полученные с помощью биопсии клетки опухоли на анализ Джорджу Гею — руководителю лаборатории исследования клеток тканей в госпитале Хопкинса. В то время культивирование клеток вне организма было только на стадии становления, и главной проблемой была неизбежная гибель клеток — после определенного количества делений вся клеточная линия погибала.


Так получилось, что Генриетта умерла именно в тот день, когда Джордж Гей выступал перед телевизионными камерами, держа в руках пробирку с ее клетками. Он заявил, что началась эпоха новых перспектив в поиске лекарств и медико-биологических исследованиях.
Четыре этапа эксперимента

Сегодня в молекулярной биологии и фармакологии, как правило, используют следующие стадии:
1.HeLa (или любая другая лабораторная клеточная линия).
2.Нетрансформированные короткоживущие клеточные линии — клетки кожи, клетки крови С ними работать в разы тяжелее, они быстро гибнут, однако если эксперимент отработан на HeLa, ученые знают что и где искать, и не тратят время на широкий поиск.
3.Модельные организмы — мыши, крысы, обезьяны. Тут уже эксперименты длятся месяцами, и стоят на порядки дороже. Однако это обязательный этап перед проверкой потенциальных лекарств или изучением причин человеческих болезней на людях.
4.Многостадийные клинические исследования на людях.
Почему ее клетки так важны?
И он был прав. Линия клеток, идентичная во всех лабораториях мира, позволила быстро получать и независимо подтверждать все новые и новые данные. Можно смело сказать, что гигантский прыжок молекулярной биологии в конце прошлого века был обусловлен возможностью культивировать клетки in vitro. Клетки Генриетты Лакс стали первыми бессмертными человеческими клетками, которые когда-либо были выращены на искусственной питательной среде. HeLa научили исследователей культивировать сотни других линий раковых клеток. И хотя в последние годы приоритет в этой области смещается в сторону культур клеток нормальных тканей и индуцированных плюрипотентных стволовых клеток (за открытие метода возвращения клеток взрослого организма в эмбриональное состояние японский ученый Синья Яманака получил Нобелевскую премию по физиологии и медицине 2012 года), тем не менее раковые клетки остаются общепринятым стандартом в медико-биологических исследованиях. Основное преимущество HeLa — неудержимый рост на простых питательных средах, что позволяет проводить масштабные исследования при минимуме затрат.

С момента смерти Генриетты Лакс клетки ее опухоли непрерывно использовались для исследования молекулярных закономерностей развития самых разных заболеваний, в том числе рака и СПИДа, для изучения воздействия радиации и токсичных веществ, составления генетических карт и огромного количества других научных задач. В мире биомедицины клетки HeLa стали столь же известны, как лабораторные крысы и чашки Петри. В декабре 1960 года клетки HeLa первыми полетели в космос в советском спутнике. Даже сегодня поражает размах экспериментов, проводившихся тогда советскими генетиками в космосе. Результаты показали, что HeLa хорошо себя чувствуют не только в земных условиях, но и в невесомости.
Без клеток линии HeLa стала бы невозможной разработка вакцины против полиомиелита, созданной Джонасом Солком. Кстати, Солк был настолько уверен в безопасности полученной вакцины (ослабленного вируса полиомиелита), что в доказательство надежности своего лекарства вколол вакцину себе, своей жене и троим детям.
С тех пор HeLa использовали и для клонирования (предварительные опыты по пересадке клеточных ядер перед клонированием знаменитой овцы Долли проводились на HeLa), для отработки методов искусственного оплодотворения и тысяч других исследований (некоторые из них приведены в таблице).
Hela использована как модель для изучения сальмонеллеза
На модели Hela доказано, что вирус папилломы может вызывать рак
На модели Hela показан механизм заражения клеток вирусом иммунодефицита человека
В клетках Hela открыт неизвестный ранее фермент теломераза
На модели Hela исследован механизм заражения туберкулезом
Клетки Hela используются для изучения потенциальных опасностей наноструктур
Секвенирование генома клеточной линии Hela
Помимо науки…
Личность самой Генриетты Лакс долгое время не афишировалась. Для доктора Гея, конечно, происхождение клеток HeLa не было тайной, но он полагал, что конфиденциальность в этом вопросе является приоритетом, и в течение многих лет семья Лакс не знала, что клетки Генриетты прославились на весь мир. Тайна раскрылась только после смерти доктора Гея в 1970 году.
Напомним, что стандарты стерильности и техники работы с клеточными линиями в то время только зарождались, и некоторые ошибки всплывали лишь спустя годы. Так и в случае с клетками HeLa — через 25 лет ученые выяснили, что множество используемых в исследованиях клеточных культур, происходящих из других типов тканей, включая клетки рака молочной и предстательной желез, оказались зараженными более агрессивными и живучими клетками HeLa. Оказалось, что HeLa могут перемещаться с частицами пыли в воздухе или на недостаточно тщательно вымытых руках и приживаться в культурах других клеток. Это вызвало большой скандал. В надежде решить проблему путем генотипирования (секвенирование — полное прочтение генома — в то время пока еще только планировалось как грандиозный международный проект), одна группа ученых разыскала родственников Генриетты и попросила образцы ДНК семьи, для того чтобы составить карту генов. Таким образом тайное и стало явным.

Кстати, американцы и сейчас переживают больше по поводу того, что семья Генриетты так и не получила компенсацию за использование клеток HeLa без согласия донора. По сей день семья живет в не очень-то хорошем достатке, и материальная помощь была бы очень кстати. Но все запросы упираются в глухую стену — ответчиков давно уж нет, а Медицинская академия и другие научные структуры предсказуемо не желают обсуждать эту тему.
11 марта 2013 года масла в огонь подлила новая публикация, где были представлены результаты полного сиквенса генома клеточной линии HeLa. Опять же, эксперимент был проведен без согласия потомков Генриетты, и после непродолжительных этических споров полный доступ к геномной информации был разрешен только для профессионалов. Тем не менее, полный геномный сиквенс HeLa имеет огромное значение для последующих работ, позволяя использовать клеточную линию в будущих геномных проектах.
Клеточные рекордсмены

Реальное бессмертие?

Тем не менее исследователи всегда помнят об ограничениях, которые необходимо иметь в виду. Во‑первых, HeLa, несмотря на все изменения, все еще остаются человеческими клетками: все их гены и биологические молекулы соответствуют человеческим, а молекулярные взаимодействия в подавляющем большинстве случаев идентичны биохимическим путям здоровых клеток. Во‑вторых, полиплоидия делает эту линию более удобной для геномных исследований, так как количество генетического материала в одной клетке увеличено, и результаты получаются более четкими и контрастными. В-третьих, широкое распространение клеточных линий по миру позволяет без проблем повторять опыты коллег и использовать опубликованные данные как фундамент для собственных исследований. Установив основные факты на модели HeLa (а все помнят, что это хоть удобная, но только модель организма), ученые пытаются повторить их на более адекватных модельных системах. Как видно, HeLa и подобные им клетки представляют собой фундамент для всей науки и сегодня. И, несмотря на этические и моральные споры, сегодня хочется почтить память этой женщины, поскольку ее невольный вклад в медицину неоценим: клетки, оставшиеся после нее, спасли и продолжают спасать больше жизней, чем это может сделать любой врач.
Прочитал книжку про историю возникновения бессмертной линии клеток человека известную под обозначением ХиЛа (от имени пациентки Генриеты Лакс).
Вкратце суть такова. В пятидесятых годах молодая негритянка умерла от рака шейки матки, произошло это в госпитале Джона Хопкинса (г. Балтимор в штате Мериленд). В то же самое время в больнице усердно трудился учёный Джордж Гай, пытаясь вот уже тридцать лет вывести раковые клетки, которые просто и удобно было бы выращивать в лабораторных условиях. Клетки эти предполагалось использовать в исследованиях для лучшего понимания процесса развития рака и выявлению методов лечения недуга. Предыдущие начинания учёного по данному направлению не увенчивались успехом -- собранные клетки довольно быстро погибали или же демонстрировали едва заметный рост. Клетки опухоли Генриеты же напротив оказались натурально "бессмертными" -- они были неприхотливы, росли и размножались в пробирке с бешеной скоростью. Гай, убедившись в значимости своего достижения, бескорыстно разослал образцы клеток другим исследователям по всему миру. В итоге клеточная линия ХиЛа помогла свершить кучу научных открытий (вакцина против полиомиелита, разработка препаратов для химиотерапии, генетические исследования, работы по клонированию, оплодотворение в пробирке и т.д. и т.д.).
Любопытно, что в настоящее время миллиарды клеток давно умершей Генриеты активно растут или же законсервированы в лабораториях разбросанных по земному шару. Если собрать все когда-либо жившие клетки ХиЛа и скинуть их в одну гигантскую кучу, то полученная гора будет весить 50 миллионов тонн. ХиЛу запускали в космос на орбитальную станцию и наблюдали, как отсутствие гравитации и космическое излучение влияет на человеческие клетки. Во время Холодной войны бессмертные клетки также облучали огромными дозами радиации для лучшего понимания воздействия ядерного оружия на человеческие ткани. Сложно представить, что только с ними не делали и какими только ядами на них не воздействовали.
Интересно, что клетки ХиЛа незаметно умудрились заразить и коварно вытеснить многие образцы других клеточных культур т.н. тканевых банков. Т.е. учёный бьётся и выращивает определённый вид клеток, но в образец посредством воздуха или же с инструментами скрытно попадает небольшое количество клеток ХиЛа, они-то со временем и вытесняют желаемую линию клеток без ведома ничего не подозревающего исследователя.
В книжке также описаны некоторые весьма противоречивые истории медицинских исследований. Выяснил, как в тридцатых годах в институте города Таскиги (штат Алабама) учёные с помощью бедного негритянского населения изучали стадии болезни и смерть от сифилиса. В обмен на еду, бесплатные медосмотры, такси до больницы и стипендию на похороны велось наблюдение за сотнями пациентов до самого момента их смерти от болезни. Удивительно, но эксперимент продолжался даже во времена доступности антибактериальных препаратов (пенициллина).
Ещё случай из истории. В начале пятидесятых учёный по имени Честер Саусэм в ходе изучения иммунной системы вводил своим онкологическим пациентам без их ведома миллионы злокачественных клеток ХиЛа и наблюдал за происходящим. Позже он набрал 150 добровольцев среди заключённых тюрем штата Огайо и проделал с ними то же самое. Организмы испытуемых добровольцев оказывались вполне способны противодействовать введённым раковым клеткам в отличие от больных с ослабленной иммунной системой, у некоторых из которых развились метастазы.
Любопытно было прочитать про отдельные былые диагностические процедуры, а в особенности про т.н. пневмоэнцефалографию. У пациента в своде черепа проделывается отверстие, через которое высасывается мозговая жидкость, а внутрь закачивается воздух или гелий -- подобные методы позволяют получить чёткие рентгенографические снимки головного мозга и желудочков.
В книжке познавательно написано про этические вопросы связанные с исследованиями человеческих тканей, про ограничения в возможности патентовать людьми собственные ткани. Одному учёному по фамилии Чакрабарти из компании Дженерал Электрик довелось создать бактерию, способную поглощать нефть. Бактерия эта оказалась чрезвычайно полезной в деле устранения последствий разливов нефти. Сперва компании не удалось запатентовать свою разработку -- суд решил, что живой организм не может быть рассмотрен в качестве изобретения и, стало быть, запатентован. Но вёрткие юристы сумели-таки обжаловать решение и в итоге получить патент на том основании, что разработанная бактерия не встречается в "дикой" природе и была выведена исключительно в лаборатории. Этот случай и положил начало возможности регистрировать патенты на генетически модифицированные организмы и линии клеток. Но, к сожалению, многочисленные родственники Генриеты Лакс кроме головной боли не получили никакой выгоды от клеточной линии ХиЛа, которая помогла миллионам людей.
Продолжаю работу по постепенному расширению своего кругозора.
- Чем раковые клетки отличаются от нормальных?
- Каковы причины появления раковых клеток?
- Какие бывают типы генов рака?
- Основные характеристики и строение раковых клеток
- Как выглядят раковые клетки под микроскопом?
- Как развиваются раковые клетки, какие этапы проходят в своем развитии?
- Ликвидация раковых клеток: что помогает их уничтожить?

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
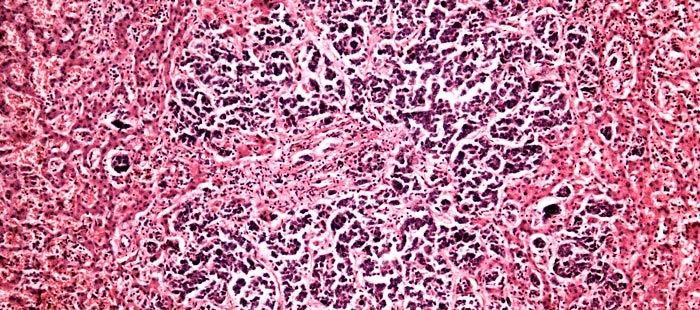
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Всего 15% больных раком поджелудочной железы спустя два года после постановки диагноза еще живы — а вот Маргарет Шварцханс протянула уже два с половиной года; да нет, не протянула — а с удовольствием прожила!
Невозможно сказать, почему ее посетила такая удача, отчасти, возможно, благодаря устойчивой психике. Маргарет недавно исполнилось 54 года, она каждый день подолгу медитирует, занимается йогой несколько раз в неделю и много гуляет. Она бывшая медсестра, и это тоже кое-что значит; она облепила дом и машину бумажками с разными вдохновляющими цитатками, она много и с радостью рисует.
Да, и еще у нее одна из дочерей — повар, готовит ей.
Это важная часть ее терапии. В хорошие дни она просто забывает, что у нее рак.
Шварцханс участвует в клиническом испытании — которое сначала не предполагало, что удачные результаты будут применены прямо на больных, но затем исследователи решили, что для тех из них, кто потерял надежду вылечиться конвенциональными препаратами, не будет чрезмерным риском воспользоваться экспериментальным лечением.
Доктор Джозеф Гроссман, руководитель программы HOPE (Harnessing Organoids for Personalized Therapy; использование органоидов для персонализированной терапии), привлек к эксперименту 12 пациентов. Предварительные результаты, а также многолетние эксперименты на мышах показывают, что поведение злокачественных органоидов в чашках Петри можно считать предиктивным для воздействия того или иного препарата на человека, точнее, на его опухоль.
Гроссман, правда, настойчиво повторяет, что его данные пока не подтверждены, не опубликованы и даже не рецензированы, так что к ним нужно относиться с большим сомнением.
Но если отвлечься от небезосновательно осторожных слов Гроссмана, нельзя не предположить, что эксперимент с органоидами в пробирках — гигантский шаг вперед в подборе лечения для самых разных раковых больных. В том числе и для больных раком поджелудочной железы, одного из самых плохо поддающихся лечению видов рака. Панкреатические опухоли плохо идут даже на таргетной терапии, замечает Деннис Пленкер, один из участников исследования,— в том числе потому, что вариантов очень немного. Но, продолжает он, и органоиды как предиктивное средство пока не так надежны, как хотелось бы. В частности, невозможно извлечь у пациента образец, в котором будут только злокачественные клетки, их там максимум 30%, а то и вообще непонятно сколько. И тогда воздействие препарата на органоид может быть обмачиво хорошим или обманчиво бессмысленным, сетует Пленкер. Кроме того, меняется с течением времени и сама опухоль, и то вещество, что еще недавно гарантированно убивало ее клетки, перестает помогать.
Шварцханс была обычной раковой больной, и в какой-то момент протокол настолько лишил ее сил – ужасная слабость, рвота, понос, судороги в руках и ногах, а то нечувствительность,— что она решила сделать перерыв. Тут-то и возник доктор Гроссман, к которому ее направили ее лечащие врачи за вторым мнением. Он взял биоптат из ее лимфатических узлов и с ее согласия включил ее в эксперимент.
По его результатам она стала получать новую комбинацию из двух препаратов, и первое время дело пошло на лад. Однако спустя краткое время онкомаркеры снова пошли вверх. И Гроссман вернул ее на обычный протокол, но исключил из него один препарат, на который ее злокачественные органоиды в чашках Петри никак не реагировали.
Это опять помогло ненадолго.
Тогда — после очередного цикла проб на органоидах — Гроссман назначил ей третий вариант протокола. И вот уже девять месяцев у нее минимальные побочные эффекты, а опухоль перестала прогрессировать.
И сама Шварцханс, и Гроссман говорят, что это может быть просто удача, в конце концов примерно 4% больных раком поджелудочной железы живут столько, сколько она. Но может быть, сочетание генетического секвенирования, необходимого для таргетной терапии, и метода органоидов дало, наконец, ей то сочетание препаратов, которое не даст развиваться ее опухоли. Чувствует же она себя, наконец, неплохо.
По материалам статьи Growing tumors in a dish, scientists try to personalize pancreatic cancer treatment в журнале Stat, октябрь 2019 г.
Читайте также:

