Рак желудка метастазы в брюшину сколько живут
Выявленный у пациента рак желудка 4 степени с метастазами означает, что опухолевое образование достигло окончательного этапа своего развития. Чаще на этой стадии диагноз уже известен и лечение не смогло предотвратить прогрессирование заболевания. Но следует понимать, что четвертая стадия не означает мгновенную смерть больного, а при использовании адекватной терапии можно продлить его жизнь. Но вылечить недуг желудка на этом этапе уже невозможно.

Причины возникновения
Нет конкретного объяснения, почему нормальные клетки слизистой оболочки желудка начинают патологически делиться. Выделяют факторы риска, повышающие шансы развития этой патологии:
- генетическая предрасположенность;
- нерациональное питание;
- злоупотребление алкоголем;
- контакт с канцерогенами;
- хроническая язва желудка;
- радиоактивное облучение;
- гастрит с метаплазией.
Наличие в анамнезе нескольких факторов значительно повышает риск возникновения рака.
Симптомы проявлений
Последняя стадия рака желудка с метастазами проявляется очень агрессивно, что значительно нарушает качество жизни пациента. Местные признаки включают частые приступы тошноты, рвоты, сильных болей в животе. Прием пищи составляет проблему для больного, поскольку параллельно возникают такие симптомы, как дискомфорт, отрыжка, метеоризм, нарушение пищеварения и испражнений.
Метастазы в лимфатических узлах проявляются увеличением последних в размерах, болезненностью, отечностью в месте поражений. Распространение раковых клеток в печень ведет к нарушению обмена веществ, недостатку микроэлементов и витаминов, грозит асцитом, желтухой и венозной недостаточностью. Метастазы также выявляются в селезенке, головном мозге, костях, что определяет соответственную симптоматику этих органов.
Онкология на 4 степени всегда сопровождается нарушением общего состояния. Симптомы включают слабость, недомогание, потерю аппетита и резкое снижение массы тела. Периодически повышается температура тела до субфебрильных показателей, как реакция на интоксикацию организма продуктами обмена опухоли. А также развивается депрессия, апатия, нестабильность настроения.
Диагностика
При объективном осмотре больного выявляется бледность кожи, увеличение лимфатических узлов, налет на языке, неприятный запах изо рта. Если рак достиг значительных размеров, его можно прощупать при поверхностной пальпации живота. Лабораторные методы включают:

Для подтверждения диагноза проводят забор крови, в которой ищут отклонения от нормы уровня эритроцитов, наличие патологического белка и т.д.
- Общий анализ крови. Указывает на снижение уровня эритроцитов и гемоглобина, повышение СОЭ.
- Биохимическое исследование. Определяется гипопротеинемия, высокий С-реактивный белок, патологические нарушения печеночных проб.
- Копрограмма. Представляет собой анализ кала, указывающий на нарушение процесса пищеварения, наличие в испражнениях слизи, крови, вторичных элементов.
- Анализ крови на онкомаркеры. На 4 стадии рака желудка патологические белки, что образовываются вследствие обмена веществ опухоли, значительно отклоняются от нормы.
- Фиброгастроскопия — эндоскопическое исследование желудка, с помощью которого можно визуально осмотреть пораженный участок, выявить тип роста новообразования, отношение к соседним структурам.
- Биопсия. Выполняется при проведении фиброгастроскопии. С помощью специального приспособления, из ракового очага берется часть тканей для дальнейшего гистологического и цитологического исследования. Это обязательно для выявления типа пораженных клеток, степени их злокачественности, роста и размножения.
- КТ и МРТ — методы обследования, послойно изучающие злокачественный очаг и участки метастазов. Эти диагностические процедуры дают сведения о физических характеристиках новообразования, особенностей его кровоснабжения и распространения.
- УЗИ органов брюшной полости, забрюшинного пространства и лимфатических узлов. Выполняется для определения метастазов.
Особенности лечения
Лечение рака желудка на 4 степени требует оперативного метода терапии только за показаниями. Операции неспособны избавить пациента от этой патологии, а только улучшить состояние. Выполняются паллиативные вмешательства при значительном болевом синдроме, не реагирующем на консервативное лечение. Удаляют часть опухоли, чтобы уменьшить влияние раковых клеток на организм. А также прибегают к выведению гастростомы при тотальном поражении желудка и распространении метастазов.
Лечить рак желудка 4 стадии с помощью химиотерапии необходимо сразу после выявления новообразования. Цитостатические средства способствуют предотвращению дальнейшего распространения метастазов по организму, уменьшению опухоли в размерах и облегчению симптоматики. Пациент лечится химиопрепаратами длительный период, что изнуряет организм, поэтому назначают витаминные средства, иммуностимуляторы, микроэлементы, минералы и дезинтоксикационные медикаменты.
Сколько живут и прогноз
Продолжительность жизни зависит от многих факторов, таких как: количество патогенных очагов, размеры опухоли, локализация метастазов и их характеристики. При адекватной терапии рак 4 степени незначительно влияет на жизнь. Но больные умирают не от новообразования, а от тех осложнений перед смертью, которые оно вызывает, это кишечная непроходимость, острая печеночная или дыхательная недостаточность. Сроки их развития зависят от диагностических мероприятий и правильного лечения.
Пятилетняя выживаемость при раке желудка 4 стадии составляет 20%. В зарубежных странах прогноз равен 40% жизни на протяжении 5 лет, поскольку они применяют более агрессивные и высокотехнологические методы терапии. В каждом конкретном случае нельзя сказать, сколько осталось времени. Люди живут с раком длительный период, если применяют все необходимые методы лечения.
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
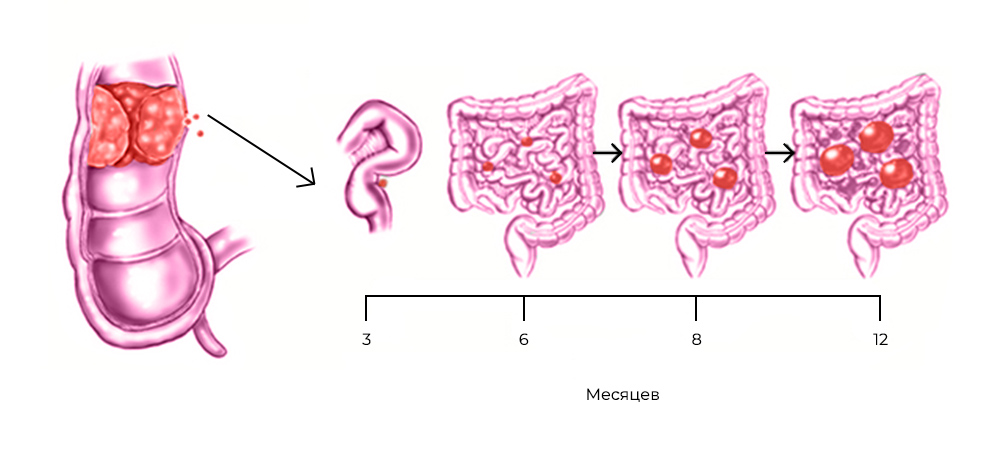
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
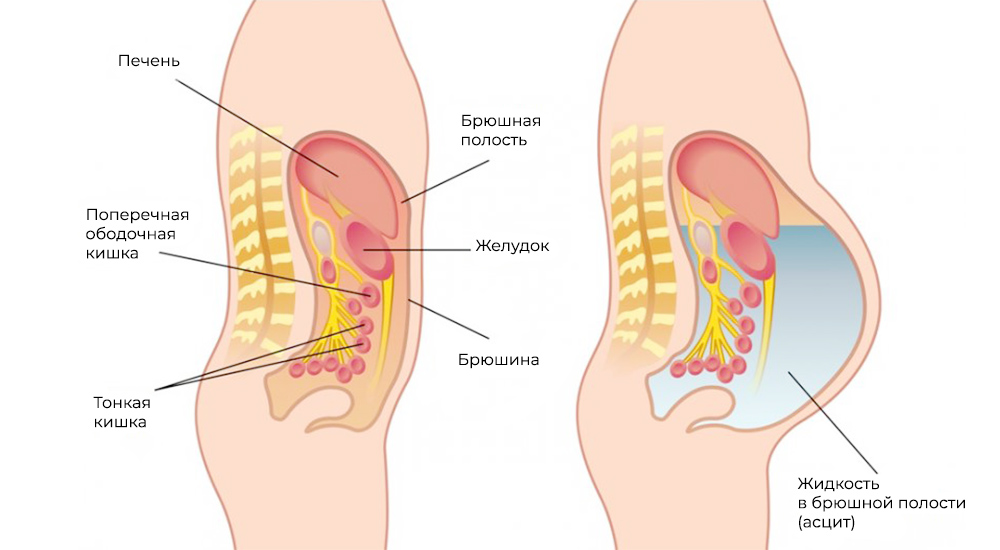
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
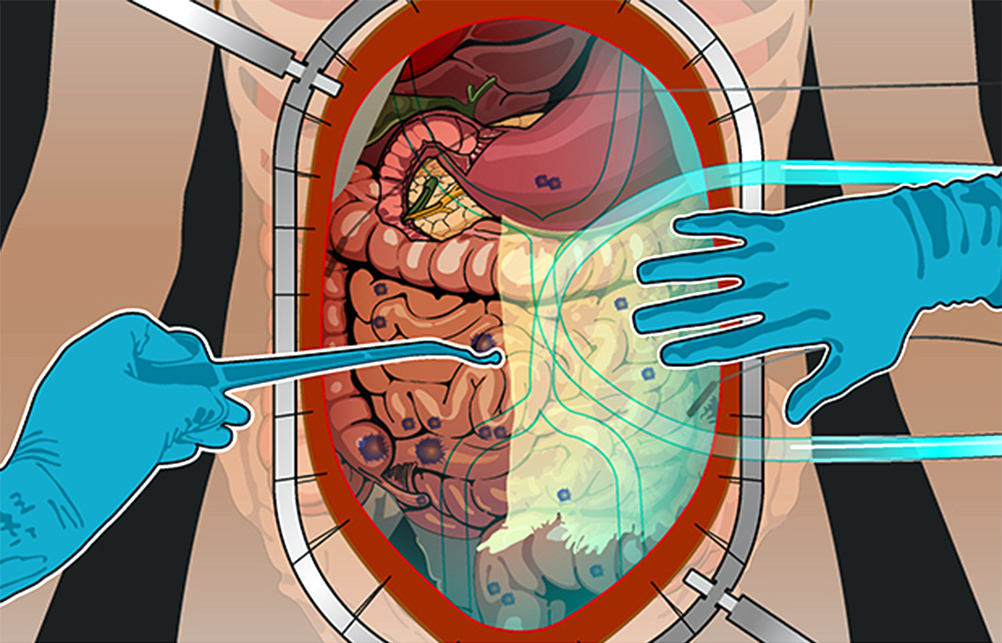
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
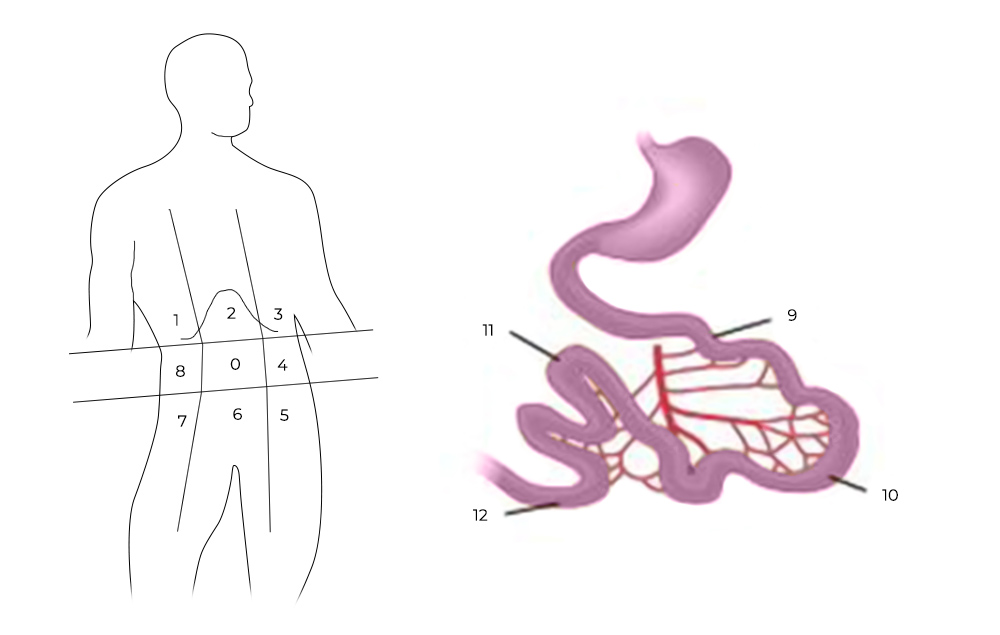
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
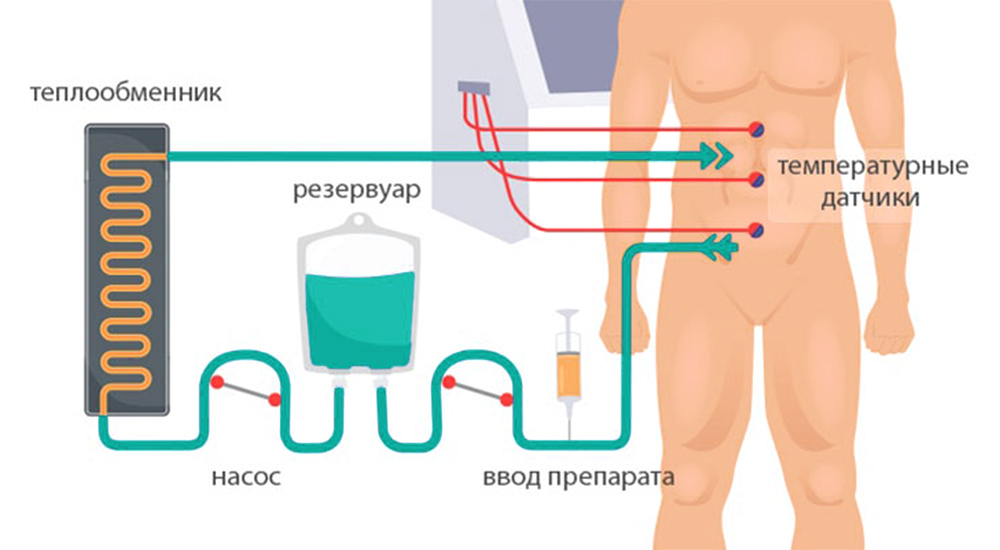
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.

Метастазы в брюшине могут развиться при всех злокачественных процессах, но при раке яичников и желудка — это типичная и самая частая локализация. В большинстве случаев метастазирование в брюшной полости отсекает возможность радикального хирургического лечения, только больные раком яичников находятся в выигрышном положении — их активно и результативно оперируют.
- Механизм формирования метастазов
- Пути распространения метастазов
- Способы диагностики метастазов
- Какой рак может дать метастазы в брюшину?
- Симптомы возникновения метастаз в брюшине
- Что делать, если пошли метастазы в брюшной полости?
- Лечение метастаз в брюшине
- Прогноз при метастазах в брюшине
Механизм формирования метастазов
Механизм образования метастазов — одна из основополагающих характеристик злокачественного процесса. Метастатический узел образуется из одной злокачественной клетки, получившей способность жить без помощи материнской опухоли и выживать на удалении от неё. К путешествию по организму злокачественную клетку понуждают образующиеся в ней и в её окружении специфические белковые комплексы — факторы роста опухоли.
В кровеносном и лимфатическом русле больного раком циркулирует огромное число злокачественных клеток, 99.9% которых погибает. Мизерное число злокачественных клеток находит приют в небольших сосудах разных органов, образуя там фиксированный раковый эмбол. По какому-то сигналу начинается размножение раковых клеток, образующих микроскопическое злокачественное сообщество, разъедающее стенку сосуда своими ферментами. Дальше клеточная группа внедряется в здоровую ткань, чтобы сначала стать микрометастазом, а после и клинически определяемым метастатическим узлом.
Пути распространения метастазов
Серозные листки организма, к которым относятся брюшина, плевра и сердечная сумка — перикард восприимчивы к опухолевым клеткам, которые попадают на них несколькими путями:
- в разветвленную сеть кровеносных сосудов внутренних органов раковые эмболы приносятся с кровотоком — гематогенное метастазирование;
- лимфатическая сеть брюшины вырабатывает влагу для исключения трения внутренних органов при дыхательных движениях, создавая отличные условия для приживления заносимых лимфой злокачественные клеток — лимфогенное метастазирование;
- лимфогематогенный путь предполагает сочетанное действие двух описанных патогенетических механизмов;
- клетки отрываются от ракового конгломерата внутреннего органа и путешествуют вместе с внутрибрюшной жидкостью, контактно внедряясь в подходящий по условиям участок серозной оболочки — это имплантационный вид распространения.
В большинстве случаев действуют все механизмы метастазирования.
Способы диагностики метастазов
Диагностика зависит от анатомической области:
- метастатические образования в коже и мягких тканях определяются на ощупь — при пальпации, их границы хорошо видны при УЗИ;
- в легких метастазы находят при рентгене, КТ и МРТ, также и в костях, но совсем крошечные очаги обнаруживают только при сцинтиграфии;
- в органах брюшной полости метастазы обнаружат УЗИ, КТ и МРТ, в желудочно-кишечном тракте большую пользу приносят эндоскопические методы обследования;
- очаговые метастатические образования в головном мозге выявляет МРТ и КТ;
- в любом месте опухолевый очаг найдет изотопное исследование — ПЭТ.
Какой рак может дать метастазы в брюшину?
Любой рак может осложниться метастазами в брюшину, но самый высокий процент отмечается при карциномах яичников, желудка, толстой кишки и поджелудочной железы.
Уже на 1-2 стадиях карциномы яичников в брюшной полости находят свободно циркулирующие раковые клетки, при 3 стадии на листках брюшины развиваются видимые метастазы разных размеров.
При карциномах всех других органов метастазы переводят процесс в неоперабельный и констатируется 4 стадия, радикальное лечение невозможно, но при случае и с пользой для пациента может выполнятся циторедукция — удаление всех видимых опухолевых образований.
Симптомы возникновения метастаз в брюшине
Клинические проявления внутрибрюшинного метастазирования часто протекают скрытно — где-то кольнуло, что-то потянуло, какая-то непонятная слабость. Симптомы появляются при значительном увеличении живота в размере за счёт образования в полости избыточного количества жидкости — асцита. Опухолевые узлы на листках брюшины находят только при УЗИ, КТ или МРТ.
Нередко прогрессирующее опухолевое поражение брюшины так и остается бессимптомным, на первый план выходят признаки накопления внутрибрюшной жидкости и вызываемые асцитом симптомы сердечно-легочной недостаточности: одышка, отеки нижней половины тела, застой в легких, кашель, нарушение сердечной деятельности, слабость. Болевой синдром, как правило, очень слабый.
Что делать, если пошли метастазы в брюшной полости?
При раке яичников с сохраненной подвижностью опухолевого конгломерата в малом тазу обязательно предложат циторедуктивную операцию, при которой убирается всё опухолевое, что можно удалить, и метастатические узелки буквально срезаются с брюшины. Цель циторедукции — удалить всю злокачественную ткань по максимуму, узелки меньше сантиметра эффективно уничтожаются лекарствами. Далее больной предстоит длительная химиотерапия с производными платины и таксанами.
При других нозологических формах рака метастазирование отрезает путь к радикальной операции, только паллиативные вмешательства по поводу осложнений и создания обходящих опухоль путей для беспрепятственного движения пищевых или каловых масс, больному предстоит системная и локальная — внутрь брюшной полости химиотерапия.
Лечение метастаз в брюшине
Системная химиотерапия помогает при чувствительных к цитостатикам злокачественных процессах: раке молочной железы, лимфомах. Карциномы органов желудочно-кишечного тракта неактивно отзываются на лекарственное лечение, но нельзя не использовать возможность их уменьшения, особенно при агрессивных быстро прогрессирующих процессах.
При раке желудка предлагается 18 недель химиотерапии, при опухоли толстой кишки — не менее 4 месяцев, при панкреатической карциноме — до прогрессирования заболевания. Схема определяется состоянием пациента, тяжелым больным проводится симптоматическое лечение при необходимости с эвакуацией асцита.
Повысить противоопухолевый эффект химиотерапии удается при локальном введении цитостатика — внутрибрюшинно. При необходимости частых введений цитостатика внутрь полости устанавливается порт-система, исключающая тягостные симптомы классического лапароцентеза. Сложности неизбежны, поскольку постоянная выработка асцитической жидкости снижает концентрацию химиопрепарата, а тяжесть состояния ограничивает спектр цитостатиков.
Прогноз при метастазах в брюшине
Прогноз определяется чувствительностью злокачественных клеток к лекарствам, но в любом случае метастазирование по брюшине относится к самым неблагоприятным, исключая рак яичников. При карциномах кишки, когда удаётся провести паллиативную операцию и максимально удалить метастатические новообразования, трёхлетняя выживаемость приближается к 20%, 2 года переживает только каждый третий. Проведение химиотерапии улучшает выживаемость, но она хуже, чем при метастазах другой локализации.
В нашей клинике никогда не отступают перед раком, предлагая пациенту оптимальные и все известные онкологии методики противоопухолевого воздействия. Мы не ограничиваемся одним оружием, используя комбинацию лекарств, паллиативных вмешательств и неинвазивных методик. Наша цель — сохранить и улучшить жизнь наших пациентов, и нам это удается.
Рак желудка 4 стадии в онкологии рассматривается как терминальный этап заболевания, характеризующийся местным распространением первичной опухоли, экспансией злокачественных клеток и образованием метастатических очагов в удаленных органах и тканях.
Какие факторы указывают на наличие последней стадии рака желудка? Стадия 4 диагностируется, когда определяется поражение метастазами отдаленных органов (печень, легких, костей, мозга).
Инструментальная диагностика:
- эндоскопическое исследование — ФГДС (позволяет оценить месторасположение опухоли, степень стеноза (сужения) желудка, взять материал для гистологического исследования — биопсия);
- рентгенография;
- магнитно-резонансная томография, фиксирующая распространение опухоли на соседние органы, локализацию (расположение) отдалённых метастазов;
- диагностическая лапароскопия — операция, выявляющая диссеминацию раковых очагов по брюшине;
- гистологическое исследование структуры биоптата (ткани, взятой из пораженного раком участка) на присутствие атипичных злокачественных клеток.
Симптомы
Последняя стадия рака желудка отличается следующими клиническими признаками:
1. Усиливаются все общие симптомы, характерные для предыдущей стадии. При этом наблюдаются:
- усугубление отрыжки, изжоги, тяжести;
- интенсивное снижение веса и развитие истощения;
- лихорадочное состояние, выраженная слабость;
- появление боли высокой степени интенсивности в области желудка, внизу живота, с иррадиацией в крестец, поясницу, промежность, что связано с поражением нервных волокон и воспалительным процессом в соседних органах.

2. Кроме этого, появляются:
- частые приступы рвоты, с примесью крови, кал темного цвета, дегтеобразной консистенции (при распаде опухоли, желудочном кровотечении);
- постоянная рвота, характерная для непроходимости желудка;
- отравление организма токсинами раковой опухоли;
- увеличение живота — при злокачественной опухоли желудка 4 стадии связано с метастазами в поджелудочную железу, печень, брюшину (оболочку, покрывающую внутренние органы брюшной полости) и накоплением асцита (жидкости) в брюшной полости;
пожелтение кожи и склер глаз при метастазах в печень; - нередко можно пропальпировать (прощупать) увеличенные лимфатические узлы в левой надключичной области, левой подмышечной области.
Лечение
Лечение рака желудка 4 стадии проводится в рамках паллиативного и симптоматического лечения, которое не излечивает саму патологию, но останавливает агрессию болезни, максимально облегчая состояние пациента.
На 4 стадии рака желудка основная задача хирургов – провести вмешательства, облегчающие состояние больного и, если это в их силах, — продлить ему жизнь. Задачи, которые решаются посредством операций:
Учитывая состояние пациентов на 4 стадии рака желудка, операции назначают только, если отсутствуют симптомы тяжелого истощения (кахексии), а онкологический процесс не захватил ткань брюшины.
Проведение химиотерапии позволяет стабилизировать состояние 50% больных. В сочетании с лучевой терапией получают более выраженный результат. Но комбинированная химиолучевая терапия возможна, только если пациент не истощен, или это приведет к угрожающей жизни полиорганной недостаточности (снижение функции органов).
Как правило, применяют различные комбинации противоопухолевых препаратов на основе 5-фторурацила, кселоды, оксалиплатина, лейковорина (FOLFOX, XELOX, CF, CX).
Если при иммуногистохимическом исследовании опухолевой ткани желудка определяется наличие HER2 – рецепторов, применяют трастузумаб.
Подбор схемы лечения индивидуален и выполняется врачом – химиотерапевтом.
Симптоматическая терапия
Средства, используемые в разрезе симптоматического лечения, назначают для предупреждения и облегчения симптомов ракового заболевания и вызванных им осложнений. Кроме того, устранение мучительных для больного проявлений, значительно увеличивает качество жизни.
При онкологии 4 стадии обезболивание — базовая часть терапии, поскольку интенсивность болевого синдрома на данном этапе наиболее выражена.
- применять анальгезирующие средства следует сразу, не дожидаясь нарастания болей;
- подбор наилучшего препарата или комбинации нескольких проводят с учетом особенностей ракового процесса и состояния больного;
- препараты назначают по степени усиления анальгезирующего эффекта — от максимальной дозы умеренного болеутоляющего средства к минимальной дозе более сильного.
Как правило, назначаются нестеройдные противовоспалительные препараты при умеренно выраженном болевом синдроме; при сильных болях назначаются анальгетики наркотического ряда.
Среди специальных методов обезболивания при возможности применяют:
Применяют следующие группы препаратов:
- серотонинергические (ондансетрон, метоклопрамид)
- дофаминергические (метоклопрамид)
- антигистаминные (циклизин, прометазин)
- антихолинергические препараты
При неэффективности лечения одним препаратом, подбираются индивидуальные комбинации.
Учитывая крайнюю степень истощения больных при раке желудка 4 стадии, применяют различимые высококалорийные энтеральные (через рот) и парентеральные (внутривенные) питательные смеси. В ряде случаев они могут длительное время поддерживать стабильное состояние больного даже при полном отсутствии возможности обычного питания.
Организм больного на данном этапе находится в критически истощённом состоянии, иммунная система крайне ослаблена. Поэтому с целью предотвращения или лечения инфекционных осложнений назначаются антибактериальные препараты. Подбор антибиотиков выполняет врач с учётом локализации инфекционного процесса, вида инфекционного агента, выделительной функции печени и почек больного.
При метастатическом поражении печени и брюшины у больных часто скапливается жидкость в брюшной полости. Для лечения данного осложнения применяют медикаментозную терапию диуретики и выполняют лапароцентез (прокол передней брюшной стенки) для выведения жидкости.
Желтуха формируется при массивном поражении печени метастазами, что, в свою очередь, приводит к нарушению выделения желчи. Больной при таком состоянии отмечает иктеричность (пожелтение) кожного покрова, склер; моча становится интенсивно окрашенной, а кал бесцветный; появляется интенсивный кожный зуд. Это состояние является жизнеугрожающим и без коррекции быстро приводит к летальному исходу. Консервативное лечение заключается в назначении инфузионной терапии в сочетании с диуретиками; противогистаминных препаратов, антибиотиков, гепатопротекторов (препаратов, защищающих ткань печени). Хирургическое лечение, чаще всего, проводится рентген — хирургами, которые выполняют прокол кожи и в желчные протоки печени вводят дренаж (трубку), для того, чтобы желчь оттекала наружу.
Прогноз
Увеличение продолжительности и улучшение качества жизни пациентов с диагнозом рак желудка четвёртой стадии является основным и приоритетным направлением работы врачей. Определяющая роль в этом непростом процессе отводится ближайшему окружению больного: родственникам, друзьям.

На продолжительность жизни больного после операции или в случае нерезектабельной опухоли влияет целый комплекс факторов, среди которых:
- вид рака желудка: экзофитная форма, при которой раковый узел ограничен по площади распространения, благоприятен для долговременного прогноза, инфильтративный тип опухоли – более агрессивен и дает меньший процент выживаемости;
возраст пациента и сопротивляемость иммунной системы; - степень истощения организма, психологическое состояние;
- правильная диагностика и грамотно разработанная программа терапии;
- распространенность метастатических очагов – один из ведущих факторов, влияющих на длительность жизни. Чем меньше объем тканей и органов, в которых сформировались метастазы, тем дольше будет жить пациент.
Сегодня при правильном лечении, наличии необходимых препаратов, соблюдении рекомендаций врача в течение 5 лет после диагностики рака 4 степени продолжают жить до 10% пациентов.
В заключение нужно сказать, что самым важном фактором, который даёт больному человеку надежду, силы — это его близкие люди. Пациент с терминальной стадией не должен быть одиноким и чувствовать себя брошенным. Каждый его день должен быть наполнен участием и небезразличным отношением близких. Только в таком случае, он будет знать ради чего борется и живёт.
Читайте также:

