Рак верхней трети трахеи с врастанием в пищевод
Рак пищевода 4 стадии диагностируется у каждого третьего больного, самое активное лечение оставляет этим пациентам немного шансов на долгую жизнь. Особенность пищеводной карциномы — высока агрессивность при запоздалом выявлении.
- Рак пищевода
- Причины развития опухоли
- Классификация и стадии
- Особенности рака пищевода на 4 стадии
- Симптомы
- Диагностика
- Лечение
- Прогноз
Рак пищевода
На рак пищевода среди всех злокачественных болезней приходится едва ли 3%, заболевает им 9-10 человек из 100 тысяч. В последнее десятилетие частота рака пищевода практически не увеличивается, но и не уменьшается. Опухоль, как правило, развивается у 65-летних мужчин, у женщин на 4 года позже. Это преимущественно мужская патология — женщины болеют в 3.5 раза реже, поскольку ведущая причина развития рака — небрежение собственным здоровьем.
Причины развития опухоли
Доказана связь злокачественных процессов в слизистой оболочке пищевода с постоянным раздражающим действием горячей пищи или токсичных продуктов, к примеру, жевательных наркотиков — наса или бетеля. На пищеводном здоровье отражаются курение и алкоголь, под их влиянием поддерживается хроническое воспаление слизистой с усиленной пролиферацией и развитием дисплазии.
Высока вероятность злокачественного новообразования при частой сегодня ГЭРБ из-за грыжи пищеводного отверстия диафрагмы. симптом которой — заброс содержимого желудка в пищевод. Недостаточность замыкания пищеводно-желудочного мышечного жома приводит к постоянному забросу едкого из-за соляной кислоты желудочного содержимого и хроническому воспалению — эзофагиту с переходом через стадию дисплазии в рак.
Вероятность рака возрастает в 30 раз при смещении слизистой желудка в нижний пищеводный отдел, что именуется пищеводом Барретта и считается предраковым процессом.
Классификация и стадии
Самый частый морфологический вариант опухоли пищевода — плоскоклеточный рак, железистый или аденокарцинома встречается только в 3-5% случаев, другие клеточные варианты крайне редки.
Анатомически пищевод подразделяется на два отдела: шейный и грудной, последний дополнительно делят на верхний, средний и нижний. По частоте развития рака лидирует зона перехода пищевода в желудок — там формируется почти половина всех новообразований, в средней части — чуть больше трети карцином, остальное — в шейном отделе.
Разделение по стадиям рака следующее:

Особенности рака пищевода на 4 стадии
Рак пищевода 4 стадии проявляется обширным опухолевым поражением пищевода и соседних органов при небольшом числе метастазов в других органах.
Злокачественный процесс в пищеводе распространяется поэтапно. Первоначально раковая опухоль разрастается по пищеводным стенкам, сужая просвет, затем проникает в средостение и вовлекает его органы. Далее присоединяется распространение по лимфатическим сосудам, довольно поздно клетки разносятся кровью, поэтому отдаленные метастазы находят, как правило, при существенном поражении органа и вовлечении соседних структур средостения. Отдаленные метастазы чаще появляются в печени, редко в легочной ткани, костях и мозге.
Симптомы
На ранней стадии рака симптомов практически нет, первые признаки болезни появляются при существенном сужении пищеводной трубки. Часто на симптом сужения — дисфагию не обращают внимания, проталкивая застревающие кусочки еды большим количеством жидкости. Трудности с прохождением пищи тянутся несколько месяцев, пациент ограничивает себя в еде и худеет. Дисфагии сопутствует обильная выработка слюны, позже присоединяется гнилостный запах изо рта из-за застоя пищи над сужением и рвота только что съеденным. Проходимость может улучшиться при распаде опухоли, сузившей просвет.
Прорастание в трахею проявится кашлем с мокротой, содержащей частички пищи. На этом этапе присоединяется высокая температура и симптомы воспаления бронхолегочной системы.
Диагностика
- Первое исследование — эндоскопия пищевода (ЭГДС) с биопсией опухоли.
- Эндо-УЗИ (эндосонография) позволит определить степень поражения пищеводной стенки и расположенных рядом органов и лимфатических узлов.
- Рентген пищевода с барием выявит свищи в трахею.
- КТ грудной полости покажет локализацию метастазов в лимфоузлах и вовлечение в конгломерат соседних структур.
- КТ брюшной полости поможет найти метастазы.
- Бронхоскопия показана при подозрении на вовлечении в опухолевый процесс трахеи и бронхов, во время исследования можно пропунктировать подозрительные на рак лимфоузлы.
- При любых сомнениях в распространенности заболевания необходима МРТ. Вся визуализация обязательно выполняется с контрастом.

Лечение
Без хирургии нет радикального лечения, дефект пищевода замещается отрезком толстой кишки или созданной из желудка трубкой, при метастазах в лимфоузлы до или после проводится химиотерапия.
При невозможности операции единственный выход — облучение с химиотерапией.
При 4 стадии основной метод воздействия — химиотерапия. При выраженной дисфагии до химиотерапии стентом или лазером восстанавливают проходимость пищевода. При плохом самочувствии ограничиваются активной симптоматической терапией.
Прогноз
При минимальном раке 100% выживаемость, при 1 стадии заболевания 5 лет проживает 85%.
Только каждый 5 пациент с 2-3 стадиями карциномы переживет пятилетку, дополнение операции химиотерапии увеличивает группу до 27%. Такие же результаты дает химиолучевое лечение.
Добиться положительных результатов лечения карциномы пищевода на поздних стадиях — крайне сложно, основное направление повышения выживаемости — раннее обнаружение опухоли при эндоскопическом обследовании, а также модификация образа жизни при эзофагите и ГЭРБ. Специалисты нашей Клиники знают, как повысить качество диагностики и помочь при предраковых процессах, какая химиотерапия даст наилучший результат.


Лечение рака пищевода. Лечение рака верхней трети пищевода.
Рак пищевода входит в 10 наиболее распространенных локализаций опухолей [1] и является одной из основных причин смертности от злокачественных новообразований. Ежегодно в мире регистрируют 8 млн новых случаев заболевания раком пищевода и 5,2 млн случаев смерти от него . В 90% случаев это плоскоклеточный рак . Общая 5-летняя выживаемость больных раком пищевода в среднем составляет 6,3%. Показатель смертности составляет в среднем 3 случая на 100 тыс. По гистологической структуре 93-95% занимает плоскоклеточный рак, 3-5% приходится на аденокарциному. По данным японских авторов, при прорастании опухоли в подслизистый слой пищевода у 40% больных обнаруживают метастазы в регионарных лимфатических узлах, в 4 раза выше, чем при раке желудка и колоректальном раке. При использовании методики иммуногистохимического исследования было выявлено, что при инвазии опухоли уровня Т1 метастазы в регионарных лимфоузлах у 14-21% пациентов, а при Т2 - в 38-60%. По данным института им. Герцена, только комбинированное лечение рака пищевода может улучшить 5-летнюю выживаемость. При раке верхних отделов 5-летняя выживаемость составляет 15-20%, средних отделов - 30-35% (только хирургическое лечение - 10%), нижних отделов - 35-45% (только хирургическое лечение - 25%) . По данным В.Л. Ганула и С.И. Киркилевського, 5-летняя выживаемость даже после радикальных оперативных вмешательств составляет 5-20%, средний срок до прогрессирования болезни - 11,9 месяца. Итак, очевидно, что химиотерапия, особенно химиолучевая терапия, играет значительную роль в лечении рака пищевода.
Лечение рака пищевода является одной из самых сложных проблем современной клинической онкологии. Пищевод тесно прилегает к окружающим его органов, при опухолевой инфильтрации невозможно удалить вместе с опухолью. Кроме того, тяжесть заболевания обусловлена тем, что опухоль пищевода при быстром росте вызывает нарушение проходимости пищи. Синдром дисфагии наносит больному серьезную психоэмоциональную травму. В течение нескольких месяцев развивается кахексия, и больные умирают от голода.
Наиболее сложным является лечение рака верхней трети пищевода, которое остается неразрешимой проблемой современной онкологии. С одной стороны, оперативные вмешательства при раке верхней трети травматические и малоэффективны, с другой стороны, результаты применения комплексной лучевой и комбинированной терапии обнадеживают. По данным разных исследователей, проведение самостоятельной химиотерапии не дает возможности получить удовлетворительную объективный ответ. Адекватных результатов лечения можно добиться только с помощью комбинации лучевой терапии и полихимиотерапии. Однако такое лечение высокотоксичным при внутривенном пути введения цитостатиков, что немаловажно ограничительным фактором.
Принимая во внимание вышесказанное была разработана методика комбинированного лечения больных раком верхней трети пищевода. Эта методика отличается от существующих внутриартериальным путем введения цитостатиков.
Материалы и методы
Целью исследования было улучшение результатов консервативного лечения больных раком верхней трети пищевода за счет комбинации лучевой терапии с селективной полихимиотерапией.
Для проведения лечения выбрана схема полихимиотерапии, указанную в стандартах лечения онкологических больных. Использовался 5-фторурацил и цисплатин. Основываясь на положительных результатах, полученных при применении внутриартериального способа введения цитостатических препаратов для лечения рака желудка, мы выбрали этот метод введения химиопрепаратов как основной.
Селективное введение цитостатиков основывается на таких преимуществах:
• целенаправленное подведение цитостатиков позволяет создать их высокую концентрацию в зоне опухолевого поражения;
• длительная инфузия цитостатика обеспечивает его контакт с опухолевыми клетками на всех стадиях клеточного цикла;
• регионарное введение химиопрепаратов значительно снижает системное токсическое действие на организм пациента.
Васкуляризация пищевода осуществляется из разных источников. Его шейный и верхньогрудинна участка кровоснабжаются нижней щитовидной артерией (бассейн щитошийного ствола), средняя часть внутреннегрудного отдела - пищеводными артериями, берущие начало непосредственно от грудного отдела аорты, а нижняя часть - пищеводными ветвями левой желудочной артерии (из бассейна чревного ствола) и нижней диафрагмальной артерии.
Опираясь на работы ученых и на собственные наработки, мы разработали методики болюсного и инфузионного селективного введения химиопрепарата для лечения больных раком пищевода различных уровней локализации.
В общем виде методика лечения была такой. Пациентам проводили 2 курса лучевой терапии в разовой очаговой дозе (РВД) 2,2 Гр, суммарной очаговой дозе (СВД) 28-32 декабря. Всего за 2 курса дистанционной лучевой терапии больные получали около 60 экз. На фоне лучевой терапии применяли 2 цикла химиотерапии с 7-го по 10-й и с 28-го по 32-й день. Через 2 недели после последнего курса лучевой терапии проводили еще 4 курса селективной химиотерапии с интервалом 3 недели между курсами.
Больным опытной группы проводили лучевую терапию (РВД - 2,2 Гр, СВД 28-32 Гр), с 7-го дня начинали лечение полихимиотерапией.
Методика катетеризации нижней щитовидной артерии аксиллярным доступом заключалась в следующем: под местным обезболиванием 5% раствором новокаина в дозе 10 мл делают пункцию аксилярной артерии дело. Ангиографический катетер F-4 Cobra-3 вводят в проксимальный отдел правой подключичной артерии. Конец катетера возвращают вверх, вводят рентгеноконтрастных вещество и определяют местонахождение щитошейного ствола. Катетер вводится в ствол и после контрастирования размещают в нижней щитовидной артерии. Подобную манипуляцию проводят с левой стороны.
В отделении проводили инфузию цитостатиков: цисплатин в дозе 75 мг/м 2 и 5-фторурацил в дозе 750 мг/м 2. Затем катетер из артерии удаляли, и пациент получал инфузию 5-фторурацила в дозе 750 мг/м 2 в сутки в течение 2 суток. При химиотерапевтического лечения пациентам проводили терапию сопровождения. Вместе с лечением цитостатиками больной продолжал получать лучевую терапию.
После окончания 1-го курса лечения пациента выписывали из стационара. Повторное проведение идентичного 1-м 2-го цикла лечения по разработанной методике начиналось на 14-е сутки после окончания 1-го курса лучевой терапии. При поступлении пациенты проходили обследование, включавшее общий и биохимический анализ крови, гастроскопию и электрокардиограмму. После обследования пациенты проходили 2-й курс лечения с последующей выпиской из стационара.
Через 2 недели после окончания 2-го этапа комбинированного лечения больные проходили контрольную компьютерную томографию и фиброэзофагоскопия, после чего они получили еще 4 курса внутриартериальной и внутривенной полихимиотерапии по разработанной методике.
После последнего курса больных выписывали из стационара и оставляли на амбулаторном наблюдении (контроль каждые 3 мес).
Пациентам контрольной группы проводили только 2 курса лучевой терапии РВД 2,2 Гр (СВД 60 Гр).
По разработанной методике проведено лечение 32 пациентов. Контрольную группу составили 30 пациентов, получавших только лучевую терапию.
Результаты
В основной группе лейкопения II-III степени выявлен у 17 (53,1%) пациентов, в контрольной - у 7 (23,3%) пациентов (р
Непосредственные результаты были такие: после проведения комплексного лечения у всех больных отмечено частичную регрессию или стабилизацию процесса, снижение степени дисфагии на 3-4-й день после лечения.
В основной группе полную регрессию опухоли зафиксировано у 4 (12,5%) больных, частичную регрессию - у 19 (59,4%), стабилизация процесса - у 9 (28,1%). В контрольной группе частичную регрессию опухоли отмечали у 16 (53,3%) больных (р> 0,05), стабилизацию процесса - у 12 (43,3%) (р> 0,05), прогрессирование заболевания - у 1 (3 , 4%). Снижение степени дисфагии в основной группе обнаружили у 31 (97%) больного (р
Однолетнее выживаемость в основной группе у больных с I-II стадией процесса составляла 93,8% (р
Выводы
Результаты сочетание внутриартериального введения цитостатиков и дистанционной лучевой терапии в лечении больных раком верхней трети пищевода достоверно лучше, чем результаты применения дистанционной лучевой терапии в монорежиме.
Несмотря на увеличение нежелательных побочных эффектов (лейкопения, Эметогенная действие), описанная методика может быть рекомендована для введения в стандарты лечения рака верхней трети пищевода.
Литература
1. Ганул В.Л., Киркилевский С.И. (2003) Рак пищевода. Киев. Медицина Плюс, 200 с.
2. Мамонтов А.С. (2003) Комбинированное лечение рака пищевода. Практическая онкология, 2 (4): 76-82.
3. Киркилевський С. И. (2000) Комплексное лечение больных раком пищевода и раком желудка с переходом на пищевод: Дис. Д-ра мед. Наук. Киев, 310 с.
4. Янкин А.В. (2003) Рак пищевода: от статистики к диагностике. Практическая онкология, 4 (2) :10-14.
5. Федоренко З.П., Гулак Л.О., Горох Е.Л. (2007) Рак в Украине 2005-2006. Бюллетень национального канцер реестр Украины № 8. Киев, 95 с.
6. Wobst A., Audisio RA, Colleoni M. et al. (1998) Oesophageal cancer treatment: studies, strategies and facts. Ann Oncol, 9: 951-962.
7. Daly JM, Fry WA, Little AG et al. (2000) Esophageal cancer: results of an American College of Surgeons Patient Care Evaluation Study. J Am Coll Surg, 190: 562-572.
8. Darnton J., Archer VR, Stocken DD et al. (2003) Preoperative Mitomycin, Ifosfamide, and Cisplatin Followed by Esophagectomy in Squamous Cell Carcinoma of the Esophagus: Pathologic Complete Response Induced by Chemotherapy Leads to Long-Term Survival Journal of Clinical Oncology, Vol 21, Issue 21 (November): 4009-4015 .
9. Watanabe H., Kato H., Tachimori Y. et al. (1995) Necessity of cervical lymph node dissection by retrospective analysis of submucosal cancer in mid-and lower thoracic esophagus. Ann Thorac Cardiovasc Surg, 1: 49-53
10. Siewert JR, Stein HJ, Feith M. et al. (2001) Histologic tumor type is an independent prognostic parameter in esophageal cancer: lessons from more than 1,000 consecutive resections at a single center in the Western world. Ann Surg, 234: 360-367.
11. Collard J.-M., Otte J.-B., Fiasse R. et al. (2001) Skeletonizing en bloc esophagectomy for cancer. Ann Surg, 234: 25-32.
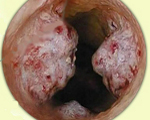
Злокачественные опухоли трахеи – новообразования, происходящие из тканей стенки трахеи. Проявляются затруднением дыхания, стридором, приступообразным мучительным кашлем (вначале сухим, затем – с гнойной мокротой), кровохарканьем и нарушением голосообразования. При прорастании пищевода возникают затруднения при приеме пищи. При распаде злокачественной опухоли трахеи развиваются кровотечения, гипертермия, увеличение СОЭ и симптомы общей интоксикации. Диагноз устанавливается на основании симптомов, данных ларингоскопии, трахеоскопии, бронхоскопии, рентгенографии, КТ, МРТ и биопсии. Лечение – хирургическое удаление опухоли с последующей рентгенотерапией.
- Этиология и патогенез злокачественных опухолей трахеи
- Симптомы злокачественных опухолей трахеи
- Диагностика злокачественных опухолей трахеи
- Лечение и прогноз при злокачественных опухолях трахеи
- Цены на лечение
Общие сведения
Злокачественные опухоли трахеи – редкие новообразования, происходящие из эпителиальной или соединительной ткани. Составляют 0,1-0,2% от общего количества злокачественных опухолей. Входят в группу онкологических заболеваний дыхательных путей. Чаще диагностируются у мужчин. Обычно развиваются в возрасте 40-60 лет, у детей выявляются крайне редко. Большинство злокачественных опухолей трахеи локализуются в верхней трети органа. Клинические проявления, вероятность развития тех или иных осложнений и особенности метастазирования определяются в зависимости от вида опухоли, локализации первичного очага и особенностей роста новообразования (инфильтрующий, экзотрахеальный, эндотрахеальный, перитрахеальный, смешанный). Лечение осуществляют специалисты в области онкологии, отоларингологии и пульмонологии.

Этиология и патогенез злокачественных опухолей трахеи
Причины развития точно не выяснены. В числе факторов риска указывают неблагоприятную наследственность, ряд онковирусов, курение, алкоголизм, хронические воспалительные процессы полости рта и дыхательных путей (гингивит, стоматит, кариес, ларингит, трахеит, бронхит), повышенный уровень радиации, неблагоприятную экологическую обстановку, длительный контакт с некоторыми химическими веществами (например, вдыхание пыли при производстве асбеста, вдыхание паров лаков, растворителей и красителей в процессе ремонтных работ или изготовления мебели и т. д.).
Злокачественные опухоли трахеи могут быть первичными или вторичными. Первичные развиваются из эпителия или соединительной ткани трахеи. Вторичные локализуются в соседних органах (пищеводе, средостении, щитовидной железе, бронхах, гортани), поражают трахею в результате агрессивного инфильтрирующего роста или аспирационного метастазирования. Наиболее распространенными первичными злокачественными опухолями трахеи являются аденокистозный и плоскоклеточный рак.
Аденокистозный рак (цилиндрома) происходит из железистого эпителия, характеризуется относительно медленным прогрессированием, агрессивным местным ростом и склонностью к рецидивированию. Возможно аспирационное, лимфогенное и гематогенное метастазирование. Плоскоклеточный рак развивается из плоского эпителия, обычно возникает на задней или боковой стенке трахеи. Эта злокачественная опухоль трахеи диагностируется у мужчин среднего и пожилого возраста, в большинстве случаев образуется в грудном отделе или на уровне бифуркации. Растет относительно медленно, склонен к прорастанию окружающих тканей.
Саркома трахеи диагностируется редко, происходит из соединительной ткани, обычно располагается на уровне бифуркации. Может быть первично злокачественной или возникать в результате перерождения доброкачественного новообразования. Преобладает местный инфильтрирующий рост, метастазы возникают только на поздних стадиях болезни. В число редких злокачественных опухолей трахеи также входят мукоэпидермоидные аденомы, карциноиды, ретикулоэндотелиомы, ретикулосаркомы, злокачественные нейрофибромы, гемангиоперицитомы и некоторые другие новообразования.
Чаще всего злокачественные опухоли трахеи распространяются путем местного агрессивного роста. Определенное значение имеет аспирационное местастазирование. Нередко выявляются метастазы в лимфатические узлы. Отдаленное местастазирование наблюдается нечасто, поскольку пациенты не успевают дожить до этого этапа болезни. Отдаленные метастазы могут обнаруживаться в плевре, почках, печени, поджелудочной железе, коже, надпочечниках и других органах. Причиной смерти обычно становятся удушье и другие осложнения, связанные с местным ростом опухоли.
Симптомы злокачественных опухолей трахеи
Какое-то время болезнь протекает бессимптомно. Первыми проявлениями обычно становятся кашель и одышка. Кашель непостоянный, на ранних стадиях сухой, приступообразный. В последующем появляется мокрота, которая то отделяется с трудом, то одномоментно откашливается большими порциями. Возможно эпизодическое или регулярное кровохаркание. Одышка сначала возникает только при физической нагрузке, а затем сохраняется и в покое. Характер одышки зависит от уровня расположения новообразования. При поражении верхних отделов развивается преимущественно инспираторная одышка, при поражении нижних – экспираторная.
Злокачественная опухоль трахеи продолжает расти и перекрывает значительную часть просвета трахеи. На поздних стадиях пациент принимает вынужденное положение (обычно сидячее), чтобы уменьшить удушье и обеспечить поступление кислорода в легкие. Дыхание становится шумным. При сохранении эластичности трахеи шум появляется на выдохе. Со временем ригидность трахеи все больше увеличивается, к шуму на выдохе присоединяется шум на вдохе. Наблюдаются расстройства голосообразования: охриплость, осиплость или афония.
При распространении злокачественной опухоли трахеи на пищевод возникают дисфагия и боли при проглатывании пищи. Со временем может развиться непроходимость пищевода. При распаде новообразования появляется мокрота с неприятным запахом, возможны кровотечения. Выявляются повышение температуры, симптомы общей интоксикации, эритропения, увеличение СОЭ и сдвиг лейкоцитарной формулы влево. Распад опухоли может сопровождаться некоторым уменьшением одышки за счет частичного восстановления просвета трахеи.
Диагностика злокачественных опухолей трахеи
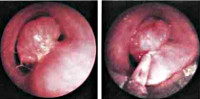
Диагноз устанавливается на основании анамнеза, клинических симптомов, данных инструментальных и лабораторных исследований. При расположении новообразования в верхних отделах трахеи его можно увидеть во время проведения зеркальной ларингоскопии. При низко расположенных злокачественных опухолях трахеи требуется прямая ларингоскопия, верхняя трахеоскопия или бронхоскопия. В ходе процедуры врач производит забор ткани или слизи для последующего гистологического и цитологического исследования.
Для определения размера и расположения опухоли, степени вовлеченности окружающих тканей и близлежащих анатомических образований применяют рентгенографию, КТ и МРТ. В процессе диагностики злокачественной опухоли трахеи учитывают возможность ложноотрицательного результата гистологического исследования. Решающее значение придают клиническим данным и совокупным результатам инструментальных исследований. Иногда требуется дифференциальная диагностика с туберкулезными или сифилитическими гранулемами.
Лечение и прогноз при злокачественных опухолях трахеи
Лечение комбинированное – хирургическое удаление новообразования в сочетании с пред- и послеоперационной лучевой терапией. Возможность радикального оперативного вмешательства определяется распространенностью и локализацией злокачественной опухоли трахеи. Чем выше расположено новообразование – тем проще его удалить. Опухоль иссекают в пределах здоровых тканей. Кольца трахеи по возможности сближают и сшивают. При небольших дефектах проводят пластику трахеи с использованием свободного кожно-мышечного лоскута. При обширных дефектах применяют мышечно-надкостничные или хрящевые трансплантаты либо кожные лоскуты, укрепленные танталовой сеткой.
При неоперабельных злокачественных опухолях трахеи осуществляют паллиативные хирургические вмешательства – трахеостомию или трахеофиссуру. При сдавлении нижней части трахеи через стенозированный участок проводят трахеотомическую канюлю. Лучевую терапию и химиотерапию назначают как при операбельных, так и при неоперабельных злокачественных опухолях трахеи, однако, в случае неоперабельного онкологического заболевания эффект от ее применения нестойкий. Через некоторое время после окончания курса лечения опухоль рецидивирует. Для увеличения эффективности применяют внутриполостную брахитерапию, дистанционную лучевую терапию.
Прогноз при злокачественных опухолях трахеи в большинстве случаев неблагоприятный. При плоскоклеточном раке пятилетняя выживаемость составляет около 40%, при аденокистозном раке – от 65 до 85%. В случае позднего начала лечения прогноз ухудшается. В число профилактических мероприятий входят отказ от курения, прекращение контакта с вредными химическими веществами и раннее обращение к пульмонологу при появлении сухого кашля, нарастающей одышки и других симптомов, характерных для злокачественных опухолей трахеи.
Проблема продолжительности жизни на поздних стадиях рака пищевода становится все более актуальной в связи с эпидемиологическим переходом этого заболевания. Что это значит?
Рак пищевода бывает двух типов — плоскоклеточный рак (SCC) и аденокарцинома. Оба типа в большей степени распространены среди мужчин.
До недавнего времени плоскоклеточный рак пищевода был наиболее распространен в Восточной Европе, Азии и Африке, в то время как аденокарцинома преобладала в странах Северной Америки и Западной Европы. В целом, преобладающим типом в мире был плоскоклеточный рак.
Но сейчас ситуация быстро меняется. Заболеваемость аденокарциномой пищевода резко возросла во всех странах, среди всех этнических групп, а также и у женщин. При этом аденокарцинома ведет себя более агрессивно, и ее региональное и отдаленное распространение начинается раньше.

Причины возникновения и факторы риска онкологии пищевода
Считается, что причина появления рака пищевода связана с воздействием на слизистую пищевода ядовитых или токсических раздражителей, что приводит к последовательному развитию дисплазии, затем карциномы in situ и, в итоге, рака.
В западных культурах ретроспективные данные указывают на то, что курение сигарет и хроническое употребление алкоголя — наиболее распространенные этиологические факторы плоскоклеточного рака.
Признаки и симптомы
Первые проявления рака пищевода начинаются тогда, когда опухоль достигает определенного размера и начинается ее прорастание в соседние структуры средостения. Эти же признаки и определяют наступление 3 стадии болезни. Именно поэтому рак пищевода чаще всего диагностируется именно на III стадии.

Признаки рака пищевода:
- Дисфагия — наиболее распространенный признак. Первоначально проблемы возникают с глотанием твердой пищи, а в конечном итоге, когда просвет пищевода сужается опухолью до размера менее 13 мм, и жидкостей.
- Потеря веса (второй по частоте симптом) из-за дисфагии и связанной с опухолью анорексии.
- Кровотечение, которое приводи к развитию железодефицитной анемии.
- Эпигастральная или загрудинная боль.
- Боль в костях при метастазировании.
- Охриплость. Когда опухолью повреждается возвратный гортанный нерв.
- Постоянный непреодолимый кашель или частая пневмония (из-за трахеобронхиальных свищей, вызванных прямой инвазией опухоли через стенку пищевода в главный бронх)
Диагностика
Лабораторные исследования, такие как общий анализ крови и комплексная метаболическая оценка используются, главным образом, для выявления факторов, которые могут повлиять на лечение (например, на состояние питания, функцию почек).

Визуальные исследования, используемые для диагностики.
- Эзофагогастродуоденоскопия (EGD; позволяет прямую визуализацию и биопсию опухоли)
- Эндоскопическая ультрасонография EUS— наиболее чувствительный тест на определение стадии TN. Используется, когда нет признаков метастазирования.
- Магнитно-резонансная томография брюшной полости и грудной клетки с контрастом (для оценки метастазов в легких, печени и инвазии в соседние структуры).
- Позитронно-эмиссионная томография (ПЭТ) — для постановки точного диагноза и определения клинического типа опухоли.
- Бронхоскопия (если опухоль находится на уровне или выше киля, чтобы исключить инвазию в трахею или бронхи).
- Лапароскопия и торакоскопия для выявления поражения регионарных лимфоузлов.
Лечение
Лечение рака пищевода на продвинутой локально-регионарной стадии (стадии III) мало чем отличается от лечения метастатического рака (стадия IV). Однако тактика лечения определяется гистологическим подтипом — плоскоклеточный рак (SCC) или аденокарцинома.
Результат проводимого при раке пищевода лечения и продолжительность жизни пациента во многом зависят от того, возможно ли провести хирургическую резекцию опухоли.
Проведение операции желательно. Поскольку при диагнозе рак пищевода, операция прогноз улучшает, и почти всегда значительно.
Противопоказания к операции включают в себя следующее:
- метастазирование в узлы N2 (т.е. шейные или надключичные лимфатические узлы) или в соседние органы (например, печень, легкие);
- инвазия соседних структур (например, возвратного гортанного нерва, трахеобронхиального дерева, аорты, перикарда)
Кроме того, наличие тяжелых сопутствующих сопутствующих состояний (например, сердечно-сосудистые заболевания, респираторные заболевания) может снизить шансы пациента на выживание при резекции пищевода.
Хирургическая резекция пищевода (эзофагэктомия) остается критически важным компонентом комплексной терапии для пациентов с опухолями любой стадии. Эта операция может проводиться двумя способами — через вскрытие грудной клетки(TTE) и через разрез в диафрагме (THE).
Многочисленные исследования не показали различий в выживаемости между операциями. Предполагается, что фактор, влияющий на выживаемость, определяется не типом операции, а стадией рака на момент операции.
У пациентов на 3 стадии с локальной недостаточностью после окончательной химиолучевой терапии по поводу плоскоклеточного рака, эндоскопическое лечение будет приемлемым вариантом.
Общая выживаемость и безрецидивная выживаемость на III стадии рака пищевода за 5 лет при такой операции составляли 38,6% и 28% соответственно.

Химиолучевая терапия при раке пищевода проводятся до операции. Выживаемость не ухудшается, когда химиолучевая терапия назначаются после операции. Однако послеоперационное продолжение химиотерапии, начатой до операции, может быть полезным.
Цели предоперационной (неоадъювантной) химиолучевой терапии состоят в том, чтобы уменьшить объем первичной опухоли перед операцией, чтобы способствовать более высокой частоте лечебной резекции и устранить или отсрочить появление отдаленных метастазов.
Одна только неоадъювантная химиотерапия в лучшем случае дает ограниченную пользу. Предоперационная химиотерапия цисплатином и фторурацилом привела к 5-летней выживаемости, равной 23,0%, по сравнению с 17,1% только для одной операции.
Лучший вариант для увеличения выживаемости — неоадъювантная терапия из комбинации лучевой терапии (приблизительно 45 Гр) и химиотерапии с использованием цисплатина и 5-фторурацила.
Инновационное лечение рака пищевода 3 стадии в Бельгии
В сентябре 2019 г. EMA одобрило Пембролизумаб (Keytruda) для пациентов с рецидивирующим, местно-распространенным или метастатическим плоскоклеточным раком (ESCC), у которых опухоли экспрессируют PD-L1.
Эффективность наблюдалась в двух клинических испытаниях. Медиана общей выживаемости составила 9,3 мес. в Кейтруде, при 6,7 мес. в контрольной группе. Причем 71% имели ответы 6 месяцев или дольше, а 57% имели ответы 12 месяцев или дольше.

ЕMA одобрило Типирацил/Трифлуридин в мае 2019 года для метастатической аденокарциномы желудка или желудочно-пищеводного перехода. Пациенты в группе типирацил / трифлуридин имели среднюю общую выживаемость 5,7 месяца по сравнению с 3,6 месяца в группе плацебо.
Схемы лечения с использованием этих препаратов уже доступны в онкологических центрах Бельгии.
Один из часто задаваемых вопросов о диагнозе рак пищевода 3 степени — сколько живут пациенты. На самом деле, важно и то, как они живут на этой стадии заболевания.
У пациентов с неоперабельным или местно-распространенным раком паллиативные вмешательства обеспечивают облегчение симптомов и могут привести к значительному продлению жизни. Также они способствуют улучшению состояния питания, ощущению благополучия, нормализации общего качества жизни.
Дисфагия — наиболее распространенный симптом у пациентов с раком пищевода на III стадии.
Руководящие принципы бельгийской онкологической сети для лучшей паллиативной помощи пациентам с полной обструкцией пищевода рекомендуют следующее:
- эндоскопическое восстановление просвета;
- радиолучевая терапия;
- химиотерапия;
- хирургия.

Долговременное смягчение дисфагии может быть достигнуто с помощью эндоскопической рентгенологической вставки расширяемых металлических или пластиковых стентов. Покрытые мембраной стенты (наиболее часто используемые сегодня в Бельгии) имеют значительно лучшую паллиативность, чем обычные голые металлические стенты из-за более низкой скорости врастания опухоли.
Лучевая терапия устраняет дисфагию примерно у 50% пациентов. У пациентов с запущенным раком предоперационная комбинация химиотерапии и лучевой терапии показала хорошие результаты.
2-летняя выживаемость составила 38% при среднем периоде выживания 12,5 месяцев для пациентов, получавших лучевую терапию в сочетании с химиотерапией (фторурацил и цисплатин).
Химиотерапия как единый метод имеет ограниченное применение. В клиниках Бельгии она используется только в комплексе с лучевой терапией.
Лазерная терапия (лазер Nd-YAG) успешна в достижении временного облегчения дисфагии у 70% пациентов. Для сохранения просвета пищевода обычно требуется несколько сеансов.

Прогноз и профилактика
При диагнозе рак пищевода, прогноз зависит, прежде всего, от стадии заболевания.
В 2009-2015 гг. Общая 5-летняя выживаемость составила 19,9%. Пациенты без поражения лимфатических узлов имеют значительно лучший прогноз и 5-летнюю выживаемость, чем пациенты с вовлеченными лимфатическими узлами. Поражения стадии IV с отдаленными метастазами связаны с 5-летней выживаемостью около 5%.
Пятилетняя выживаемость при раке пищевода по стадиям на момент постановки диагноза в 2009-2015 гг.
Локализованный (1-2 стадия)
Региональный (3 стадия)
25.1
Отдаленный (4 стадия)
Лучшая 5-летняя выживаемость (48%) была выявлена в подгруппе пациентов, у которых был полный ответ (исчезновение опухоли) после предоперационной (неоадъювантной) химиолучевой терапии.
Исследование показало, что ПЭТ-компьютерная томография (ПЭТ-КТ) может использоваться для прогнозирования выживаемости. В этом исследовании наличие лимфоузлов, содержащих фтордезоксиглюкозу (FDG), было независимым неблагоприятным прогностическим фактором.
Позитивность HER-2 и амплификация генов независимо связаны с плохой выживаемостью. В исследовании, в котором участвовало 154 пациента с аденокарциномой, положительная реакция на HER-2 наблюдалась у 12% этих пациентов, а избыточная экспрессия - у 14%.

Для плоскоклеточного рака профилактика состоит из прекращения курения, усилий по сокращению злоупотребления алкоголем, а также диеты, содержащей достаточное количество витаминов.
Для аденокарциномы пищевода профилактика включает остановку последовательности событий, ведущих от гастроэзофагеальной рефлюксной болезни (ГЭРБ) к пищеводу Барретта.
Лучший контроль гастроэзофагеального рефлюкса может предотвратить развитие метаплазии Барретта у пациентов с ГЭРБ, что может препятствовать развитию дисплазии высокой степени у пациентов с метаплазией. Эндоскопическая последующая оценка проводиться с интервалом от 1 до 2 лет, чтобы обнаружить наличие дисплазии, что позволяет вмешаться до развития рака.
Современные подходы к лечению рака пищевода на 3 стадии в Бельгии позволяют продлевать жизнь с сохранением ее качества. Получите больше информации о новых возможностях для пациентов с таким заболеванием. Напишите нам или закажите обратный звонок.
Читайте также:

