Рак шейки матки асцит
Страница 1 из 3
Рак шейки матки (асцит)?
Здравствуйте, моей матери 58 лет, в 1998 году она прошла лучевую и химиотерапии, диагноз рак шейки матки. Лечение прошло успешно, сейчас у нее сильно болит поджелудочная, несколько раз лежала в терапии. Последний раз ее отказались лечить, при этом устно сказав что вам надо обращаться в онкологический центр и не выдав никаких направлений. Всеми правдами и неправдами мы попали на прием к онкологу, который ее осмотрел, так же ничего не сказав определенного, прошли узи, взяли кровь(результат пока неизвестен), предварительный диагноз поставил: рак шейки матки(асцит), после чего назначали еще ряд анализов, которые она еще не прошла. У меня возникает вопрос, что нам делать, куда обращаться и чего ждать? в местной больнице ее не лечат, в онкологии надо ждать неделю, а у нее сейчас острые боли, она не ест, почти не встает. Что это может быть, панкреатит, или метастазы?
Здравствуйте. Если живот не увеличен в размерах, боли ощущаются в области эпигастрия, хирург исключил острую хирургическую патологию и маму уже осмотрел онколог-гинеколог, то Следующим этапом необходимо выполнить УЗИ брюшной полости, малого таза и забрюшинного пространства, а также дождаться результатов общего и биохимического анализов крови. Думаю, что это позволит прояснить ситуацию.
А вообще на что нам надеяться? Ее вчера госпитализировали в хирургию, боль ушла, но пришла тошнота, ничего не ест, хотя хочется. Прошла узи брюшины, которая показала наличие жидкости, но визуально живот не сильно увеличен, отеков нет. Назначили ФГДС, что он даст?
Асцит не обязательно является следствием рака, тем более, что спустя почти 20 лет вероятность рецидива значительно снижается. Но ранее вылеченный один рак не гарантия того, что в другом органе не появится новый злокачественный процесс, в том числе и в желудке (для чего и назначен фгдс).
Диагноз поставлен. Канцероматоз, асцит! отправили на симптоматическое лечение! Чем мне ей можно помочь?
Симптоматическое лечение подразумевает устранение беспокоящих симптомов заболевания, например, обезболивание, антианемическое лечение.
Может все таки можно пройти химию? на основании вот этого обследования ей отказали, сказали только симптоматическое лечение.
Компьютерная томография органов бр. полости. Контрастное усиление изображения: болюсное. На уровне исследования в левой плевральной полости свободная жидкость толщиной слоя до 4,5 см. В брюшной полости и в малом тазу свободная жидкость, на этом фоне отмечается инфильтрация брюшины до 2 см толщиной, патологических образований в брюшной полости и в малом тазу не выявлено. Печень, почки, селезенка, желчный пузырь, ворота печени, пожделудочная железа, надпочечники, аорта, нижняя полая вена - правильной формы, обычных размеров. Забрюшинные лимфоузлы не увеличены. Патологии со стороны почечных,селезеночных сосудов, чревного ствола, непарной и полунепарной вен не выявлено. Компьютерная томография органов малого таза. Матка обычной формы и размеров, ее полость расширена до 13 мм с жидкостным содержимым, шейка матки до 15 мм шириной, ее контуры фиброзированы, придатки не дифференцируются, внутритазовые ЛУ не увеличены. Мочевой пузырь достаточно наполнен, его контуры четкие, стенки не утолщены, костные структуры на уровне исследования без деструкции.
Добавлено через 14 минут
может найдутся какие либо онкоцентры, которые возьмутся за лечение?
Отказывают в специальном лечении не из-за распространённости ракового процесса, а потому, что на взгляд врачей Ваша мама не выдержит полноценного лечения.
Вот именно, что в онкологическом диспансере Белгородской области ей отказали в лечении, ссылаясь только на исследование узи брюшной полости и малого таза, а так же СКТ. ее обследовали в течении получаса максиму, и все. Я хочу добиться полноценного обследования , слышал что центр имени Бурденко берется за тяжелые случаи, что вы можете посоветовать? Заранее благодарю!
Тогда логичнее ехать не в Бурденко, а в РОНЦ, НИИ им Герцена или центр рентгенорадиологии. По КТ распространённый канцероматоз, но явный очаг в шейке матки оно не видит. SCC очень неспецический маркёр, поэтому его нормальные показатели не исключают рецидив. А чем, кроме данными КТ подтверждён рецидив: биопсией с шейки, пункцией лимфоузлов ?
вот именно что ничем, ничего больше не проводилось. И проводить не хотят.
Как то не укладывается болезнь в рецидив рака шейки матки. Больше похоже на патологию поджелудочной железы (в том числе и недоброкачественную). Может есть смысл в выполнении лапароскопии. А какие показатели АЛТ, АСТ, амилазы, билирубина?
Алт 15,1 ед/л, АСТ 34,1 ед/л, амилазы 38,6 ед/л, билирубин, 10,0
И подскажите пожалуйста, инфильтрация брюшины это и есть канцерамотоз? То есть тут без сомнений диагноз?
Добавлено через 59 минут
Вернее, как легко по СКТ определить именно канцероматоз, а не какую либо другую патологию? и доктор при определении диагноза руководствовался в первую очередь наличием ранее наблюдавшегося заболевания ршм?
У меня просто возникают большие сомнения относительно диагноза, по словам мамы, боли появились не два года назад, а в 2008 году, и тогда их интенсивность была намного сильней, и была тошнота и рвота, но в 2008 году она еще находилась на контроле у онколога, у нее все было без патологий. Насколько я знаю, канцероматоз очень агрессивная форма и с ней долго не живут. Проконсультироваться не с кем, уровень нашего онколога оставляет желать лучшего, это не мое мнение, а мнение его же коллег, свое нежелание дать направление на обследование в областной онкодиспансер он объясняет конфликтом интересов, так как мы уже обращались туда и нам был поставлен диагноз, сейчас мама находится в терапевтическом отделении местной больницы , якобы на обследовании, но больница то не специализированная, уровень подготовки специалистов на уровне ветеринарных врачей. Диагностическое оборудование на порядок хуже чем в области. Человека просто списали. Сейчас она заново проходит, кровь, мочу и УЗИ плевральной полости, но это она делала совсем недавно. Я не понимаю что вообще происходит
Канцероматоз это выраженное уплотнение брюшины и спутать его с чем-то сложно. Другое дело, что для рака шейки матки это очень нехарактерный симптом, возникающий, как правило, после появления метастазов яичниках, хорошо видимых при КТ. Поэтому даже и не знаю, что ещё путного посоветовать в Вашей ситуации. Можно попробовать провести цитологическое исследования асцита. Может быть тип опухоли совпадёт с тем, что ранее был на шейке матки.
Взяли жидкость из плевральной полости, нашли атипичные клетки соответствующие канцероме, что это означает?
Подтвердили наличие распространённого рака.
Асцит — патологическое состояние, при котором в брюшной полости скапливается жидкость. Причины его бывают различными. Чаще всего к асциту приводит цирроз печени. Так же он возникает как осложнение онкологических заболеваний, при этом ухудшается состояние больного, снижается эффективность лечения.
- При каких видах рака может развиваться асцит?
- Почему рак приводит к скоплению жидкости в брюшной полости?
- Проявления асцита при онкологических заболеваниях
- К каким осложнениям приводит асцит?
- Методы диагностики
- Лечение асцита в онкологии
- Прогноз при асците у онкологических больных
- Цены
Некоторые цифры и факты:
- На ранних стадиях онкологических заболеваний умеренный асцит развивается примерно у 15–50% пациентов;
- Тяжелый асцит развивается примерно у 7–15% онкологических больных;
- При асците в брюшной полости может скапливаться до 5–10 литров жидкости, в тяжелых случаях — до 20 литров.
При каких видах рака может развиваться асцит?
Чаще всего асцит развивается при следующих онкологических заболеваниях:
- рак яичников;
- рак печени;
- рак поджелудочной железы;
- рак желудка и кишечника;
- рак матки;
- рак молочной железы;
- неходжкинские лимфомы, лимфома Беркитта.
Почему рак приводит к скоплению жидкости в брюшной полости?
При раке печени причины асцита те же, что при циррозе (собственно, рак печени в большинстве случаев и развивается на фоне цирроза): нарушение оттока крови, повышение давления и застой в венах, нарушение синтеза альбумина и снижение онкотического давления крови.
При злокачественных опухолях других органов (желудка, кишечника, матки, яичников) асцит возникает из-за поражения раковыми клетками брюшины. Из-за этого нарушается всасывание жидкости. Если опухолевые клетки поражают лимфатические узлы, асцит может возникать из-за нарушения оттока лимфы.
Проявления асцита при онкологических заболеваниях
Если в брюшной полости скапливается небольшое количество жидкости (100–400 мл), симптомы отсутствуют. В таких случаях асцит обнаруживают зачастую случайно во время УЗИ или КТ органов брюшной полости.
Постепенно, по мере нарастания асцита, живот увеличивается в объеме. Пациент чувствует тяжесть в животе, ноющие боли. За счет задержки жидкости увеличивается масса тела. Происходит сдавление внутренних органов, возникают такие симптомы асцита брюшной полости, как тошнота и рвота, отрыжка, расстройство стула и мочеиспускания. Изменяется внешний вид пупка: он выбухает, как во время беременности. Больной чувствует слабость, постоянную усталость, снижается аппетит.
К каким осложнениям приводит асцит?
При выраженном, длительно существующем асците жидкость скапливается в плевральной полости, развивается гидроторакс. Это приводит к еще большему расстройству дыхания, тяжелой одышке.
*По аналогии с брюшной полостью, в грудной клетке находится тонкая оболочка из соединительной ткани — плевра, париетальный листок которой выстилает стенки, висцеральный покрывает легкие.
При портальной гипертензии микроорганизмы из кишечника могут проникать в асцитическую жидкость. Развивается спонтанный бактериальный перитонит. Ситуация усугубляется тем, что в асцитической жидкости мало антител, поэтому иммунный ответ слабый.
Редкое, но очень тяжелое осложнение асцита — гепаторенальный синдром. При этом цирроз и печеночная недостаточность приводят к серьезному нарушению функции почек, вплоть до тяжелой почечной недостаточности. Пациенты с гепаторенальным синдромом в среднем живут от 2 недель до 3 месяцев. Причины этого состояния до конца не известны. Считается, что кровоток в почках нарушается из-за чрезмерного применения мочегонных средств, внутривенных контрастов во время рентгенографии и компьютерной томографии, некоторых лекарственных препаратов.
Методы диагностики
Если во время осмотра врач обнаруживает у пациента признаки асцита, он может назначить следующие методы диагностики:
- УЗИ, КТ и МРТ помогают диагностировать асцит и оценить количество жидкости в брюшной полости, состояние внутренних органов, обнаружить злокачественную опухоль, оценить количество, размеры, локализацию патологических очагов, степень прорастания опухоли в различные органы и ткани;
- Биохимический анализ крови помогает оценить функцию печени, почек, определить уровни электролитов, степень снижения количества белка;
- Исследование свертываемости крови помогает выявить нарушения, связанные с расстройством функции печени (печень синтезирует некоторые факторы свертывания);
- Диагностический лапароцентез — процедура, во время которой проводят пункцию брюшной полости под контролем УЗИ и получают небольшое (примерно столовую ложку) количество асцитической жидкости. В ней исследуют уровни лейкоцитов и эритроцитов, общего белка и альбумина, глюкозы, амилазы. Проводят анализы на присутствие микроорганизмов, цитологическое исследование на предмет наличия опухолевых клеток.
Лечение асцита в онкологии
Лечение асцита у онкологических больных — сложная задача. От правильного подхода к ее решению зависит качество и продолжительность жизни пациента, эффективность противоопухолевой терапии. В идеале нужна клиника, которая специализируется на лечении асцита у онкобольных.
Такая терапия помогает выводить до 1 литра жидкости в сутки. Она существенно улучшает состояние примерно у 65% пациентов. Но применять ее можно только при умеренном асците. Многие пациенты на поздних стадиях рака плохо переносят ограничение жидкости и соли. Поэтому консервативная терапия не рассматривается как основной метод лечения асцита при онкологии.
Лапароцентез — процедура, во время которой в брюшную полость под контролем УЗИ вводят троакар — специальный инструмент в виде трубки с острыми краями (напоминает иглу, только толще) и выводят жидкость. Лапароцентез проводят под местной анестезией в стерильных условиях, во время процедуры пациент сидит или лежит. Троакар вводят по средней лини живота или по линии, которая соединяет пупок с подвздошной костью. Во время процедуры из брюшной полости можно безопасно вывести до 5–6 литров жидкости.
После лапароцентеза врач может установить в брюшную полость перитонеальный катетер — трубку, соединенную с резервуаром для оттока асцитической жидкости. При выраженном асците катетер может быть оставлен на несколько дней.
Возможные осложнения во время и после лапароцентеза:
Некоторым пациентам назначают внутрибрюшинную химиотерапию — химиопрепарат вводят в высоких дозах в брюшную полость, иногда предварительно нагрев его до 41 градуса (такую химиотерапию называют гипертермической). Это помогает уменьшить асцит. Проводят системную химиотерапию.
Один из новых препаратов для лечения асцита у онкологических больных — моноклональное антитело Катумаксомаб. Его также вводят внутрибрюшинно. Катумаксомаб взаимодействует с рецепторами опухолевых и иммунных клеток и индуцирует иммунную реакцию. Но препарат действует лишь на раковые клетки, обладающие определенными молекулярно-генетическими характеристиками.
Некоторым пациентам показана оментогепатофренопексия. Во время этой операции сальник подшивают к печени или диафрагме. Благодаря возникновению такого контакта улучшается всасывание асцитической жидкости.
В качестве паллиативного хирургического вмешательства прибегают к перитонеовенозному шунтированию. В брюшную полость устанавливают катетер, который соединяет ее с венозной системой. Катетер оснащен клапаном — он открывается, когда давление в брюшной полости превышает центральное венозное давление. При этом происходит сброс жидкости в вены.
Деперитонизация стенок брюшной полости — вмешательство, во время которого хирург удаляет участки брюшины, тем самым создавая дополнительные пути для оттока асцитической жидкости.
Применяются и другие виды хирургического лечения.
Прогноз при асците у онкологических больных
Обычно асцит возникает на поздних стадиях рака, ухудшает прогноз для онкологического пациента. При злокачественных опухолях, осложнившихся асцитом, отмечается низкая выживаемость. Паллиативное лечение помогает улучшить качество жизни, несколько увеличить ее продолжительность. Врач должен тщательно оценить состояние пациента, выбрать оптимальные методы лечения, исходя из их потенциальной эффективности и рисков.
В Европейской клинике действует специальное предложение на дренирование асцита в условиях дневного стационара - 50000 руб.
В цену включено:
- Осмотр и консультация хирурга-онколога.
- Общий анализ крови, биохимический анализ крови, ЭКГ.
- УЗИ органов брюшной полости с определением уровня свободной жидкости
- Проведение лапароцентеза с УЗИ навигацией.
- Комплексная медикаментозная терапия, направленная на восстановление водно-электролитного баланса.
Удаление жидкости из брюшной полости проводится с применением наиболее современных методик, передового опыта российских и зарубежных врачей. Мы специализируемся на лечении рака и знаем, что можно сделать.

В нормальных условиях в замкнутом пространстве брюшной полости не должно быть жидкости. Асцит – это одно из проявлений системной водянки, когда в полостях тела происходит умеренное или выраженное накопление экссудата или транссудата, обусловленное различными видами патологии. Злокачественный асцит, возникающий на фоне раковой опухоли, является поздним симптомом: наличие выпота в брюшной полости с тенденцией к неуклонному увеличению размеров живота указывает на неблагоприятный прогноз болезни.
- Описание
- Причины
- Симптомы
- Диагностика
- Лечение
- Прогноз
В подавляющем большинстве случаев (около 85%) асцит возникает на фоне различных вариантов патологии печени, не связанных с онкологической заболеваемостью (портальная гипертензия, печеночная недостаточность, алкоголизм). Застойная сердечная недостаточность может стать причинным фактором водянки разных органов. При обнаружении патологического синдрома скопления свободной жидкости в животе врач в первую очередь будет исключать заболевания, провоцирующие портальный асцит. Однако сочетание быстрого похудения с накоплением выпота в брюшной полости может указывать на онкологическую патологию.
Симптомы патологии
Типичное проявление асцита – увеличение размеров живота. Этот симптом может стать основанием для обращения к врачу при бессимптомном течении болезни. При прогрессировании опухоли появляются следующие симптомы:
- болевые ощущения разного характера в животе и груди;
- отечность конечностей;
- температурная реакция от субфебрилитета до выраженной гипертермии;
- нарушение работы пищеварительной системы на фоне сдавливания органов (тошнота, рвота, диарея или запор, отсутствие аппетита);
- одышка из-за нарушений дыхания (сдавление легочной ткани);
- сухость кожи и постоянное ощущение жажды, обусловленное обезвоживанием;
- падение артериального давления.
Важный диагностический критерий – наличие выпота в других полостях тела. Асцит при раке яичников может сочетаться с гидротораксом (накопление свободной жидкости в легких), что указывает на синдром Мейгса, часто возникающий при гинекологической патологии.
Причины появления асцита при раке
Злокачественные новообразования являются причиной водянки брюшины в 10% случаев. Асцит брюшной полости при онкологии возникает при следующих заболеваниях:
- рак внутренних органов (желудок, печень, панкреатическая железа, толстый кишечник);
- гинекологическая патология (рак яичников, матки или молочных желез);
- мезотелиома брюшины;
- метастатический рак;
- лимфогранулематоз (болезнь Ходжкина);
- рак крови (лейкемия).
Наличие выпота в животе при отсутствии симптомов портальной гипертензии или сердечной недостаточности указывает на высокий риск опухолевой патологии. Необходимо проводить комплексное обследование, чтобы максимально быстро выявить новообразование в органах живота и малого таза.
Основные принципы диагностики
Внешнее увеличение размеров живота является основой классификации асцита:
- степень – наличие выпота определяется только при УЗИ, а внешне нет никаких изменений;
- степень – живот умеренно увеличен, врач с помощью перкуссии без особых сложностей выявит жидкость в брюшной полости;
- степень – большой размер живота с выраженным напряжением брюшной стенки.
Инструментальная диагностика предполагает проведение следующих исследований:
- ультразвуковое сканирование брюшной полости;
- компьютерная томография;
- МРТ с контрастом.
Обязательный специфический метод обследования – диагностический лапароцентез (прокол передней брюшной стенки специальным инструментом с последующей аспирацией выпота из живота). Основной целью исследования является возможность получить асцитическую жидкость с последующим проведением диагностических тестов для выявления опухолевых клеток.
Методы лечения
Выпот в животе, как поздний симптом рака, может существенно осложнить течение болезни. Лечение асцита при онкологии надо проводить параллельно с основной терапией злокачественной опухоли, используя хирургические и медикаментозные методы.
1. Хирургическое вмешательство
Показаниями к лечебно-диагностическому лапароцентезу при злокачественных вариантах асцита являются:
- первичное выявление выпота в брюшной полости, когда надо поставить диагноз;
- 2-3 степень асцита с наличием симптомов, осложняющих общее состояние больного человека.
Важные факторы оперативного лечения – объем удаляемой асцитической жидкости и предотвращение осложнений. Обычно используют следующие варианты лечебного лапароцентеза:
- одномоментная аспирация выпота в объеме 6-10 литров;
- длительное выведение асцитической жидкости через постоянный перитонеальный катетер;
- комбинация методов – на первом этапе лечения удаление большого объема, а в последующие дни ежедневная аспирация около 1 литра выпота.
Паллиативные (облегчающие жизнь пациенту) варианты операций при асците используют в тех ситуациях, когда на фоне злокачественной опухоли необходимо обеспечить человеку комфорт повседневной жизни. Для этого применяют следующие виды вмешательств:
- перитонеовенозное шунтирование (создание постоянного оттока жидкости через вены печени);
- частичное удаление внутренней серозной поверхности брюшной полости (деперитонизация);
- оментогепатофренопексия (специальное подшивание большого сальника для увеличения всасывающей способности перитонеальной полости).
Для каждого метода существуют показания и противопоказания, поэтому врач будет выбирать разновидность хирургического вмешательства индивидуально.
2.Лекарственная терапия
Основные задачи медикаментозного лечения – симптоматическое воздействие и уменьшение накопления асцитического выпота. Для этого врач назначит следующие лекарственные средства:
- мочегонные препараты;
- диетотерапия с ограничением соли;
- обезболивание;
- терапия сопутствующей патологии.
Длительное применение медикаментов облегчит жизнь пациенту, но не избавит от онкологической патологии. Обязательное условие терапии – воздействие на очаг раковой опухоли (химиотерапия, лучевое воздействие, хирургическое удаление).
Прогноз
Быстрое и выраженное накопление выпота в животе является прогностически неблагоприятным синдромом, особенно если асцит нечувствителен к лекарственной терапии. Лапароцентез с аспирацией жидкости на определенное время устранит неприятные симптомы. Прогноз для жизни зависит от локализации раковой опухоли, стадии онкопатологии и наличия метастазов. Выявление 2-3 степени асцита необходимо рассматривать, как одну из последних стадий злокачественного новообразования.
Разработка современных методик терапии может стать основой для успешного лечения запущенных форм рака с асцитом. При метастатическом раке и опухоли печени применяются следующие эффективные методики:
- радиохирургическое удаление злокачественного очага;
- селективная химиотерапия (введение препарата непосредственно в опухолевую ткань);
- прицельная селективная радиотерапия (введение раствора с радиоактивным изотопом в злокачественное новообразование).
Обнаружение злокачественного асцита в большом объеме существенно ухудшает прогноз для жизни, но это вовсе не приговор: использование новейших высокотехнологичных методик может стать основной для успешной борьбы с опухолью.
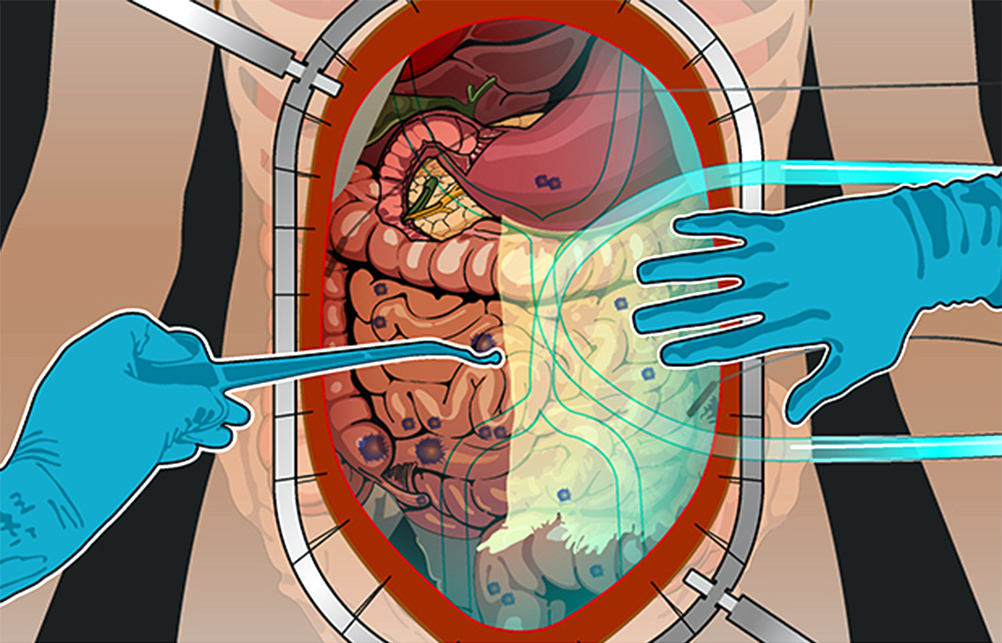
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
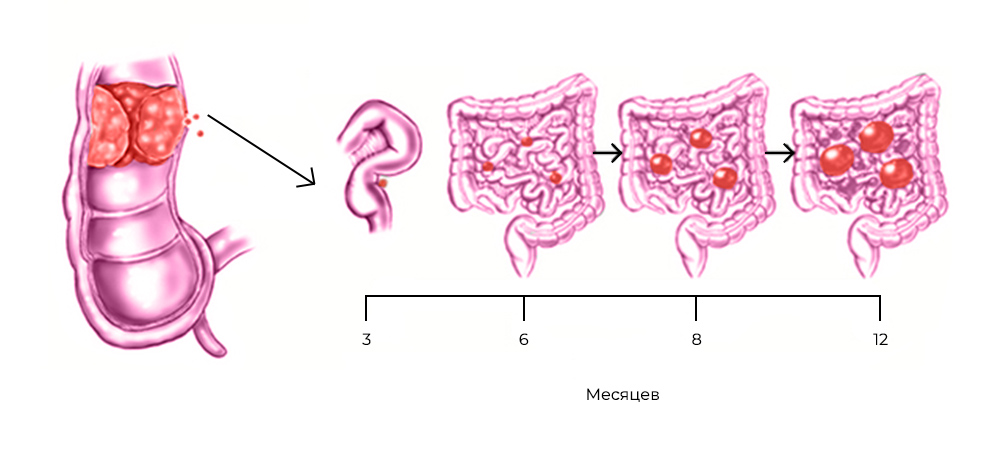
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
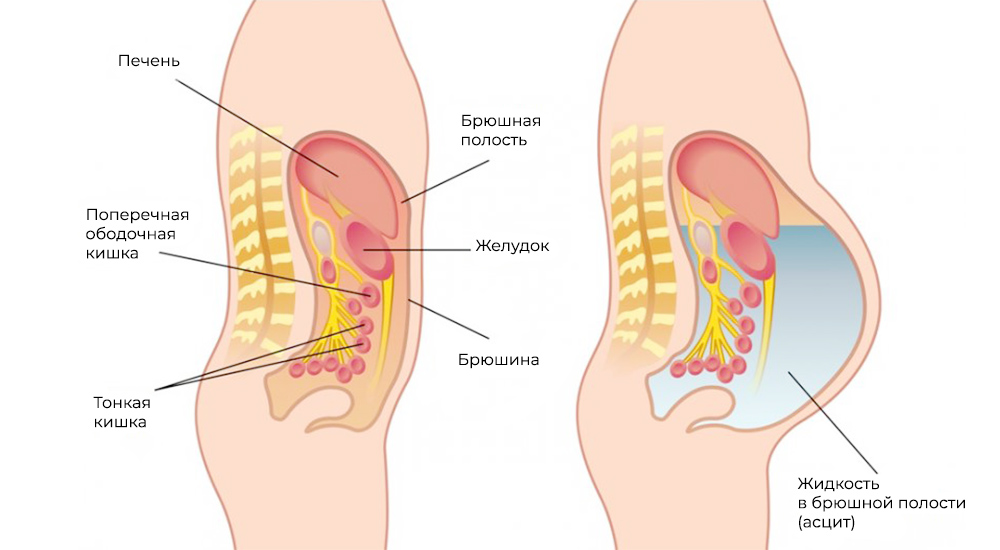
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
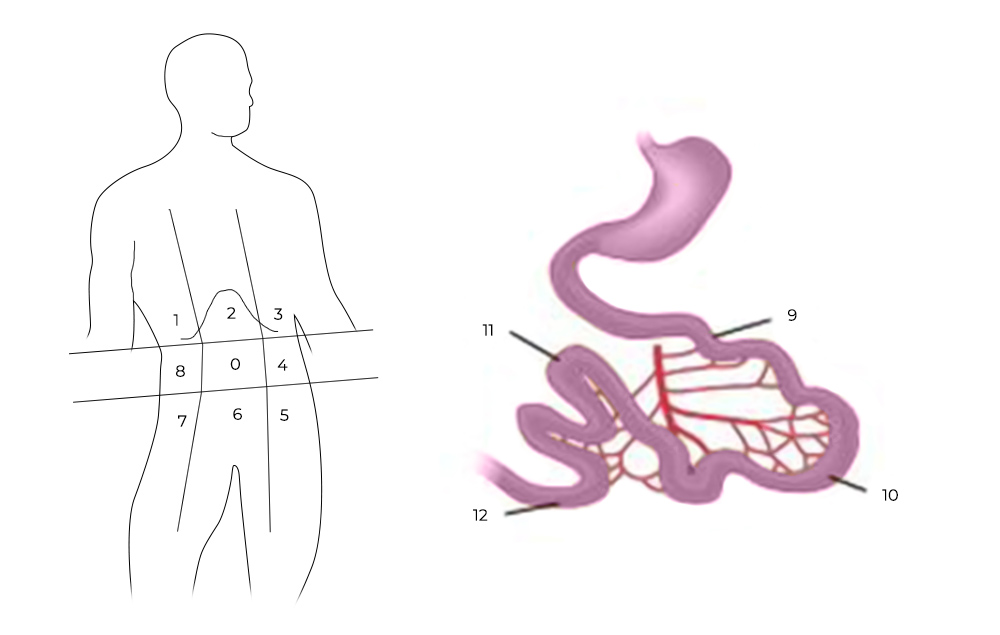
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
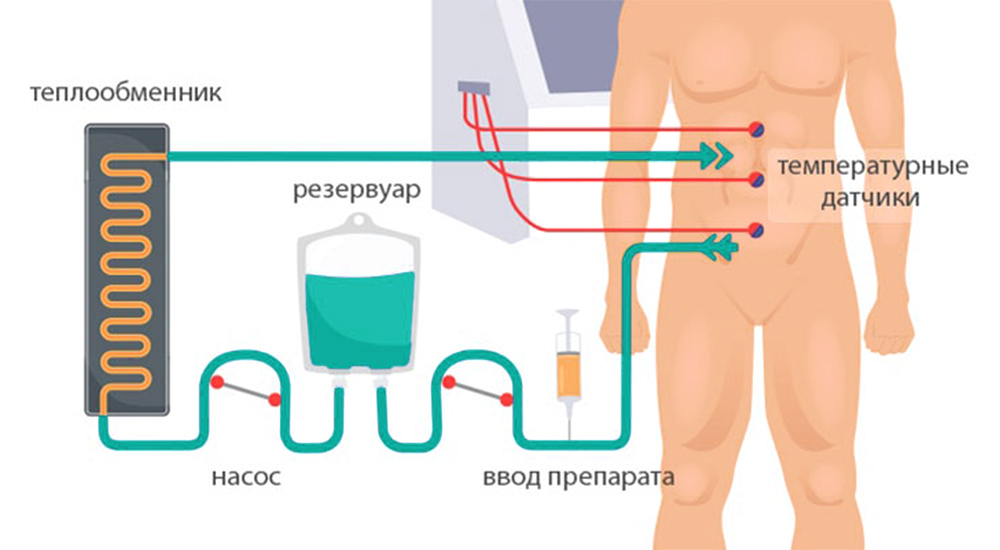
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Читайте также:

