Рак щитовидной железы фадеев
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В представленном обзоре освещены современные подходы к диагностике, терапии и динамическому наблюдению дифференцированного рака щитовидной железы
Для цитирования. Нечаева О.А., Бавыкина Л.Г., Древаль А.В. Дифференцированный рак щитовидной железы: современные подходы к диагностике, тера- пии и динамическому наблюдению (обзор) // РМЖ. 2016. No 1. С. 9–12.
Рак щитовидной железы (РЩЖ) является наиболее распространенным злокачественным заболеванием эндокринных органов с неуклонно растущим числом впервые выявленных форм как в России, так и в США и странах Европы. Это обусловлено прежде всего увеличением выявляемости данной патологии благодаря появлению высокотехнологичных методов диагностики и визуализации щитовидной железы (ЩЖ) и общей высокой онконастороженностью населения.
РЩЖ обычно развивается в узловых образованиях, которые могут встречаться в любом возрасте, хотя заболеваемость узловым зобом достоверно увеличивается с возрастом. Тем не менее большинство таких образований носит доброкачественный характер, и только около 2–5% являются злокачественными. Их основная масса представлена высокодифференцированным РЩЖ [1, 2, 16].
Высокодифференцированный РЩЖ представлен эпителиальными опухолями из фолликулярных клеток и подразделяется на папиллярную и фолликулярную карциному.
Анапластический, или низкодифференцированный, РЩЖ характерен для старшей возрастной группы и часто возникает в результате накопления мутаций при длительном течении дифференцированных форм [6, 7].
Для описания анатомического распространения опухоли и прогноза возможной смертности используется классификация опухолей TNM [5, 15]. Для прогнозирования риска рецидивирования опухоли Американская тиреоидологическая ассоциация (АТА) предложила использовать дополнительную классификацию, учитывающую клинико-патологическую характеристику опухоли [9].
Несмотря на последние успехи в изучении патогенеза дифференцированного рака щитовидной железы (ДРЩЖ) с точки зрения молекулярно-генетических механизмов, хирургическое удаление остается самым частым методом лечения. При наличии очага >1 см в диаметре без прорастания капсулы и отсутствии метастазов целесообразной является экстрафасциальная тиреоидэктомия без удаления лимфатических узлов шеи. Вместе с тем после анализа клинических, ультразвуковых признаков и цитологического исследования в некоторых случаях может быть рекомендовано проведение молекулярно-генетического анализа в дополнение к принятым оценкам риска злокачественности [2, 4, 5–7].
Диагностика ДРЩЖ базируется на проведении тонкоигольной аспирационной биопсии (ТАБ) с последующим цитологическим исследованием, что не всегда приводит к однозначным результатам. Примерно в 25%случаев клиницист получает неопределенный цитологический диагноз. Российская ассоциация эндокринологов (РАЭ) рекомендует использовать оценку цитологического исследования в соответствии с международной классификацией Bethesda System. К неопределенным цитологическим диагнозам в соответствии с этой системой относятся: недиагностический или неудовлетворительный пунктат (Bethesda I); атипия неопределенного значения или фолликулярные изменения неопределенного значения (Bethesda III); фолликулярная неоплазия или подозрение на фолликулярную неоплазию (Bethesda IV) и подозрение на рак (BethesdaV). Тактика врача при цитологическом диагнозе из категорий Bethesda I и Bethesda III предполагает проведение повторной ТАБ с переклассификацией в другую группу по системе Bethesda. При отнесении цитологического результата к диагностическим категориям Bethesda IV и Bethesda V рекомендуется проведение гемитиреоидэктомии с последующим гистологическим анализом интраоперационного материала [3].
Диагностическое хирургическое вмешательство является стандартом лечения при подозрении на злокачественное новообразование. Однако, согласно рекомендациям АТА, опубликованным в 2016 г., молекулярный анализ образца, полученного методом ТАБ, может являться целесообразной альтернативой хирургическому методу диагностики. Например, наиболее часто встречающимися мутациями при папиллярном РЩЖ являются точечные мутации генов BRAF и RAS [7, 8, 11–14], а также перестановки генов RET / PTC [7, 8 ,11, 14]. Из них два наиболее распространенных типа RET / PTC перестановок – это RET / PTC1 (RET / CCDC6) и RET / PTC3 (RET / ELE1) [7, 8, 11]. Фолликулярный РЩЖ обычно связан с точечными мутациями в гене RAS или перестановкой генов PAX8 / PPARγ [6–8, 14]. Наличие дополнительных мутаций в генах TP53 и CTNNB1 свидетельствует о более агрессивном течении хорошо дифференцированного РЩЖ, а также встречается у малодифференцированных карцином и при анапластическом РЩЖ [8, 11, 14]. Медуллярные карциномы ЩЖ часто ассоциированы с точечными мутациями генов RET и RAS. Соматические мутации генов TSHR и GNAS часто встречаются при автономно функционирующих доброкачественных узлах ЩЖ, хотя определенные точечные мутации гена TSHR связаны с фолликулярной карциномой ЩЖ [7, 8, 11, 14]. Таким образом, для диагностики фолликулярных неоплазий (цитологическое заключение соответствует категории Bethesda IV) на сегодняшний день предложена диагностическая панель из 7 генов: BRAF, KRAS, HRAS, NRAS, RET/PTC1, RET/PTC3, PAX8/PPARγ с чувствительностью 57–75% и специфичностью 97–100% [7, 9, 11, 14].
В случае категории, соответствующей критериям Bethesda III, может быть использована молекулярно-генетическая панель с определением BRAF, NRAS, HRAS, KRAS, RET/PTC1 , RET/PTC3, PAX8/PPARγ мутаций, которая имеет значительно более высокую чувствительность в определении злокачественного потенциала (63–80%) по сравнению с простым цитологическим исследованием (5–15%). Узлы из диагностической категории Bethesda III с точечной мутацией BRAF V600E и перестановкой генов RET/PTC или PAX8/PPARγ имеют более 95% риска злокачественности. При подозрении на папиллярный РЩЖ (Bethesda V) может быть исследован ген BRAF (чувствительность – 36%, специфичность – 100%) или панель генов BRAF, RAS, RET/PTC, PAX8/PPARγ (чувствительность – 50–68%, специфичность – 86–96%) [3, 4, 7, 9, 11].
Однако несмотря на прорыв в области молекулярной диагностики, в настоящее время не существует единого оптимального молекулярно-генетического анализа, который может окончательно исключить злокачественность новообразования во всех случаях неопределенного цитологического заключения [7–14].
Вместе с тем рекомендации по лечению ДРЩЖ четко определяют возможности использования хирургии, радиоактивного йода, применения супрессивной терапии левотироксином и ингибиторов протеинкиназы [2, 9]. Медиана выживаемости при ДРЩЖ составляет >10 лет для 85% всех пациентов, получавших лечение [17, 18].
В настоящее время обязательным методом лечения пациентов с диагнозом ДРЩЖ, как сказано выше, является хирургическое удаление органа с последующей супрессивной терапией левотироксином. В случае умеренного или высокого риска рецидивирования (табл. 1) в дальнейшем проводится терапия радиоактивным йодом (радиойодтерапия) (РЙТ). Лучевая и химиотерапия не играют ведущей роли в лечении ДРЩЖ вследствие своей низкой эффективности. Исключениями могут быть устойчивость к радиоактивному йоду, наличие метастазов, невозможность полной хирургической резекции опухоли [2, 9, 17–19, 28, 29, 39]. Для злокачественных образований >4 см с метастазированием в регионарные лимфатические узлы или отдаленными метастазами рекомендована тотальная тиреоидэктомия с последующей РЙТ. Методом выбора может быть и гемитиреоидэктомия при наличии очага в одной из долей не более 2 см по мнению РАЭ и 4 см по мнению АТА [2, 9].

Показания к проведению РЙТ целесообразно оценивать с точки зрения наличия риска возможного рецидива. Обязательным использование данного метода является при злокачественных образованиях >4 см с наличием отдаленных метастазов, экстраорганным ростом, агрессивным гистологическим строением опухоли и высоким индивидуальным риском. Относительными показаниями к РЙТ являются небольшой размер очага (1–4 см), мультифокусная микрокарцинома с экстратиреоидным распространением и обнаруженной точечной мутацией гена BRAF V600E. При низком риске прогрессии ограничиваются только хирургическим лечением с повторной оценкой возникновения рецидива при каждом визите пациента в течение первых 2-х лет наблюдения [40–43].
После тиреоидэктомии, независимо от необходимости применения радиоактивного йода, должна быть назначена терапия левотироксином для компенсации гипотиреоза и минимизации стимулирующего действия тиреотропного гормона (ТТГ) на рост опухоли. Целевые значения такой супрессии определяются в соответствии с индивидуальным риском возможности возникновения рецидива. По мнению экспертов АТА, супрессивная терапия должна проводиться с достижением уровня ТТГ 10 мЕд/л и отрицательном результате при радиоиодизотопном исследовании. КТ целесообразно использовать при подозрении на метастазы в легкие и средостение [2, 9].
Последним достижением в ведении пациента с ДРЩЖ стала возможность молекулярно-генетического анализа материала опухоли ЩЖ. Определение мутаций гена BRAF и других потенциальных мутаций (например, гена TERT) имеет высокий потенциал для уточнения оценки риска. Например, выявление мутации BRAF V600E связано со значительно более высоким риском рецидива ДРЩЖ [7, 9, 12, 13]. Перспективными направлениями молекулярно-генетического метода являются: диагностика как злокачественных, так и доброкачественных новообразований ЩЖ; прогнозирование риска малигнизации доброкачественных узлов при обнаружении мутаций, характерных для карцином, а также возможность прогнозирования рецидива и выявления пациентов, резистентных к РЙТ в периоперационном периоде [7–11].
Таким образом, на сегодняшний день клиницист может обеспечить индивидуальный подход к ведению пациента с ДРЩЖ и, в перспективе использования новых инструментов анализа и терапии, сократить диагностический поиск и количество оперативных вмешательств при ДРЩЖ. 
Источник:
Фадеев В.В. То , что вы хотели бы знать о гипотиреозе – недостатке гормонов щитовидной железы / В. В. Фадеев, Москва, 2013
Где находится щитовидная железа и как она работает?
Как часто встречается гипотиреоз?
Как указывалось, гипотиреоз — это частое заболевание. Оно встречается у 1—10% взрослых людей. В 8—10 раз чаще он обнаруживается у женщин, при этом его распространённость прогрессивно нарастает с возрастом у лиц обоего пола. В некоторых странах среди лиц старше 60 лет распространённость гипотиреоза достигает 9—16%. Для Москвы, по нашим данным, эта цифра составляет примерно 6—7%, что тоже немало. Среди молодых женщин (25—35 лет) распространённость гипотиреоза составляет примерно 2—4%. У детей гипотиреоз встречается достаточно редко.
Каковы наиболее частые причины гипотиреоза?
Гипотиреоз развивается в результате разрушения клеток щитовидной железы, которые синтезируют тироксин, при этом для развития гипотиреоза должно быть разрушено большинство этих клеток.
Наиболее часто гипотиреоз развивается вследствие аутоиммунного тиреоидита, и именно этот, медленно и подспудно развивающийся гипотиреоз представляет наибольшую проблему для выявления. Аутоиммунный тиреоидит – достаточно сложное заболевание. Суть его заключается в том, что по не вполне понятной причине иммунная система даёт сбой, в результате которого направляет всю свою мощь против собственных клеток, в данном случае – против клеток щитовидной железы. В результате в щитовидной железе развивается воспаление, в результате которого щитовидная железа разрушается и перестаёт вырабатывать достаточно тироксина. Это разрушение в большинстве случаев происходит медленно – много лет и даже десятилетий. В крови у большинства пациентов с аутоиммунным тиреоидитом обнаруживаются антитела к щитовидной железе – белки, участвующие в развитии этого заболевания. Важно отметить, что обратное утверждение не будет правильным – то есть обнаружение антител к щитовидной железе далеко не всегда свидетельствует о наличии аутоиммунного тиреоидита, и уж тем более гипотиреоза. К сожалению, методы лечения, которые могли бы воздействовать на сам процесс иммунного воспаления в щитовидной железе, в настоящее время не разработаны. Разработано лишь лечение конечного результата аутоиммунного тиреоидита – гипотиреоза, о котором пойдёт речь дальше.
Другими частыми причинами гипотиреоза (около 1/3 случаев) являются операции на щитовидной железе, которые могут предприниматься по поводу различных заболеваний (токсический зоб, многоузловой и узловой зоб, опухоли щитовидной железы и проч.), а также терапия радиоактивным йодом – основным методом лечения токсического зоба за рубежом. Причина гипотиреоза в этих случаях очевидна – в первом щитовидная железа удаляется хирургически, а во втором – подвергается лучевому разрушению. В обоих случаях выявление гипотиреоза не представляет серьёзных трудностей, поскольку он развивается в ближайшие сроки после лечения и активно отслеживается врачами.
Вопреки бытующим представлениям, лёгкий и умеренный дефицит йода, который наблюдается на большей части территории России, практически никогда не приводит к развитию гипотиреоза у взрослых. Хронический йодный дефицит может приводить к серьёзным изменениям со стороны как щитовидной железы, так и – в определённой ситуации и определённом возрасте – других систем, но эта проблема выходит за рамки нашего обсуждения. Здесь следует лишь оговориться, что йод является субстратом для производства тиреоидных гормонов. В ситуации же, когда у взрослого человека развился гипотиреоз, ему нужна терапия препаратами тирео- идных гормонов (тироксином), но не йодом. Если разрушены клетки щитовидной железы (тиреоидит, хирургическое удаление), сколько ни назначай йод, эти клетки не начнут синтезировать из него гормоны. По аналогии: если сломался двигатель у машины, сколько бензина ни заливай в бак, это не устранит поломки.
Как проявляется и чем опасен гипотиреоз?
При гипотиреозе происходит нарушение всех обменных процессов в организме. Нарушается сердечная деятельность, работа нервной системы, желудка, кишечника, почек, печени и половой системы. Гипотиреоз может проявиться нарушением работы любого органа и системы.
Все без исключения симптомы и проявления гипотиреоза характеризуются следующими особенностями:
Как устанавливается диагноз гипотиреоза?
Подтвердить или отвергнуть диагноз гипотиреоза достаточно просто. Для этого проводится определение уровня тиреотропного гормона (ТТГ). Это наиболее важный и абсолютно необходимый тест для диагностики любых нарушений щитовидной железы. Определение уровня ТТГ важнее, чем определение уровня Т4, поскольку на начальных этапах нарушения функции щитовидной железы происходит изменение именно уровня ТТГ. Важно подчеркнуть, что наличие нормального уровня ТТГ практически полностью исключает нарушение функции щитовидной железы. При гипотиреозе уровень ТТГ будет повышен. При необходимости врач дополнит исследование, определив уровень Т4 в крови. При явном гипотиреозе уровень Т4 понижен. В гормональных лабораториях проводятся два варианта тестов для определения Т4: может быть определён так называемый общий Т4 — это весь тироксин, который находится в крови, и свободный Т4. Последнее исследование, в котором определяется не связанный с белками гормон, значительно более информативней, и, за исключением достаточно редких ситуаций, именно на него желательно ориентироваться.
Кому необходимо определение уровня ТТГ в крови, чтобы исключить или подтвердить нарушение функции щитовидной железы?
Среди всевозможных гормональных исследований, которые назначают не только эндокринологи, но и врачи многих других специальностей, тест на ТТГ — абсолютный рекордсмен. Это самое часто проводимое во всём мире гормональное исследование. Причина этого становится понятной, если проанализировать симптомы гипотиреоза, приведённые выше. По большому счёту вряд ли найдётся взрослый человек, у которого хотя бы временно не присутствовал бы хоть один из них. Привести хотя бы такие симптомы, как депрессия, прибавка веса, сухость кожи и т. п.?
Итак, определение уровня ТТГ показано в следующих ситуациях:
необъяснимая прибавка веса и невозможность его снизить на фоне реально соблюдаемой диеты и физических упражнений;
склонность к запорам или неустойчивый стул;
чувство зябкости (всё время холодно, когда окружающие чувствуют себя комфортно);
вялость, медлительность, быстрая утомляемость;
снижение памяти и концентрации внимания;
депрессия, тревожность;
сухость и огрубение кожи;
интенсивное выпадение волос;
понижение голоса и его беспричинная охриплость;
ощущение задержки жидкости, отёчность лица;
распространённая болезненность суставов;
любые нарушения менструального цикла (отсутствие, нерегулярность, обильность и т. д.);
снижение полового влечения;
выделения из молочных желёз (вне связи с грудным вскармливанием);
бесплодие2;
склонность к инфекционным заболеваниям;
храп во сне;
неприятное ощущение в области шеи (чувство комка в горле);
витилиго (участки депигментации кожи).
Этот список можно продолжать до бесконечности, тем не менее выделим группы людей, у которых вероятность наличия гипотиреоза существенно выше, чем у других (по сути, это продолжение списка показаний для определения уровня ТТГ):
женщины старше 40 лет;
женщины в послеродовом периоде (через 6 месяцев), при наличии перечисленных симптомов;
повышение уровня холестерина в крови;
в прошлом было какое-то заболевание щитовидной железы (любое);
в прошлом проводилась лучевая терапия на область головы и/или шеи;
приём таких препаратов, как литий и амиодарон (кордарон);
наличие таких заболеваний, как болезнь Адцисона (надпочечниковая недостаточность); сахарный диабет 1-го типа; пернициозная анемия; ревматоидный артрит; системная красная волчанка (по сути, любые аутоиммунные заболевания);
у прямых родственников было (есть) заболевание щитовидной железы;
увеличение щитовидной железы.
Ловлю себя на мысли, что проще описать ситуации, в которых определение ТТГ не показано или, лучше сказать, вряд ли показано. Пожалуй, это молодые люди, преимущественно мужского пола, у которых нет ни малейших проблем со здоровьем. Гели речь идёт о женщинах (молодых и здоровых), особняком стоит вопрос о необходимости определения уровня ТТГ при планировании беременности. В силу того, что гипотиреоз определяется примерно у 2% беременных женщин, ряд врачебных сообществ рекомендует активно предлагать женщинам проведение теста на ТТГ при планировании беременности или на её ранних сроках.
Как лечится гипотиреоз?
Гипотиреоз, как указывалось, это недостаток в организме гормона тироксина. В связи с этим лечение подразумевает возмещение этого недостатка, которое называется заместительной терапией. Другими словами, лечение гипотиреоза не подразумевает
– Бесплодие пары определяется как отсутствие зачатия после одного года регулярной половой жизни (в среднем 2 раза в неделю) без применения каких- либо противо зачаточных средств и методов.
назначение какого-то вещества, не свойственного организму человека, — при этом необходимо возместить в строго необходимых количествах недостающий тироксин. Это довольно просто сделать, ежедневно принимая внутрь современные таблетирован- ные препараты тироксина, которые по структуре абсолютно ничем не отличаются от того тироксина, который в норме производит щитовидная железа человека. К таким препаратам относится Эутирокс®. Правильно подобранная заместительная терапия гипотиреоза предотвращает все возможные неблагоприятные последствия дефицита тиреоидных гормонов и позволяет вести образ жизни, который практически не отличается от обычного. В подавляющем большинстве случаев для назначения заместительной терапии тироксином не требуется госпитализации.
Если речь идёт о выраженном гипотиреозе, особенно у пожилых людей с сердечнососудистой патологией, терапия начинается с небольшой дозы препарата (обычно 25 мкг, например, Эутирокс® 25 мкг), которая постепенно увеличивается до полной. Молодым людям препарат может быть сразу назначен в полной дозе, которая для начальной ориентировки рассчитывается исходя из веса пациента (1,6 мкг на килограмм массы тела). Аналогичным образом поступают в ситуации, когда щитовидная железа была удалена оперативно — на следующий день назначается полная заместительная доза, которая в дальнейшем индивидуально корригируется.
После того как пациент с гипотиреозом впервые начинает получать заместительную терапию тироксином, проявления заболевания и его симптомы проходят не сразу после приёма первой же таблетки. На это требуется время, измеряемое неделями, после начала приёма полной дозы препарата. После того как достигнуто улучшение состояния, ни в коем случае нельзя прекращать приём тироксина. Иначе все симптомы и проявления гипотиреоза через некоторое время возникнут вновь.
/. /
Как нужно изменить свой образ жизни при гипотиреозе?
Если вы принимаете нужную дозу тироксина, которая обеспечивает стойкое поддержание уровня ТТГ на нормальном уровне, то нет никаких ограничений в образе жизни. Вы можете питаться как обычно, заниматься любым видом спорта, вам не противопоказан никакой климат и никакой вид деятельности. Принимайте препарат — и живите счастливо!
Нужно ли при гипотиреозе контролировать уровень антител к щитовидной железе?
Влияют ли сопутствующие заболевания и приём других препаратов на подходы к заместительной терапии гипотиреоза?
Если у пациента развился гипотиреоз, то независимо от наличия или отсутствия у него сопутствующих заболеваний ему показана заместительная терапия тироксином[1]. Варьироваться может лишь скорость достижения полной заместительной дозы тироксина, которая должна быть небольшой у пожилых пациентов с сердечно-со- судистой патологией.
Параллельный приём ряда препаратов может отразиться на терапии тироксином, то есть при этом может понадобиться изменение его дозы как в одну, так и в другую сторону. К таким препаратам относятся эстрогены, включая оральные контрацептивы, тестостерон, некоторые противосудорожные средства, ряд антидепрессантов. Препараты железа, сои, кальция, а также некоторые средства для нормализации уровня холестерина крови могут обусловить нарушение всасывания тироксина в кишечнике. Врача необходимо информировать о приёме всех препаратов, а также минеральных и витаминных комплексов. Следует избегать приёма пищевых добавок, содержание которых зачастую реально не известно.
Следует ли на фоне приёма тироксина ограничивать физические нагрузки?
Если гипотиреоз компенсирован (стойкая нормализация уровня ТТГ), они полезны, как и всем людям. Можно привести много фамилий рекордсменов мира по всевозможным видам спорта, которые завоевывали свои награды, принимая тироксин в связи с гипотиреозом.
Что такое субклинический гипотиреоз и нужно ли получать при нём заместительную терапию?
Есть ли какие-то особенности лечения гипотиреоза и наблюдения пациентов с гипотиреозом, развивающимся после операции на щитовидной железе и после терапии радиоактивным йодом?
Принципиальных отличий, пожалуй, нет. Тем не менее в ряде случаев, если пациент в прошлом перенёс более или менее длительное повышение функции щитовидной железы (токсический зоб), по поводу которого и было предпринято оперативное лечение, какое-то время после операции, даже при условии адекватной компенсации гипотиреоза, отмечаются некоторые симптомы, сходные с таковыми при гипотиреозе. В ряде случаев в такой ситуации помогает небольшое увеличение дозы тироксина, что ни в коем случае нельзя делать самостоятельно, без врачебного контроля.
Вопрос, который мы не обсуждаем в этой брошюре, это наблюдение пациентов, которые получали комплексное лечение в связи с раком щитовидной железы.
- 2587
- 1,8
- 1
- 3
![]()
Аполлинария Боголюбова![]()
Андрей Панов



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Несомненно, XXI век — время развития научно-технического прогресса. Вместе с совершенствованием технологий приходит и их доступность в повсеместном использовании. Медицина не является исключением. Благодаря развитию технологий диагностики и лечения самых разных заболеваний мы стали спасать тех пациентов, которые когда-то входили в число неизлечимых. Однако не на все сферы медицины прогресс повлиял так положительно. Поэтому сегодня мы бы хотели познакомить вас с такими животрепещущими вопросами медицины, как гипердиагностика и гиперлечение. Сейчас мы остановимся лишь на одной, но весьма значимой стороне данной проблемы — гипердиагностика узлов щитовидной железы, а также гиперлечение этих узлов и рака щитовидной железы.
Что мы знаем сегодня про узлы щитовидной железы?
Однако то, что эта проблема была озвучена совсем недавно, не значит, что о ней больше не надо писать. Мы не хотим загружать вас медицинской терминологией, вновь писать о TI-RADS и разбирать по кусочкам, что может написать функциональный диагност в заключении. Мы обращаемся к вам в качестве потенциальных пациентов и хотим донести мысль, что не всегда узел в щитовидной железе опасен, а рак априори смертелен.
База, с которой нам нужно познакомиться: щитовидная железа
Немножко о щитовидной железе (ЩЖ). Это орган эндокринной системы человека, который располагается на передней поверхности шеи в области гортани, прямо перед щитовидным хрящом. Состоит железа из левой и правой долей и перешейка. ЩЖ богато кровоснабжается разными артериями, а иннервируется гортанными нервами.
Главной функцией щитовидной железы (лат. glandula thyroidea) является синтез тиреоидных гормонов, необходимых нашему организму. Под тиреоидными гормонами мы подразумеваем два соединения: тироксин (Т4) и трийодтиронин (Т3). Основной функцией Т4 и Т3 является увеличение потребления клетками кислорода. Иначе говоря, эти гормоны стимулируют все энергетические процессы в клетке и обмен веществ, причем их влияние распространяется на все клетки организма.
Также клетки ЩЖ производят кальцитонин, ответственный за обмен кальция в организме.
Прямо за щитовидной железой располагаются четыре небольшие паращитовидные железы. Последние производят паратиреоидный гормон, который также отвечает за поддержание уровня кальция в организме, причем в большей степени, чем кальцитонин.
Откуда берется столько случаев рака щитовидки?
Рак щитовидной железы (РЩЖ) — наиболее распространенное злокачественное новообразование эндокринной системы [2]. Все чаще мы слышим, что заболеваемость РЩЖ неуклонно растет. И звучит это ужасающе, однако так ли всё просто на самом деле? Возможно, вы будете шокированы, какая правда скрывается за этими, на первый взгляд, однозначными научными фактами. И прежде, чем мы разберемся с истинной причиной роста заболеваемости РЩЖ, необходимо ознакомиться с тем, какие виды рака щитовидки существуют.
Итак, начнем. Сейчас нам понадобится привести немного численных данных, но не пугайтесь их, всё крайне просто. В научном сообществе выделяют пять типов РЩЖ:
- Папиллярный (80–85% случаев).
- Фолликулярный (10–15% случаев).
- Медуллярный (5% случаев).
- Низкодифференцированный (1% случаев).
- Недифференцированный (0,1–0,2% случаев).
Наиболее благоприятными принято считать два первых типа РЩЖ. И как мы можем заметить, они встречаются наиболее часто. Их также называют высокодифференцированными типами рака. Медуллярный, низкодифференцированный и недифференцированный типы считаются агрессивными формами РЩЖ. В нашей статье мы сделаем акцент лишь на первых двух типах РЩЖ, так как они являются наиболее распространенными.
Что касается рака — если клетки, из которых состоит опухоль, являются высокодифференцированными, в большинстве случаев врачи считают исход благоприятным. Однако если опухоль состоит из низкодифференцированных клеток, то с большой вероятностью она склонна к агрессивному течению. Как уже было сказано, наиболее часто выявляемые РЩЖ являются высокодифференцированными.
Папиллярный РЩЖ — наиболее распространенная форма: 80–85%. И с самым хорошим прогнозом. Пятилетняя выживаемость пациентов с РЩЖ — 98,1% [2]. Что это значит для пациента? Что наиболее часто выявляемые случаи РЩЖ имеют благоприятный исход!
Рак, ушедший в себя
Подбираемся к корню проблемы: статистика и диагностика
Вернемся к распространенности РЩЖ. Теперь мы готовы понять, что возросшее число случаев данной патологии не является поводом для беспокойства.
В 1975 году заболеваемость РЩЖ составляла 4,9 на 100 000 человек и оставалась относительно стабильной до начала 1990-х годов [6]. За последние 25 лет заболеваемость РЩЖ выросла более чем в 3 раза, то есть на 300% (рис. 1) [7], [8], причем в большинстве случаев за счет высокодифференцированного папиллярного РЩЖ. При этом очень важно понимать, что, несмотря на такой значительный рост, смертность от РЩЖ остается стабильной, примерно 0,5 случаев на 100 000 человек [6].
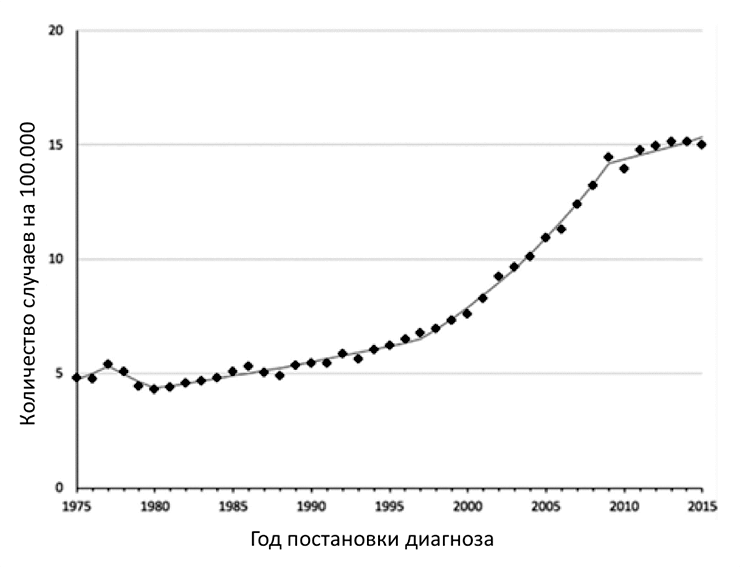
Рисунок 1. Данные заболеваемости раком щитовидной железы в период с 1975 по 2015 годы
Чувствуете, что тут что-то не так? Нет связи между возросшим числом случаев РЩЖ и смертностью от этой патологии! Среди врачей и ученых до сих пор продолжаются дебаты, почему так происходит. Сейчас выделяют несколько теорий. Наиболее вероятная — широкое распространение методов ультразвуковой диагностики (УЗИ). Пусть корни УЗИ уходят к Леонардо да Винчи и XV веку, широкое медицинское распространение данный метод получил с 50-х годов XX века [9], [10]. Сегодня УЗИ является наиболее простым, дешевым, неинвазивным и информативным методом выявления опухолевых образований щитовидной железы. Поэтому, как вы можете догадаться, УЗИ стали делать почти всем, причем независимо от показаний.
Сейчас научное сообщество активно дискутирует на тему, связаны ли такие показатели с истинным увеличением заболеваемости РЩЖ, или же проблема в гипердиагностике тех небольших образований ЩЖ, которые не требуют никакого вмешательства со стороны человека [11], [12].
Для более полного понимания проблемы вернемся на чуть более ранний этап диагностики РЩЖ.
Что такое узлы и как их найти?
Узлы ЩЖ — это радиологически различимые объемные образования в ЩЖ, которые могут быть доброкачественными и злокачественными. Узлы можно найти в 50% случаев всех проводимых УЗИ ЩЖ. При этом только 5% выявляемых образований будут злокачественными [13], [14].
Весомый вклад УЗИ в возросшее количество диагностированных узлов и РЩЖ можно показать на примере одного нашумевшего исследования в Южной Корее [3], [15], [16]. В 1999 году там была утверждена национальная программа, направленная на скрининг злокачественных заболеваний. Под программу попала и щитовидная железы. В результате повсеместного внедрения УЗИ щитовидки частота выявления рака выросла в 15 (!) раз с 1993 по 2011 год. И это мы еще не говорим просто об узлах, которые также могут быть психологической проблемой пациента. Большинство выявляемых случаев — папиллярный РЩЖ. Как вы помните, этот вид рака имеет весьма благоприятный исход. Однако простому населению идея жить с раком настолько чужда и неприятна, что было проведено огромное число полного удаления щитовидных желез, причем часто без видимой на то необходимости! А такая операция имеет серьезные последствия, о которых мы расскажем чуть ниже.
Врачи, осознав свою ошибку, убрали УЗИ щитовидки из списка обязательных скрининговых тестов. И результат не заставил себя ждать. В последней на эту тему публикации 2015 года сказано, что на 30% снизилась заболеваемость РЩЖ, а число операций на щитовидной железе снижалось на 35% ежегодно. Вывод напрашивается сам собой: в основе увеличения числа диагностированных случаев узлов щитовидки (в том числе и РЩЖ) является ставшее таким доступным УЗИ.
Думаем, следует также сказать, что образования ЩЖ выявляются не только при выполнении УЗИ, но и при использовании других методов лучевой диагностики (КТ, МРТ, ПЭТ), что стало возможным благодаря улучшению разрешающей способности оборудования. Следовательно, увеличилось чисто случайно выявляемых образований щитовидной железы (в том числе, рака) — инциденталóм (от англ. incidence — случайность) [17]. Инциденталомы клинически никак себя не проявляют и могут оставаться в организме бессимптомно всю жизнь. И многие из таких инциденталом обнаруживались лишь посмертно, случайно, и не являлись причиной кончины человека. Это позволяет говорить нам о существовании резервуара пациентов с узлами или раком щитовидной железы, который клинически является скрытым и никак себя не проявляет до его случайного обнаружения [18].
Приведенные данные обобщены на рисунке 2.

Рисунок 2. Что даст нам УЗИ щитовидки на самом деле?
рисунок авторов статьи
Напомним, что в нашей статье мы делаем акцент на наиболее распространенных типах РЩЖ (папиллярный, фолликулярный). Агрессивные формы РЩЖ (медуллярный, низкодифференцированный, недифференцированный и редко папиллярный) требуют дальнейшего более детального изучения
Самое главное: почему гипердиагностика и гиперлечение РЩЖ являются проблемой?
В связи с выявленным фактом, что в оперативном лечении таких РЩЖ, вполне возможно, нет необходимости (а ведь удаление ЩЖ сопровождается серьезными последствиями, о чем мы расскажем далее), с 2015 года в США уже принимаются меры по снижению частоты гипердиагностики и гиперлечения [24]. Например, уже настоятельно рекомендовано не проходить скрининг РЩЖ пациентам, у которых нет никаких симптомов, поскольку выявление агрессивных типов рака в этом случае крайне маловероятно.
Что врачи думают о данной проблеме?
Проблема гиперлечения РЩЖ существует не только среди пациентов, но и среди медицинского сообщества.
Конечно, выбор, удалять ли щитовидную железу или нет, стоит больше перед пациентом, нежели перед лечащим врачом. И пациент вполне может выбрать хирургическую тактику лечения. А врач должен определять, сколько ткани щитовидной железы в конкретном случае нужно убирать.
В качестве уменьшения гипердиагностики Американская тиреоидологическая ассоциация рекомендует воздержаться от скрининга и биопсии мелких образований щитовидной железы при отсутствии на то иных клинических симптомов [6].
Как вообще лечат рак щитовидной железы?
Давайте разберемся, какие существуют пути лечения РЩЖ [26].
- Полное удаление ЩЖ, тотальная тиреоидэктомия, вместе с окружающей клетчаткой, а иногда и рядом лежащими лимфатическими узлами.
- Терапия радиоактивным йодом I 131 после тотальной тиреиодэктомии. Не пугайтесь — это не опасно! Такой йод влияет только на клетки щитовидной железы и убивает их.
Почему мы, авторы, так не хотим, чтобы щитовидную железу удаляли без серьезных на то причин? Казалось бы, мы уберем орган, где сидит рак, и будем жить себе спокойно, только лишь принимая препараты гормонов щитовидной железы. Это ведь лучше, чем жить с раком. Или все-таки нет? Так вот, сама сложность вопроса заключается в операции.
Чем чревато полное удаление щитовидки (или, как говорят врачи, тотальная тиреоидэктомия)?
Существует два серьезных осложнения тотальной тиреоидэктомии [27].
- Стойкое снижение функции щитовидной железы (гипопаратиреоз). Наиболее серьезное и жизнеугрожающее осложнение. Итак, прямо за щитовидной железой располагаются четыре паращитовидные железы. Они производят паратиреоидный гормон, который отвечает за обмен кальция в нашем организме (а из него состоит бóльшая часть наших костей!). Паращитовидные железы совсем маленькие: диаметром 5 мм и весом 0,5 г. Их легко не заметить во время операции и удалить вместе с щитовидной железой. К тому же, даже если сохранить эти железы, высока вероятность повреждения питающих их кровеносных сосудов и нервов. А значит, железы просто перестанут работать, и в организм перестанет поступать паратиреиодный гормон. Это чревато возникновением тетанических приступов (подергиваний, которые могут переходит в судороги), нарушением питания волос и ногтей, кожи, эмали зубов, а также отложением кальция вне костей, например, между нервными клетками, что может проявляться в виде паркинсонизма или хореоатетоза — комбинации быстрых порывистых движений с медленными судорожными.
- Повреждение возвратного гортанного нерва и парез гортани. Щитовидная железа располагается прямо перед гортанью. Там же рядом находятся голосовые связки. Все эти структуры иннервируются гортанными нервами. И в случае повреждение некоторых из них — возвратных гортанных нервов — у пациента будет наблюдаться уменьшение активности гортанных мышц, что влечет за собой проблемы работы голосовых связок (в основном, осиплость голоса) и нарушения функций дыхания.
Какой существует выход?
Одним из наиболее перспективных выходов из ситуации является частичное удаление ткани ЩЖ, а именно поврежденной доли. В таком случае пациент, во-первых, избавляется от необходимости принимать пожизненную заместительную терапию гормонами щитовидной железы, а во-вторых, избегает тех серьезных последствий, которые несет за собой операция полного удаления ЩЖ. Однако стоит понимать, что такой вариант не касается опухолей большого размера, а также тех новообразований, которые потенциально могут быть агрессивными (это решает врач!).
Сейчас терапевты и хирурги, которые занимаются патологией щитовидной железы, разделились на два лагеря: те, кто считает, что лучше перестраховаться, и при выявлении даже самой маленькой опухоли удалить всю щитовидную железу, и те, кто считает, что лучшим выходом будет частичное удаление ткани железы, а именно поврежденной ее доли. К сожалению, этот вопрос до сих пор остается открытым. Врачи все еще не могут прийти к единому знаменателю в данном вопросе. Проблема в том, что достоверная объективная доказательная база, на которую врачи могли бы опираться в качестве актуального клинического руководства, вовсе отсутствует. Существуют лишь отдельные исследования, которые обозревают вопрос лишь с одной субъективной стороны [21]. Оптимальным решением данной проблемы, на наш взгляд, стало бы объединение всех существующих статей с объективным и всесторонним взглядом на этот вопрос. Однако подобное исследование лишь ожидает нас в будущем.
Финальный аккорд
С этими и другими мыслями вы можете ознакомится по оставленной нами ссылке [26].
Итак, дорогие наши читатели! Опираясь на всё, о чем мы рассказали выше, мы бы хотели, чтобы вы сделали три главных вывода:
Всем хорошего дня, и берегите свои щитовидки и нервы. :)
Читайте также:



