Рак с метастазами прекратился
Самое сложное в онкологии – когда диагностируют метастазы рака в разных органах, а первичного очага не находят. Обратился больной, метастазы рака в легких, в позвонках, в надпочечниках – в одном 10 см, в другом – 4. А где первичная опухоль – неизвестно.
Лечение надо проводить? Надо! А какое лечение? Какая опухоль?
Опухоли сейчас настолько изменились, что даже при иммуногистохимическом исследовании метастазов трудно сказать где очаг. На КТ, МРТ всего тела также не всегда удается его найти, т.к. при шаге срезов в 1,5-2 см легко пропустить большинство начальных опухолей.
Лечение недопустимо затягивается и упускается шанс для направленного противоопухолевого лечения. Таких больных становится все больше…
В таких случаях действовать нужно путем исключения, перебирая все варианты. А чтобы не уходило время, можно, сдерживать рост метастазирования общей электромагнитной гипертермией, и уже параллельно проводить дополнительные обследования, пытаясь найти очаг.
Метастазы рака нужно начинать лечить
Общая электромагнитная гипертермия – универсальное средство лечения онкологии: температурный фактор работает как при высоко- так и при низкодифференцируемых опухолях, независимо от локализации очага и метастаз. Но, его надо стараться дополнить химиотерапией, иммунотерапией для усиления эффекта и получения устойчивого результата.
Химиотерапия в условиях общей гипертермии эффективнее обычной. Принципиальная разница, что действующих фактора при гипертермии два – температура и химиопрепараты. Разогрев больного в температурных интервалах 42,5–43 °С приводит к прямой гибели опухолевых клеток. Вводимые в момент нагрева химиопрепараты дают больший противоопухолевый эффект и снижение токсического действия. В ходе общей гипертермии стимулируется иммунная система организма, которая и сама начинает оказывать сопротивление раку.
Выживаемость при лечении рака с метастазами методом общей гипертермии:
| Диагноз | 1 год | 3 года | 5 лет |
| Рак желудка, 4-я стадия | 57,0 | 26,3 | 21,5 |
| Рак ободочной кишки, 4-я стадия | 64,5 | 15,2 | 15,2 |
| Рак прямой кишки, 4-я стадия | 61,3 | 52,5 | 27,3 |
| Рак молочной железы (с обширными метастазами), 4-я стадия | 86,6 | 50,9 | 49,3 |
| Саркомы мягких тканей, 4-я стадия | 94,2 | 68,2 | 49,8 |
Расчет произведен с даты первого сеанса общей гипертермии для больных, у которых в результате лечения был получен клинический эффект (полная регрессия, частичная регрессия, стабилизация).
Подсчет показателей выживаемости проводился по методу Каплана — Майера. Результаты достоверны (P Рубрики
- Блог профессора Карева И.Д.
- Истории пациентов
- Новости клиники
- СМИ о клинике
- Услуги
Распад опухоли — это закономерное следствие слишком активного роста ракового узла по периферии или осложнение избыточно высокой реакции распространённого злокачественного процесса на химиотерапию.
Не каждому пациенту доводится столкнуться с тяжелой проблемой распада ракового процесса, но при любой интенсивности клинических проявлений инициируемое распадом злокачественной опухоли состояние непосредственно угрожает жизни и радикально меняет терапевтическую стратегию.

Распад опухоли: что это такое?
Распад — это разрушение злокачественного новообразования, казалось бы, что именно к распаду необходимо стремиться в процессе противоопухолевой терапии. В действительности при химиотерапии происходит уничтожение раковых клеток, только убийство органичное и не массовое, а единичных клеток и небольших клеточных колоний — без гибели большого массива ткани с выбросами в кровь из распадающихся клеток токсичного содержимого.
Под действием химиотерапии клетки рака приходят не к распаду, а к процессу апоптоза — программной смерти. Останки раковых клеток активно утилизируются фагоцитами и уносятся прочь от материнского образования, а на месте погибших возникает нормальная рубцовая ткань, очень часто визуально не определяющаяся.
Регрессия злокачественного новообразования в форме апоптоза происходит медленно, если наблюдать за новообразованием с перерывами в несколько дней, то заметно, как по периферии раковый узел замещается совершенно нормальной тканью и сжимается в размере.
При распаде раковый конгломерат не замещается здоровыми клетками соединительной ткани, мертвые клеточные пласты формируются в очаг некроза, отграничивающийся от остальной раковой опухоли мощным воспалительным валом. Внутри злокачественного новообразования некроз не способен организоваться и заместиться рубцом, он только увеличивается, захватывая новые участки ракового узла, походя разрушая опухолевую сосудистую сеть. Из мертвого очага в кровь поступают продукты клеточного гниения, вызывая интоксикацию.
Массированный выброс клеточного субстрата становится причиной тяжелейшей интоксикации, способной привести к смерти.
Причины распада злокачественной опухоли
Инициируют распад ракового образования всего только две причины: сама жизнедеятельность клеток злокачественной опухоли и химиотерапия.
Первая причина спонтанного — самопроизвольного распада характерна для солидных новообразований, то есть рака, сарком, злокачественных опухолей головного мозга и меланомы. Вторая причина распада типична для онкогематологических заболеваний — лейкозов и лимфом, при онкологических процессах встречается чрезвычайно редко.

Второй вариант распада, типичный для онкогематологических заболеваний, можно констатировать по клиническим симптомам тяжелейшей интоксикации с осложнениями — тумор-лизис-синдрому (СОЛ) и биохимическим анализам крови, где резко повышена концентрация мочевой кислоты, калия и фосфора, но существенно снижен кальций. Конкретная побудительная причина для развития СОЛ — обширное злокачественное поражение с очень высокой чувствительностью к химиотерапии.
При онкологических процессах — раках, саркомах, меланоме реакция на цитостатики преимущественно умеренная и не столь стремительная, поэтому СОЛ принципиально возможен только в исключительных случаях мелкоклеточного, недифференцированного или анаплазированного злокачественного процесса.
Симптомы распада злокачественной опухоли
Клиническим итогом спонтанного распада раковой опухоли становится хроническая интоксикация, нередко сочетающаяся с симптомами генерализованного воспаления вследствие образования гнойного очага. Симптомы разнообразны, но у большинства отмечается прогрессивно нарастающая слабость, повышение температуры от субфебрильной до лихорадки, сердцебиение и даже аритмии, изменение сознания — оглушенность, нарушение аппетита и быстрая потеря веса.
Локальные проявления спонтанного разрушения раковой опухоли определяются её локализацией:
- рак молочной железы, меланома и карцинома кожи, опухоли ротовой полости — гнойная, обильно секретирующая открытая язва с грубыми подрытыми краями, часто источающая гнилостный запах;
- распадающаяся карцинома легкого — при прободении некротической полости в крупный бронх возникает приступообразный кашель с гнойной мокротой, нередко с прожилками крови, иногда случается обильное легочное кровотечение;
- разрушение новообразования органов желудочно-кишечного тракта — развитие локального перитонита при прободении ракового конгломерата в брюшную полость, кровотечение с чёрным стулом и рвотой кофейной гущей;
- распадающаяся карцинома матки — интенсивные боли внизу живота, нарушение мочеиспускания и дефекации при образование гнойных свищей.
Синдром опухолевого лизиса при лейкозах и лимфомах потенциально смертельное состояние, приводящее:
- в первую, очередь к осаждению кристаллов мочевой кислоты в почечных канальцах с выключением функции и острой почечной недостаточностью;
- дополнительно повреждает почки быстрое закисление крови — лактатацидоз;
- снижение уровня кальция и повышение фосфатов инициирует судорожный синдром, дополняемый неврологическими проявлениями вследствие выброса цитокинов;
- повышения калия негативно отражается на сердечной деятельности;
- выброс биологически-активных веществ из клеток приводит к повышению проницаемости мелких кровеносных сосудов, что снижает уровень белков и натрия крови, уменьшает объем циркулирующей плазмы, клинические проявляется падением давления и усугублением поражения почек;
- обширные и глубокие нарушения метаболизма во всех системах органов с исходом в полиорганную недостаточность.
Лечение распада опухоли
Формально при распадающейся опухоли невозможна радикальная операция, зачастую заболевание считается неоперабельным, но химиотерапия и облучение исключаются из программы, потому что способны усугубить некроз. Отчаянное положение пациента и вероятность массированного кровотечения из изъеденного раком крупного сосуда оправдывает выполнение паллиативной операции, основная цель которой — удаление очага хронического воспаления и интоксикации.
Синдром лизиса опухоли лечится многочасовыми капельными вливаниями при усиленном диурезе — выведении мочи, связыванием мочевой кислоты специальными лекарствами. Одновременно поддерживается работа сердечно-сосудистой системы, купируется интоксикация и воспаление. При развитии острой почечной недостаточности проводится гемодиализ.
Синдром лизиса опухоли сложно лечить, но можно предотвратить или хотя бы уменьшить его проявления. Профилактика начинается за несколько дней до курса химиотерапии и продолжается не менее трёх суток после завершения цикла. Кроме специальных препаратов, выводящих мочевую кислоту, назначаются продолжительные капельницы, вводятся недостающие микроэлементы, а избыточные выводятся или связываются другими лекарствами.
Профилактика лизиса опухоли стала стандартом лечения онкогематологических больных, чего нельзя сказать об онкологических пациентах с распадающимися злокачественными процессами, которым очень сложно найти хирурга, готового выполнить паллиативную операцию. Во вмешательстве по санитарным показаниям отказывают из-за сложности выхаживания тяжелого больного после обширного хирургического вмешательства. В нашей клинике никому не отказывают в помощи.

- Что такое метастазы?
- Из-за чего возникают метастазы?
- С какой вероятностью возникают метастазы?
- От чего зависит скорость распространения метастазов по организму?
- Как метастазируют различные виды рака?
- Как проявляются метастазы?
- Как диагностируются метастазы?
- Можно ли вылечить метастазы, и что это дает?
- Где лучше лечить рак с метастазами — в Москве, в Израиле или в Германии?
Что такое метастазы?
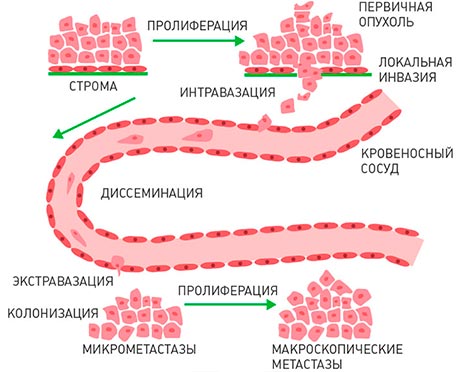
Современные концепции развития метастазов основаны на том, что метастазы развиваются практически сразу, как только появляется сама злокачественная опухоль. Отдельные оторвавшиеся от нее клетки сначала проникают в просвет кровеносного (гематогенный путь диссеминирования) или лимфатического (лимфогенный путь диссеминирования) сосуда, а затем переносятся с током крови или лимфы, останавливаются на новом месте, выходят из сосуда и растут, образуя метастазы. Вначале этот процесс идет медленно и незаметно, поскольку раковые клетки из материнского очага подавляют активность вторичных очагов.
С момента, когда возникают вторичные очаги, рак называют метастатическим. Процесс распространения раковых клеток называют метастазированием.
Способность к метастазированию — один из ключевых признаков злокачественных опухолей, который отличает их от доброкачественных новообразований.
Из-за чего возникают метастазы?
Будут ли отдельные клетки отрываться от материнской опухоли и формировать метастазы? Опухолевые клетки отрываются и будут отрываться всегда. Местные факторы иммунной системы очень долгое время защищают организм от быстрого роста опухолевых клеток. Вопрос лишь в вероятности возникновения метастазов, а она зависит от типа опухоли, скорости ее роста, степени дифференцировки клеток (насколько они отличаются от нормальных), стадии, на которой был диагностирован рак, и других факторов.
Распространившись, опухолевые клетки долго, на протяжении ряда лет, могут оставаться неактивными или расти очень медленно. Точные механизмы запуска быстрого роста метастазов в организме не изучены.
Важен другой факт: по мере увеличения числа клеток в метастазе, они начинают выделять особые вещества - факторы роста. Эти факторы роста стимулируют образование капиллярной сети, что обеспечивает клетки раковой опухоли всеми питательными веществами в ущерб остальным тканям организма.
Можно выделить несколько стадий распространения рака по организму:
- Проникновение опухолевых клеток в ближайший кровеносный или лимфатический сосуд;
- Распространение с током крови или лимфы по различным частям тела;
- Затем раковая клетка останавливается в одном из мелких сосудов и проникает через его стенку в ткани;
- Какое-то время она неактивна или размножается, но очень медленно;
- Бурный рост, разрастание капиллярной сети.
Многие опухолевые клетки погибают на одной из этих стадий. Те, которым удалось выжить, дают начало метастазам.
С какой вероятностью возникают метастазы?

От чего зависит скорость распространения метастазов по организму?
Время, необходимое для клинического проявления первых метастазов, во многом определяется видом опухоли и степенью дифференцировки её тканей.
- Высокодифференцированные опухоли, как правило, метастазируют гораздо реже и позднее, чем низкодифференцированные опухоли.
- В низкодифференцированных опухолях клетки практически утрачивают черты нормальной ткани. Такой рак ведет себя агрессивнее.
Вероятность метастазирования можно снизить при помощи разных методов лечения:
- Химиотерапия. Например, адъювантная химиотерапия проводится после операции и помогает уничтожить раковые клетки, которые, возможно, остались в организме.
- Лучевая терапия.
Существует такое заблуждение, что метастазы возникают из-за проведенных процедуры. Однако, удаление части опухоли или ее биопсия (взятие ткани опухоли на исследование) не повышают частоту развития метастазов.
Как метастазируют различные виды рака?
Наиболее часто метастазы обнаруживаются в лимфатических узлах, печени, легких, существенно реже — в мышце сердца, скелетных мышцах, коже, селезенке, поджелудочной железе. Промежуточное место по частоте обнаружения метастазов при различных видах рака занимают центральная нервная система, костная система, почки, надпочечники.
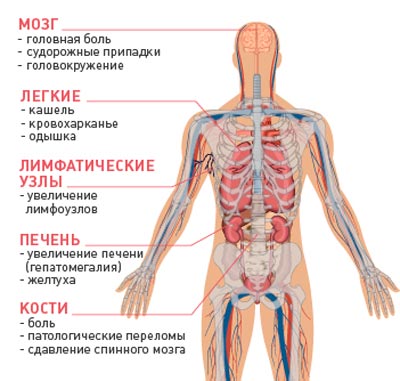
- Метастаз Крукенберга — в яичники;
- Метастаз сестры Марии Джозеф — в пупок;
- Метастаз Вирхова — в лимфоузлы над левой ключицей.
- Рак молочной железы: легкие, печень, кости.
- Рак яичников: брюшина, печень, легкие.
- Рак желудка: печень, брюшина, легкие.
- Рак кишечника (толстой кишки): печень, брюшина, легкие.
- Рак прямой кишки: печень, легкие, надпочечники.
- Рак предстательной железы: кости, легкие, печень.
- Рак матки: печень, легкие, брюшина.
- Рак почек: легкие, печень, кости.
- Рак легкого: надпочечники, печень, второе легкое.
- Меланома: легкие, кожа/мышечные ткани, печень.
- Рак поджелудочной железы: печень, легкие, брюшина.
- Рак щитовидной железы: легкие, печень, кости.
Метастазирование, как правило, происходит в случаях, когда исчерпаны резервы организма в борьбе с опухолью. Метастазы существенно нарушают функционирование всех жизненно важных органов и систем. В подавляющем большинстве смерть онкологических пациентов обусловлена именно метастазами.
Кроме того, метастазы существенно ухудшают общее состояние, нередко сопровождаясь нестерпимыми болями, требующими постоянного обезболивания.
Как проявляются метастазы?
Клиническая картина метастатического рака определяется местом расположения метастазов:
- Поражение брюшины (канцероматоз брюшины) приводит к возникновению асцита, что требует проведения лапароцентеза;
- Поражение плевры (канцероматоз плевры) вызывает развитие экссудативного плеврита, который требует выполнения торакоцентеза;
- Поражение костей и позвоночника ведет к болям в разных частях тела, переломам;
- Поражение легких проявляется в виде одышки;
- Метастазы головного мозга приводят к головным болям, головокружениям, судорогам, нарушению сознания;
- Поражение печени приводит к механической желтухе.
Кроме того, высвобождающиеся в ходе постоянной гибели опухолевых клеток токсины вызывают раковую интоксикацию организма.
Как диагностируются метастазы?
Обзорная рентгенография, ультразвуковое исследование, радиоизотопное исследование, компьютерная томография, магнитно - резонансная томография, позитронно - эмиссионная томография, — все эти методики имеют существенное значение в распознавании метастазов. Эти методики дают возможность уточнить величину, распространенность и характер роста метастазов, их распад, нагноение, прорастание в соседние органы и ткани. Кроме того, эти же методики диагностики позволяют контролировать эффективность лечения по степени регресса метастазов.
Условно можно выделить два этапа диагностики метастазов:
- Первичное обследование, когда только диагностирована основная опухоль;
- Наблюдение у онколога после пройденного лечения. Если изначально метастазы обнаружены не были, а лечение прошло успешно, в будущей все равно придется периодически проходить обследования - есть риск рецидива.
Можно ли вылечить метастазы, и что это дает?
Основной целью активной химиотерапии и лучевой терапии является профилактика возникновения метастазов рака на максимально ранней стадии. Лечение основано на общих принципах лечения опухолей, включая химиотерапию, лучевую терапию, оперативное лечение (при одиночных метастазах).
Лечение метастазов рака имеет определенные сложности. Поэтому в ряде случаев мы проводим лечение метастазов с целью облегчения симптомов и продления жизни. Мы используем системную терапию (химиотерапия, гормонотерапия, таргетная терапия), и местные виды лечения (хирургия, радиотерапия). Лечение тормозит рост опухоли, уменьшает ее размеры, замедляет процесс метастазирования. Это помогает подарить пациенту лишние месяцы, а иногда и годы.
Параллельно проводят поддерживающую терапию, которая помогает справиться с симптомами и побочными эффектами химиотерапии. При болях назначают сильные обезболивающие средства.
За рубежом при метастатических очагах в печени часто используют чрескожную чреспеченочную радиочастотную аблацию. Данная методика доступна нашим пациентам в Европейской клинике.
Как говорилось выше, лечение в таких случаях является средством облегчения состояния пациента. Вероятность достижения ремиссии очень мала.
Мы в Европейской клинике также используем такую методику как эмболизация артерий, питающих крупные метастазы в различных органах.
Узнайте о современных методах лечения метастазов рака в печени, которые применяют врачи Европейской клиники, а также о результатах лечения - историях пациентов Европейской клиники.
Где лучше лечить рак с метастазами — в Москве, в Израиле или в Германии?
Для того чтобы получить наиболее современное и эффективное лечение при раке с метастазами, российскому пациенту не обязательно ехать за границу. В Европейской клинике применяются те же препараты и технологии, что и в ведущих онкологических центрах мира.
Даже если вероятность ремиссии мала, лечение нужно продолжать. Врачи-онкологи Европейской клиники знают, как облегчить страдания пациента, продлить жизнь. Для этого мы используем наиболее современные методики и препараты. Если вы проходите курс лечения в другой клинике, у нас всегда можно получить второе врачебное мнение: иногда подходы разных врачей к лечению метастатического рака сильно различаются.
Выберите врача и запишитесь на приём:

Главный врач Европейской клиники, онколог, к.м.н.
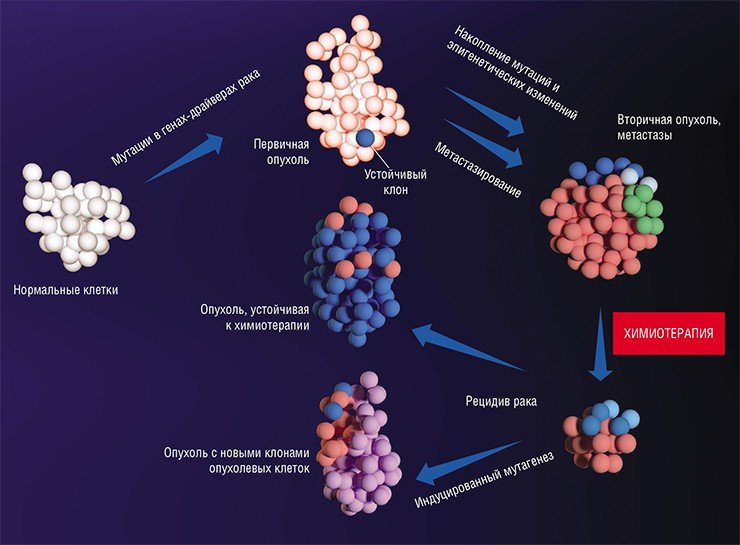
В последние десятилетия усилия многих онкологов были направлены на установление детальных механизмов зарождения раковой опухоли, регуляции ее активного роста и процессов формирования благоприятного для нее микроокружения из клеток стромы, соединительнотканного каркаса органа. Со временем стало понятно, что основная угроза рака заключена в его способности к распространению по организму.
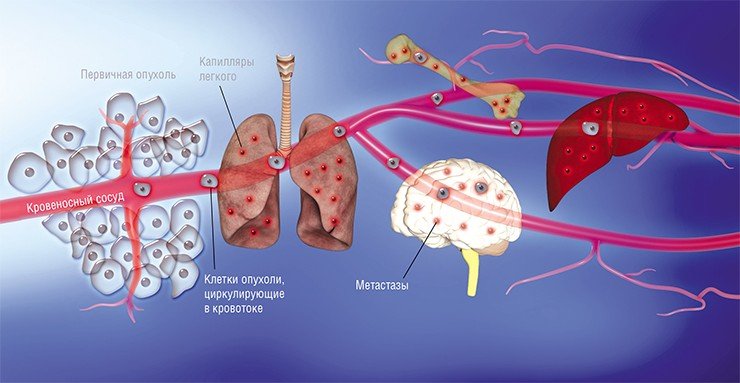
Наконец в 1970-е гг. благодаря экспериментам на лабораторных мышах, которым делались инъекции раковых клеток, меченных радиоактивными изотопами, американский исследователь И. Фидлер смог доказать, что на результат метастазирования влияет природа раковых клеток: клетки меланомы метастазировали в легкие, но не в печень, в сосудах которой они не выживали. Позднее были установлены и другие факты, подтверждающие, что раковые клетки разной природы метастазируют преимущественно в определенные органы, иногда даже и в определенной последовательности. Например, клетки рака молочной железы формируют метастазы сначала в костях, печени, лимфатических узлах и легких, и лишь потом уже – в мозге. Явление специфичного распределения метастазов по организму назвали органотропией метастазирования.
И сегодня в онкологии все еще остается много вопросов без ответов. Например, отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? И главное: как метастазам удается выжить после удаления первичной опухоли и проведения химиотерапии?
Метастазы: от генетики до эпигенетики
Интересно, что был обнаружен как минимум один ген – FBXW7, мутации в котором противодействуют метастазированию (Mlecnik et al., 2016). Происходит это за счет усиления провоспалительной реакции, увеличения численности и роста активности T-лимфоцитов, что стимулирует формирование иммунных реакций по отношению к опухолевым клеткам. Таким образом, появление мутаций в гене FBXW7 раковых клеток предотвращает развитие характерной для опухолей иммуносупрессии.
После формирования преметастазных ниш с благоприятным клеточным окружением некоторые раковые клетки покидают первичную опухоль и формируют микрометастазы в других тканях и органах. Финальный этап формирования вторичного очага может занимать от нескольких месяцев до нескольких лет
До сих пор мы говорили о непосредственных изменениях в самой структуре ДНК. Следующая ступень в регуляции экспрессии генов – эпигенетические изменения, связанные с метилированием ДНК и гистонов (ДНК-связывающих белков). По своей природе такие изменения более пластичны по сравнению с генетическими: они подвержены влиянию клеточных каскадов передачи сигнала, подстраивающихся под действие внешних факторов.
На развилке метаболических путей
Эпигенетическая регуляция – один из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области, куда не доходят кровеносные сосуды и где возникает кислородная недостаточность (гипоксия). В результате деметилирования ДНК в раковых клетках начинает активно работать ген, кодирующий белок HIF‑1-альфа, который так и называется – фактор, индуцируемый гипоксией. Усиленное образование этого белка, в свою очередь, влияет на уровень экспрессии генов множества метаболических ферментов и белков-транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток.
Как известно, клеточный метаболизм включает процессы расщепления соединений с выделением энергии (катаболизм) и их образования с использованием энергии (анаболизм). Энергетический обмен клетки обеспечивается благодаря клеточному дыханию, в котором выделяют гликолиз (ферментативный распад глюкозы), цикл трикарбоновых кислот (окислительные превращения промежуточных продуктов распада и синтеза белков, жиров и углеводов) и окислительное фосфорилирование (запасание энергии в результате окисления молекул органических веществ).
Раковые клетки по-своему приспосабливают энергетический обмен к условиям недостатка кислорода. В первичной опухоли они в основном используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение и расщепление глюкозы до молочной кислоты, которая выделяется раковыми клетками, названо эффектом Варбурга. Такая адаптация позволяет раковым клеткам успешно выживать и активно размножаться при недостатке кислорода.
Но все это относится к первичной опухоли, для клеток же метастазов особенности генерирования энергии до сих пор мало изучены. Тем не менее, используя клетки рака молочной железы, обладающие широкой органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, более активно использовали окислительное фосфорилирование, а колонизировавшие печень – гликолиз. Когда раковые клетки колонизировали все возможные органы-мишени, в них активировались оба метаболических пути (Rosen, Jordan, 2009). Похоже, что такая метаболическая пластичность помогает раковым клеткам осваивать новые ниши.
Почему же метастазам в одном случае выгоднее использовать преимущественно один вид метаболизма, а в другом – другой? Ответ на этот вопрос, как и на вопрос о роли различных факторов в регуляции метаболической пластичности раковых клеток, еще только предстоит узнать.
Несмотря на всю свою адаптационную пластичность, метастазные раковые клетки не могут в одиночку справиться со столь непростой задачей – освоением совершенно незнакомого места обитания.
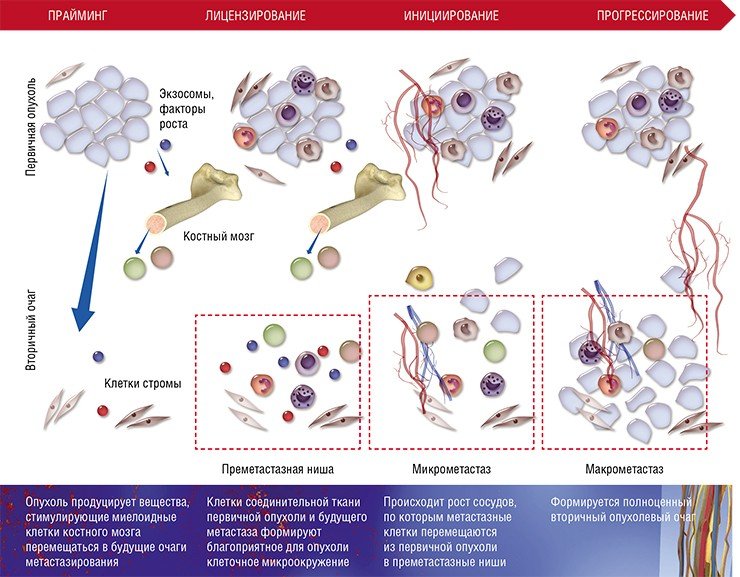
Хотя описанная выше схема характерна для большинства органов, у нее имеются особенности в зависимости от места (органа), где формируются метастазы. Например, в печени и легких в процессе создания преметастазной ниши активно участвуют еще одни клетки крови – нейтрофильные гранулоциты. Известно, что лейкоциты этого вида помогают раковым клеткам интегрироваться в новую нишу, секретируя протеазы и цитокины и непосредственно контактируя с раковыми клетками при выходе из капилляров.
Основная же функция лизилоксидазы заключается в формировании поперечных связей между коллагеновыми волокнами соединительной ткани. При развитии гипоксии раковые клетки молочной железы увеличивают синтез этого фермента, что способствует ремоделированию внеклеточного матрикса при подготовке уже другой преметастазной ниши – в легких.
При некоторых типах рака (например, меланоме) для успешного метастазирования в лимфатические узлы и органы необходимо, чтобы в их преметастазной нише сформировались новые лимфатические сосуды. Недавно было установлено, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, а медиатором его запуска является белковый фактор роста мидкин, секретируемый клетками меланомы (Olmeda et al., 2017).
Ученые провели интересный эксперимент: выделив экзосомы от раковых клеток разного происхождения (рака груди, поджелудочной железы и др.), они ввели их в кровоток лабораторных мышей, которым были привиты опухоли другого типа (Hoshino et al., 2015). Оказалось, что с помощью экзосом можно перепрограммировать распределение метастазов по органам.
Подведем итог. Все описанные механизмы метастазирования, безусловно, усложняют картину течения онкозаболеваний и тактики их лечения. Особого внимания требует гетерогенность первичной опухоли и метастазов по ряду самых разных признаков, из чего следует необходимость использовать комбинированное и таргетное (направленное) лечение на разных стадиях течения болезни. Подтверждение этому – результаты одного из последних исследований, базирующихся на лечении онкологического пациента с рецидивами между курсами длительной иммунотерапии (Jiménez-Sánchez et al., 2017). Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны. Следовательно, первичная, вторичные и последующие опухоли по-разному отвечают на лечение.
Alderton G. K. Tumour evolution: epigenetic and genetic heterogeneity in metastasis // Nat Rev Cancer. 2017. V. 17. N. 2. P. 141.
Cox T. R., Rumney R. M. H., Schoof E. M., et al. The hypoxic cancer secretome induces premetastatic bone lesions through lysyl oxidase // Nature. 2015. V. 522. N. 7554. P. 106—110.
Jiménez-Sánchez A., Memon D., Pourpe S., et al. Heterogeneous Tumor-Immune Microenvironments among Differentially Growing Metastases in an Ovarian Cancer Patient // Cell. 2017. V. 170. N. 5. P. 927—938.e20.
Hoshino A., Costa-Silva B., Shen T.-L., et al. Tumour exosome integrins determine organotropic metastasis // Nature. 2015. V. 527 N. 7578. P. 329—335.
Mlecnik B., Bindea G., Kirilovsky A., et al. The tumor microenvironment and Immunoscore are critical determinants of dissemination to distant metastasis // Sci Transl Med. 2016. V. 8. N. 327. P. 327ra26-327ra26.
Olmeda D., Cerezo-Wallis D., Riveiro-Falkenbach E., et al. Whole-body imaging of lymphovascular niches identifies pre-metastatic roles of midkine // Nature. 2017. V. 546 N. 7660. P. 676—680.
Rosen J. M., Jordan C. T. The increasing complexity of the cancer stem cell paradigm // Science. 2009. V. 324. N. 5935. P. 1670–1673.
Yates L. R., Knappskog S., Wedge D., et al. Genomic Evolution of Breast Cancer Metastasis and Relapse // Cancer Cell. 2017. V. 32. N. 2. P. 169—184.e7
Читайте также:

