Рак ободочной кишки клинические рекомендации минздрав

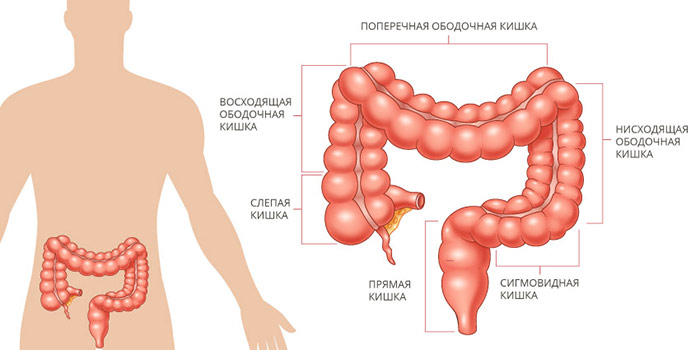
Ободочная кишка составляет примерно 4/5 от общей длины толстой кишки. В ней выделяют четыре отдела: восходящую, поперечную, нисходящую и сигмовидную ободочную кишку. Последняя переходит в прямую кишку.
Обычно возникновению злокачественной опухоли ободочной кишки предшествует возникновение доброкачественного новообразования — полипа. Существуют разные типы полипов, они обладают различным потенциалом к озлокачествлению. Риски повышаются с возрастом, поэтому всем, кому 50 лет и больше, рекомендуется проходить скрининговое эндоскопическое исследование — колоноскопию.
В зависимости от того, в каком анатомическом отделе возникла опухоль, выделяют рак в поперечной ободочной кишке, восходящей и нисходящей, сигмовидной.
- Причины развития рака ободочной кишки
- Классификация
- Стадии рака ободочной кишки
- Как происходит метастазирование рака из ободочной кишки?
- Симптомы
- Осложнения рака ободочной кишки
- Методы диагностики
- Методы лечения
- Прогноз
Причины развития рака ободочной кишки
Нельзя точно сказать, почему у конкретного человека в ободочной кишке возникла злокачественная опухоль. Рак всегда является результатом определенного набора мутаций в клетке, но что к этим мутациям привело — вопрос, на который сложно ответить.
Выделяют некоторые факторы риска, которые повышают вероятность развития колоректального рака:
Ни один из этих факторов не вызовет рак ободочной кишки со стопроцентной вероятностью. Каждый из них лишь в определенной степени повышает риски. На некоторые из этих факторов можно повлиять, например, начать правильно питаться, отказаться от алкоголя и сигарет, заняться спортом.
Классификация
Самая распространенная разновидность рака ободочной кишки и вообще колоректального рака — аденокарцинома. Она развивается из железистых клеток, которые находятся в слизистой оболочке. Аденокарциномами представлено более 96% злокачественных новообразований толстой кишки. В этой группе опухолей выделяют ряд подгрупп. Наиболее агрессивные из них — муцинозный и перстневидноклеточный рак. Такие пациенты имеют самый неблагоприятный прогноз.
Стадии рака ободочной кишки
Рак ободочной кишки классифицируют по стадиям, в зависимости от размеров и глубины прорастания первичной опухоли (T), наличия очагов в регионарных лимфатических узлах (N) и отдаленных метастазов (M). Выделяют пять основных стадий:
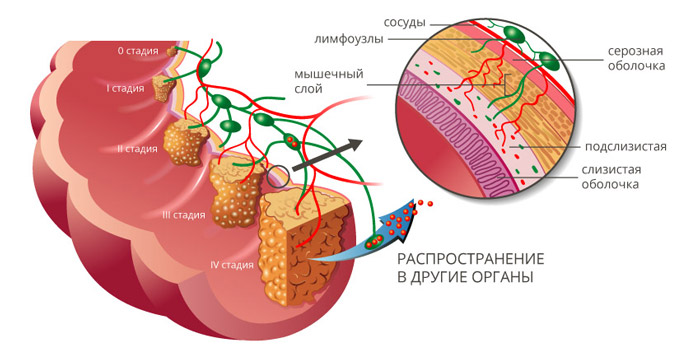
Как происходит метастазирование рака из ободочной кишки?
Рак ободочной кишки может распространяться в другие органы разными способами:
Чаще всего метастазы при раке толстой кишки обнаруживаются в легких и печени, реже — в костях, головном мозге.
Симптомы
Рак толстой ободочной кишки зачастую существует длительное время, не вызывая каких-либо симптомов. Но даже когда симптомы возникают, они неспецифичны и напоминают признаки многих других заболеваний. Если вас беспокоят расстройства из этого списка, скорее всего, у вас не рак, но нужно обязательно посетить врача и пройти обследование:
- запоры или диарея, которые сохраняются в течение нескольких дней;
- изменение внешнего вида стула: если он стал темным, как деготь, или тонким, как карандаш;
- примеси крови в стуле;
- после посещения туалета возникает ощущение, что кишка опорожнилась не полностью;
- боли, спазмы в животе;
- беспричинная слабость, чувство усталости, необъяснимая потеря веса.
Осложнения рака ободочной кишки
Если опухоль блокирует просвет ободочной кишки, у больного развивается кишечная непроходимость. Это состояние проявляется в виде отсутствия стула, сильных болей в животе, тошноты, рвоты, сильного ухудшения общего состояния. Больному немедленно требуется медицинская помощь, иначе может произойти некроз (гибель) участка кишки, разовьется перитонит.
Если опухоль приводит к постоянным кровотечениям, развивается анемия. Пациент становится бледным, постоянно испытывает слабость, его беспокоят головные боли, головокружения. В тяжелых случаях требуется переливание крови.
Метастазирование рака кишки в печень грозит нарушением оттока желчи и развитием механической желтухи — состояния, при котором кожа и слизистые оболочки приобретают желтоватый оттенок, беспокоит кожный зуд, боли в животе, ухудшается общее состояние. Пока не восстановлен отток желчи, становится невозможным проведение активного противоопухолевого лечения.
Состояние, при котором раковые клетки распространяются по поверхности брюшины, называется канцероматозом, при этом развивается асцит — скопление жидкости в животе. Это осложнение развивается при раке ободочной кишки стадии IVC. Асцит ухудшает состояние пациента, затрудняет лечение и резко негативно сказывается на прогнозе.
В Европейской клинике есть всё необходимое для эффективной борьбы с осложнениями злокачественных опухолей ободочной кишки. При неотложных состояниях пациенты получают лечение в полном объеме в отделении интенсивной терапии. Наши хирурги выполняют паллиативные операции, устанавливают стенты при кишечной непроходимости. При механической желтухе мы проводим дренирование, стентирование желчевыводящих путей. При асците наши доктора выполняют лапароцентез (эвакуацию жидкости через прокол), устанавливают перитонеальные катетеры, проводят системную и внутрибрюшинную химиотерапию.
При IVC стадии рака ободочной кишки, когда развивается канцероматоз брюшины, хирурги в Европейской клинике применяют инновационный метод лечения — гипертермическую интраперитонеальную химиотерапию (HIPEC). Удаляют все крупные опухоли, затем брюшную полость промывают раствором химиопрепарата, подогретым до определенной температуры — это помогает уничтожить мелкие очаги. Согласно результатам мировой практики, HIPEC может продлить жизнь онкологического больного до нескольких лет.
Методы диагностики
Если пациента беспокоят симптомы, которые могут указывать на рак ободочной кишки, врач первым делам назначит УЗИ органов брюшной полости и колоноскопию. Эти исследования помогут обнаружить опухоль, а во время колоноскопии можно провести биопсию — получить фрагмент патологически измененной ткани и отправить в лабораторию. Биопсия — самый точный метод диагностики рака.
После того, как рак диагностирован, нужно установить его стадию. Для этого применяют КТ, МРТ, ПЭТ-сканирование. Метастазы в легких выявляют с помощью рентгенографии грудной клетки. Если имеются метастазы в печени, применяют ангиографию — рентгенологическое исследование, во время которого в кровеносные сосуды вводят контрастный раствор.
Дополнительно врач может назначить анализ стула на скрытую кровь, общий и биохимический анализ крови, чтобы выявить анемию, оценить функции печени. Анализы крови на онкомаркеры обычно проводят в процессе лечения, чтобы проконтролировать его эффективность.
Симптомы, возникающие при раке ободочной кишки, могут беспокоить при многих других патологиях. Чаще всего злокачественную опухоль приходится дифференцировать с такими заболеваниями, как кишечные инфекции, хронические воспалительные процессы, геморрой, синдром раздраженного кишечника.
Методы лечения
При раке ободочной кишки возможны разные варианты лечения. Врач выбирает оптимальную тактику, в зависимости от стадии злокачественной опухоли, ее локализации, общего состояния пациента, наличия у него тех или иных осложнений, сопутствующих заболеваний. Выполняют хирургические вмешательства, применяют разные типы противоопухолевых препаратов, проводят курсы лучевой терапии.
Химиотерапия при злокачественных опухолях ободочной кишки может преследовать разные цели:
- Неоадъювантную химиотерапию назначают до хирургического вмешательства, чтобы сократить размеры опухоли и упростить ее удаление.
- Адъювантная химиотерапия проводится после хирургического вмешательства, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива.
- В качестве основного метода лечения химиотерапию применяют при поздних стадиях рака, в паллиативных целях.
При злокачественных новообразованиях толстой кишки применяют разные типы химиопрепаратов: капецитабин, 5-фторурацил, оксалиплатин, иринотекан, трифлуридин/типирацил (комбинированный препарат). Чаще всего одновременно используют два или более препаратов, это помогает повысить эффективность лечения.

Таргетные препараты воздействуют более прицельно по сравнению с классическими химиопрепаратами: они направлены на определенные молекулы-мишени, которые помогают раковым клеткам бесконтрольно размножаться и поддерживать свою жизнедеятельность. Чаще всего при злокачественных опухолях кишки применяют две группы таргетных препаратов:
- Ингибиторы VEGF — вещества, с помощью которого раковые клетки стимулируют ангиогенез (образование новых кровеносных сосудов). К этой группе относятся: Зив-афлиберцепт (Залтрап), Рамуцирумаб (Цирамза), Бевацизумаб (Авастин). Их применяют при прогрессирующем раке ободочной кишки, вводят внутривенно раз в 2 или 3 недели, обычно сочетают с химиотерапией.
- Ингибиторы EGFR — белка-рецептора, который находится на поверхности раковых клеток и заставляет их бесконтрольно размножаться. В эту группу входят такие препараты, как Цетуксимаб (Эрбитукс), Панитумумаб (Вектибикс). Ингибиторы EGFR вводят внутривенно раз в неделю или через неделю.
В некоторых случаях применяют препараты из группы ингибиторов контрольных точек. Они блокируют молекулы, которые мешают иммунной системе распознавать и атаковать раковые клетки. К этой группе препаратов относятся: Пембролизумаб (Кейтруда), Ниволумаб (Опдиво), Ипилимумаб (Ервой). Обычно их применяют при неоперабельном, метастатическом раке, когда неэффективна химиотерапия, если произошел рецидив.
Колэктомия может быть выполнена открытым способом (через разрез) или лапароскопически (через проколы в брюшной стенке).
Иногда анастомоз не получается наложить сразу. В таких случаях накладывают временную колостому или илеостому — участок ободочной или подвздошной кишки подшивают к коже и формируют отверстие для отхождение стула. В дальнейшем стому закрывают.
Если опухоль блокирует просвет кишечника, и ее нельзя удалить, накладывают постоянную колостому. Проходимость кишечника можно восстановить с помощью стента — металлического каркаса в виде полого цилиндра с сетчатой стенкой. Такие операции называются паллиативными: они направлены не на удаление рака, а на борьбу с симптомами, улучшение состояния пациента.
Лучевая терапия может быть назначена до (неоадъювантная), после (адъювантная) операции на кишке или в качестве основного метода лечения при метастатическом раке, для борьбы с симптомами.
Если лучевую терапию сочетают с химиотерапией, то такое лечение называется химиолучевой терапией.
Прогноз
Основной показатель, с помощью которого определяют прогноз при онкологических заболеваниях ободочной кишки и других органов — пятилетняя выживаемость. Он показывает процентную долю пациентов, которые остались живы спустя пять лет после того, как им был установлен диагноз.
Пятилетняя выживаемость при колоректальном раке зависит от стадии:
- При локализованном раке (не распространился за пределы кишечной стенки — стадии I, IIA и IIB) — 90%.
- При раке, распространившемся на соседние органы и регионарные лимфатические узлы (стадия III) — 71%.
- При метастатическом раке (стадия IV) — 14%.
Как видно из этих цифр, наиболее успешно лечатся злокачественные опухоли ободочной кишки на ранних стадиях, а при возникновении метастазов прогноз резко ухудшается. Однако, данные показатели носят лишь ориентировочный характер. Они рассчитаны на основе статистики среди пациентов, у которых рак в толстой кишке был диагностирован пять лет назад и ранее. За это время в онкологии произошли некоторые изменения, появились новые технологии, препараты.
Никогда нельзя опускать руки. Даже при запущенном раке с метастазами больному можно помочь, продлить его жизнь, избавить от мучительных симптомов. Врачи Европейской клиники берутся за лечение любых пациентов. Мы знаем, как помочь.
Вам поставили диагноз: рак ободочной (толстой) кишки?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Филиалы и отделения где лечат рак ободочной (толстой) кишки
Абдоминальное отделение
Заведующий отделения – д.м.н. Дмитрий Владимирович Сидоров.
Контакты: (495) 150 11 22
Абдоминальное отделение
Заведующий отделения – д.м.н. Дмитрий Владимирович Сидоров.
Контакты: (495) 150 11 22
Рак ободочной (толстой) кишки

Введение

Ободочная кишка является частью пищеварительной системы, занимающая периферические отделы брюшной полости. Ободочная кишка является основной частью толстой кишки и имеет длину около 150 см. Протяженность органа варьирует в зависимости от роста человека. В толстой кишке происходят процессы обратного всасывания воды и формирования стула. На следующей картинке продемонстрирована локализация и положение ободочной кишки.
Ободочная кишка состоит из нескольких отделов:
0. Слепая кишка
1. Аппендикс
2. Восходящая ободочная кишка
3. Печеночный изгиб ободочной кишки
4. Поперечно- ободочная кишка
5. Селезеночный изгиб ободочной кишки
6. Нисходящая ободочная кишка
7. Сигмовидная кишка
Эпидемиология рака ободочной (толстой) кишки
Заболеваемость раком ободочной кишки имеет устойчивую тенденцию к росту во всех развитых странах. Согласно данным Globocan за 2012 год зафиксировано около 0,7 млн новых случаев заболеваемости раком ободочной кишки по всему миру. При этом опухоли ободочной кишки занимают третье и четвертое место в структуре заболеваемости среди женщин и мужчин соответственно. Нужно отметить, что ежегодно в мире около 0,3 млн человек умирает от рака ободочной кишки. В России за 2017 год диагноз рака ободочной кишки впервые установлен более чем 35000 больных, и более половины всех пациентов имеют на момент диагностики заболевания III-IV стадию опухолевого процесса. Среди них радикальное хирургическое лечение выполнено 70,8% пациентов. В большинстве случаев болезнь диагностируется у людей, перешагнувших 50-летний рубеж.
Морфология рака ободочной (толстой) кишки
Стадии рака ободочной (толстой) кишки и симптоматика
Рак ободочной кишки, как и прочие злокачественные опухоли, систематизируются согласно TNM-классификации. Единая международная классификация служит не только для научных целей (оценки результатов лечения, непрерывного процесса обмена данными между крупными центрами, учета ЗНО), но и для планирования лечения групп пациентов и формирования прогностических факторов.
Цифра рядом с компонентом указывает на степень распространённости злокачественного новообразования.
| Стадия | T | N | M |
| 0 | Tis | N0 | M0 |
| I | T1 | N0 | M0 |
| T2 | |||
| IIa | T3 | N0 | M0 |
| IIb | T4a | N0 | M0 |
| IIc | T4b | N0 | M0 |
| IIIa | T1-T2 | N1/N1c | M0 |
| T1 | N2a | M0 | |
| IIIb | T3–T4a N1/N1c T2–T3 | N1/N1c | M0 |
| T1–T2 N2b | N2a | M0 | |
| N2b | M0 | ||
| IIIc | T4a | N2a | M0 |
| T3–T4a | N2b | M0 | |
| T4b | N1–N2 | M0 | |
| IVa | Любой T | Любой N | M1a |
| IVb | Любой T | Любой N | M1b |
Симптомы рака ободочной кишки отличаются многообразием и зависят от локализации и вида опухоли, а также стадии и степени поражения близлежащих тканей. На начальных этапах болезнь протекает бессимптомно. Но со временем возникают расстройства пищеварения, присоединяются боли, появляются патологические слизистые или кровянистые выделения. Нарушается общее самочувствие пациента: отмечается повышенная утомляемость, слабость, похудение, температура — появление этих симптомов связано с интоксикацией организма при распространении опухоли. Опухоли нередко спонтанно выявляются при профилактических осмотрах или при обращении в ЛПУ первичного звена и к профильным специалистам на фоне выраженных изменений стенки кишки. При отсутствии лечения развиваются осложнения, которые угрожают жизни пациента. К ним относятся кишечная непроходимость, перфорация, кровотечение и др.
Причины возникновения и факторы риска рака ободочной (толстой) кишки
В развитии рака ободочной кишки принимают участие различные факторы:
• Генетические - наличие мутации в гене АРС (семейный аденоматозный полипоз) и герминальная мутация в одном из генов репарации неспаренных оснований (Синдром Линча);
• нутритивные - алкоголь, потребление жирных мясных продуктов, поваренной соли;
• воспалительные - язвенный колит, болезнь Крона;
• различные канцерогенные факторы - курение, ожирение;
• малоподвижный образ жизни.
Диагностика рака ободочной (толстой) кишки
Несмотря на это в некоторых случаях при невозможности проведения тотальной колоноскопии (состояние после лапаратомии, толстокишечная непроходимость, перитонит, отказ пациента от манипуляции) больному показано проведение ирригоскопии с целью оценки локализации и размеров опухоли. Затем проводится обследование на предмет распространенности опухолевого процесса. При ультразвуковом исследовании (УЗИ) или компьютерной томографии (КТ) необходимо оценить изменения в регионарных лимфатических узлах, наличие отдаленных метастатических изменений паренхимы печени, легких, костей (наиболее частые места отдаленного метастазирования рака ободочной кишки). Далее проводится комплекс обследований по выявлению сопутствующей патологии: эхокардиография, холтеровское мониторирование сердечной деятельности, исследование функции внешнего дыхания, ультразвуковое исследование сосудов шеи и нижних конечностей, исследование свёртывающей системы крови, анализы мочи, консультации специалистов терапевтической направленности.
Принципы диагностики рака ободочной (толстой) кишки
Анамнез и физикальный осмотр
• Тотальная колоноскопия с биопсией
• Ирригоскопия при невозможности выполнения тотальной колоноскопии
• УЗИ органов брюшной полости и забрюшинного пространства, либо КТ органов брюшной полости с внутривенным контрастированием
• КТ органов грудной клетки
• Развернутые клинический и биохимический анализы крови
• ЭКГ
• Онкомаркеры РЭА, СА 19.9
• Оценка нутритивного статуса
• Анализ биоптата опухоли на мутацию в генах семейства RAS (экзоны 2–4 генов KRAS и NRAS), если диагностированы или заподозрены отдаленные метастазы аденокарциномы.
• Остеосцинтиграфия при подозрении на метастатическое поражение костей скелета.
• Биопсия под контролем УЗИ/КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения.
• ПЭТ-КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения.
• Лапароскопия при подозрении на диссеминацию опухоли по брюшине
• МРТ или КТ головного мозга с внутривенным контрастированием при подозрении на метастатическое поражение головного мозга.
Лечение рака ободочной (толстой) кишки
Лечение, как правило, комбинированное, состоящее из хирургического и химиотерапевтических компонентов. Выбор лечебной тактики зависит от многих факторов и определяется коллегиально (в виде проведения консилиума) на основании стадии опухолевого процесса, общего соматического состояния пациента, формы и распространенности опухолевого процесса. При возможности проведения радикального оперативного вмешательства (при возможности убрать опухоль единым блоком в пределах здоровых тканей) оно проводится на первом этапе комбинированного лечения. Объем операции определяется степенью распространения опухоли. Также удалению подлежат близлежащие лимфатические узлы. Химиотерапия применяется по показаниям. При высоких рисках прогрессирования, которые определяются при гистологическом исследовании удаленного препарата, назначается послеоперационная полихимиотерапия (адъювантная), к схеме которой могут быть добавлены препараты таргетной терапии, воздействующие на опухоль точечно. Такая терапия может быть включена в схему лечения только при наличии генетического исследования опухоли, о котором мы говорили ранее.
Осложнения противоопухолевого лечения рака ободочной (толстой) кишки и их коррекция
Нередко на фоне проведения химиотерапии у больных развиваются различные осложнения, к которым относятся тошнота и рвота, диарея, воспалительные изменения со стороны полости рта, побочные реакции со стороны кожи, угнетение кровяных ростков, проявляющихся снижением уровня ряда элементов крови (лейко-, нейтро- и тромбоцитопения). Все эти осложнения корректируются при помощи ряда лекарственных средств, гигиенической обработки полости рта. Все назначения проводятся химиотерапевтом, назначающим лечение, и корректируются в зависимости от тяжести развившегося осложнения.
Использование уникальных методик при лечении рака ободочной (толстой) кишки
Особенности реабилитации после лечения рака ободочной (толстой) кишки
Прогноз заболевания
• Снижение и поддержание массы тела на уровне нормальных значений (данный показатель и способы его достижения обсуждаются индивидуально больным и его лечащим врачом)
• Ряд исследований доказали, что активный образ жизни (достаточная суточная активность) способны не только улучшить качество жизни, снизить симптомы усталости, но и снизить вероятность рецидива рака ободочной кишки
• Диета, сочетающая в себе достаточный объем фруктов, овощей, клетчатки и здорового белка (птица, рыба), способна снизить риск развития рецидива
• Снижение суточного потребления алкоголя также способно оказать эффект на снижение вероятности прогрессирования
• Отказ от курения является независимым фактором снижения риска смерти от прогрессирования опухолевого процесса и иных причин.
В ряде случаев, на фоне крайне высокой распространенности опухолевого процесса и тяжести общего состояния больному может быть завершено проведение лекарственного (в данном случае, паллиативного) лечения с целью проведения симптоматической терапии, направленной на улучшения качества жизни и общего состояния пациента.
ЛЕЧЕНИЕ рака ободочной (толстой) кишки
Основным методом лечения рака ободочной кишки является хирургический. В ФГБУ "НМИЦ радиологии" Минздрава России выполняется полный спектр оперативных вмешательств при всех локализациях опухолей в ободочной кишке.
Правосторонняя гемиколэктомия. Операцию выполняют при локализации опухоли в слепой кишке, червеобразном отростке, восходящем отделе ободочной кишки. При этом, удаляются все правые отделы ободочной кишки единым блоком с окружающей клетчаткой и лимфатическими узлами, правой половиной большого сальника.
Резекция поперечной ободочной кишки. Операцию выполняют при локализации опухоли в средних отделах поперечной ободочной кишки. Всю поперечную ободочную кишку удаляют вместе с ее брыжейкой, в которой расположены кровеносные сосуды и лимфатические коллекторы, полностью удаляют большой сальник.
Левосторонняя гемиколэктомия. Операцию выполняют при локализации опухоли в нисходящей ободочной кишке, начальных отделах сигмовидной кишки. Удаляется левая половина ободочной кишки вместе с сигмовидной кишкой, единым блоком с лимфатическими узлами и левой половиной большого сальника.
Резекция сигмовидной кишки. Выполняют операцию при наличии опухоли в средней трети сигмовидной кишки.
Удаляется вся сигмовидная кишка в едином блоке с окружающей клетчаткой, лимфатическими узлами.
Наибольшие трудности представляет лечение местнораспространенных опухолей ободочной кишки, когда имеется прорастание в соседние органы. Наиболее часто речь идет о поражении мочевыделительной системы (почки, мочеточники, мочевой пузырь), реже матка, яичники, печень, желудок, тонкая кишка. Хирургическое лечение таких пациентов подразумевает выполнение так называемых расширенных и комбинированных резекций. При лечении этой тяжелой группы необходимо участие хирургов-онкологов различных специальностей – абдоминальных онкологов, онкоурологов, онкогинекологов.
Еще более сложной проблемой является лечение больных с наличием так называемой перитонеальной диссеминации (канцероматоз брюшины). Таким больным хирурги-онкологи в большинстве медицинских учреждениях (в том числе и специализированных) либо сразу отказывают в лечении, или столкнувшись с этой проблемой во время операции, завершают ее пробным разрезом и осмотром брюшной полости. В ФГБУ "НМИЦ радиологии" Минздрава России в этих случаях прибегают к выполнению расширенных циторедуктивных вмешательств, подразумевающих удаление первичной опухоли и максимально возможное удаление отсевов по брюшине. Оперативные вмешательства дополняют по показаниям фотодинамической терапией или интраоперационной внутрибрюшной гипертермической химиотерапией, что дает надежду на улучшение отдаленных результатов лечения.
К сожалению, только хирургическое лечение не может обеспечить полное выздоровление при запущенных стадиях заболевания. Причинами этого является поздняя обращаемость пациентов за квалифицированной медицинской помощью, несвоевременное, и проведенное не полном объеме, обследование. В таких случаях приходится прибегать к комбинации хирургического и лекарственного лечения. Показаниями для проведения комбинированного лечения является III стадия опухолевого процесса, наличие метастазов в удаленных лимфатических узлах, низко- и недифференцированные опухоли. Выбор схемы лечения определяется в зависимости от степени распространенности опухолевого процесса, результатов морфологического исследования, наличия факторов прогноза (опухолевые непроходимость, перфорация, абсцедирование), возраста больного, общего состояния и сопутствующей патологии. Современные схемы химиотерапии позволяют значительно улучшить результаты хирургического лечения, а в ряде случаев достигнуть полного выздоровления.
При выполнении любого варианта операции на ободочной кишке, при отсутствии полноценного кровоснабжения толстой кишки, особенно при срочных операциях на неподготовленной кишке, при наличии кишечной непроходимости хирургам приходится формировать временную колостому. В ФГБУ "НМИЦ радиологии" Минздрава России возможно выполнение практически всех восстановительных операций (закрытие колостомы, восстановление непрерывности кишечного тракта после операции Гартмана и т.п.). Данные операции позволяют достичь полной социальной реабилитации и возвращают пациентов к нормальной жизни.
Филиалы и отделения Центра, в которых лечат рак толстой (ободочной) кишки
Рак ободочной (толстой) кишки можно лечить:
Контакты: (495) 150 11 22
Заболеваемость
Рак ободочной и прямой кишки вместе занимают третье место в мире по частоте среди всех злокачественных опухолей. Рак ободочной кишки встречается чаще, чем рак прямой кишки: в популяции высокого риска соотношение составляет 2:1, тогда как при низком риске это соотношение приближается к 1:1.
В Европе ежегодно регистрируется около 250 тыс. новых случаев заболевания, что составляет 9% от всех пациентов. Заболеваемость возрастает с ростом урбанизации и индустриализации и несколько выше в странах западной и северной Европы, чем в южных и восточных ее частях. В настоящее время отмечается рост заболеваемости в странах с низкой ее частотой, тогда как в государствах с исторически высокими показателями наметилась тенденция к ее снижению, в частности у молодых пациентов. У почти 70% больных заболевание диагностируется в возрасте свыше 65 лет, в то время как до 45 лет оно встречается крайне редко (2 х 100 тыс.).
В Европе продолжительность жизни больны, с впервые выявленным заболеванием в 1995-1999гг. составила 72% (1-летняя) и 54% (5-летняя). 5-летняя выживаемость снижается с 63% до 49% среди молодых (15-45 лет) и стариков (старше 75 лет) соответственно. Улучшение продолжительности жизни больных фиксируется с конца 1970-х годов во всех странах.
Этиология и факторы риска
Колоректальный рак в большинстве случаев является спорадической опухолью, наследственные формы составляют около 5-10%. Исследования среди детей иммигрантов из стран с низкой (например, Япония) в страны с высокой заболеваемостью (например, США) показали значительный рост заболеваемости колоректальным раком. На сегодняшний день наиболее важным экзогенным фактором, влияющим на возникновение колоректального рака, является диета. Недавно было установлено, что возникновение многих опухолей можно было бы предотвратить подходящей диетой.
Не связанные с диетой факторы
Среди не связанных с диетой факторов, влияющих на развитие рака толстой кишки, наиболее важными являются курение, прием нестероидных противовоспалительных средств, некоторые сопутствующие заболевания и наследственная предрасположенность. Курение ассоциировано с развитием больших аденом кишки. Предполагается, что период от начала воздействия генотоксических веществ и развитием колоректального рака составляет около 30-40 лет. Считается, что один из пяти случаев колоректального рака в США обусловлен курением.
Прием нестероидных противовоспалительных препаратов, в частности аспирина по данным трех рандомизированных исследований, достоверно снижает риск развития спорадических аденоматозных полипов [I,A]. В то же время у пациентов с наследственным аденоматозом этот эффект существенно ниже.
Хронические воспалительные заболевания кишечника (болезнь Крона и неспецифический язвенный полип) увеличивают риск развития колоректального рака. В недавнем мета-анализе показано, что у пациентов с болезнью Крона колоректальный рак развивается в 2,59 (95% ДИ, 1,54-4,36) чаще, чем у здоровых людей. В другой работе была показана даже еще большая зависимость между неспецифическим язвенным колитом и колоректальным раком, особенно в случае панколита и анамнезе заболевания свыше 10 лет.
Пациенты с имевшейся ранее злокачественной опухолью также имеют риск развития второй опухоли толстой кишки. Метаболический синдром (артериальная гипертензия, увеличение объема живота, гиперглицеридемия, низкий уровень ЛПВП, сахарный диабет) также предрасполагает к развитию колоректального рака у мужчин, тогда как у женщин такой зависимости не выявлено. Применение гормонзаместительной терапии эстрогенами и прогестероном после менопаузы также уменьшают риск развития колоректального рака.
Генетические факторы
Развитие колоректального рака генетически связано с полипозным или неполипозным синдромами. Главным синдромом первой группы является семейный аденоматозный полипоз (FAP), связанный с потерей гена FAP (или по другому ― APC).
Синдром наследственного неполипозного рака (HNPCC) ассоциирован с мутациями шести генов, отвечающих за репарацию ДНК (mismatch repair system). По данным Финского Ракового Регистра к возрасту 70 лет злокачественная колоректальная патология развилась у 82% носителей данных мутаций.
Обнаружение аденоматозных полипов, на фоне которых развивается большинство опухолей, наряду с хорошим прогнозом при ранних стадиях делате колоректальный рак идеальным кандидатом для проведения скрининга.
До сегодняшнего дня существовало две стратегии: анализ кала на скрытую кровь и эндоскопия. Первая методика изучалась в трех рандомизированных исследованиях, в которых продемонстрировала снижение смертности на 25% среди хотя бы однократно обследованных [I, A]. На основании этих данных комитет по профилактике рака Евросоюза рекомендует применение анализа кала на скрытую кровь, а в случае положительного результата –выполнение эндоскопического исследования.
Скрининг должен быть предложен мужчинам и женщинам с 50 лет и продолжаться с интервалом в 1-2 года до 74 лет [A].
Диагноз
Диагноз может быть установлен при обращении пациентов с симптомами заболевания либо при скрининге. Так как для начальных стадий рака толстой кишки характерно полное отсутствие либо скудная специфическая симптоматика (изменение стула, общий дискомфорт в животе, необъяснимая потеря веса, повышенная усталость), то крайне необходимо диагностировать ранние опухоли при скрининговых программах.
Эндоскопия является главным диагностическим методом. Ирригоскопия применяется в качестве дополнения к колоноскопии в случаях, когда по анатомическим причинам не удается осмотреть правую половину кишечника, либо у пациентов крайне высокого риска с множественными аденомами. Дополнительные методики могут улучшить результаты: виртуальная колоноскопия способна более точно визуализировать локализацию опухоли, что особенно полезно в планировании лапароскопической резекции кишки. Кроме того данный метод способен выявить вторичные опухоли и аденомы у пациентов со стенозирующимими опухолями дистальных отделов толстой кишки, делающими невозможными эндоскопическую визуализацию [IV].
Позитрон эмиссионная томография (ПЭТ) может быть полезна в идентификации отдаленных метастазов, однако ее выполнение на момент постановки диагноза не рекомендуется, так в большинстве случаев не меняет лечебной тактики [II].
Наибольшую диагностическую проблему представляет выявление диссеминации по брюшине.
Активно изучалась и возможность применения серологических маркеров для ранней диагностики колоректального рака. Наиболее изученным является раково-эмбриональный антиген (РЭА), который бывает полезен в предоперационном стадировании и наблюдении за больными после лечения. Если использовать уровень РЭА 2,5 нг/мл как верхнюю границу норму, то маркер оказывается повышенным у 36% больных с Dukes A и B, у 74% при Dukes C и у 83% при Dukes D.
Стадирование
Стадирование осуществляется в соответствие с классификацией TNM. Данная классификация включает в клиническую классификацию, осуществляемую на основании предоперационного обследования (cTNM), и послеоперационную ― pTNM.
Стадирование позволяет получить информацию, необходимую для выбора адекватного лечения и отбора больных с операбельными солитарными метастазами в печень или легкое.
Предоперационное обследование включает в себя: физикальный осмотр, общий и биохимический анализы крови с оценкой функции почек и печени, определение уровня РЭА, рентгенография органов грудной клетки, КТ органов брюшной полости (хотя рентгенография органов грудной клетки и УЗИ органов брюшной полости также вполне достаточно), колоноскопия. Если предоперационно из-за опухолевого стеноза осмотреть всю ободочную кишку не удалось, колоноскопию следует повторить после операции. МРТ органов малого таза чаще всего выполняется для стадирования рака прямой кишки. ПЭТ может быть полезна для пациентов с изолированным поражением печени перед хирургическим лечением для исключения метастазов в других органах.
Операционное стадирование. Во время операции оценивается печень, регионарные лимфоузлы, прорастание опухолью стенки кишки и врастание в окружающие структуры. Для адекватного pN стадирования необходимо исследование не менее 12-14 лимфоузлов. Это особенно важно для II стадии, где прогноз четко зависит от числа исследованных лимфоузлов. Интраоперационное УЗИ печени наиболее точно в диагностике метастазов в печень: оккультные метастазы обнаруживаются у 15% больных, а у 5% являются солитарными и могут быть легко резецированы.
Факторы прогноза
Прогноз при колоректальном раке четко зависит от глубины опухолевой инвазии (параметр Т) и статуса регионарных лимфоузлов. Дополнительными прогностическими факторами являются дифференцировка, микроскопическая сосудистая или приневральная инвазия, лимфоцитарная инфильтрация опухоли, вовлечение краев резекции, что не отражается в классификации Dukes и TNM.
Много других потенциальных факторов находится в стадии изучения, такие как p53, k-ras, bcl-2, TGF-a, EGF, пролиферативный индекс и анеуплоидность. Кишечная непроходимость, перфорация опухоли, повышенные уровни РЭА и Са 19.9 также являются негативными клиническими прогностическими факторами.
План лечения в зависимости от стадии болезни
Лечение малигнизированных полипов
Во всех возможных случаях необходимо стремиться к полному удалению полипа. Наличие инвазивной карциномы в полипе требует тщательного патоморфологического изучения на предмет наличия факторов риска развития рецидива. К таковым относятся лимфатическая или венозная инвазия, низкая степень дифференцировки, 4-й уровень инвазии (в субмукозу стенки кишки под полипом), позитивные края резекции. Хотя последние два фактора и являются наиболее значимыми, их отсутствие не всегда позволяет в исключить в будущем развития рецидива. Было предложено множество систем, позволяющих классифицировать агрессивность полипов, например, степень инвазии субмукозы, инвазия в ножку или абсолютная толщина инвазивного компонента глубже собственной мышечной пластинки слизистой оболочки.
Если присутствуют неблагоприятные гистологические факторы у пациента, потенциально способного легко перенести операцию, показана резекция кишки.
При локализации карциномы в головке полипа на ножке и в отсутствие факторов риска, вероятность прогрессирования болезни минимальна. В случае инвазии ножки, но с четкими негативными краями резекции и в отсутствие факторов риска достаточно одной полипэктомии. В то же время наличие любого инвазивного компонента в плоском полипе (без ножки) должно стадироваться как 4-й уровень инвазии, что требует выполнения резекции кишки.
Локализованная опухоль
Задачей хирургического лечения является широкое иссечение сегмента толстой кишки вместе с лимфатическим коллектором. Объем резекции определяется особенностями кровоснабжения и распределением лимфатических узлов, но не менее 5 см от обеих сторон опухоли. Лапароскопические вмешательства могут безопасно выполняться при раке толстой кишки, особенно при левосторонней локализации опухоли [I]. В то же время при правосторонней локализации чаще требуется дополнительно выполнять лапаротомии для ручного наложения анастомоза [IV]. Отдаленные результаты лапароскопических и открытых резекций толстой кишки схожи [I]. Преимуществами лапароскопии являются меньший болевой синдром, меньшее пребывание в стационаре и снижение продолжительности пареза кишечника [II].
Опухоли кишки, осложненные развитием кишечной непроходимости, могут оперироваться в два этапа (наложение колостомы и позже выполнение резекции). Как вариант возможно выполнение и одномоментной операции в виде субтотальной колэктомии с наложением илеоректального анастомоза, либо сегментарной резекции кишки после ее интраоперационного лаважа [III]. Эндоскопическое стентирование опухоли дистальной части толстой кишки позволяет в ряде случаев разрешить кишечную непроходимость и позже выполнить одноэтапную операцию. Обструктивные опухоли правосторонней локализации могут быть прооперированы с одномоментным наложением анастомоза [IV].
Стадия 0 (Tis N0 M0, T1 N0 M0)
Возможны следующие варианты лечения:
- Локальная эксцизия или полипэктомия;
- Сегментарная резекция
Стадия I (T2 N0 M0)
Широкая резекция с наложением анастомоза.
Стадия II (T3 N0 M0, T4N0M0)
Широкая резекция с наложением анастомоза. При наличии хотя бы одного из упоминавшихся выше факторов риска возможно проведение адъювантной химиотерапии [II, B]. Оптимальным также представляется участие таких пациентов в клинических исследованиях.
Стадия III (любая T, N1M0, любая T, N2M0)
Широкая резекция с наложением анастомоза. После операции стандартом является проведение адъювантной химиотерапии комбинацией оксалиплатина и фторпиримидина ― режимы FOLFOX или FLOX [I,A]. При противопоказаниях к применению оксалиплатина возможна монотерапия фторпиримидинами в виде длительных инфузий 5-фторурацила (режимы DeGramont или AIO), либо приема капецитабина [I,A]. Успех режимов с оксалиплатином был продемонстрирован в двух рандомизированных исследованиях ― MOSAIC и NSABP C-07. В первом из них применение режима FOLFOX позволило снизить а 23% риск развития рецидива заболевания по сравнению с одним инфузионным лейковорином и 5-фторурацилом, а абсолютный выигрыш в 6-летней общей выживаемости при III стадии составил 4,2%. Во втором исследовании применялся режим FLOX, в котором применялся еженедельный струйный 5-фторурацил. При схожем с MOSAIC снижении риска рецидива, комбинация FLOX значительно чаще осложнялась диареей 3-4 степени. Поэтому в настоящее время режим 12 курсов FOLXOХ стали стандартом терапии III стадии рака толстой кишки [A].
В исследовании X-ACT при III стадии сравнивались монотерапия капецитабином и струйный 5-фторурацил с лейковорином, в котором капецитабин показал свое преимущество в отношении токсичности и общей стоимости лечения [I].
Режим капецитабина и оксалиплатина в рамках исследования XELOXA сравнивался со струйным 5-фторурацилом/лейковорином (режим Мейо или клиники Roswell Park). Предварительные данные сообщены только в абстрактном виде, но свидетельствуют о достоверном улучшении безрецидивной выживаемости и, в целом, меньшей токсичности режима XELOX.
В трех рандомизированных исследованиях в качестве адъювантной терапии изучались режимы с включением иринотекана. Во всех них не было продемнострировано улучшение результатов по сравнению с одними фторпиримидинами.
В двух рандомизированных исследованиях ― NSABP С-08 и INT NO 147 к стандартному режиму FOLFOX добавлялись бевацизумаб и цетуксимаб соответственно. В обоих из них это не привело к улучшению отдаленных результатов и поэтому применение моноклональных антител в адъювантной терапии рака толстой кишки в настоящее время не рекомендуется.
В настоящее время в ряде рандомизированных исследованиях исследуется возможность сокращения продолжительности адъювантной терапии с 6 до 3 месяцев, а также значение молекулярных факторов, позволяющих индивидуализировать ее назначение.
Наблюдение
Задачей наблюдения является ранее обнаружение рецидива заболевания. Однако это имеет клинический смысл лишь в случае, когда это приводит к улучшению общей выживаемости. В последние годы в четырех системных обзорах было показано, что более интенсивное наблюдение приводит к улучшению общей выживаемости на 7-13% [I]. Это, главным образом, было обусловлено ранней диагностикой местных рецидивов и изолированных метастазов в печень, что позволяло чаще выполнять радикальные хирургические вмешательства.
Кроме жалоб и физикального обследования следующие обследования рекомендуются больным, которым в случае рецидива болезни будет проводиться терапия:
- УЗИ печени каждые 6 месяцев в течение первых 3 лет, далее ежегодно на 4-й и 5-й год после операции. У больных с высоким риском рецидива заболевания рекомендуется проведение КТ органов грудной клетки и брюшной полости каждые 6 месяцев на протяжении 3 лет [II, B].
- Колоноскопия выполняется после первого года наблюдения и далее каждые 3-5 лет с целью выявления метахронной опухоли или резекции обнаруженных полипов толстой кишки [III, B].
- Рентгенография органов грудной клетки имеет низкую специфичность, тем не менее, рекомендуется ежегодно в течение 5 лет.
- Определение РЭА каждые 3-6 месяцев в течение первых 3 лет и каждые 6-12 месяцев на 4- и 5-м годах даже в случаях, если исходно перед операцией он не был повышен [II, B].
Другие клинические, лабораторные и лучевые исследования показаны лишь больным с соответствующими симптомами.
Читайте также:

