Препараты железа при лейкозе
Виды лейкозов - острые и хронические
Анатомия и физиология костного мозга
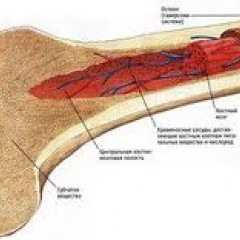
Костный мозг – это ткань находящаяся внутри костей, преимущественно в костях таза. Это самый главный орган, участвующий в процессе кроветворения (рождение новых клеток крови: эритроцитов, лейкоцитов, тромбоцитов). Этот процесс необходим организму, для того чтобы, заменить погибающие клетки крови, новыми. Костный мозг состоит из фиброзной ткани (она образует основу) и кроветворной ткани (клетки крови на разных этапах созревания). Кроветворная ткань включает 3 клеточные линии (эритроцитарный, лейкоцитарный и тромбоцитарный), по которым образуются соответственно 3 группы клеток (эритроциты, лейкоциты и тромбоциты). Общим предком этих клеток, является стволовая клетка, которая запускает процесс кроветворения. Если нарушается процесс образования стволовых клеток или их мутация, то нарушается процесс образования клеток по всем 3 клеточным линиям.
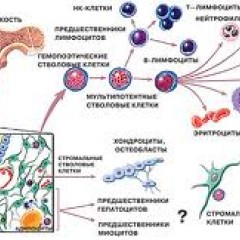
Эритроциты – это красные кровяные клетки, содержат гемоглобин, на нём фиксируется кислород, при помощи которого питаются клетки организма. При недостатке эритроцитов происходит недостаточное насыщение клеток и тканей организма кислородом, в результате чего проявляется различными клиническими симптомами.
Лейкоциты к ним относятся: лимфоциты, моноциты, нейтрофилы, эозинофилы, базофилы. Представляют собой белые клетки крови, они играют роль в защите организма и выработке иммунитета. Их недостаток вызывает снижение иммунитета и развитие различных инфекционных заболеваний.
Тромбоциты – это кровяные пластинки, которые участвуют в образовании тромба. Недостаток тромбоцитов приводит к различным кровотечениям.
Подробнее о видах кровяных клеток читайте в отдельной статье пройдя по ссылке.
Причины лейкоза, факторы риска
Симптомы различных видов лейкозов
- При острых лейкозахотмечаются 4 клинических синдрома:
- Анемический синдром: развивается из-за недостатка выработки эритроцитов, могут присутствовать множество симптомов или некоторые из них. Проявляется в виде усталости, бледности кожи и склер, головокружение, тошнота, быстрое сердцебиение, ломкость ногтей, выпадение волос, патологическое восприятие запаха;
- Геморрагический синдром: развивается в результате недостатка тромбоцитов. Проявляется следующими симптомами: вначале кровотечения из десен, образование синяков, кровоизлияния в слизистые оболочки (язык и другие) или в кожу, в виде мелких точек или пятен. В дальнейшем при прогрессировании лейкоза, развиваются и массивные кровотечения, в результате ДВС синдрома (диссеминированное внутрисосудистое свёртывания крови);
- Синдром инфекционных осложнений с симптомами интоксикации: развивается в результате недостатка лейкоцитов и с последующим снижением иммунитета, повышение температуры тела до 39 0 С, тошнота, рвота, потеря аппетита, резкое снижение веса, головная боль, общая слабость. У больного присоединяются различные инфекции: грипп, пневмония, пиелонефрит, абсцессы, и другие;
- Метастазы - по току крови или лимфы опухолевые клетки попадают в здоровые органы, нарушая их структуру, функции и увеличивая их в размере. В первую очередь метастазы попадают в лимфатические узлы, селезёнку, печень, а потом и в другие органы.
Эритробластный острый лейкоз, поражаются клетки предшественницы, из которых в дальнейшем должны развиться эритроциты. Чаще встречается в пожилом возрасте, характеризуется выраженным анемическим синдромом, не наблюдается увеличение селезёнки, лимфатических узлов. В периферической крови снижено количество эритроцитов, лейкоцитов и тромбоцитов, наличие молодых клеток (эритробластов).
Монобластный острый лейкоз, нарушается выработка лимфоцитов и моноцитов, соответственно они будут снижены в периферической крови. Клинически, проявляется, повышением температуры и присоединением различных инфекций.
Мегакариобластный острый лейкоз, нарушается выработка тромбоцитов. В костном мозге при электронной микроскопии обнаруживают мегакариобласты (молодые клетки, из которых образуются тромбоциты) и увеличенное содержание тромбоцитов. Редкий вариант, но чаще встречается в детском возрасте и обладает неблагоприятным прогнозом.
Хронический миелолейкоз, усиленное образование миелоидных клеток, из которых образуются лейкоциты (нейтрофилы, эозинофилы, базофилы), в результате чего, уровень этих групп клеток будет повышен. Долгое время может протекать бессимптомно. Позже появляются симптомы интоксикации (повышение температуры, общая слабость, головокружение, тошнота), и присоединение симптомов анемии, увеличение селезёнки и печени.
Хронический лимфолейкоз, усиленное образование клеток - предшественниц лимфоцитов, в результате уровень лимфоцитов в крови повышается. Такие лимфоциты не могут выполнять свою функцию (выработка иммунитета), поэтому у больных присоединяются различные виды инфекций, с симптомами интоксикации.
Диагностика лейкоза
- Повышение уровня лактатдегидрогеназы (норма 250 Ед/л);
- Высокий АСАТ (норма до 39 Ед/л);
- Высокая мочевина (норма 7,5 ммоль/л);
- Повышение мочевой кислоты (норма до 400 мкмоль/л);
- Повышение билирубина ˃20мкмоль/л;
- Снижение фибриногена 30%;
- Низкий уровень эритроцитов, лейкоцитов, тромбоцитов.
- Трепанобиопсия (гистологическое исследование биоптата из повздошной кости): не позволяет точно поставить диагноз, а лишь определяет разрастание опухолевых клеток, с вытеснением нормальных клеток.
- Цитохимическое исследование пунктата костного мозга: выявляет специфические ферменты бластов (реакция на пероксидазу, липиды, гликоген, неспецифическую эстеразу), определяет вариант острого лейкоза.
- Иммунологический метод исследования: выявляет специфические поверхностные антигены на клетках, определяет вариант острого лейкоза.
- УЗИ внутренних органов: неспецифический метод, выявляет увеличенные печень, селезёнку и другие внутренние органы с метастазами опухолевых клеток.
- Рентген грудной клетки: является, неспецифическим метом, обнаруживает наличие воспаления в лёгких при присоединении инфекции и увеличенные лимфатические узлы.
Лечение лейкозов
- Полихимиотерапия, применяется с целью противоопухолевого действия:
- Трансфузионная терапия: эритроцитарная масса, тромбоцитарная масса, изотонические растворы, с целью коррекции выраженного анемического синдрома, геморагического синдрома и дезинтоксикации;
- Общеукрепляющая терапия:
- применяется с целью укрепления иммунитета. Дуовит по 1 таблетке 1 раз в день.
- Препараты железа, для коррекции недостатка железа. Сорбифер по 1 таблетке 2 раза в день.
- Иммуномодуляторы повышают реактивность организма. Тималин, внутримышечно по 10-20 мг 1 раз в день, 5 дней, Т-активин, внутримышечно по 100 мкг 1 раз в день, 5 дней;
- Гормонотерапия: Преднизолон в дозе по 50 г в день.
- Антибиотики широкого спектра действия назначаются для лечения присоединяющих инфекций. Имипенем по 1-2 г в сутки.
- Радиотерапия применяется для лечения хронического лейкоза. Облучение увеличенной селезёнки, лимфатических узлов.
Использование солевых повязок с 10% солевым раствором (100 г соли на 1 литр воды). Намочить льняную ткань в горячем растворе, ткань немного сжимать, сложить в четверо, и накладывать на больное место или опухоль, закрепить лейкопластырем.
Настой из измельчённых игл сосны, сухая кожа лука, плоды шиповника, все ингредиенты смешать, залить водой, и довести до кипения. Настоять сутки, процедить и пить вместо воды.
Употреблять соки из красной свеклы, граната, моркови. Кушать тыкву.
Настой из цветков каштана: взять 1 столовую ложку цветков каштана, залить в них 200 г воды, вскипятить и оставить настаиваться на несколько часов. Пить по одному глотку на один приём, необходимо выпить 1 литр в день.
Хорошо помогает в укреплении организма, отвар из листьев и плодов черники. Кипятком примерно 1 литр, залить 5 ложек листьев и плодов черники, настоять несколько часов, выпивать всё за один день, принимать около 3 месяцев.
Это онкологическая патология кроветворной системы, к которой можно отнести обширную группу заболеваний разной этиологии [3] .
При лейкозе клетки костного мозга не производят нормальные лейкоциты, а мутируют и превращаются в раковые. От других разновидностей онкологических заболеваний лейкоз или лейкемия отличается тем, что раковые клетки не образуют опухоль, а находятся в костном мозге, в крови или во внутренних органах. Костный мозг замещается раковыми клетками и не производит достаточное количество здоровых клеток крови. Из-за этого к крови возникает дефицит тромбоцитов, лейкоцитов и эритроцитов. Дефективные лейкоциты не способны нормально функционировать, организм становится восприимчив к инфекциям.
Лейкоз считается самым распространенным онкологическим заболеванием у детей, на его долю приходится около 30% от всех раковых патологий.
Острая лейкемия развивается вследствие перерождения незрелых клеток крови. Несозревшие клетки подвергаются злокачественному перерождению и прекращают нормально развиваться. Такой вид лейкоза назвали острым, так как еще каких-то 50 лет назад такая патология приводила к смерти больного. В наши дни эта форма лейкемии успешно поддается терапии, особенно на ранних стадиях.
Острому лейкозу особенно подвержены дети в возрасте 3-5 лет и, как правило, мужчины 60-70 лет.
Хроническая или медленно развивающаяся форма чаще всего встречается у подростков и у взрослых людей в возрасте 50-60 лет. При хронической лейкемии перерождаются уже созревшие клетки крови.
Точные причины возникновения лейкоза все еще не установлены. На сегодняшний день 60-70% причин развития лейкемии не выяснены. Однако можно выделить ряд факторов риска, которые угнетают мозговое кроветворение, к которым относятся:
- 1 поражение организма вирусными и инфекционными заболеваниями, при этом здоровые клетки могут переродиться в атипичные;
- 2 курение;
- 3 генетическая предрасположенность, особенно от отца к детям;
- 4 генетические нарушения – синдром Дауна, нейрофиброматоз;
- 5 токсическое воздействие на организм химическими соединениями – пестициды, растворители, некоторые лекарственные средства;
- 6 побочный эффект после химиотерапии;
- 7 патологии кровеносной системы – анемия и другие.
Под воздействием какой-либо причины в костном мозге начинают размножаться недифференцированные клетки, которые вытесняют здоровые. Для развития лейкоза достаточно лишь одной онкологической клетки, которая быстро делится, клонируя раковые клетки. Атипичные клетки с кровью разносятся по организму и образуют метостазы в жизненно важных органах.
Начало заболевания обычно протекает бессимптомно. Больной чувствует себя нормально до тех пор, пока пораженные клетки не начинают распространяться по кровеносной системе. Затем появляется анемия, пациент постоянно чувствует себя уставшим, жалуется на одышку и тахикардию. В связи с уменьшением количества тромбоцитов в крови возможно развитие гемофилии. Поэтому возможна кровоточивость десен, склонность к незаживающим синякам, носовым, маточным и желудочным кровотечениям. Затем появляются боли в позвоночнике, ногах, вплоть до хромоты.
При некоторых формах лейкемии может подниматься температура, у больного пропадает аппетит. Часто лейкозные клетки поражают клетки печени, селезенки, кожи, почек и головного мозга, поэтому печень и селезенка могут быть незначительно увеличены, возможны боли в области живота.
При лимфобластной лейкемии поражаются и, соответственно, увеличиваются лимфатические узлы на шее или в паху б, при пальпации больной не испытывает болевой синдром.
Если лейкозные клетки проникают в почки, то развивается почечная недостаточность.
При лейкозной пневмонии пациент жалуется на хриплое дыхание, сухой кашель и одышку.
Хроническая форма лейкоза может протекать без явных симптомов в течение нескольких лет.
Настороженность относительно лейкемии должны вызвать:
- воспаление и кровоточивость десен;
- рецидивирующая ангина;
- потеря веса;
- ночная потливость;
- бледность кожных покровов;
- склонность к кровоизлияниям на коже;
- увеличение лимфоузлов после перенесенных инфекций.
Острая форма лейкоза возникает внезапно, быстро прогрессирует и может привести к смерти пациента.
Со стороны сосудистой системы распространение раковых клеток может привести к закрытию просвета лейкемическими тромбами и закончиться инфарктом.
При проникновении лейкозных клеток в оболочку головного мозга и больного развивается нейролейкоз. При этом у пациента возможны обмороки, судороги, головокружения, рвота.
При проникновении метостаз в жизненно важные органы, у больного могут появиться головные боли, кашель, одышка, зуд кожных покровов, интенсивные маточные и носовые кровотечения.
При поражении кожных покровов у больного на поверхности кожи могут появиться узелки, сливающиеся между собой.
Специальных профилактических мер против лейкемии нет. Для людей с отягощенной наследственностью и людям, чья профессиональная деятельность связана с радиоактивными и токсическими веществами важна ранняя диагностика.
Общие профилактические меры лейкоза – это здоровый образ жизни, умеренные регулярные физические нагрузки, правильное питание, сезонная витаминотерапия.
Чем раньше начать терапию лейкоза, тем более вероятность выздоровления. Вид комплексного лечения зависит от стадии и типа патологии. В первую очередь пациент нуждается в консультации гематолога. В зависимости от симптомов затем подключают хирурга, дерматолога, ЛОР-врача, гинеколога или стоматолога.
Пациенту с лейкемией необходима химиотерапия с целью уничтожения лейкозных клеток. При этом противоопухолевые средства можно комбинировать. Лечение начинают с индукционной терапии, продолжительность которой должна составлять 4-5 недель.
Хороших результатов в терапии лейкоза можно добиться с помощью трансплантации костного мозга. Для этого сначала клетки крови больного облучают, и они разрушаются, а затем в костный мозг вводят здоровые донорские клетки с идентичным типом ткани. Донором, как правило, выступают близкие родственники больного.
Терапия лейкоза возможна только в условиях стационара, так как организм пациента ослаблен и нельзя допустить возможности инфицирования.
Полезные продукты при лейкозе
Пациентам с лейкемией важно витаминизированное правильно сбалансированное питание, так как в период терапии больные испытывают слабость из-за анемии и токсического воздействия химиотерапии. Поэтому рацион пациента должен включать:
- 1 продукты с большим количеством витамина С и микроэлементов, которые способствуют восстановлению красных кровяных телец;
- 2 такие овощи как кукуруза, хрен, тыква, краснокочанная капуста, кабачки, красная свекла;
- 3 фрукты: виноград темных сортов, земляника, гранат, апельсины, черника, вишня;
- 4 каши из пшена, гречки и риса;
- 5 морепродукты и такая рыба как сельдь, скумбрия, форель, треска;
- 6 молочные продукты: нежирный сыр, творог, пастеризованное молоко;
- 7 мясо кролика;
- 8 субпродукты: печень, язык, почки;
- 9 мед и прополис;
- 10 шпинат;
- 11 ягоды черной смородины;
- 12 отвар ягод шиповника.
Лечение лейкоза народными средствами не может заменить терапию в стационаре, но вполне может быть дополнением лечению, назначенным гематологом.
- отвар цветов барвинка отличается хорошим противоопухолевым эффектом;
- для очистки лимфы по 1 л сока грейпфрута и апельсина смешивают с 300 г сока лимона и добавляют 2 л воды. Принимать 3 дня подряд по 100 г через каждые 30 минут, ничего при этом не есть [1] ;
- как можно больше черники в свежем виде или отвар из листьев и стеблей растения;
- березовые почки залить водой в соотношении 1:10 и настаивать в течение 3-х недель, принимать по 1 ч.л. трижды в день;
- принимать 4 раза в день по 150-200 г запеченной тыквы;
- пить как чай отвар из листьев брусники;
- 1 ст. очищенных орехов кедра залить ½ л водки, настаивать в темноте 14 дней и пить 3р в день по 1 ч.л. [2] ;
- употреблять 2 р в день по 1 ст.л. распаренных семян льна;
- пить чай из травы земляники;
- употреблять 3 р в день по 1 ч.л. пыльцы, запивая молоком.
Больным лейкозом следует отказаться от:
- мяса с тугоплавкими жирами – свинины, баранины, говядины, а также сала, так как они способствуют формированию тромбов.
- для того, чтобы лучше усваивалось железо необходимо исключить продукты с содержанием кофеина: чай, кофе, пепси-колу;
- ограничить прием продуктов, разжижающих кровь, таких как орегано, карри, имбирь, калину, чеснок;
- сдобной выпечки, крепких бульонов и бобовых при низком уровне нейтрофилов;
- уксуса и маринованных овощей, так как они разрушают кровеносные тельца.
Запрещено использование любых материалов без нашего предварительного письменного согласия.
Администрация не несет ответственности за попытку применения любого рецепта, совета или диеты, а также не гарантирует, что указанная информация поможет и не навредит лично Вам. Будьте благоразумны и всегда консультируйтесь с соответствующим врачом!
Снеговой Антон Владимирович - канд. мед. наук, ст. науч. сотр., специалист по поддерживающей терапии отд. изучения новых противоопухолевых лекарств
Рассмотрена проблема анемии у онкологических больных. Одной из причин развития анемии является дефицит железа. Абсолютная или функциональная нехватка железа снижает эффективность применения рекомбинантного эритропоэтина, используемого для лечения анемии индуцированной химиотерапией. Многочисленные исследования показали, что внутривенные формы железа по сравнению с пероральными более эффективно восполняют дефицит железа необходимый для оптимального эритропоэза. Современные американские и европейские рекомендации (ESMO, NCCN) по лечению анемии у онкологических больных включают обязательное использование внутривенных форм железа.
Ключевые слова: анемия, химиотерапия, железодефицитная анемия, эритропоэз.
Iron preparations in the treatment of anemia in cancer patients
S.V. MOISEYEV
N.N. Blokhin Russian Cancer Research Center, Russian Academy of Medical Sciences
The paper considers the problem of anemia in cancer patients. Iron deficiency is one of the causes of anemia. Absolute or functional iron deficiency lowers the efficacy of recombinant erythropoietin used to treat anemia with induced chemotherapy. Numerous trials have shown that intravenous versus oral iron preparations are more effective in compensating for the lack of iron indispensable for optimal erythropoiesis. Today’s American and European guidelines (ESMO, NCCN) for the treatment of anemia in cancer patients include the compulsory use of intravenous iron formulations.
Key words: anemia, chemotherapy, iron-deficiency anemia, erythropoiesis.
В последние годы анемия привлекает к себе пристальное внимание ученых, так как является частым осложнением опухолевых заболеваний и противоопухолевой цитотоксической терапии. На фоне лекарственного лечения частота анемии среднетяжелой (НЬ 8-10 г/л) и тяжелой (НЬ 6,5-8 г/л) степени достигает 75%, что отрицательно сказывается на качестве жизни пациентов [1]. Кроме того, анемия ведет к тканевой гипоксии, снижает чувствительность опухоли к химиотерапии и лучевой терапии и является независимым прогностическим фактором, определяющим выживаемость онкологических больных [2].
В течение многих лет единственным методом лечения тяжелого анемического синдрома в онкологии была гемотрансфузия (ГТ), а точнее переливание донорской эритроцитарной массы. ГТ и сейчас используется при необходимости быстрого повышения уровня гемоглобина, хотя обладает множеством побочных эффектов и, по данным американских авторов, существенно увеличивает риск тромбоэмболии и смерти [3].
Создание и внедрение в практику лечения онкологических больных рекомбинантных человеческих эритропоэтинов (ЭПО) значительно снизило количество ГТ и обусловленных ими осложнений. При этом отмечено положительное влияние ЭПО на качество жизни пациентов [4]. Однако, являясь единственным патогенетическим методом лечения анемии, ЭПО не всегда позволяют достичь желаемого результата. Одной из причин этого может быть дефицит железа.
Спорные вопросы, касающиеся использования ЭПО у онкологических больных, достаточно подробно освещены в ряде отечественных публикаций [5, 6]. Целью данного обзора является оценка роли дефицита железа и препаратов для его коррекции в лечении анемии у онкологических больных.
Железо является функциональным компонентом большого числа ферментов, играющих важную роль в основных метаболических процессах. По мнению M. Aapro и соавт. [7], дефицит железа у онкологических больных составляет 30-60%.
Этиопатогенетические механизмы развития анемии при злокачественных опухолях многофакторны и сложны. Активация иммунной системы и гиперэкспрессия провоспалительных цитокинов (интерлейкины-1 и 6, фактор некроза опухоли, интерферон-гамма и др.) нарушает продукцию эндогенного эритропоэтина, эритроцитов и метаболизма железа 10.
Гепсидин - гормон синтезируемый печенью, открыт и описан A. Krause и соавт. [11] как LEAP - liver expressed antimicrobial peptide. Установлено, что гиперпродукция интерлейкина-6 способствует повышенному синтезу гепсидина. Циркулируя в плазме, гепсидин взаимодействует с транспортным белком ферропортином, подавляет всасывание железа в кишечнике, высвобождение его и макрофагов из депо, что приводит к дефициту железа в костном мозге и развитию анемии [12]. При том, что количество железа в организме может быть достаточным и даже повышенным, возникает так называемый функциональный дефицит железа (ФДЖ) [13, 14].
Таким образом, существует дефицит железа абсолютный и функциональный. Функциональный дефицит железа характеризуется нормальным или высоким уровнем ферритина в сыворотке ( 800 нг/мл), насыщением трансферрина 800 мг/мл и насыщении трансферрина - 20% препараты железа не вводятся.
В клинической практике для внутривенного введения используются следующие препараты: карбоксимальтозат железа (феринжект), сахарат железа (венофер), глюконат железа (ферлицит), декстран железа (феррумлек, космофер). Все они представляют собой сферические железо-углеводные коллоидные комплексы, включающие железо-(111)-оксигидроксидное ядро, сходное по структуре с ферритином, которое покрыто углеводной оболочкой. Оболочка придает комплексу стабильность и замедляет выделение железа. Эффективность и переносимость внутривенных препаратов зависят от состава оболочки, молекулярной массы и стабильности комплекса. Глюконаты имеют низкую молекулярную массу, менее стабильны и быстрее высвобождают железо: период полувыведения (Т½) - 1 ч. Декстраны имеют большую молекулярную массу, более стабильны - Т½ - 30-60 ч, но наиболее часто дают аллергические реакции, включая анафилактический шок. Сахараты имеют Т½ - 5,3 ч, значительно реже дают аллергические реакции.
Карбоксимальтозат железа (феринжект) характеризуется медленным физиологическим высвобождением железа из стабильного комплекса с углеводом, что определяет его низкую токсичность. Феринжект после внутривенного ведения захватывается ретикулоэндотелиальной системой и распределяется на железо и карбоксимальтозу. После однократного внутривенного введения препарата в дозах от 100 до 1000 мг максимальная его концентрация в сыворотке (37-333 мкг/мл) достигается через 15 мин - 1,21 ч. Время полувыведения составляет 7-12 ч, среднее время удержания в организме 11-12 ч. Препарат практически не выделяется почками. Феринжект вводится внутривенно струйно в максимальной дозе 200 мг не более 3 раз в неделю или в дозе 1000 мг внутривенно капельно 15 мин не чаще 1 раза в неделю. Препарат хорошо переносится и не требует проведения тест-дозы, возможность возникновения аллергических реакций минимальна [16].
Таким образом, больные со злокачественными опухолями часто страдают анемией, которая может быть железодефицитной. Для лечения этих состояний используют средства, стимулирующие эритропоэз и гемотрансфузии. Одновременно необходимо возмещение дефицита железа.
Впервые эффективность комбинации ЭПО с препаратами железа была выявлена в нефрологии, причем было установлено преимущество именно внутривенных форм железа по сравнению с пероральными. В последнее десятилетие проведен ряд исследований по оценке такого лечения у онкологических больных с анемией, индуцированной химиотерапией. Результаты некоторых из них представлены ниже.
В исследовании М. Auerbach и соавт. [17] 157 пациентов, получавших эритропоэтин альфа еженедельно в течение 6 нед, были рандомизированы на три группы: 1-я - дополнительно вводился декстран железа внутривенно струйно или капельно; 2-я - получала препарат железа внутрь, 3-я - была контрольной. Все пациенты имели исходный уровень НЬ 105 г/л и низкое насыщение трансферрина 19%. При оценке через 6 нед лечения в контрольной группе средний уровень НЬ 105 г/л (анемия сохраняется), во 2-й группе НЬ - 112 г/л, целевой уровень не достигнут, существенной разницы с контролем нет. В 1-й группе достигнут максимальный уровень гемоглобина - 119-122 г/л, отличий при струйном и капельном введении нет. Дополнительно оценивали частоту гематологического ответа - процент больных, достигших уровень НЬ > 120 г/л или имевших увеличение НЬ > 20 г/л. Гематологический ответ достоверно превышал показатели 2-й группы и контроля: 68, 36 и 25% соответственно (р 110 г/л и насыщением трансферрина 15%. При оценке через 8 нед лечения прирост уровня НЬ в 1-й группе составил 24 г/л, а во 2-й и 3-й - 16-15 г/л. Гематологический ответ в 1-й группе составил 73%, во 2-й и 3-й группе соответственно 45 и 41%. Разница статистически достоверна как между 1-й и 2-й группами (р=0,009), так и между 1-й и контролем (р=0,0044).
В 2008 г. L. Bastit и соавт. [19] опубликовали результаты крупного (n=396) открытого рандомизированного исследования III фазы. Пациенты с исходным уровнем НЬ 105 г/л и насыщением трансферрина > 15% получали лечение дарбэпоэтином альфа по 500 мкг 1 раз в 3 нед в течение 16 нед. Сравнивались две группы: исследовательская - дополнительно внутривенно 1 раз в неделю вводился сахарат железа; контрольная - железо вводилось перорально или не вводилось. Частота гематологического ответа в исследовательской группе составила 86%, а в контрольной - 73%. Дополнительно оценивалась потребность в заместительных гемотрансфузиях, которая в группе комбинированного лечения достоверно различалась с контролем (9% против 20% соответственно, р=0,005).
В исследовании P. Pedrazzoli и соавт. [20] 149 больным дарбэпоэтин вводился по 150 мкг 1 раз в неделю с внутривенным железом или без него. Авторы показали достоверное преимущество комбинированного лечения с включением внутривенного железа. Интересные данные получили М. Hedenus и соавт. [21], оценившие не только гематологический ответ, но и количество израсходованного ЭПО. Было установлено, что комбинированное применение ЭПО с внутривенным железом в среднем на 25% снижает расход ЭПО по сравнению с контролем.
В литературе имеются публикации, указывающие на возможность достижения целевого уровня гемоглобина и снижения потребности в гемотрансфузиях у онкологических больных с анемией, при использовании только внутривенных форм железа. В 2010 г. Р. Dangsuvan и соавт. [22] опубликовали результаты локального исследования (n=44), в котором сравнивался сахарат железа и пероральные препараты у пациенток с анемией на фоне химиотерапии без дополнительного введения ЭПО. Потребность в заместительных гемотрансфузиях в группе внутривенного сахарата железа составила 22,7%, с пероральным препаратом железа - 63,6%. Опубликованы данные, показавшие эффективность внутривенных препаратов железа для лечения анемии у онкологических больных без применения средств, стимулирующих эритропоэз. В 2010 г. Т. Steinmetz и соавт. [23] опубликовали результаты исследования по оценке эффективности и переносимости карбоксимальтозата железа у онкологических больных с анемией и абсолютным или функциональным дефицитом железа. Оценка эффективности проведена у 420 пациентов, которые были рандомизированы в группу внутривенного железа без средств стимулирующих эритропоэз (n=347), и группу, получавших этот же препарат в комбинации со стимуляторами эритропоэза (n=73). Через 5 нед лечения гемоглобин в обеих группах повысился до 11-12 г/л. Нежелательные явления (в основном тошнота и диарея), возможно, связанные с карбоксимальтозатом железа, составили 2,3%. Препарат в обоих случаях эффективно повышал и стабилизировал уровень гемоглобина у онкологических больных [23].
Заключение
Анемия часто встречается у больных со злокачественными новообразованиями и связана как с основным заболеванием, так и с его лечением: цитотоксическая и лучевая терапия оказывают прямое подавляющее действие на кроветворение. Анемия при злокачественных опухолях по патогенезу ассоциируется с анемией при хронических заболеваниях и нередко сочетается с дефицитом железа - функциональным или абсолютным. Результаты международных исследований показали необходимость использования внутривенных форм железа с гемостимулирующей терапией ЭПО для лечения анемии, возникшей на фоне химиотерапии. Одновременно существуют указания на эффективность внутривенного железа в монотерапии при функциональном его дефиците. Это явилось основанием для включения в международные рекомендации (NCCN, ESMO) по проведению гемостимулирующей терапии у онкологических больных внутривенных форм железа [15, 24]. При отсутствии дефицита железа (ферритин >800 нг/мл и насыщение трансферрина > 20%) вводить его не рекомендуется, как и пациентам с признаками активной инфекции [15]. Целевой уровень гемоглобина при лечении анемии не должен превышать 12,0 г/дл (120 г/л), его достижение сопровождается улучшением качества жизни пациентов и, возможно, результатов противоопухолевого лечения и выживаемости. Надеемся, что дальнейшее проведение хорошо спланированных международных исследований позволит ответить на многие вопросы, еще существующие в этой проблеме.
Недавно в клинической практике появился новый препарат для внутривенного введения - железа карбоксимальтозат (феринжект), показавший высокую эффективность как в комбинации с ЭПО, так и в монорежиме. Феринжект не требует проведения тест-дозы, обладает хорошей переносимостью и минимальным риском развития аллергических реакций.
Список использованной литературы
Читайте также:

