Рак молочной железы метаболизм

Ученые работают над новыми методами борьбы с онкологией молочной железы
Научно-исследовательская группа специалистов, возглавляемая профессором Сарой-Марией Фендт, представляющей VIB-KU Leuven, провела исследования и обнаружила, что раковые клетки, поражающие молочную железу и распространяющиеся на другие органы, взаимодействуют с процессом метаболизма полезных веществ. В результате этого процесса производится энергия, в отличие от обычных клеток организма и других клеток рака, не находящихся в процессе метастазирования. Для наглядной демонстрации полученных результатов ученые использовали мышиные модели – это позволило показать, что при замедлении процесса образования энергии в результате метаболизма полезных веществ в организме заметно снижается скорость развития и количество метастазов – показатели составили порядка 60%. Данные результаты исследования могут быть первыми шагами на пути к разработке инновационных методик противораковой терапии молочной железы, которые позволят предупредить развитие метастазов с помощью воздействия на процесс метаболизма. Полученные результаты и идеи по их продвижению были опубликованы в научном издании Nature Communications.
Раковая опухоль, которая распространяется и на другие органы, в большинстве случаев приводит к летальному исходу пациента. Помимо этого перед медиками также стоит задача в нахождении способа предотвращения развития онкологии, то есть предупреждения метастаз. На данный момент более четверти из обследуемых пациентов, у которых был диагностирован рак молочной железы с метастазированием, не получала эффективного лечения. Наряду с этим профессор Сара-Мария Фендт акцентирует внимание на важности роли питательного пролина в энергопроизводстве в результате метаболического процесса для метастазирующих клеток рака, атакующих молочную железу.
Процесс изучения роли пролина
Как отметила профессор Сара-Мария Фендт, ученые провели параллель в сравнении повышения метаболизма пролина при метастазах рака, поражающего молочную железу людей и мышей, с раком на начальных этапах развития. Также специалисты смогли ингибировать фермент, управляющий пролином Prodh, что позволило снизить скорость распространения метастазов в легкие и не нанесло повреждения здоровым тканям и не снизило функциональность внутренних органов. Как вывод, ученые отмечают высокую вероятность участия Prodh в противораковой терапии для достижения действенных результатов в борьбе против рака молочной железы.
Пути разработки противораковой терапии
Результаты проведенных исследований являются первыми шагами на пути к возможности фактического ингибирования определенного фермента, участвующего в метаболизме и отвечающего за его скорость, что позволит разрабатывать на его основе целую противораковую методику лечения. Профессор Фендт отмечает, что ученые будут продвигаться по двум направлениям в своих исследованиях, чтобы воплотить полученные результаты на практике.
Профессор Фендт рассказала, что научно-исследовательская группа собирается определить способ воздействия замедленного с помощью Prodh метаболизма на работу пораженных клеток, что позволит определить комплекс терапии, который будет включать как стандартные способы лечения, включая химиотерапию, так и инновационные методы воздействия для достижения наилучшего эффекта. Также ученые находятся в поисках промышленных партнеров в области фармакологии и биохимии для взаимного сотрудничества и помощи в определении мощных соединений, ингибирующихся ферментом. Это позволит ощутимо продвинуться в результатах и дать шанс на выживание большому количеству пациентов – испытания планируется проводить в течение пяти лет.
Онкология, обусловленная мутациями KRAS-гена .
Геномы раковых клеток (клетки, которые не .
Наиболее распространенным и часто встречаемым .
Похожие темы научных работ по клинической медицине , автор научной работы — Шашова Е. Е., Кондакова И. В., Слонимская Е. М., Бочкрева Н. В.
‘З (17) сентябрь 2006 г Тема номера: ОНКОЛОГИЯ, ХИРУРГИЯ
— при создании аудио- и видео- рекламы целесообразно Действенные результаты в противораковой борьбе могут быть
включать интервью с пациентками и врачами, которые помогут получены лишь при объединении усилий органов здравоохране-изменить представление женщин о безысходности и бесперспек- ния со всеми общественными, политическими и промышленными тивности лечения рака репродуктивных органов. кругами общества, при обязательной поддержке правительствен-
Рак молочной железы: значение ферментов метаболизма эстрогенов в патогенезе и прогнозе данного заболевания
Е. Е. ШАШОВА, И. В. КОНДАКОВА, Е. М. СЛОНИМСКАЯ, Н. В. БОЧКРЕВА. ГУ НИИ онкологии ТНЦ СО РАМН, Томск.
Рак молочной железы (РМЖ) занимает первое место в структуре злокачественных новообразований среди женского населения и является гормонозависимой опухолью. Развитие и биологические характеристики гормонозависимых опухолей женской половой сферы во многом определяются метаболизмом эстрогенов. Показан широкий спектр важных биологических функций, которые регулируют эстрогены, связываясь с внутриклеточными рецепторами и активируя экспрессию различных генов [Suzuki T., et al., 2005]. К наиболее важным эффектам эстрогенов относят активацию пролиферации [Han H., et al., 2006], ингибирование процесса апоптоза, а также стимуляцию выработки факторов роста [See-ger H., 2006]. Вышеперечисленные эффекты могут обуславливать развитие рака в эстроген-зависимых тканях. Наибольший вклад в процесс синтеза эстрогенов вносят ферменты ароматаза и стероид-сульфатаза. Ароматаза осуществляет превращение андростендиона и тестостерона в эстрон и эстрадиол, тогда как стероидсульфатаза катализирует конверсию биологически инертного эстрон сульфата в эстрон. Основной транспортной формой эстрогенов, циркулирующих в периферической крови, у женщин в постменопаузе является эстрон сульфат, поэтому стероидсульфатаза имеет особое значение в патогенезе РМЖ в постменопаузальном периоде. Доказано, что локальное образование эстрогенов в постменопаузе является более важным фактором патогенеза РМЖ по сравнению с системным уровнем циркулирующих гормонов [Nakata T., et al., 2003].
Гормоны, не связавшиеся с соответствующими рецепторами, подвергаются инактивации. Первоначально происходит окисление эстрогенов до высокоактивных электрофильных интермедиатов — катехолэстрогенов в реакции, катализируемой 2-,4-,16-эстро-генгидроксилазами [Zhao Z., 2006]. Дальнейшее превращение катехолэстрогенов происходит в ходе реакций метилирования, осуществляемых катехол-О-метилтрансферазой (КОМТ), и коньюги-рования, катализируемых различными трансферазами, наиболее важной среди которых является глутатион^-трансфераза (rST). Недостаточная активность этих ферментов может являться причиной накопления таких высокоактивных метаболитов эстрогенов, как катехолэстрогены, хиноны и семихиноны, которые могут связываться с ДНК и индуцировать генотоксические повреждения, мутагенез и канцерогенез [Zhao Z., 2006]. Кроме того, метаболиты эстрогенов, главным образом 4-катехолэстрогены, способствуют увеличению риска развития рака за счет их выраженного митоген-ного эффекта [Seeger H, 2005; Zhao Z, 2006].
Высокая активность ароматазы и стероидсульфатазы в тканях молочной железы обеспечивает локальный синтез эстрогенов и связана с развитием РМЖ. Высокий уровень экспрессии гена ароматазы коррелирует с низкой выживаемостью и прогрессированием заболевания. Результаты анализа 10-летней выживаемости показали, что в образцах тканей опухолей больных РМЖ, имеющих регионарные и отдаленные метастазы, экспрессия гена ароматазы была значительно выше по сравнению с тканями опухолей больных, характеризующихся безметастатическим течением заболевания [Salhab M., 2006].
Целью настоящей работы явилось изучение активности ферментов синтеза и метаболизма эстрогенов, содержание рецепторов стероидных гормонов в нормальной, опухолевой тканях и в ткани лимфогенных метастазов при РМЖ, а также оценка их прогностической значимости.
В исследование были включены 85 больных РМЖ после выполненного радикального хирургического вмешательства. Изучались образцы нормальной, опухолевой тканей и ткань лимфогенных метастазов. Возраст больных составил 30-69 лет. Распространенность процесса оценивалась как Т13 N„2 М01. У всех больных, включенных в исследование, диагноз РМЖ был морфологически верифицирован.
Активность ароматазы стероидсульфатазы, КОМТ и суммарная 2/4-эстрогенгидроксилазная активность был оценены радиометрическими методами, активность ГОТ — спектрофотометрически. Содержание рецепторов эстрогенов и прогестерона определяли радиолигандным методом. Статистический анализ результатов включал использование непараметрического критерия Манна-Уитни, метода Каплана-Майера. Однофакторный анализ прогностической значимости признаков в отношении 2-летней безрецидивной и безметастатической выживаемости при РМЖ был выполнен с использованием критерия Гехана-Уилкса.
При сопоставлении активности ферментов с менструальной функцией больных РМЖ было обнаружено увеличение активности КОМТ в группе больных в постменопаузе, по сравнению с больными с сохраненной менструальной функцией. Изменения активности ферментов локального синтеза эстрогенов, а также суммарной 2/4-эстрогенгидроксилазной активности и ГОТ были не достоверны.
Важно отметить, что у женщин в пременопаузе активность КОМТ была значительно выше в опухолях с отрицательным статусом рецепторов эстрогена по сравнению с рецептор-положительными опухолями. Повышенная активность КОМТ в сочетании с отрицательным рецепторным статусом в опухоли в молодом возрасте, вероятно, определяет менее благоприятное течение заболевания.
В наших исследованиях наблюдалось увеличение активности ферментов синтеза: ароматазы и стероидсульфатазы и достоверное снижение активности ферментов инактивации эстрогенов геТ и КОМТ при увеличении размера опухоли при РМЖ. При исследовании ферментов в зависимости от распространенности
Тема номера: ОНКОЛОГИЯ, ХИРУРГИЯ ‘3 (17) сентябрь 2006 г
процесса на регионарные лимфоузлы наблюдалось снижение активности 2,4-эстрогенгидроксилаз и ТСТ в опухолевой ткани при увеличении количества вовлеченных в процесс метастазирования регионарных лимфоузлов. Подобные изменения свидетельствуют о связи ферментов инактивации эстрогенов — ТСТ и КОМТ с формированием высокого метастатического потенциала РМЖ.
Выявлено, что 2-летняя безрецидивная и безметастатическая выживаемость была выше в группе больных с низкой активностью ароматазы, высокой активностью эстрогенгидроксилаз и высокой активностью ТСТ в опухолях при РМЖ.
Таким образом, проведенное исследование подтвердило значимость некоторых клинических параметров как факторов риска развития РМЖ в различные возрастные периоды. Вместе с тем, были выявлены новые факторы прогноза, ассоциированные с метаболизмом эстрогенов. Полученные данные являются принципиально новыми и позволяют прояснить в значительной степени патогенез этих процессов в различные возрастные периоды. На основании выявленных прогностических факторов возможно создание принципиально новых подходов к лечению больных РМЖ.
1. Han H., Heo J. S., Lee I. J. Estradiol-17beta stimulates proliferation of mouse embryonic stem cells: involvement of MAPKs and CDKs as well as protooncogenes. // Am J Physiol Cell Physiol. — 2006. — Vol. 290 — P. 10671075.
2. Nakata T, Takashima S, Shiotsu Y, et al. Role of steroid sulfatase in local formation of estrogen in post-menopausal breast cancer patients. // J Steroid Biochem Mol Biol. — 2003 — Vol. 86 — P. 455-60.
3. Salhab M. The role of aromatase and 17-I(2)-hydroxysteroid dehydrogenase type 1 mRNA expression in predicting the clinical outcome of human breast cancer. //Breast Cancer Res Treat. — 2006. — Mar 16.
4. Seeger H., Wallwiener D, Kraemer E. Comparison of possible carcinogenic estradiol metabolites: Effects on proliferation, apoptosis and metastasis of human breast cancer cells. // Maturitas. — 2006. — Vol. 54. — P. 72-77.
5. Suzuki T, Miki Y, Nakamura Y et al. Sex steroid-producing enzymes in human breast cancer. // Endocrine-Related Cancer. — 2005. — Vol. 12.
6. Zhao Z., Kosinska W, Khmelnitsky. Mutagenic Activity of 4-Hydrox-yestradiol, but Not 2-Hydroxyestradiol, in BB Rat2 Embryonic Cells, and the Mutational Spectrum of 4-Hydroxyestradiol. // Chem Res Toxicol. — 2006.
— Vol. 3. — P. 475-479.
Обоснование патогенетической гормональной терапии у больных раком молочной железы
И. Г. ГАТАУЛЛИН, С. В. ПЕТРОВ, М. Р. ГИЛЬМУТДИНОВА, Г. А. УСМАНОВА, И. Г. КОБЗЕВА. Клинический онкологический диспансер республики Татарстан, Казань.
Казанская государственная медицинская академия.
Рак молочной железы (РМЖ) — одно из самых распространенных онкологических заболеваний у женщин. РМЖ является гормонозависимой опухолью, в патогенезе возникновения которой большое значение имеет состояние гормонального фона, вследствие чего важно изучение гормонального статуса больных с этой патологией.
Основную роль в регуляции процессов пролиферации и дифференциации эпителия молочных желез играют половые стероиды,уровенькоторыхворганизмеконтролируетсягипоталамо-гипофизарной системой. При РМЖ наблюдаются нарушения как продукции стероидных гормонов, связанные с дисфункцией яичников, так и взаимосвязи между гипоталамо-гипофизарной системой и яичниками.
Состояние эндокринной системы у больных РМЖ является важным фактором при выборе правильных методов лечения. Поэтому поиск надежных критериев, с помощью которых можно было бы предсказать и оценить эффект от применяемого лечения, сохраняет свою актуальность.
Современные представления о роли и механизме действия гормональных факторов в генезе рака молочной железы создают предпосылки для поиска более эффективных методов лечения и профилактики этого заболевания.
Целью настоящего исследования явилось изучение клинической значимости изменения уровня пролактина в крови и обоснование патогенетической терапии распространенных форм заболевания.
Материалы и методы
Нами проанализированы сведения о 50 больных раком молочной железы стадий T1-4 N0-3 M1 в возрасте от 36 до 75 лет. Гормональный профиль был исследован у женщин, страдающих РМЖ, до оперативного вмешательства и включал в себя исследование лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), тестостерона, пролактина. Для определения гормонов в сыворотке крови использовали метод иммуноферментного анализа. У всех больных диагноз подтвержден при гистологическом исследовании. Определение гормонального статуса опухоли выполняли при помощи моноклональных антител к эстрогеновым рецепторам клона 1D5 (DAKO), моноклональных антител к прогестероновым рецепторам клона PgR 636 (DAKO). Характер иммуногистохимических реакций на онкобелок HER 2/NEU оценивали по протоколу ГЕРЦЕПТ-ТЕСТА (фирма DAKO Cytomation) визуально в баллах с учетом интенсивности окраски и процента окрашенных клеток. В каждом случае подсчитывали 200 клеток.
Все образцы первичных опухолей фиксировали в формалине и заливали в парафин.
При клиническом анализе исследуемой группы больных I стадия заболевания была диагностирована у 4 пациенток, стадия IIA — у 16, стадия IIB — у 10, стадия IIIA — у 6, стадия IIIB — у 12 , IV — у 2 пациенток. Наиболее часто встречающейся морфологической формой является инфильтративно протоковый рак
Российский научный центр рентгенорадиологии, г.Москва
Введение
Рак молочной железы (РМЖ) – наиболее распространенный вид опухолей, встречающихся среди женского населения Европы, Америки и некоторых стран Азии [4,5,8-10,12]. В течение последних 20 лет в мире, а также в России наметилась устойчивая тенденция к росту заболеваемости этим видом рака, особенно в городах и мегаполисах [7-9,12]. Начиная с 1985 г. РМЖ занимает 1-е место среди онкологических заболеваний у женщин (частота встречаемости – 31,2%) [4,5,8-10].
Известно, что развитие опухоли связано с нарушением роста и дифференцировки клеток и злокачественным их перерождением. Во многих случаях такие нарушения обусловлены мутациями или резким повышением активности клеточных онкогенов – нормальных генов, которые участвуют в регуляции клеточного цикла, передаче сигналов и других процессах жизнедеятельности клеток. В 10% случаев заболевание передается из поколения в поколение и обусловлено наличием врожденных мутаций в генах предрасположенности BRCA1 или BRCA2 (BReast CАncer) [1,8,9,13,14].
Развитие и биологические характеристики рака молочной железы во многом определяются метаболизмом эстрогенов. К наиболее значимым проявлениям действия эстрогенов относят активацию пролиферации, ингибирование процессов апоптоза, а так же стимуляцию выработки факторов роста. Вышеперечисленные эффекты могут обуславливать развитие пролиферативных гиперпластических процессов и рака в эстроген-зависимых тканях.
В настоящее время при определении прогноза заболевания и выбора наиболее адекватной тактики лечения больных раком молочной железы основываются на ряде факторов, определяющих как особенности организма (возраст, состояние менструальной функции), так и биологические характеристики самой опухоли (размер опухоли, наличие метастазов в регионарные лимфоузлы, тип опухолевого роста, гистологическая принадлежность, степень злокачественности, инвазия кровеносных и лимфатических сосудов, уровень экспрессии рецепторов эстрогенов и прогестерона и др.). Однако результаты лечения далеко не всегда являются удовлетворительными. И в настоящее время ведется поиск новых, более информативных параметров, позволяющих адекватно учитывать молекулярные механизмы развития опухолевого процесса.
Несмотря на значительные достижения молекулярной биологии и генетики последнего десятилетия в диагностике, лечении и профилактике рака молочной железы тема остается актуальной. Железистый компонент молочной железы является гормонозависимой мишенью по отношению к яичниковым гормонам, особенно эстрогенам и его метаболитам [3,11].
В настоящее время в отечественной литературе уделяется мало внимания роли метаболитов эстрогенов в генезе гормонозависимых опухолей репродуктивных органов у женщин. Более того, практически отсутствуют исследования, касающиеся попыток их коррекции. Вместе с тем, современная фармакологическая индустрия выделила ряд соединений, активно участвующих в регуляции эстрогенных метаболитов [2,3,15]. Одним из таких препаратов, корректирующий соотношение 2 -ОНЕ1 к 16α-ОНЕ1 является индинол - фитонутриент, содержащийся в овощах семейства крестоцветных, обладающий противоопухолевой активностью. В биохимических исследованиях установлено, что Индинол препятствует образованию 16 α-гидроксистерона, блокирует проведение сигналов в опухолевые клетки, которые побуждают ее к активному делению, и обладает свойством индуцировать в опухолевых клетках процессы апоптоза [3,15].
Для нас было важным на основе современных методологий, на одном клиническом материале обозначить роль метаболического синдрома и убедиться в реальной значимости влияния Индинола на уровень экспрессии метаболитов эстрогенов, что позволит существенно расширить представление о подходах к предупреждению и лечению опухолей молочной железы.
Цель исследования: Изучить роль метаболического синдрома у больных раком молочной железы, оценить изменение экспрессии метаболитов эстрогенов (16α-ОН и 2-ОН) и возможности их коррекции.
Материалы и методы
В основу работы легли результаты наблюдений за 86 больными РМЖ I–IV стадий и 50 пациентками с фиброзно-кистозной мастопатией, находящихся на лечении в ФГУ РНЦРР в период с 2006 по 2009 г. Средний возраст больных РМЖ составил 47,3±4,1 года, в контрольной группе этот показатель был равен 49,6±2,5 года. Распределение по стадиям пациенток со злокачественными новообразованиями молочной железы было следующим: I стадия РМЖ диагностирована у 31 (36,04%), II – у 40 (46,5%), III – у 15(17,4%) больных. В план лечения входили различные варианты хирургических вмешательств: секторальная резекция молочной железы; радикальная резекция молочной железы с регионарной лимфаденэктомией (ЛАЭ); радикальная резекция молочной железы с регионарной ЛАЭ и одномоментной пластикой торакодорзальным лоскутом и фрагментом большой грудной мышцы; мастэктомия по Маддену; подкожная мастэктомия (одно- или двусторонняя) с одномоментным аломаммопротезированием. Гистологическое и иммуногистохимическое исследования биопсийного и операционного материалов проводили в отделении патоморфологии ФГУ РНЦРР.
Молекулярно-генетическое исследование проводилось с использованием метода полимеразной цепной реакции (ПЦР). Основные этапы исследования включили в себя: подготовку материала и выделение из него ДНК, аплификацию и детекцию продуктов ПЦР.
Для количественного определения соотношения метаболитов эстрогенов в моче (2 гидроксиэстрон/16α-гидроксиэстрон) в настоящей работе использован иммуноферментный набор ESTRAMET 2/16 ELISA.
Использовалась утренняя моча 40 мг с добавлением 50 мг аскорбиновой кислоты (лучше всего для хранения образца), затем образец мочи подписывался и помещался в заморозку при -20°С и ниже. Образцы в таком состоянии могут храниться в замороженном состоянии несколько месяцев без потери метаболитов.
Принцип методики: тест ESTRAMET 2/16α ELISA основан на конкурентном методе твердофазного иммуноферментного анализа (рис.1).
С помощью набора ESTRAMET 2/16 определялась индивидуальная концентрация 2-гидроксиэстрона (2ОНЕ1) и 16α-гидроксиэстрон (16αОНЕ1) в моче. В методе используются антитела, связанные с твердой фазой (лунки микропланшета) и антиген (метаболит эстрогена), конъюгированный с ферментом. Во время инкубации связывание конъюгированного с ферментом антигена с иммабилизованными в лунках микропланшета антителами ингибируется добавленными в лунки свободным антигеном, присутствующим в стандартных образцах. Так как число сайтов связанных с антителами, иммобилизованными в лунке, ограничено, то активность фермента, связавшегося с твердой фазой (в лунке) снижается в присутствии свободного антигена. После промывки лунок добавляется субстрат, в результате его взаимодействия с ферментом появляется цветное окрашивание (рис 2).

Рис. 1. Метод твердофазного иммуноферментного анализа
Рис. 2. Цветное окрашивание лунок при взаимодействии субстрата с ферментом
Интенсивность окрашивания обратно пропорциональна концентрации свободного антигена. Моноклональные антитела к метаболитам эстрогена иммобилизованы непосредственно в лунках микропланшета. Метаболиты эстрогена конъюгированы со щелочной фосфатазой.
2ОНЕ1 и 16α-ОНЕ1 в моче обнаруживаются в форме 3-глюкуронида и 3- или 3,16α–глюкуронидов, соответственно. Для глюкуронидов требуется удаление сахаров перед тестированием, для распознавания моноклональными антителами. Для высвобождения эстрогенов от глюкуроновой кислоты и от сульфата используют смесь β-глюкуронидазы и арилсульфатазы, выделенных из улитки Helix pomatia. В ходе анализа при подготовке образцов, аликвоту мочи разводят в соотношении 1:20 буфером, содержащим ферменты и инкубируют до полного расщепления. Затем смесь ферментов нейтрализуется, и полученный раствор используется непосредственно для анализа.
Результаты и обсуждение. В нашей работе мы оценили индекс массы тела больных раком молочной железы в сравнении с контрольной группой. Как видно из табл. 1 в группе больных раком молочной железы всего у 14 пациенток (16,3%) нормальный индекс массы тела, у 44 больных (51,2%) он повышенный и у 28 (32,5%) индекс массы тела превышает 30 кг/м 2 . При этом в контрольной группе повышенный индекс массы отмечен лишь у 10 женщин, что составило 20,0% и только в 24,0% наблюдений индекс массы тела превышал 30 кг/м 2 . Из 50 женщин контрольной группы у 28 (56,0%) индекс массы тела был в пределах нормы.
Таблица 1. Индекс массы тела у больных раком молочной железы и контрольной группы (абс/%).
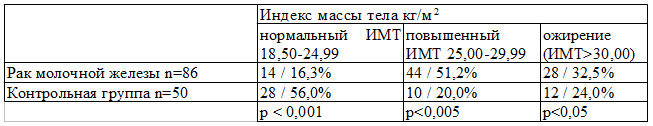
Таким образом, ожирение, являясь патогенетическим субстратом продукции эстрона в постменопаузе, становится как бы маркером гиперэстрогении. Кроме того, жировая ткань является источником ряда значимых с онкологической точки зрения цитокинов: фактора некроза опухолей-α (ФНО-α) и интерлейкина 6. Многие исследователи рассматривают ФНО-α как медиатор инсулинорезистентности. Количество интерлейкина-6, продукция которого сосредоточена в абдоминальной жировой ткани, значительно увеличивается с развитием ожирения.
Следующим этапом наших исследований стало изучение уровня продукции 2 – гидроксиэстрона, 16а-гидроксиэстрона и их соотношений.
Как видно из приведенных данных, средний уровень метаболита 2-ОН в группе больных раком молочной железы (7,80 нг/мл) в 3,2 раза ниже, чем в контрольной группе (25,08 нг/мл). В то же время, средний уровень метаболита 16α-ОН оказался выше, чем в контрольной группе (18,63 нг/мл и 12,00 нг/мл соответственно) в 1,6 раза. Соотношение метаболитов в группах также демонстрировало существенные, статистически достоверные (Р 2 ) в группе контроля
Особое значение в рамках настоящего исследования имеет анализ данных об уровнях метаболитов при различных вариантах рака молочной железы (гормонозависимый и гормононезависимый варианты). В нашем исследовании у 42 больных имелся гормонозависимый и у 44 – гормононезависимый рак молочной железы. Следует заранее оговорить, что определение варианта рака молочной железы выполнялось с помощью иммуногистохимического исследования.
Таблица 3. Средний уровень и соотношение метаболитов эстрогенов 2-ОН/16α-ОН в зависимости от варианта рака молочной железы
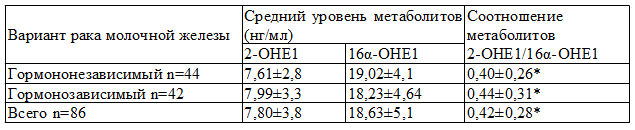
Примечание: *- статистически достоверные отличия между группами, р 2 ) коэффициент соответствует 2,24, при ИМТ>30 кг/м 2 он снижается до 1,99.
5. При всех вариантах рака молочной железы проявляется эффект корректирующего действия Индинола наиболее выраженный по истечении 6 месяцев приема.
Список использованных источников:
1. Ашрафян Л.А., Киселев В.И. Опухоли репродуктивных органов (этиология и патогенез). - М., 2007; с. 103–27.
2. Ашрафян Л.А., Киселев В.И., Муйжнек Е.Л. Патогенетическая профилактика рака репродуктивных органов. - М., 2009; с. 123–30.
3. Боженко В.К. Молекулярные маркеры рака молочной железы// Клин маммология. 2005;1:51–7.
4. Давыдов М.И., Аксель Е.М. Злокачественные новообразования в России и странах СНГ в 2008г. – М., 2010.
6. Карпухин А.В., Поспехова Н.И.,Любченко Л.Н. и др. Частоты олигонуклеотидных полиморфизмов и мутаций в гене BRCA1 при наследственно обусловленном раке молочной железы и/или яичников// ДАН 2002;383(5).
7. Любченко Л.Н. Генодиагностика наследственной предрасположенности к раку молочной железы и разработка системы индивидуального прогнозирования развития, течения и профилактики заболевания: Автореф. дис. . канд. мед. наук. - М., 2002.
8. Моисеенко В.М. “Естественная история” роста рака молочной железы// Практикующая онкология 2002;3(1):6–14.
9. Рожкова Н.И. Современные системы и методы обследования молочной железы// Клин. маммол 2005;(1):66–97.
10. Трапезников Н.Н., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ. - М.:РОНЦ им. Н.Н. Блохина РАМН, 2001.
11. Auborn K.J., Fan S., Rosen E.M. et a. Indole-3-carbinol is a negative regulator of estrogen// J Nutr, 2003, 133, 2470S-2475S.
12. Klijn J.G.M. et al.// Breast Cancer Res Treat 1998; 50(3). Special issue p. 227 (abstr4). 21st Annual San Antonio Breast Cancer Symposium.
13. Seal S., Barfoot R., Jayatilake H. et al. Evaluation of Fanconi Anemia in familial breast cancer// BCLC Familial cancer 2003;2:212–3.
14. Szabo C., Neuhausen S., Devilee P.et al. BRCA1 founder mutations: population genetics and genome evolution// BCLC Familial Cancer 2003;2:177–8.
15. Wormke M., Castro-Rivera E., Chen I., Safe S. Estrogen and aryl hydrocarbon receptor expression and crosstalk in human Ishikawa endometrial cancer cells// J Steroid Biochem Mol Biol, 2000, 72(5), 197-207.

Гормонотерапия при раке молочной железы сегодня проводится теми же препаратами, что и 20 лет назад, не изменились и основополагающие принципы её назначения, существенное отличие современного подхода в более точном подборе лекарственного средства с ориентировкой на биологические характеристики опухоли и индивидуальные эндокринные показатели пациентки.
- Что такое гормонотерапия?
- Показания для назначения
- Особенности гормонотерапии при раке молочной железы
- Виды гормональной терапии
- Препараты
- Побочные действия
- Диета при гормонотерапии
- Эффективность
- Прогноз при применении гормонотерапии
Что такое гормонотерапия?
Конечная цель гормонотерапии — не допустить поступления половых гормонов в раковую клетку молочной железы, чем нарушается синтез необходимых для её жизни веществ и вынужденно включается программа клеточной гибели — апоптоз.
В качестве гормональных (эндокринных) лекарственных средств при раке молочной железы используют:
- натуральные гормоны и их синтетические аналоги — эстрогены, андрогены и прогестины;
- блокирующие связывание естественного гормона с рецептором опухолевой клетки антигормоны — антиэстрогены;
- нарушающие локальный синтез гормонов в жировой ткани ингибиторы ароматазы;
- гонадотропин-релизинг-гормон — химическое вещество, подменяющее естественный гормон гипоталамуса, который блокирует синтез яичниками собственных половых гормонов.
Аналогично гонадотропин-релизинг-гормону действуют хирургическое удаление придатков или облучение яичников, без них невозможно лечение менструирующих женщин ингибиторами ароматазы.
Показания для назначения
Рак молочной железы возникает на фоне гормонального дисбаланса, но не все опухоли чувствительны к гормональному воздействию, некоторые популяции клеток не используют половые гормоны для своей жизнедеятельности — они гормонально независимы. Как правило, независимой считается опухоль, в которой не больше 1% клеток нуждается в эстрогенах.
Наиболее благоприятно для назначения гормонотерапии при раке молочной железы сочетание максимально высокого уровня ЭР+ с ПР+. Формально гормонотерапия показана всем пациенткам, в опухоли молочной железы которых имеется более 1% клеток ЭР+ без учёта концентрации ПР+.
Особенности гормонотерапии при раке молочной железы
Гормональная зависимость рака молочной железы обещает чувствительность к гормонотерапии, но не гарантирует её.
Во-первых, не все ЭР способны взаимодействовать с лекарственным препаратом, нацеленным на него антиэстрогеном. Результат лечения прогнозирую по объёму популяции чувствительных клеток, считается, что чем больше в раке ЭР+, тем эффективнее будет эндокринная терапия.
Во-вторых, некоторые опухоли формируют устойчивость к лекарству, ускоренно разрушая его в своей цитоплазме или выводя из клетки в межклеточную жидкость. Формирование устойчивости легло в основу поэтапной гормонотерапии, когда при утрате опухолью чувствительности к одному препарату переходят на другую группу лекарственных средств. Особенность рака молочной железы — возможность перехода с одной линии гормонотерапии на другую при снижении клинической эффективности воздействия.
В-третьих, ради собственного выживания на фоне гормонотерапии опухоль постепенно становится нечувствительной к препарату, происходит естественный отбор — реагирующие на гормональные лекарства клетки погибают, выживают и дают потомство нечувствительные. Отчасти на этой особенности рака молочной железы базируется отказ от одновременного использования химиотерапии и гормонотерапии — только последовательно.
И третья особенность — при подборе лекарственного препарата обязательно учитывается гормональный период, в котором пребывает женщина, при недавнем прекращении менструации определяется концентрация производимых гипофизом лютеинезирующего (ЛГ) и фолликулостимулирующего (ФСГ) гормонов, стимулирующих работу яичников.
Виды гормональной терапии
В зависимости от цели гормонотерапию подразделяют на неоадъювантную, адъювантную и лечебную.
Неоадъювантная ГТ проводится до радикальной операции для уменьшения объема опухолевого узла и уничтожения микрометастазов, попутно выясняется клиническая чувствительность опухоли к конкретному лекарственному препарату и перспективность профилактической антигормональной терапии после операции. Этот вид ГТ назначается при люминальном молекулярно-биологическом подтипе рака молочной железы с ЭР+ и ПР+. Эффект при гормонотерапии отсроченный, в отличии от химиотерапии, поэтому неоадъювантное лечение проводится не менее 4 месяцев, при хорошем результате — 8 месяцев и дольше, соответственно, на такой же срок откладывается операция на молочной железе. Поскольку наименее токсичными считаются ингибиторы ароматазы, их и используют, но они разрешены только для переживших менопаузу женщин.

Адъювантная гормонотерапия назначается для профилактики рецидива и метастазирования, она проводится всем больным с ЭР+, в том числе при карциноме in situ, только цель при 0 стадии иная — предотвращение развития рака в другой молочной железе. Продолжительность терапии — до прогрессирования или 5-10 лет в зависимости от исходного прогноза, а начинают ГТ строго после завершения адъювантной химиотерапии. Выбор препарата зависит от менструального статуса женщины.
Лечебная ГТ применяется при неоперабельном раке молочной железы или метастазах после радикального лечения. Длительность эндокринного воздействия зависит от эффективности, при прогрессировании переходят на следующий по очереди лекарственный препарат, выбор которого определяется по гормональному статусу женщины.
Препараты
Гормональная терапия рака молочной железы проводится антиэстрогенами и ингибиторами ароматазы, применение эстрогенов, прогестинов и андрогенов ограничено высокой частотой осложнений. Каждый препарат в лечебных целях принимают до прогрессирования заболевания, в профилактически — до появления метастазов или не менее 5 лет.
Антиэстрогены представлены двумя препаратами:
- ежедневно принимаемые при всех видах ГТ и в любом гормональном периоде таблетки тамоксифена;
- фулвестрант (Фазлодекс™) используется при распространенном раке молочной железы, ранее прогрессировавшем на тамоксифене, и только после менопаузы, он вводится в мышцу раз в месяц, главный недостаток — стоимость инъекции около 500$.
Ингибиторы ароматазы в таблетках для ежедневного приема применяются при любом виде ГТ у женщин после менопаузы, все лекарства одинаково эффективны:
- анастрозол (Аримидекс™);
- летрозол (Фемара™);
- эксеместан (Аромазин™).
Никогда одновременно не используются лекарственные средства разных групп — только по-отдельности. Некоторые схемы адъювантной ГТ предполагают смену лекарства через определенный срок, например, молодая женщина 5 лет пьет тамоксифен, при прекращении менструальной функции ещё 2 года получает ингибиторы ароматазы. При лечении неоперабельного рака или метастазов смена группы происходит при возобновлении опухолевого роста или появлении выраженных побочных осложнений.
Для временного выключения функции яичников у менструирующих женщин применяются аналоги гонадотропин-рилизинг-гормона (ГРГ), при раке молочной железы Стандарты рекомендуют каждые 28 дней инъекцию одного из одинаково эффективных средств:
- гозерелин (Золадекс™);
- трипторелин (Диферелин™);
- бусерелин (Бусерелин-депо™);
- лейпрорелин (Люкрин-депо™)
Группа ГРГ вспомогательная, используется вместе с ингибиторами ароматазы или антиэстрогенами. Прием таблеток начинают после полутора-двух месяцев инъекций антагонистов гонадотропинов. ГРГ конкуренты удаления или облучения яичников, после прекращения инъекций менструация у молодых женщин восстанавливается в ближайшие 3 месяца.
Побочные действия
Антиэстрогены и ингибиторы ароматазы обладают схожими побочными реакциями, самые опасные из которых: образование тромбов и дисгормональный остеопороз. Тамоксифен активнее влияет на свертываемость крови, и при многолетнем использовании у небольшого процента женщин индуцирует рак эндометрия. Ингибиторы ароматазы чаще осложняются остеопорозом. Одинаково часто обе группы вызывают приливы.
Все гормональные препараты подвергаются трансформации в печени. Тамоксифен может вызвать токсическое поражение печени и привести к застою желчи — холестазу, клиника которого отчасти напоминает острый холецистит, все симптомы исчезают после отмены антиэстрогена.
В настоящее время нет однозначного мнения по выбору лекарственного средства — эффективность их одинаковая, поэтому ориентируются на гормональный возраст и сопутствующую патологию, к примеру, при варикозной болезни или патологии эндометрия целесообразно избегать тамоксифена, при остеопорозе — ингибиторов.
В подавляющем большинстве случаев ГТ хорошо переносится, что позволяет при неблагоприятных прогностических факторах пролонгировать её до 7-10 лет.
На фоне приёма тамоксифена:
Использование препарата группы ГРГ часто сопровождается посткастрационным синдромом с приливами, частыми кольпитами, недержанием мочи, болями в мочевом пузыре и т.д. У женщин в пременопаузе при совместном применении ГРГ с ингибитором ароматазы возможно повышение уровня эстрадиола, что исключает эффект от лечения.
Диета при гормонотерапии
Многие женщины считают, что на фоне гормональных препаратов растет вес тела, клинические исследования на счет ГТ относят всего лишь 1,6% — 4% случаев повышения веса. Избыток веса обусловливается не фармакологическим действием, а изменением ритма жизни после выявления рака молочной железы, нормализацией питания после завершения химиотерапии и снижением уровня стресса после проведения радикальной терапии. На профилактической ГТ женщина успокаивается и бережет себя, избегая физических нагрузок, и вес растет даже без лекарств.
Гормонотерапия не нуждается в особой диете, необходима коррекция питания с учетом ежедневных нагрузок и сопутствующих болезней.
Эффективность
Результат терапии зависит от чувствительности опухолевых клеток к лекарствам, поэтому в обязательном порядке до начала лечения определяется молекулярно-биологический подтип рака молочной железы.
Эффект адъювантной терапии оценивается по времени появления метастазов — на фоне ГТ или в течение года после её завершения. В отсутствии клинически определяемой опухоли косвенно об эффективности свидетельствует уровень эстрадиола в крови.
Результат гормонального воздействия более медленный, нежели химиотерапии, поэтому оценка эффективности при распространенном раке молочной железы проводится каждые 3-4 месяца приема. Общий эффект ГТ — от 15% до 36%, и тем выше, чем больше концентрация ЭР и ПР.
Прогноз при применении гормонотерапии
Распространенность рака молочной железы на момент выявления косвенно свидетельствует об агрессивности и гормональной независимости опухоли. ГТ мало полезна при метастатической стадии, сопровождающейся висцеральным кризом — при множественных злокачественных новообразованиях внутренних органов с нарушением их функции.
При распространенном процессе с высоким уровнем ЭР и ПР на фоне ГТ регрессируют множественные метастазы, особенно в костях, коже и лимфоузлах, даря женщине годы качественной жизни. Эндокринное воздействие бесполезно при прогрессировании рака молочной железы на фоне трех линий ГТ.
Лечение рака должно быть своевременным и адекватным, в нашей Клинике проводится геномный анализ опухоли на чувствительность к лекарствам, что повышает непосредственные результаты терапии и сказывается на продолжительности жизни больных.
Читайте также:

