Рак это болезнь старения
У 90% людей с выявленными злокачественными опухолями проблемы возникают в возрасте 45 лет и старше. Рак – это болезнь старения: для накопления раковых клеток и начала заболевания нужно время, поэтому в подавляющем большинстве случаев онкология бывает во второй половине жизни человека. Рак у детей – это наследственно обусловленная патология, связанная с врожденными дефектами в генах.
Опухоль возникает тогда, когда ослабевает противоопухолевая защита
Болезнь старения – когда возникает рак
По статистике злокачественные опухоли в большинстве случаев обнаруживаются у людей, переваливших рубеж в 40 лет. Вне зависимости от возраста в клеточных структурах организма человека постоянно появляются раковые клетки, но это вовсе не означает, что будет опасное заболевание: противоопухолевая защита срабатывает, обеспечивая удаление клеточных структур с мутациями. Для возникновения злокачественного новообразования необходимо накопление не менее 5-6 мутантных трансформаций в одном клеточном клоне, что требует достаточно большого количества времени и снижения противоракового иммунитета: болезнь старения запрограммирована природой – чем старше человек, тем больше проблем со здоровьем и иммунной защитой. И не забываем о времени: с годами у раковых изменений есть шанс накопить нужное количество клеточных мутаций.
Основные механизмы накопления раковых клеток
Рак неумолим – как бы мы не хотели, чтобы болезнь старения миновала каждого из нас, но вероятность онкологии достаточно велика:
- у мужчин на протяжении жизни опухоль может возникнуть в 40% случаев;
- у женщин – в 50%.
К основным причинам формирования раковых трансформаций относятся:
- Генетически запрограммированный феномен накопления раковых мутаций в клетках органов;
- Снижение противоопухолевой защиты с возрастом;
- Накопление хронических болезней, снижающих иммунитет.
Чем дольше живет человек, тем больше шансов, что у него будет рак. Во всем мире в последние десятилетия идет увеличение продолжительности жизни: кривая роста онкологических болезней неуклонно растет, сопровождая увеличивающуюся длительность жизни. И пока медицинская наука ничего с этим сделать не может: рак, как болезнь старения, ограничивает возможности прогресса по долгожительству.
Исключения из правил: рак у молодых
Людей, переваливших 100-летний рубеж, сравнительно мало. Болезнь старения возникает далеко не у всех – часто бывает, что человек умирает от старости, а не от заболевания. Худший вариант, когда рак обнаруживается у молодых людей. Или, что еще хуже, у детей. Это исключение из правил – онкология в возрасте от 0 до 40 лет является врожденной и наследственно обусловленной патологией: в органах уже имеются онкогенные мутации, и путь к раку становится значительно короче (достаточно накопить 2-3 мутации, и – начинается рост злокачественной опухоли). Кроме этого, рак у молодых людей возникает на фоне следующих факторов:
- выраженный иммунодефицит (СПИД, нарушения питания);
- действие канцерогенов;
- вредные привычки;
- радиоактивное облучение.
Типичный возраст появления опухоли – 45-60 лет. Именно в это время надо регулярно посещать врача и проводить обследование для выявления ранних форм опухолей. И не нужно забывать о профилактике (здоровый образ жизни, отказ от вредных привычек, поддержание противоопухолевого иммунитета).
В августе 1997 г. умер самый старый человек в мире - француженка Жанн Кальман. Ей было 122 года и 150 дней. Столетнюю ее каждый день видели на улицах городка, разъезжающей на велосипеде. На вопрос о секрете своего долголетия она с усмешкой отвечала, что о ней просто забыл Бог. Надо сказать, что определенной диеты она не соблюдала.
Чемпионкой по возрасту в Беларуси является жительница г. Минска Екатерина Клочкова. Ей 108 лет. Секрета долголетия не знает. Всю свою трудную жизнь она много работала. Не болела. Водку никогда не пила. В еде не привередлива. Любит мясо и свежую рыбу.
Вдохновляющих примеров долголетия женщин и мужчин, живущих в разных странах мира, немало. Ученые не оставляют эти случаи без внимания.
Как правило, родители долгожителей и их ближайшие родственники умирали в преклонном возрасте. Весь путь жизни, начиная от ее зарождения до эпилога - смерти, записан в наших генах. Продолжительность жизни - тоже. Старость и смерть запрограммированы. Но в силах человека процесс старения затормозить, а значит, отодвинуть наступление ранней старости, вызываемой неблагоприятными условиями внешней среды, вредными привычками, несбалансированным питанием. Так элитное зерно, посаженное в удобренную почву, при хорошем уходе даёт полноценный колос. И из такого же зернышка на бедной земле вырастает хилое и больное растение. Наша задача -сберечь заложенное природой.
Старение и рак связаны прочными узами. Любопытно, что даже в тех случаях, когда злокачественная опухоль развивается в молодом возрасте, в организме закономерно определяются некоторые признаки интенсивного старения (Ю. Я. Грицман, 1988). Онколог профессор В. М. Дильман (1986) установил совпадение особенностей обмена веществ, свойственных старению, с изменениями, вызываемыми в организме химическими канцерогенами: нарушение усвоения глюкозы тканями, как это бывает при сахарном диабете; использование в качестве источника энергии жирных кислот; избыток в крови холестерина; преобладание эффекта контринсулярных гормонов на фоне высокого содержания инсулина в крови. Эти сдвиги вносят разлад в состояние иммунной системы организма, увеличивают риск онкологических заболеваний.
Старение считается важнейшим фактором канцерогенеза. Действительно, с возрастом частота заболевания раком стремительно нарастает: по сравнению с юными сорокалетние болеют раком в 11 раз чаще, 50-летние - в 47 раз. 60-летние - в 120 раз, старики - в 215 раз (Н. Н. Александров, 1977). Женский организм развивается раньше, но старость и смерть приходят позже. И заболеваемость злокачественными опухолями отражает эту закономерность: если молодые женщины болеют чаще мужчин, то в 40- 49 лет - реже и после 60 лет их заболеваемость составляет 1/2 часть от таковой у мужчин.
В странах с высоким уровнем жизни число онкологических больных выше, чем в экономически бедных, поскольку продолжительность жизни людей в последних меньше.
Изучение случаев профессионального рака и исследования на животных позволили сделать вывод, что скрытый период развития рака, т.е. продолжительность предопухолевых изменений, составляет 1/4-1/3. часть жизни организма. Впервые это было установлено при обследовании рабочих анилинокрасоч-ных производств в Германии, когда у проработавших 15-20 лет стали регистрироваться случаи редкого для того времени заболевания - рака мочевого пузыря. Известно также, что перерождение доброкачественных полипов толстой кишки в рак наступает через 20-30 лет от момента появления первых полипов (Н. Н. Александров, 1977).
Да, чем мы старше, тем больше вероятность заболеть раком. Но, во-первых, мы можем преградить дорогу ранней старости и тем самым отодвинуть границу онкологического риска; во-вторых, в некоторых случаях именно особенности обмена увядающего организма препятствуют развитию рака. К примеру, статистиска свидетельствует, что частота заболеваемости раком молочной железы у женщин пожилого возраста по сравнению с молодыми не только не увеличивается, но даже уменьшается (Н. Н. Александров, 1977). Это объясняется тем, что после 40-45 лет постепенно снижается выработка половых гормонов, избыток которых у молодой женщины и является основной причиной возникновения рака этой локализации. Следовательно, устранение основной причины заболевания несмотря на возраст, может предотвратить развитие опухоли.
С возрастом повышается риск многих заболеваний, и рак — не исключение. Для того чтобы это понять, достаточно посмотреть на график, который составили американские ученые. Он показывает, как меняется заболеваемость и смертность от онкологических заболеваний в разных возрастных группах. Эти данные получены в конце прошлого века, но они актуальны и по сей день:
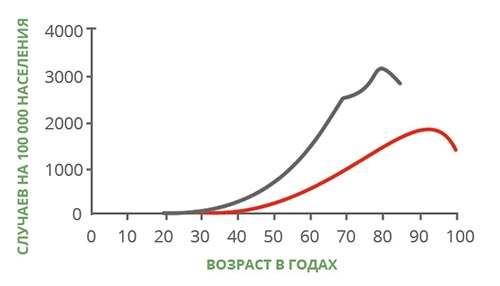
- Главная причина — накопление мутаций
- Превратности эволюции человека
- Развивается ли рак у пожилых людей более медленно?
- Никогда не поздно заняться профилактикой
- Никогда не поздно лечиться
Главная причина — накопление мутаций
Например, не так давно ученые из Кембриджского Университета в Соединенном Королевстве решили проверить слизистую оболочку пищевода у людей в возрасте 20–75 лет. Оказалось, что у лиц 20 лет на одну клетку приходится примерно по 100 мутаций, а в более старшем возрасте — более 2000. Некоторые из них потенциально способны привести к раку. И это только пищевод!
Подробнее о данном исследовании читайте в нашей статье "Мутации, которые способны привести к раку«.
В 2016 году в научном журнале Nature была опубликована статья, в которой ученые рассказали, что бремя соматических (не связанных с половыми клетками) мутаций у каждого человека удваивается примерно каждые 8 лет. Аналогичными темпами растет и смертность от разных причин, в том числе от онкологических заболеваний.
Накопление ошибок в генах с возрастом — одна из основных причин, почему врачам, вероятно, никогда не удастся победить рак окончательно. Проблема борьбы с онкологическими заболеваниями теснейшим образом переплетена с проблемой старения.
Превратности эволюции человека
Ответ нужно искать в теории эволюции и особенностях жизни наших первобытных предков. В каменном веке редко кто доживал до тридцатилетнего возраста. Всю свою жизнь человек тратил на то, чтобы вырасти, окрепнуть, набраться опыта. Можно сказать, рождение детей и уход за ними в первые годы был апогеем, главным смыслом жизни. Вскоре после этого многие люди погибали от инфекций, природных катастроф и зубов хищников.

Для выживания популяции было нужно, чтобы люди доживали до того момента, когда они могли оставить потомство. Все это время защитные механизмы в организме работают на пике эффективности. Этому способствовал естественный отбор.
Возможно, все это звучит жестоко. Но в противовес этой жестокости законов биологии человечество создало гуманную высокоразвитую медицину. Благодаря усилиям врачей продолжительность жизни современных людей растет, появляются все новые возможности для борьбы с раком и другими серьезными заболеваниями.
Ниже представлены средние возраста, в которых диагностируются разные типы злокачественных опухолей:
- Рак молочной железы - 62
- Рак легкого - 70
- Рак предстательной железы - 66
- Колоректальный рак - 68
- Рак мочевого пузыря - 73
- Меланома - 63
- Неходжкинская лимфома - 63
- Рак щитовидной железы - 51
- Рак почки - 64
- Лейкемия - 66
- Все типы рака - 65
Развивается ли рак у пожилых людей более медленно?
Когда-то бытовало мнение о том, что в старшем возрасте злокачественные опухоли растут медленнее и в целом ведут себя менее агрессивно. Это верно, но лишь отчасти. Да, действительно, есть данные о том, что рак молочной железы и простаты у пожилых имеют тенденцию расти медленнее.
Пожилым мужчинам, страдающим злокачественными опухолями предстательной железы, даже не всегда назначают лечение. Но врачи принимают такое решение отнюдь не из-за того, что такой рак не опасен. Просто в таких случаях человек настолько стар, что, вероятно, он не доживет до того момента, когда рак успеет сильно распространиться в организме и стать смертельно опасным. В каждой ситуации это нужно оценивать индивидуально.
Другие опухоли в пожилом возрасте, такие как рак прямой кишки, мочевого пузыря, поджелудочной железы, ведут себя очень агрессивно, и их даже сложнее лечить, чем у более молодых пациентов. Из-за слабого здоровья людям старшего возраста зачастую противопоказаны хирургические вмешательства, химиотерапия.

Никогда не поздно заняться профилактикой
Возраст — лишь один из факторов риска рака. Многие другие связаны с образом жизни, и на них вполне можно повлиять:
- Откажитесь от курения.
- Перейдите на здоровое питание.
- Оставайтесь физически активны.
- Поддерживайте здоровый вес.
- По максимуму ограничьте алкоголь.
- Используйте защитные средства, когда работаете с химикатами.
- Защищайтесь от солнечных лучей, не лежите подолгу на пляже и избегайте солярия.
- Своевременно начинайте лечение любых заболеваний.
Конечно, лучше вести здоровый образ жизни смолоду. Но никогда не поздно начать. Вы в любом случае получите пользу для здоровья.
Защититься от рака на 100% невозможно, поэтому людям старшего возраста особенно важно регулярно проверяться — проходить скрининг. Всем женщинам после 40 лет рекомендуется периодически выполнять маммографию, всем людям после 50 лет — колоноскопию. Найти патологические образования на коже поможет дерматоскопия. Заядлым курильщикам с большим стажем нужно проконсультироваться с врачом: возможно, стоит пройти компьютерную томографию. При повышенном риске рака желудка нужно провериться с помощью гастроскопии.
Посетите врача в Европейской клинике, и он порекомендует скрининговую программу, подходящую в вашем случае.
Никогда не поздно лечиться
Еще лет 20 назад мало какая клиника в мире взялась бы за активное лечение рака у 90-летнего человека. Это большие риски и ответственность. Многие клиники не берутся и сейчас. Но постепенно ситуация меняется. Появляются новые препараты, подходы. Они помогают лечить злокачественные опухоли более эффективно, снижаются риски, пациенты переносят операции и химиотерапию более комфортно.

Мы считаем, что помочь можно всегда. Врачи в Европейской клиники берутся за лечение рака у людей любого возраста, с любой стадией заболевания.
Мы знаем, как продлить жизнь пациента в сложных случаях, избавить от мучительных симптомов, справиться с побочными эффектами химиопрепаратов. Иногда после активной поддерживающей терапии становится возможным проведение курса химиотерапии, хирургического вмешательства.
Никогда не стоит сдаваться. Приезжайте и получите консультацию у наших специалистов.
Старение – плата за подавление раковых опухолей?
Уже более 50 лет прошло с тех пор, как на культуре фибробластов доказан феномен старения клеток, но существование старых клеток в организме долгое время подвергалось сомнению. Не было доказательств, что старение отдельных клеток играет важную роль в старении всего организма. В последние годы были открыты молекулярные механизмы старения клеток, их связь с онкологическими заболеваниями и воспалением. По современным представлениям, воспаление играет ведущую роль в генезе практически всех возраст-зависимых заболеваний, которые в конечном итоге приводят организм к смертельному исходу. Оказалось, что старые клетки, с одной стороны, выступают в качестве супрессоров опухолей (поскольку необратимо перестают делиться сами и снижают риск трансформации окружающих клеток), а с другой – специфический метаболизм старых клеток может вызывать воспаление и перерождение соседних предраковых клеток в злокачественные. В настоящее время проходят клинические испытания лекарственных препаратов, избирательно элиминирующих старые клетки в органах и тканях, тем самым предотвращая дегенеративные изменения органов и рак.
Деление клетки. Клеточный цикл.

В организме человека присутствует примерно 300 типов клеток, и все они делятся на две большие группы: одни могут делиться и размножаться (то есть, они митотически компетентны), а другие – постмитотические – не делятся: это достигшие крайней стадии дифференцировки нейроны, кардиомиоциты, зернистые лейкоциты и другие.
В нашем организме существуют обновляющиеся ткани, в которых есть пул постоянно делящихся клеток, которые заменяют отработанные или погибающие клетки. Такие клетки есть в криптах кишечника, в базальном слое эпителия кожи, в костном мозге (кроветворные клетки). Обновление клеток может происходить довольно интенсивно: так, клетки соединительной ткани в поджелудочной железе заменяются каждые 24 часа, клетки слизистой желудка – каждые три дня, лейкоциты – каждые 10 дней, клетки кожи – каждые шесть недель, примерно 70 г пролиферирующих клеток тонкого кишечника удаляется из организма ежедневно [1].
Стволовые клетки, существующие практически во всех органах и тканях, способны делиться неограниченно. Регенерация тканей происходит за счет пролиферации стволовых клеток, которые могут не только делиться, но и дифференцироваться в клетки той ткани, регенерация которой происходит.
Стволовые клетки есть в миокарде, в головном мозге (в гипокампе и в обонятельных луковицах) и в других тканях. Это открывает большие надежды в плане лечения нейродегенеративных заболеваний и инфаркта миокарда [2–4].
Постоянно обновляющиеся ткани способствуют увеличению продолжительности жизни. При делении клеток происходит омоложение тканей: новые клетки приходят на место поврежденных, при этом интенсивнее происходит репарация (устранение повреждений ДНК) и возможна регенерация при повреждении тканей. Не удивительно, что у позвоночных значительно выше продолжительность жизни, чем у беспозвоночных – тех же насекомых, у которых во взрослом состоянии клетки не делятся.
Но в то же время обновляющиеся ткани подвержены гиперпролиферации, что ведет к образованию опухолей, в том числе – злокачественных. Это происходит из-за нарушений регуляции деления клеток и повышенной частоты мутагенеза в активно делящихся клетках. По современным представлениям, чтобы клетка приобрела свойство злокачественности, ей необходимо 4–6 мутаций*.
Мутации возникают редко, и для того, чтобы клетка стала раковой – это подсчитано для фибробластов человека – должно произойти около 100 делений (такое число делений обычно происходит у человека примерно в возрасте 40 лет) [5].
В целях защиты от самого себя, в организме сформировались специальные клеточные механизмы супрессии опухолей. Один из них – репликативное старение клеток (сенесценция), заключающееся в необратимой остановке деления клетки в стадии G1 клеточного цикла. При старении клетка перестает делиться: она не реагирует на ростовые факторы и становится устойчивой к апоптозу.
Феномен старения клеток был впервые открыт в 1961 г. Леонардом Хейфликом с коллегами на культуре фибробластов. Оказалось, что клетки в культуре фибробластов человека при хороших условиях живут ограниченное время и способны удваиваться примерно 50±10 раз, – и это число стали называть лимитом Хейфлика [6, 7]. До открытия Хейфлика господствовала точка зрения, что клетки бессмертны, а старение и смерть – это свойство организма в целом.
Эта концепция считалась неопровержимой во многом благодаря экспериментам Карреля, который поддерживал культуру клеток сердца цыпленка 34 года (ее выбросили лишь после его смерти). Однако, как выяснилось впоследствии, бессмертие культуры Карреля было артефактом, поскольку вместе с эмбриональной сывороткой, которая добавлялась в культуральную среду для роста клеток, туда попадали и сами эмбриональные клетки (и, скорее всего, культура Карреля стала уже далеко не тем, чем была в начале).
По-настоящему бессмертными являются раковые клетки. Так, клетки HeLa, выделенные в 1951 г. из опухоли шейки матки Генриетты Лакс, до сих пор используются цитологами (в частности, c помощью клеток HeLa была разработана вакцина против полиомиелита). Эти клетки даже побывали в космосе.
Еще один важный фактор биологического старения – строение хромосом и их кончиков – теломеров.
Теломерная теория старения

Рисунок 1. Теломеры — концевые участки хромосом.
Поскольку хромосом у человека 23 пары (то есть, 46 штук), теломер получается 92.
Теломеры состоят из повторяющихся (1000–2000 раз) последовательностей (5’–TTAGGG–3’), что в сумме дает 10–15 тысяч нуклеотидных пар на каждый хромосомный кончик. На 3’-конце теломеры имеют довольно длинный однонитевой участок ДНК (150–200 нуклеотидов), участвующий в образовании петли по типу лассо [10, 11] (рис. 2).

Рисунок 2. Состав и структура теломер. Многократное деление клетки в случае отсутствия активности теломеразы
ведет к укорочению теломер и репликативному старению.

Рисунок 3. Строение теломерного комплекса (шелтерина).
Теломеры находятся на концах хромосом и состоят из тандемных повторов TTAGGG,
которые заканчиваются 32-членным выступающим одноцепочечным фрагментом.
С теломерной ДНК связан шелтерин – комплекс из шести белков: TRF1, TRF2, RAP1, TIN2, TPP1 и POT1.
Длина теломер и скорость их укорочения зависит от возраста. У человека длина теломер варьирует от 15 тысяч нуклеотидных пар (т.н.п.) при рождении до 5 т.н.п. при хронических заболеваниях. Длина теломер максимальна у 18-месячных детей, а затем она быстро снижается до 12 т.н.п. к пятилетнему возрасту. После этого скорость укорачивания снижается [14].
Любопытно, что у мышей очень длинные теломеры (50–40 т.н.п., по сравнению с 10–15 т.н.п. у человека). У некоторых линий лабораторных мышей длина теломер достигает 150 т.н.п. Более того, у мышей теломераза всегда активна, что не дает теломерам укорачиваться. Однако это, как всем известно, не делает мышей бессмертными. Мало того: у них опухоли развиваются намного чаще, чем у людей, что позволяет предположить, что укорачивание теломер как механизм защиты от опухолей у мышей не работает [15].
При сравнении длины теломер и теломеразной активности у разных млекопитающих оказалось, что виды, для которых характерно репликативное старение клеток, имеют большую продолжительность жизни и большой вес. Это, например, киты, продолжительность жизни которых может достигать 200 лет. Таким организмам репликативное старение просто необходимо, поскольку слишком большое число делений порождает множество мутаций, с которыми необходимо как-то бороться. Предположительно, репликативное старение и есть такой механизм борьбы, который сопровождается к тому же репрессией теломеразы [16].
Старение диференцированных клеток происходит иначе. Стареют и нейроны, и кардиомиоциты, а ведь они не делятся! Например, в них накапливается липофусцин – старческий пигмент, который нарушает функционирование клеток и запускает апоптоз. В клетках печени и селезенки с возрастом накапливается жир.
Связь репликативного старения клеток со старением организма, строго говоря, не доказана, но возрастная патология сопровождается и старением клеток (рис. 4).

Рисунок 4. Гистохимически окрашенные на наличие бета-галактозидазной активности
фибробласты человека линии WI-38. A: молодые; B: старые (сенесцентные).
Злокачественные новообразования пожилого возраста в большинстве своем связаны с обновляемыми тканями. Онкологические заболевания в развитых странах – одна из основных причин заболеваемости и смертности, причем независимым фактором риска раковых заболеваний является просто. возраст. Число смертей от опухолевых заболеваний увеличивается с возрастом по экспоненте, так же как и общая смертность. Это говорит нам, что между старением и канцерогенезом существует фундаментальная связь.
Теломераза – фермент, который был предсказан
В организме должен существовать механизм, компенсирующий укорочение теломер, – такое предположение сделал А.М. Оловников. Действительно, в 1984 г. такой фермент был открыт Кэрол Грейдер и назван теломеразой. Теломераза (рис. 5) – это обратная транскриптаза, которая увеличивает длину теломер, компенсируя их недорепликацию. В 2009 году Э. Блэкберн, К. Грэйдер и Д. Шостак за открытие этого фермента и цикл работ по изучению теломер и теломеразы была присуждена Нобелевская премия.

Рисунок 5. Теломераза содержит каталитический компонент (обратную транскриптазу ТERT),
теломеразную РНК (hTR или TERC), содержащую две копии теломерного повтора
и являющуюся матрицей для синтеза теломеров, и белок дискерин.
По данным Э. Блекберн, теломераза участвует в регуляции активности примерно 70 генов. Теломераза активна в зародышевых и эмбриональных тканях, в стволовых и пролиферирующих клетках. Ее обнаруживают в 90% раковых опухолей, что обеспечивает неудержимое размножение раковых клеток. В настоящее время среди препаратов, которые используют для лечения рака, есть и ингибитор теломеразы. Но в большинстве соматических клеток взрослого организма теломераза не активна.
В состояние сенесценции клетку могут привести многие стимулы – дисфункция теломер, повреждения ДНК, причиной которых могут быть мутагенные воздействия окружающей среды, эндогенные процессы, сильные митогенные сигналы (сверхэкспрессия онкогенов Ras, Raf, Mek, Mos, E2F-1 и др.), нарушения хроматина, стрессы и др. Фактически, клетки перестают делиться – становятся сенесцентными – в ответ на потенциально вызывающие рак события.
О молекулярных механизмах старения клеток
Чтобы были понятны молекулярные механизмы перехода клетки в состояние сенесцентности, я напомню вам, как происходит деление клетки.
Процесс размножения клеток называют пролиферацией. Время существования клетки от деления до деления именуют клеточным циклом. Процесс пролиферации регулируется как самой клеткой – аутокринными ростовыми факторами, – так и ее микроокружением – паракринными сигналами.
Активация пролиферации происходит через клеточную мембрану, в которой присутствуют рецепторы, воспринимающие митогенные сигналы – это в основном ростовые факторы и межклеточные контактные сигналы. Ростовые факторы обычно имеют пептидную природу (к настоящему времени их известно около 100). Это, например, фактор роста тромбоцитов, который участвует в тромбообразовании и заживлении ран, эпителиальный фактор роста, различные цитокины – интерлейкины, фактор некроза опухолей, колониестимулирующие факторы и т.д. После активации пролиферации клетка выходит из фазы покоя G0 и начинается клеточный цикл [19] (см. рис. 6).

Рисунок 6. Схема клеточного цикла.
Клеточный цикл подразделяют на четыре стадии:
1. G1 (предсинтетическая) – период, когда клетка готовится к репликации ДНК. В этой стадии может произойти остановка клеточного цикла в случае обнаружения повреждений ДНК (на время репарации). Если обнаруживаются ошибки в репликации ДНК, и они не могут быть исправлены репарацией, клетка не переходит на стадию S.
2. S (cинтетическая) – когда происходит репликация ДНК.
3. G2 (постсинтетическая) – подготовка клетки к митозу, когда происходит проверка точности репликации ДНК; если обнаружены недореплицированные фрагменты или другие нарушения в синтезе, переход на следующую стадию (митоз) не происходит.
4. М (митоз) – формирование клеточного веретена, сегрегация (расхождение хромосом) и формирование двух дочерних клеток (собственно деление).
50% случаев злокачественных опохолей. Другое проявление активности р53 связано с апоптозом наиболее поврежденных клеток.
Сенесценция клеток и возраст-зависимые заболевания
Сенесцентные клетки накапливаются с возрастом и способствуют возрастным заболеваниям. Они снижают пролиферативный потенциал ткани и истощают пул стволовых клеток, что приводит к дегенеративным нарушениям ткани и снижает способность к регенерации и обновлению.
Сенесцентные клетки характеризуются специфической экспрессией генов: они секретируют воспалительные цитокины и металлопротеиназы, разрушающие межклеточный матрикс. Получается, что старые клетки обеспечивают вялотекущее старческое воспаление, а накопление старых фибробластов в коже служит причиной возрастного снижения способности к заживлению ран (см. рис. 7).

Рисунок 7. Взаимосвязь между старением клеток и старением организма.
Старые клетки также стимулируют пролиферацию и малигнизацию близлежащих предраковых клеток, благодаря секреции эпителиального фактора роста [20]. Сенесцентные клетки накапливаются во многих тканях человека, присутствуют в атеросклеротических бляшках, в язвах кожи, в пораженных артритом суставах, а также в доброкачественных и пренеопластических гиперпролиферативных поражениях простаты и печени. При облучении раковых опухолей некоторые клетки также переходят в состояние сенесценции, тем самым обеспечивая рецидивы заболевания.
Таким образом, клеточное старение демонстрирует эффект отрицательной плейотропии, суть которого состоит в том, что хорошее для молодого организма, может стать плохим для старого. Самый яркий пример – процессы воспаления. Выраженная реакция воспаления способствует быстрому выздоровлению молодого организма при инфекционных заболеваниях. В пожилом же возрасте активные воспалительные процессы приводят к возрастным заболеваниям. Сейчас принято считать, что воспаление играет определяющую роль практически при всех возрастных заболеваниях, начиная с нейродегенеративных.
Список указанных в тексте литературных источников см. в оригинале статьи.
Читайте также:

