Рак эндометрия лимфатические узлы
Чаще лимфогенно. Метастазы при раке тела матки ухудшают прогноз, но не являются абсолютно неблагоприятным фактором для выживания: при выполнении всех стандартов терапии можно надеяться на стойкую ремиссию.
Лимфатическая система малого таза
Рак эндометрия
Риск появления раковых клеток в лимфоузлах нарастает при прорастании злокачественной опухоли в эндометрий. Лимфогенные метастазы при раке тела матки могут быть выявлены уже при 2 стадии. Выделяют следующие прогностически негативные факторы:
- Прогрессирующий рост карциномы с погружением в стенку матки более чем на половину толщины;
- Рак эндометрия T1b стадии и выше;
- Высокая степень злокачественности;
- Пожилой возраст (старше 60 лет).
Значительно чаще опухоль в матке выявляется у молодых женщин (около 50 лет), у которых сохранен менструальный цикл или начался переходный период (первые годы после прекращения менструаций). В большинстве случаев в этой ситуации врач обнаружит гормонозависимый и прогностически благоприятный тип рака матки.
Метастазы при раке тела матки
Крайне редко, но вполне возможно метастатическое распространение злокачественного новообразования уже при 1 стадии, поэтому при обнаружении рака эндометрия необходимо проводить полное обследование для ранней диагностики осложнений. Все варианты метастазирования можно разделить на 3 группы:
- Поражение региональных лимфоузлов;
- Прорастание опухоли в околоматочные ткани;
- Отдаленные метастазы при раке матки.
Даже если при предварительном обследовании ничего не выявлено, то это вовсе не означает, что во время операции хирург не обнаружит увеличенных лимфоузлов. При раке эндометрия нежелательно использовать органосохраняющие и нерадикальные хирургические вмешательства (особенно у женщин с наследственной предрасположенностью, наличием мутаций генов BRCA, выявленными ранее опухолями в яичниках, молочных железах и кишечнике).
Лимфогенное метастазирование
Первыми на пути раковых клеток, начавшими путь из первичного очага в матке, будут тазовые и поясничные лимфатические узлы. Помимо стандартных диагностических процедур, к необходимому методу обследования перед операцией относится компьютерная томография с контрастом для оценки состояния лимфоузлов малого таза. При 1 стадии рака эндометрия риск невелик (региональные лимфогенные метастазы при раке матки обнаруживаются не более чем у 10% пациенток).
Околоматочное метастазирование
Это еще не отдаленное метастазирование, но прогностически неблагоприятно, если при обследовании выявлены следующие очаги:
- Прорастание опухоли в шейку матки;
- Поражение маточных труб;
- Распространение карциномы на стенку влагалища;
- Прорастание в околоматочную клетчатку;
- Переход опухоли на яичники;
- Распространение опухолевых клеток по тазовой брюшине.
Все, что рядом с маткой – это еще не так плохо. Но – уже неблагоприятно. И это обязательно оказывает влияние на выбор объема операции и тактики лечения.
Отдаленные метастазы
Сравнительно редкая ситуация, потому что в большинстве случаев рак эндометрия выявляется на ранних стадиях или на этапе атипической гиперплазии. Тем не менее, отдаленные метастазы при раке тела матки – это чаще всего:
- Поражение паховых лимфатических узлов;
- Обнаружение лимфоаденопатии в любых лимфоузлах брюшной полости;
- Очаги в печени;
- Обнаружение вторичных очагов в легких;
- Костные метастазы;
- Канцероматоз брюшины.
Наиболее частым вариантом метастатического распространения злокачественного новообразования тела матки являются близкорасположенные лимфоузлы, которые надо обязательно удалить во время операции. Отдаленные метастазы при раке матки ухудшают прогноз, но с ними можно и нужно бороться, используя все методы комбинированной терапии (хирургическое удаление, адъювантная химиотерапия, облучение, гормонотерапия).
Длительное время абдоминальная гистерэктомия с придатками считалась стандартом лечения рака эндометрия (РЭ). По этой причине без внимания оставалась большая частота метастазирования в лимфоузлы. Несмотря на то что и первые, и более поздние публикации указывали на то, что у большого числа больных раком эндометрия (РЭ) даже с I стадией появятся метастазы в лимфоузлах, эти потенциальные очаги распространения опухоли в схемах лечения не учитывали.
В 1973 г. Morrow и соавт. установили, что из 369 пациентокс I стадией рака эндометрия (РЭ) метастазы влимфоузлахтаза обнаружены у 39. В 1976 г. Creasman и соавт. привели примеры еще 140 больных, у 16 из которых выявлены метастазы в тазовых лимфоузлах. Эти данные уточняли по ходу появления новых случаев рака эндометрия (РЭ). В относительно большой группе пациенток с клинически установленной I стадией рака эндометрия (РЭ) почти у 10% были обнаружены метастазы в лимфоузлах таза.
В исследовании Morrow и соавт. только 31 % больных с I стадией заболевания и метастазами в лимфоузлах пережили 5-летний рубеж, при том, что большинству из них была проведена послеоперационная ЛТ. Polish и соавт. опубликовали показатели выживаемости больных с микроскопическими метастазами в лимфоузлах, которым провели ЛТ как этап первичного лечения.
5-летняя выживаемость при подтвержденных хирургическим стадированием метастазах в лимфоузлах таза составила 67%, а в случаях поражения парааортальных узлов с метастазами или без таковых в лимфоузлах таза — 47 и 43% соответственно. В исследовании Creasman и соавт. у 102 больных для гистологической диагностики удаляли парааортальную жировую клетчатку, в результате чего в 10 (9,8 %) случаях выявили метастазы в этой области.
Boronow и соавт. при дополнении и обновлении одного из первых в этом направлении исследований GOG обнаружили, что из 222 пациенток с I стадией рака эндометрия (РЭ) у 23 (10,4 %) выявлены метастазы в лимфоузлах таза. Из 156 больных, которым провели микроскопическую оценку парааортальных лимфоузлов, метастазы были выявлены у 16 (10,2 %).

DiSaia в ходе длительного наблюдения отметил рецидивы заболевания у 21 (10,5%) из 199 пациенток, у которых не было метастазов в лимфоузлах таза, и у 13(56 %) из 23, имевших метастатическое поражение этих узлов. При отсутствии метастазов в парааортальных узлах рецидивы наблюдались у 15 (11 %) из 140 больных, а при их поражении — у 10 (59 %) из 17. Creasman, анализируя данные GOG о 621 пациентке с I стадией РЭ, обнаружил, что в 144 (22%) случаях заболевание распространилось за пределы матки: в тазовые и парааортальные лимфоузлы, придатки матки, органы брюшной полости — и/или были обнаружены злокачественные клетки в смывах.
Частота метастазирования в лимфоузлы у больных со II стадией рака эндометрия (РЭ) значительно выше, чем при 1 стадии заболевания. Morrow и соавт. привели данные о 85 пациентках: в 31 (36,5 %) случае выявлены метастазы в лимфоузлахтаза. В исследовании GOG 148 больным с клинически установленной II стадией РЭ провели хирургическое стадирование; у 66 процесс распространялся на шейку матки. Среди больных с поражением только желез эндоцервикса метастазы в тазовых лимфоузлах были обнаружены у 3 (17%) по сравнению с 35% пациенток с вовлечением стромы. Ни у одной больной с поражением только желез шейки матки метастазов в парааортальных лимфоузлах не было по сравнению с 23 % пациенток с вовлечением стромы.
При наличии инвазии в строму шейки матки метастазы в тазовых и парааортальных лимфоузлах выявляли у 46 % больных. В годовом отчете FIGO приведены данные о 43, 103 и 121 пациентке с III стадией рака эндометрия (РЭ) и степенью дифференцировки G1, G2 и G3 соответственно. 5-летняя выживаемость составила 62, 61 и 47 % соответственно.
Ben-Shachar и соавт. представили результаты лечения 349 больных, которых прооперировали по поводу рака эндометрия (РЭ). До операции у 52 % из них диагностированы высокодифференцированные опухоли (G1). Хирургическое стадирование ± парааортальная лимфаденэктомия были выполнены в 82 % случаев. После сравнения результатов пред- и послеоперационного гистологического исследования у 19 % пациенток оказалась более высокая степень дифференцировки (G2 или G3).
Метастазы в лимфоузлах обнаружены у 3,9 % пациенток с высокодифференцированной аденокарциномой (G1), у 10,5% заболевание распространилось за пределы матки. Признаки высокого риска — инвазия, захватывающая более половины толщины миометрия, низкодифференцированные (G3) и неблагоприятные морфологические варианты опухоли, переход процесса на шейку матки — были выявлены у 26 % больных, у которых до операции диагностирован высокодифференцированный рак (G1). Результаты хирургического стадирования указали па необходимость проведения адъювантной терапии у 12 % пациенток и отказ от нее — у 17 %.
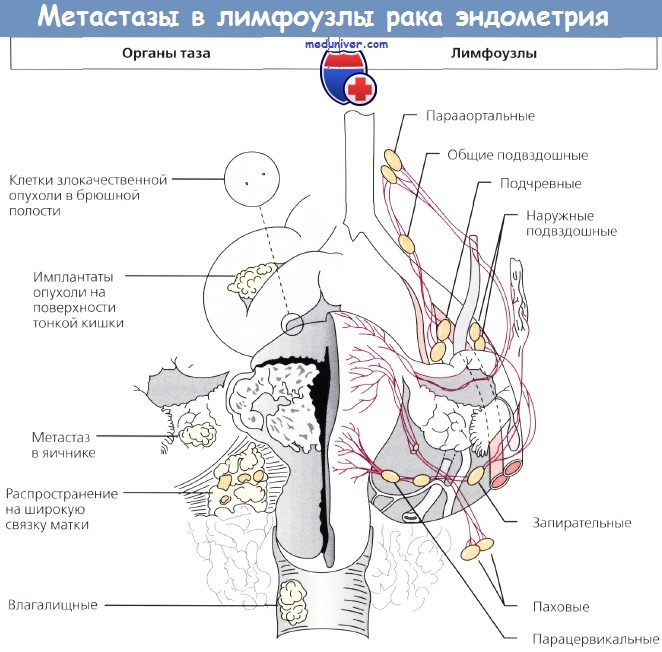
С 1988 г., когда эксперты FIGO перешли с клинического определения стадии рака эндометрия (РЭ) на хирургическое стадирование, возник вопрос о роли лимфаденэктомии при лечении стадии рака эндометрия (РЭ). Несет ли она только диагностическую функцию, что уже существенно, или служит и лечебной процедурой? В первоначальных исследованиях выполняли селективную лимфаденэктомию — удаление подозрительных на наличие метастазов лимфоузлов.
Все большее количество данных свидетельствует о том, что необходимо выполнять полную лимфаденэктомию. Onda и соавт. провели тазовые и парааортальные лимфаденэктомии у 173 больных при 1—III стадии стадии рака эндометрия (РЭ), удалив в среднем 38 тазовых и 29 парааортальных узлов. Метастазы в лимфоузлах обнаружены у 30 (17%) пациенток: у 10 — только в тазовых лимфоузлах (группа Т), у 2 — только в парааортальных и у 18 — в тех и других (последние 20 больных вошли в группу А). В группе Т провели ЛТ обычными полями, в группе Л — расширенными и/или ПХТ. У 143 больпых без метастазов в лимфоузлах 5-летняя выживаемость составила 95 %, у 30 пациенток с метастазами в группе Т — 100 %, а в группе А — 75%.
По мнению авторов, системная тазовая и парааортальная лимфаденэктомия, а также последующие ЛТ и XT, назначенные на основании результатов гистологического исследования лимфоузлов, позволили улучшит!) выживаемость больных. Mohan и соавт. проанализировали результаты лечения 159 больных с I стадией заболевания,которым была выполнена тазовая лимфаденэктомия е последующей брахитерапией (контактной лучевой терапией). Общая 15-летняя выживаемость составила 92%, частота рецидивирования — 4,4%; во всех случаях рецидивы представляли собой отдаленные метастазы. В публикации под редакцией Podratz и соавт. рассмотрены 4 исследования, включая и вышеназванное, в которых лимфаденэктомию выполняли самым тщательным образом больным в группах умеренного и высокого риска, а послеоперационную ЛТ не назначали.
Среди 305 больных диагностировано 20 (6,6%) рецидивов заболевания; только в 5 из них рецидивы были местными/регионарными, причем 4 локализовались во влагалище. Этим 4 пациенткам не провели послеоперационную брахитерапию, но в последующем излечение было достигнуто с помощью ЛТ.
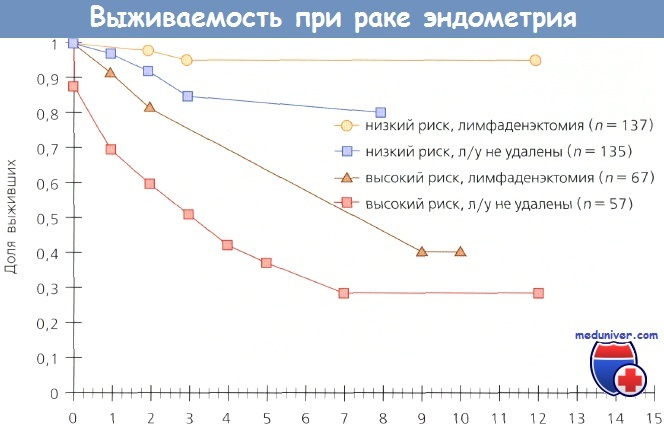
Выживаемость в зависимости от того, выполнена тазовая лимфаденэктомия или нет, и группы риска: низкого (р = 0,026) и высокого (р = 0,0006)
В ретроспективном исследовании, выполненном в клинике Мауо, 137 больных с высоким риском поражения лимфоузлов метастазами, которым была выполнена парааортальная лимфаденэктомия (ПЛА+), сравнили с пациентками, которым этот этап не выполняли (ПЛА—). В группе ПЛА+ 5-летняя выживаемость составляла 85 % по сравнению с 77 % в группе ПЛА—. У 51 больной с метастазами в тазовых или парааортальных лимфоузлах показатель выживаемости равнялся 77 % в группе ПЛА+ по сравнению с 42 % в группе ПЛА—. Kilgore и соавт., анализируя результаты лечения 649 пациенток, пришли к выводу о том, что выживаемость перенесших тазовую и парааортальную лимфаденэктомию значительно лучше, чем у пациенток с сохраненными лимфоузлами.
Кроме того, выживаемость после лимфаденэктомии лучше, чем без нее, но с послеоперационной ЛТ. В небольшом исследовании, включавшем 41 пациентку с РЭ III стадии, Bristow и соавт. установили, что безрецидивная выживаемость больных значительно возрастает при полном удалении всех макроскопически измененных лимфоузлов по сравнению со случаями, когда во время операции не были удалены явно метастатические узлы (37,5 vs 8,8 мес; р = 0,006).
В исследовании Havrilesky у 91 больной была установлена III стадия РЭ, причем у 39 обнаружены микрометастазы в нормальных по размеру лимфоузлах и у 52 — увеличенные метастатические узлы. После операции 92 % этих больных получали адъювантную терапию; ЛТ проведена 85% пациенток. У 39 пациенток с микроскопическими метастазами в лимфоузлах 5-летняя выживаемость равнялась 58 %, а у 41 больной с полным удалением макроскопически увеличенных метастатических узлов — 48% и всего 22 % у 11 женщин с неудаленными лимфоузлами. Авторы пришли к выводу, что эти данные свидетельствуют о терапевтической эффективности лимфаденэктомии.
Schink и соавт. определили размер опухолей у 91 больной с I стадией РЭ. Частота метастазов в лимфоузлах при размере опухоли менее 2 см составляла всего 5,7%, более 2 см в диаметре — 21 %, а в случаях поражения всего эндометрия этот показатель возрастал до 40 %. У пациенток с опухолью менее 2 см и инвазией менее чем на 1/2 толщины миометрия метастазов в лимфоузлах не было. На основании многофакторного анализа авторы установили, что размер опухоли — независимый прогностический фактор.
Однако Watanabe и соавт. придерживаются другого мнения и считают, что этот показатель не коррелирует с частотой метастазов в лимфоузлах.
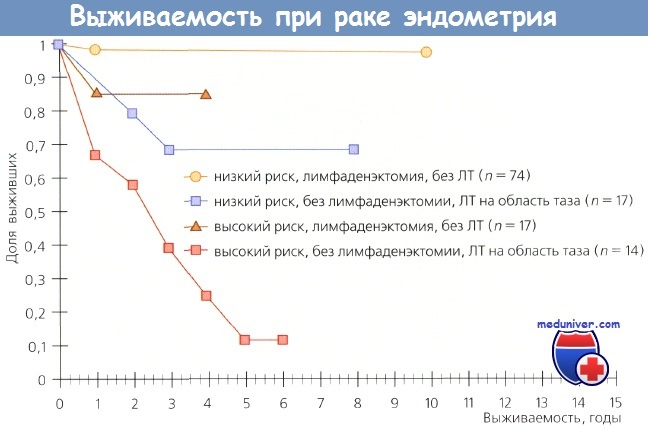
Сравнение показателей выживаемости больных, которым выполнена лимфаденэктомия, но лучевая терапия не проведена, и больных, которым лимфаденэктомия не выполнена, но проведена лучевая терапия на область таза.
Низкий риск, р = 0,003; высокий риск, р = 0,041
Лимфатические узлы — биологические фильтры организма. Они не дают распространяться инфекциям и служат местом для созревания иммунных клеток. Всего в теле человека 500–600 лимфоузлов. Иногда они увеличиваются. Это может происходить по разным причинам, чаще всего инфекций.

Первичные злокачественные опухоли в лимфатических узлах составляют 3–4% от всех онкологических заболеваний и представлены лимфомами. Помимо лимфоузлов, лимфомы встречаются и в других органах, в которых представлена лимфоидная ткань: в вилочковой железе (тимусе), миндалинах, пищеварительном тракте, селезенке и др.
Злокачественные опухоли в лимфоузлах часто называют раком лимфатических узлов, но это неверно. Рак — злокачественные новообразования, которые происходят из эпителиальных тканей: кожи, слизистых оболочек, желез. Лимфомы — опухоли из лимфоидной ткани. Они бывают двух типов: ходжкинские (болезнь Ходжкина) и неходжкинские.
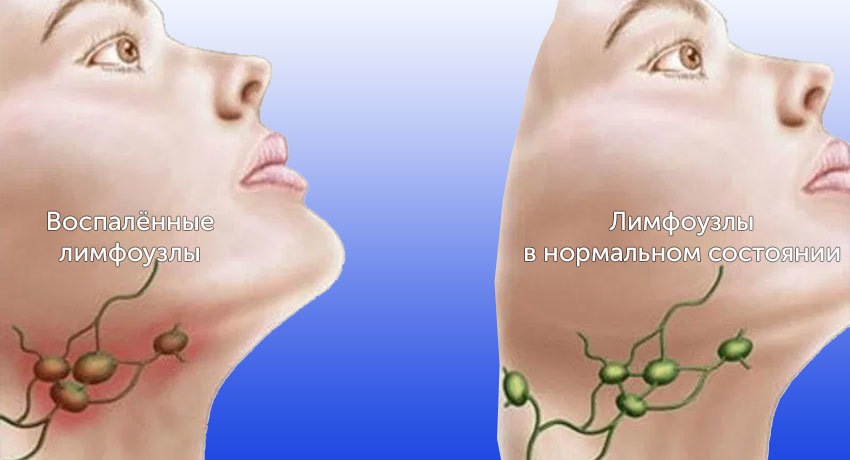
Помимо первичных опухолей, в лимфатических узлах очень часто встречаются вторичные очаги при раке в других органах. Опухолевые клетки, попавшие в лимфатические сосуды, в первую очередь достигают регионарных лимфоузлов — тех, которые принимают лимфу от области тела, где находится первичное новообразование.
Лечение лимфом
Основным методом лечения болезни Ходжкина и неходжкинских лимфом является химиотерапия. Применяются комбинации различных химиопрепаратов.
При лимфоме Ходжкина чаще всего прибегают к схеме ABVD — эта аббревиатура составлена из первых букв названий препаратов:
- Адриамицин, другое название — Доксорубицин (Adriamycin).
- Блеомицин (Bleomycin).
- Винбластин (Vinblastine).
- Дакарбазин (Dacarbazine).
Иногда применяют схемы BEACOPP (Блеомицин + Этопозид + Доксорубицин + Циклофосфамид + Винкристин + Прокарбазин + Преднизон) и Стэнфорд V (Доксорубицин + Мехлорэтамин + Винкристин + Винбластин + Блеомицин + Этопозид + Преднизон).
За 1–2 дня до введения химиопрепаратов нужно провести общий анализ крови. Если результат удовлетворительный, можно проводить лечение. Непосредственно перед процедурой пациенту вводят препараты для предупреждения побочных эффектов: противорвотные и противоаллергические. Химиотерапевтические средства вводят в определенной последовательности: Доксорубицин, затем Винбластин, в последнюю очередь Блеомицин и Дакарбазин.
При неходжкинских лимфомах чаще всего применяют две схемы химиотерапии:
- Схема CHOP включает 4 препарата. Циклофосфамид (Cyclophosphamide), Доксорубицин, или Гидроксидаунорубицин (Hydroxydaunorubicin) и Винкристин, или Онковин (Oncovin) вводят внутривенно. Преднизон (Prednisone) принимают в виде таблеток.
- CVP — схема из трех препаратов. Циклофосфамид (Cyclophosphamide) и Винкристин (Vincristine) вводят внутривенно, Преднизон (Prednisone) в таблетках.
Чаще всего химиотерапию при лимфомах проводят амбулаторно, в условиях дневного стационара. Иногда успешно проводят несколько циклов лечения комбинацией препаратов первой линии, но затем она становится менее эффективной, и приходится назначать другую.
В современных клиниках при длительном курсе химиотерапии пациенту устанавливают венозную . Она представляет собой небольшую титановую емкость с мембраной, которую помещают через небольшой разрез под кожу и соединяют тонкой трубкой (катетером) с веной. В дальнейшем, чтобы ввести раствор препарата внутривенно, достаточно лишь проколоть кожу и мембрану. Это делает процедуру более удобной для врача, позволяет пациенту избежать стресса и дискомфорта многократных уколов в вену, помогает предотвратить флебит — воспаление венозной стенки.
Оставьте свой номер телефона
Некоторые агрессивные типы неходжкинских лимфом часто метастазируют в головной мозг. Системная химиотерапия при этом неэффективна, потому что химиопрепаратам, введенным внутривенно или перорально (путем проглатывания) сложно проникнуть в спинномозговую жидкость. Проблема решается введением химиопрепаратов интратекально — непосредственно в спинномозговую жидкость. Эту процедуру можно проводить амбулаторно, как в профилактических целях, так и при уже возникших метастазах в головном мозге. Чаще всего применяют химиопрепараты Метотрексат и Цитарабин.
Иногда вместо интратекальной химиотерапии проводят системную терапию метотрексатом в высоких дозах.
Лимфомы обычно хорошо отвечают на облучение, поэтому лучевую терапию часто применяют для борьбы с этим типом опухолей. При лимфомах Ходжкина она используется, как правило, в виде дополнения к курсу химиотерапии — вместе с ним или после него.
Показания к лучевой терапии при неходжкинских лимфомах:
- При опухолях I и II стадии — в качестве самостоятельного метода лечения.
- При НХЛ на более поздних стадиях — в качестве дополнения к химиотерапии.
- Облучение всего тела в сочетании с высокодозной химиотерапией после трансплантации стволовых клеток.
- При лимфоме с метастазами в качестве симптоматического лечения.
Иммунотерапия — современное направление в лечении онкологических заболеваний. Она предполагает использование ресурсов иммунной системы для уничтожения опухолевых клеток.
При лимфомах используются моноклональные антитела, которые специфически нацелены на белок CD20, находящийся на поверхности лимфоцитов. Чаще всего при ходжкинских и неходжкинских лимфомах применяется Ритуксимаб (Ритуксан). Врач может назначить его отдельно или в сочетании лучевой терапией, химиотерапией.
Другие препараты из группы ингибиторов CD20 (применяются при неходжкинских лимфомах):
- Обинутузумаб (Газива) часто применяют в сочетании с химиопрепаратами для лечения малой лимфоцитарной лимфомы (SLL), хронического лимфоцитарного лейкоза (CLL).
- Офатумумаб (Арзерра), как правило, применяют у пациентов с SLL/CLL, которым не помогают другие виды лечения.
- Ибритумомаб тиуксетан (Зевалин) представляет собой моноклональное антитело, к которому прикреплена радиоактивная молекула.
При лимфомах Ходжкина в настоящее время также применяют Брентуксимаб ведотин (Адцетрис). Это моноклональное антитело, соединенное с молекулой химиопрепарата, нацелено на молекулу CD30.
Этот метод лечения применяют в случаях, когда заболевание не поддается излечению с помощью химиотерапии и лучевой терапии. Суть состоит в том, чтобы уничтожить патологически измененные клетки и заменить их новыми. Для этого сочетают высокодозную химиотерапию и трансплантацию собственных или донорских стволовых клеток. Это сложный вид лечения, он грозит серьезными, опасными для жизни осложнениями. Проводить его должны опытные врачи в специализированных онкологических центрах, предварительно тщательно взвесив все потенциальные преимущества и риски для конкретного пациента.
Лечение вторичных очагов в лимфатических узлах
Если злокачественная опухоль, изначально возникшая в другом органе, распространилась в лимфатические узлы, тактика лечения будет зависеть от стадии онкологического заболевания.
Радикальные операции при раке зачастую предусматривают одновременное удаление пораженного органа и определенного количества регионарных лимфатических узлов. Обычно хирургическое вмешательство дополняется курсом адъювантной химиотерапии и/или лучевой терапии.
При раке с очагами в лимфатических узлах и отдаленными метастазами, когда хирургическое лечение невозможно, проводят химиотерапию, лучевую терапию. В зависимости от типа злокачественной опухоли, могут быть назначены современные таргетные препараты, иммунопрепараты.
В клинике Медицина 24/7 работают ведущие врачи-онкологи, применяются все современные типы противоопухолевых препаратов, зарегистрированные на территории России. Мы работаем в соответствии с последними версиями международных протоколов.
Клинические проявления рака эндометрия
Жалобы больных при раке эндометрия условно делят на 3 группы:
1) связанные с нарушением менструальной функции (кровянистые выделения в пременопаузе, постменопаузе);
2) обусловленные болевым синдромом;
3) вызванные обменными и эндокринными нарушениями.
Кровянистые выделения из половых путей различного характера - самая частая и, что очень важно, ранняя жалоба, предъявляемая больными злокачественными опухолями тела матки. Матка достаточно стереотипно реагирует на патологический процесс слизистой оболочки. Различия в характере кровянистых выделений зависят в основном от возраста больных.
В репродуктивном возрасте - кровянистые выделения из половых путей в межменструальный период, а также до или после менструации.
В постменопаузе - больные отмечают скудные кратковременные или длительные кровянистые выделения, контактные кровотечения.
Группы риска больных по развитию рака эндометрия
Группы риска связаны:
1) с поздним наступлением менопаузы;
2) с ожирением, сахарным диабетом, гипертонической болезнью;
3) с рецидивирующими дисфункциональными маточными кровотечениями и гиперэстрогенией в постменопаузе;
4) с ановуляторными циклами;
5) с диэнцефальным синдромом, протекающим по типу болезни Иценко-Кушинга;
6) с феминизирующими опухолями яичников;
7) с гиперпластическими процессами эндометрия, особенно рецидивирующими и протекающими на фоне ожирения, артериальной гипертензии, нарушением синтеза белка в печени, функции щитовидной железы;
8) с синдромом Штейна-Левенталя.
Диагностика
Используется целый комплекс методов определения состояния слизистой оболочки тела матки.
Эхография органов малого таза. У здоровых женщин репродуктивного возраста длина матки в среднем равна 5,38+0,03 см, ее переднезадний размер 4,23±0,02 см, ширина - 5,11±0,07 см. Значения М-эха составляют: длина - 2,48±0,04 см, переднезадний размер - 0,49±0,01 см, ширина - 1,9±0,03 см.
В пременопаузальном периоде с учетом величины М-эхо пациентки подразделяются на 3 группы:
1) М-эхо в пределах нормальной величины, наиболее частой причиной кровотечения является миома матки и внутренний эндометриоз;
2) величина М-эхо в пределах 9-14 мм, наиболее частой причиной кровотечения является гиперплазия эндометрия;
3) величина срединных маточных структур превышает 14 мм, причиной атипических кровотечений являются гиперпластические процессы эндометрия. Однако именно в этой группе наиболее часто диагностируется злокачественный процесс.
В постменопаузальном периоде с учетом величины М-эхо пациентки подразделяются на 2 группы:
1) величина М-эхо в пределах возрастной нормы (до 4мм.), патология диагностируется чаще всего в цервикальном канале или происходит на фоне атрофии эндометрия.
2) величина срединных маточных структур превышает 4 мм, наиболее частой патологией являются различные гиперпластические процессы и рак эндометрия.
Это основной способ диагностики. Раздельное диагностическое выскабливание слизистой оболочки матки и цервикального канала позволяет получить материал для исследования из всех участков матки. Зондирование полости матки и расширение цервикального канала, выполняемое до взятия материала из эндоцервикса, могут исказить картину за счёт попадания частиц из полости матки в цервикальный канал. Возможно, более точно судить о характере изменений в цервикальном канале можно, если выполнить забор тканей эндоцервикса до прохождения зондом внутреннего зева. Пользоваться частичным соскобом (цугом, штрих-биопсией) при ГПЭ не рекомендуется.
При сохраненном ритме менструаций выскабливание целесообразно проводить в секреторной фазе, за 3-4 дня до ожидаемой менструации. При очаговой гиперплазии и полипах эндометрия - на 5-7 день менструального цикла. При метроррагии - в 1 день появления кровянистых выделений.
Диагностический алгоритм
При подозрении на злокачественный процесс тела матки последовательно проводят:
1) общеклиническое исследование;
2) бимануальное и ректовагинальное исследование;
3) цитологическое исследование аспирата из полости матки;
4) раздельное диагностическое выскабливание цервикального канала и полости матки;
5) гистероскопию или гистерографию;
6) ультразвуковое исследование органов малого таза и органов брюшной полости, забрюшинных лимфоузлов таза и поясничной области, мочевыводящих путей;
7) цистоскопию и ректороманоскопию (при подозрении на распространённый процесс);
8) при необходимости компьютерная томография, экскреторная урография, ирригоскопия, пункция ЛУ, радиоизотопное исследование функции почек.
Классификация рака эндометрия
Классификация применима для рака и злокачественных смешанных мезодермальных опухолей. Должно быть гистологическое подтверждение диагноза и определена гистопатологическая дифференцировка и grade (G). Диагноз должен основываться на данных исследования материала, полученного при частичном выскабливании.
Для оценки категорий Т, N и М применяются следующие методы:
Т-категории - физикальный осмотр и методы визуализации, включая урографию и цистоскопию;
N-категории - физикальный осмотр и методы визуализации, включая урографию;
М-категории - физикальный осмотр и методы визуализации.

Рис. 27. Регионарные лимфоузлы. 1 - внутренние подвздошные (включая запирательные); 2 - общие подвздошные; 3 - внешние подвздошные; 4 - боковые крестцовые.
Таблица 3. Классификация TNM и классификация Всемирной организации акушеров и гинекологов (FIGО) рака эндометрия

Примечание: FIGО (2001) рекомендует классифицировать опухоли с 1 стадией, получающих лучевую терапию, следующим образом: стадия 1 - опухоль ограничена телом матки; стадия 1А - длина полости матки 8 см. Данная рекомендация в настоящее время не используется.

Рис. 28. Стадирование злокачественного новообразования тела матки по символу T. а - опухоль ограничена слизистой оболочкой матки (Т1а), инвазия опухоли в миометрий до половины толщины стенки (Т1b), инвазия опухоли достигает серозного покрова матки (Т1с); б - переход опухолевого поражения на цервикальный канал (Т2).

Рис. 29. Стадирование злокачественного новообразования тела матки по символу T. Переход опухоли на стенку влагалища, выход за пределы матки (Т3).

Рис. 30. Стадирование злокачественного новообразования тела матки по символу T. Непосредственное прорастание опухолью слизистой мочевого пузыря и/или прямой кишки. (Т4).
N - регионарные лимфатические узлы
Nx - недостаточно данных для оценки состояния регионарных лимфатических узлов;
N0 - нет признаков поражения метастазами регионарных лимфатических узлов;
N1 - метастазы в регионарных лимфатических узлах;
М - отдаленные метастазы
Мх - недостаточно данных для определения отдалённых метастазов;
М0 - нет признаков отдалённых метастазов;
M1 - имеются отдалённые метастазы.
Гистопатологическая дифференцировка (G)
Gх - степень дифференцировки не может быть установлена;
G1 - высокая степень дифференцировки;
G2 - средняя степень дифференцировки;
G3 - низкая степень дифференцировки.
Группировка по стадиям с учетом вышеназванных критериев представлена в таблице 4.
Таблица 4. Группировка рака эндометрия по стадиям развития процесса

Лечение рака эндометрия
Наиболее часто компонентами комбинированной терапии рака эндометрия является оперативный этап и лучевая терапия. Минимальным радикальным объёмом для данной патологии является экстирпация матки с придатками, но имеется ряд особенностей, когда выбирается более агрессивное вмешательство. Так, при опухоли, ограниченной телом матки, но расположенной в нижней трети её полости, значительно повышается риск метастазирования в регионарные лимфоузлы. Такой же риск мы отмечаем и при наличии низкодифференцированных форм опухолей.
В этом случае имеются прямые показания для выполнения расширенной экстирпации матки с лимфаденэктомией, а при распространении опухоли на цервикальный канал особенности её метастазирования начинают напоминать таковые при раке шейки матки, поэтому необходимым вмешательством в данном случае будет являться операция Вертгейма.
Европейские программы лечения данной патологии во всех случаях рекомендуют выполнять расширенную экстирпацию матки по Вертгейму.
Лучевой компонент реализуется чаше всего в виде сочетанной лучевой терапии. Лечение начинается через 10-14 дней после операции и проводится в виде дистанционной гамма-терапии на область малого таза и регионарного лимфооттока (40-46 Гр в зависимости от дифференцировки опухоли) и внутриполостной гамма-терапии на стенку и купол влагалища с помощью кольпостата до 12-21 Гр.
У пациенток, имеющих противопоказания к оперативному лечению (экстрагенитальная патология), проводится сочетанная лучевая терапия в самостоятельном варианте.
Химиотерапия становится частью комплексного лечения карцином эндометрия при местнораспространённых и распространённых формах опухоли. Схемой выбора является САР (циклофосфан, адриабластин, цисплатин).
Первые успехи гормонотерапии в онкологии были получены при лечении больных с распространённым раком эндометрия, имеющим метастазы в лёгкие. Именно использование препаратов с прогестагенной активностью показало высокую эффективность в отношении опухолей с сохранённым рецепторным аппаратом к половым стероидам.
Гестагены могут быть использованы у пациенток с опухолью эндометрия более чем Т1аN0M0 и наличием G1-2 (либо наличием в опухоли рецепторов к эстрадиолу и прогестерону). Для лечения могут быть использованы следующие схемы: гестонорон капронат (депостат) по 200 мг в/м 1 раз в неделю; медроксипрогестерон ацетат (провера, фарлутал) по 200-800 мг внутрь ежедневно; депопровера по 500-1500 мг в/м еженедельно; 17 ОПК по 500-1000 мг в/м 2-3 раза в неделю; мегестрол ацетат (мегейс) по 160-320 мг в день. Кроме гестагенов в схемы могут быть включены антиэстрогены (тамоксифен).
Продолжительность лечения составляет, как правило, от 6 месяцев до 2 лет. Гормонотерапия может назначаться пожизненно, при III-IV стадиях, а также при рецидивах и метастазах рака тела матки.
Исследования последних лет указывают на наличии раскола среди авторов относительно адъювантной гормонотерапии. Поскольку продолжительность жизни таких пациенток не изменяется, а количество тромботических осложнений увеличивается, частота профилактического назначения гестагенов в последнее время снижается.
Наблюдение за пациентками в условиях поликлиники онкологического диспансера проводится в 1-ый год после лечения - 1 раз в 3 месяца, со второго по четвёртый годы после лечения - 1 раз в 6 месяцев, а затем 1 раз в год.
А.С. Марьенко, A.И. Новиков, В.К. Косенок, В.А. Акулинин
Читайте также:





