Рак эндометрия и толстой кишки
Цена исследования 35 000 руб.
Срок выполнения
35 раб.дн.
Записаться на исследование
+7 (495) 150-66-47
Исследуем: 22 гена
Для кого это исследование
Назначение этой панели исследований показано следующим группам обследуемых:
Здоровым людям с имеющимися случаями онкологических заболеваний этих органов в семье (например, при наличии трёх и более случаев опухолей толстого кишечника и/или рака эндометрия в семье в одной линии);
Здоровым людям без семейного анамнеза онкологических заболеваний исследование может дать важную информацию о генетической предрасположенности к онкологическим поражениям этих органов. Такая вероятность существует, поскольку человек может быть носителем новых мутаций, которых нет у родителей, и кроме того, наследственный рак может наследоваться от здоровых носителей мутаций. При этом в семье может не быть случаев рака, но у данного конкретного пациентабудет присутствовать новая комбинация онкогенных мутаций, унаследованных от обоих родителей-носителей, вызывающая рак.
Пациентам с аденоматозным полипозом.
Пациентам с уже диагностированной опухолью толстого кишечника или эндометрия в случае подозрения на наследственную природу заболевания, например,
- в случае относительно раннего возраста развития рака (у пациентов моложе 50 лет),
- в случае онкологически отягощённого семейного анамнеза,
- при определённых типах опухолей (например, опухоли с высокой микросателлитной нестабильностью),
- при наличии двух и более первичных очагов опухоли у одного пациента (в одном органе или в разных).
У этой группы пациентов выявление мутаций позволяет уточнить диагноз и прогноз, а также выбрать правильную стратегию лечения.
Конечная цель исследования – полная информация о мутациях, связанных с наследственными формами рака толстой кишки и эндометрия, интерпретированная специалистом с точки зрения клинической значимости.
Какие гены мы смотрим
Гены, включенные в панель (на основе рекомендаций Национальной онкологической сети США, NCCN):
APC, ATM, AXIN2, BLM, BMPR1A, CHEK2, EPCAM, GALNT12, GREM1, MLH1, MSH2, MSH3, MSH6, MUTYH, NTHL1, PMS2, POLD1, POLE, PTEN, SMAD4, STK11, TP53
Как сдать тест?
Материал для исследования – венозная кровь, которая берется в специальную пробирку.
Кровь можно сдать по месту жительства в любой лаборатории, либо в лаборатории Genetico в Москве. Наша логистическая служба доставит биоматериал из любой точки России до места проведения исследования без дополнительных расходов для заказчика.
Метод исследования — высокопроизводительное секвенирование ДНК нового поколения (next generation sequencing, NGS). Секвенирование – определение последовательности нуклеотидов ДНК, относится к современным высокоточным методам молекулярного анализа.
Срок выполнения
Мы проводим полное исследование и формируем заключение в течение 35 рабочих дней.
Может показаться, что это большой срок, но это не так. Это самая высокая скорость на рынке для подобных исследований такого объёма, проводимых с использованием технологии NGS.
Указанное время требуется для выполнения многоступенчатого исследования, включающего в себя большое количество высокотехнологичных лабораторных этапов и промежуточного контроля качества. В результате получается большой массив генетических данных, требующих отдельного анализа и интерпретации с помощью методов биоинформатики, на что тоже необходимо время.
Как выглядит заключение
Формат итогового заключения включает в себя описание результатов исследования и даёт следующую информацию:
у здорового человека – список патогенных и вероятно патогенных мутаций, их описание и интерпретация. Мутации с неизвестным клиническим значением в заключение не выносятся в связи с серьёзными сложностями их дальнейшей клинической интерпретации у здорового человека и низкой информативностью для дальнейших диагностических мероприятий.
у пациентов с диагностированным раком – список патогенных, вероятно патогенных мутаций и мутаций с неизвестным клиническим значением, их описание и интерпретация с точки зрения клинической значимости.
Заключение отправляется заказчику по электронной почте. Если есть необходимость получить заключение в бумажном варианте, мы отправим его в любой регион почтой России без дополнительных расходов для заказчика.
Что делать, если мутации выявлены?
После выполнения исследования, анализа данных и оформления заключения вы получите информацию о наличии мутаций, ассоциированных с наследственными формами рака толстой кишки и эндометрия и наследственными опухолевыми синдромами, связанными с повышенным риском развития рака молочной железы и рака яичников. В случае обнаружения мутаций возможны следующие варианты дальнейших действий:
- обсуждение выявленных мутаций с врачом-генетиком (есть возможность онлайн консультации) с целью клинической интерпретации полученных результатов;
- обсуждение с врачом-онкологом плана профилактических (УЗИ, колоноскопия, биопсия эндометрия, МРТ и т.д.) и превентивных (гистерэктомия, колэктомия) мероприятий у здорового человека;
- обследование ближайших кровных родственников на наличие мутаций для выявления носительства методом секвенирования по Сэнгеру;
- обсуждение с врачом-генетиком возможностей планирования беременности для рождения здорового потомства (пренатальная диагностика, ПГД) у пациентов детородного возраста;
- уточнение диагноза и прогноза у пациентов с диагностированным раком;
- выбор стратегии и тактики лечения у пациентов с диагностированным раком.
При этом у здорового человека появится возможность ранней диагностики или даже предотвращения развития опухолевого процесса, обусловленного наличием единичной мутации или парных мутаций, а у пациента с диагностированным раком в случае выявления мутаций может быть больше вариантов для эффективного лечения.
Стоимость исследования
Нам удалось достичь минимальной цены для исследования такого уровня и такого охвата. Стоимость панели составляет 35 000 рублей. При этом все возможные логистические издержки (доставку биоматериала из других городов, отправку заключений) мы берём на себя без дополнительных затрат со стороны обследуемого. Выгрузка сырых данных в указанную стоимость не входит.
Рекомендации
Это максимально полная панель в России, охватывающая наибольшее количество генов (всего – 207), мутации в которых наблюдаются при различных наследуемых злокачественных опухолях.
Хотя эндометриоз с участием сигмовидных сероз нередко встречается у женщин детородного возраста, участие слизистых является редким, а дифференциальный диагноз рака толстой кишки может быть затруднен из-за отсутствия патогномонических симптомов и плохой диагностической отдачи от колоноскопии и биопсии толстой кишки.
Мы представляем случай с молодой женщиной с сигмовидным эндометриозом, при которой в начальной диагностической работе предполагался рак толстой кишки. Гистологические данные, полученные из второй колоноскопии, наряду с результатами тазобедренного ультразвука привели к окончательному диагнозу эндометриоза кишечника, который был подтвержден лапароскопией.
Эндометриоз толстой кишки часто является диагностическим вызовом и должен рассматриваться у молодых женщин с симптомами нижнего желудочно-кишечного тракта.
Экстралептический эндометриоз относится к эндометриотическим имплантатам, расположенным в другом месте тела, включая желудочно-кишечный тракт, мочевую систему, легочную систему, ЦНС, кожу и поперечнополосную мышцу [1,2]. Точная распространенность экстрапельного эндометриоза неизвестна. Медианный возраст на момент диагноза составляет от 34 до 40 лет. Периодическая гематоцезия во время менструации является признаком, обычно связанным с эндометриозом кишечника [3]. Тем не менее, этот катаманский характер кровотечения и всех других сопутствующих симптомов очень часто отсутствует, что делает историю болезни весьма ошибочной [4]. Более того, дифференциальная диагностика эндометриоза толстой кишки от других заболеваний толстой кишки является довольно сложной из-за отсутствия патогномонических симптомов и плохого диагностического выхода колоноскопии и биопсий толстой кишки.
В этом отчете мы представляем случай молодой женщины с эндометриозом кишечника, в которой первоначальная диагностическая работа предполагает рак толстой кишки.
35-летнюю женщину поместили в отделение гастроэнтерологии из-за ректального кровотечения и приступов боли в животе. За девять месяцев до поступления у пациента началось ректальное кровотечение, связанное, во-первых, с менструальными циклами. Она также сообщила о эпизодах тяжелой боли в нижней части живота, которая не соответствовала ее менструации и сопровождалась вздутием живота и запорами, особенно в течение последних двух месяцев. За три недели до приема у нее началось почти ежедневное лечение гематоцезии и табуретов небольшого калибра.
У пациента был ее менархе в возрасте 13 лет. После этого у нее были 27-дневные 28-дневные менструальные циклы и менструальные периоды продолжительностью 6-7 дней с нормальной кровопотери. У нее было два нормальных родов в возрасте 22 и 25 лет. Из ее прошлой истории болезни она сообщила о тонзилэктомии в возрасте 11 лет и аппендиксэктомии в возрасте 18 лет. Она также сообщила о сокращении болей в животе, сопровождающих менструацию в течение последних трех лет. Ее отец страдал гипертонией. Ее мать была здоровой, не сообщая о предыстории эндометриоза или миомате матки. Ее брат тоже был здоров.
Физическое обследование показало умеренную нижнюю брюшную нежность. Никаких масс не было пальпировано. Звуки кишечника были слегка увеличены. Ректальное обследование показало ярко-красную кровь, но не имела выраженной массы. На гинекологическом обследовании ее вульва, влагалище и шейка матки оказались нормальными. Ее матка имела нормальный размер и была антеверта. Лабораторная работа показала умеренную анемию (Hb: 11,3 г / дл, Hct: 34,5%, MCV: 91,7 fL) с увеличением количества белых кровяных телец (12000 / мкл: нейтрон: 80,8%, лимфа: 12,1%, моно : 4,6%) и СОЭ: 36 мм. Параметры коагуляции, сывороточная мочевина, креатинин, электролиты и тесты функции печени были в нормальном диапазоне.
Колоноскопия выявила обширное полиповидное поражение слизистой оболочки, на ректосигмоидном переходе, а также эритему, отек и изъязвление, которые привели к стенозу просвета. Эндоскоп не мог быть введен за пределы поражения. Гистология вышеупомянутого поражения продемонстрировала умеренное расширение склепов без разрушения кубиков. Ламиновая пропия была отечной с расширенными капиллярами и воспалительными инфильтратами лимфоцитов и плазматических клеток. Бариальная клизма (рисунок 1) на следующий день показала стеноз ректосигмоидной области из-за дефекта заполнения и внешнего уплотнения кишечника. Остальная толстая кишка была нормальной. Абдоминальная КТ, полученная двумя днями позже, показала утолщение эксцентриковой стенки сигмоида и подтвердила дефект заполнения. Кроме того, он показал кисты яичников (рис. 2,3).
Бариальная клизма, показывающая стеноз ректосигмоидной области из-за дефекта заполнения и внешнего уплотнения кишечника.
Эксцентриковая утолщение стенки сигмоида с дефектом заполнения. Обратите внимание также на кисты яичников
Эксцентриковая утолщение стенки сигмоида с дефектом заполнения. Обратите внимание также на кисты яичников
Из-за большого подозрения на рак толстой кишки в течение 20-го дня менструального цикла была проведена новая колоноскопия, чтобы получить больше образцов биопсии. На этот раз гистология толстой кишки показала строму и железы эндометрия, вызывающие эндометриоз (рис. 4).
Слизистая оболочка толстой кишки с фокусом эндометриоза в пробах ламины (строма и железы эндометрия). Гематоксилин Eosin × 100
Наследственный неполипозный рак толстой кишки (ННПРТК, синдром Линча I/II, синдром Х) — наиболее распространенная форма наследственного колоректального рака (КРР). В основе — аутосомно-доминантная мутация в генах репарации ошибочно спаренных оснований ДНК: hMLH1 или hMSH2 (90% мутаций в семьях с ННПРТК), hMSH6 (7-10%), PMS1 и PMS2 (5%).
а) Эпидемиология наследственного неполипозного рака толстой кишки (ННПРТК):
• Случаи заболевания составляют 3-5% от всего колоректального рака (КРР). ННПРТК: аутосомно-доминантное заболевание с пенетрантностью гена -80% и ускоренной последовательностью аденома — рак (2-3 года).
• Пожизненный риск развития рака толстой кишки отмечается приблизительно в 80% случаев, рака эндометрия — в 40-60%, рака мочевыводящих путей — в 18-20%, рака яичников — в 9-12%. Риск развития метахронного колоректального рака составляет 45% (после сегментарной резекции, 10-15% — после колэктомии с илеоректальным анастомозом); 70% опухолей расположены проксимальнее селезеночного изгиба.
б) Симптомы. Развитие колоректального рака (КРР) (и сопутствующих опухолей) в молодом возрасте. Симптомы отсутствуют или не отличаются от симптомов спорадического колоректального рака (КРР).
в) Дифференциальный диагноз наследственного неполипозного рака толстой кишки (ННПРТК):
• Другие варианты наследственного рака: САТК, МАП.
• Семейный КРР без идентификации мутантного гена.
• Макроскопическое исследование: ограниченное число полипов (часто плоских), в основном, в правых отделах (т.е. проксимальнее селезеночного изгиба).
• Микроскопическое исследование: обычно малодифференцированная аденокарцинома с медуллярным ростом, перстневидноклеточным и слизистым строением.
Микросателлитная нестабильность (MSI): 90-95% опухолей при ННПРТК MSI+, высокая частота MSI (изменения в двух и более из пяти панелей) по сравнению с 15-20% MSI+ при спорадическом КРР.
д) Обследование при наследственном неполипозном раке толстой кишки (ННПРТК)
Необходимый минимальный стандарт:
• Выявление/лечение членов семьи с риском развития ННПРТК (у всех больных): запись в истории болезни о консультации и информировании пациента относительно данного заболевания (внимание: возможность судебного иска!)
Пациенты без симптомов/члены семьи при наличии семейного анамнеза:
• Семейный анамнез, генетическая консультация/тестирование (если не выполнено).
• Ежегодные колоноскопии, начиная с 25-летнего возраста (не позднее 10-15 лет с момента выявления рака у наиболее молодого члена семьи).
• Женщины: ежегодное исследование аспирата эндометрия.
• Скрининг других внекишечных опухолей: четкие рекомендации отсутствуют => в зависимости от семейных особенностей. При наличии рака, полипа с высокой степенью дисплазии или при увеличивающемся числе полипов => операция.
Больные колоректальным раком (КРР) моложе 50 лет:
• Семейный анамнез: Амстердамские критерии? Семья не соответствует критериям, если доказанность ННПРТК около 50%.
• Генетическое тестирование: критерии Бетезда?
• Идентификация/лечение членов семьи с риском развития ННПРТК: запись в истории болезни о консультации и информировании пациента относительно данного заболевания (внимание: возможность судебного иска!)
• Индивидуальная программа обследования для выявления КРР до операции.
Дополнительные исследования (необязательные) — такие же, как и при колоректальном раке (КРР).
е) Классификация наследственного неполипозного рака толстой кишки (ННПРТК):
• Амстердамские критерии II: примерно в 50% семей, соответствующих критериям, выявляется ННПРТК.
• Критерии Бетезда МSI+, MSI-.
• Линч I: только колоректальный рак (КРР).
• Линч II: КРР и рак внекишечной локализации.
• Синдром Мюир — Торре: наследственный колоректальный рак (КРР) с опухолями сальных желез кожи.
• Синдром X: семейный колоректальный рак (КРР) неопределенного типа; выраженный семейный анамнез только колоректальный рак (КРР) (соответствует Амстердамским критериям, MSI- , нормальный ген ММР), более типична левосторонняя локализация, опухоли неслизеобразующие, немультифокальные, средний возраст выявления — 50 лет.
ж) Лечение без операции наследственного неполипозного рака толстой кишки (ННПРТК):
• Химиопрофилактика: роль не определена.
• Ежегодные колоноскопии и полипэктомии.
• В зависимости от стадии опухоли: адъювантная химиотерапия (рак толстой кишки), или (нео-) адъювантная химиолучевая терапия (рак прямой кишки).
з) Операция при наследственном неполипозном раке толстой кишки (ННПРТК)
Показания:
• Любой рак, прогрессирующая аденома (большой размер или дисплазия высокой степени) либо увеличение числа полипов, за исключением случаев множественных метастазов или абсолютных противопоказаний.
Хирургический подход:
• Субтотальная резекция ободочной кишки (лечебная + профилактическая): рекомендована при всех опухолях, расположенных проксимальнее сигмовидной кишки, за исключением случаев отказа больного или наличия противопоказаний к операции, связанной со значительным укорочением толстой кишки.
• Сегментарная колоректальная резекция: только с лечебной целью в соответствии с онкологическими принципами.
• Рак прямой кишки при ННПРТК: низкая передняя резекция (с/без неоадъювантной химиолучевой терапии), профилактическая проктоколэктомия обычно не рекомендуется из-за полной утраты функции прямой кишки.
• Женщины (в частности, при наличии семейного анамнеза рака матки или мутации в hMSH6 или в hMLHl и hMSH2): обсуждение вопроса о гистерэктомии/овариоэктомии (в пострепродуктивном периоде, при наступлении менопаузы или во время других абдоминальных вмешательств).
и) Результаты. Несмотря на худшие патоморфологические признаки при ННПРТК, влияние микросателлитной нестабильности (MSI) на ответ при химиотерапии по сравнению со спорадическим колоректальным раком (КРР) при сопоставлении в соответствии со стадией, все еще дискутабельно.
к) Наблюдение. Непрерывное ежегодное наблюдение/скрининг колоректального рака (КРР) и внекишечных опухолей => ежегодная полная колоноскопия, сигмоидоскопия (после операции), исследование аспирата эндометрия.
Об этом мы поговорили с онкогинекологом, хирургом Владимиром Носовым, руководителем Клиники гинекологии и онкогинекологии Eвропейского медицинского центра – первой клиники в России, где персонализированная терапия онкогинекологических заболеваний стала стандартной практикой.
В своём нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от опухолевого перерождения. Если возникает мутация в этих генах, здоровые клетки оказываются не защищенными и сами могут становиться злокачественными. Вероятность заболеть раком груди при носительстве мутации гена BRCA 1/2 колоссальная — до 80%(в общей популяции у женщин без мутации — около 10-12%), риск заболеть раком яичников — до 40-45 %( в популяции —около 1,5%) .
В большинстве случаев назначение этих препаратов после первой линии химиотерапии обеспечивает ремиссию около 3 лет – это огромное достижение, еще никогда в онкогинекологии ремиссия при 3-4 стадии заболевания не продлевалась каким-либо лекарством на столь длительный срок.
Дальнейшие исследования позволили выяснить, что мутации могут быть не только герминогенными, то есть присутствующими во всех клетках организма. Дополнительные 15-20% мутаций генов BRCA происходят только в клетках опухоли, но в крови и других клетках организма их нет. Эти мутации называют соматическими. Они не передаются по наследству, не увеличивают риск развития других онкологических заболеваний, но пациенты, у которых обнаружены мутации в клетках опухоли, также являются кандидатами для лечения ингибиторами PARP.
В Институте онкологии EMC мы предлагаем всем пациентам с раком яичников провести полное секвенирование генов BRCA опухоли и крови. Это позволяет подобрать наиболее эффективную персонализированную терапию. Если речь идет о наследственной мутации – мы рекомендуем в обязательном порядке генетическое обследование детям, сестрам, братьям, родителям, а самим пациенткам-носителям мутации – также пройти дополнительный скрининг на рак молочных желез, риски которого колоссально повышены.
Плохое наследство
Наследственная мутация передается детям с вероятностью 50%, причем как по женской, так и по мужской линии. Носителям мы рекомендуем специальную программу наблюдения и профилактические мероприятия для снижения риска онкологических заболеваний, а также обсуждаем с ними вопросы сохранения репродуктивной функции.
Например, на днях я оперировал пациентку 57 лет с раком яичника. На плановой гистологии был подтвержден злокачественный характер опухоли. Мы провели генетическое исследование опухоли, выявили мутацию BRCA1. Затем было выполнено полное генетическое исследование по крови, чтобы понять, является ли мутация соматической (присутствующей только в опухоли) или герминогенной (наследственной). Выяснилось, что мутация наследственная. Мы рекомендовали пройти обследование двум дочерям пациентки, которые, к сожалению, унаследовали эту мутацию. Женщины-близнецы, им сейчас 31 год, обе еще не планировали беременность и роды. Я рекомендовал им обратиться к репродуктологу, провести стимуляцию и заморозить яйцеклетки, а в 35 лет, именно с этого возраста риски рака яичников начинают расти, удалить профилактически яичники и маточные трубы. В этом случае мы сохраняем матку, и в будущем они смогут выносить своих биологических детей.
Более того, во время ЭКО можно провести предимплантационную диагностику и подсадить эмбрионы, не унаследовавшие мутацию. Таким образом, будущее поколение уже будет защищено.
Рак эндометрия (рак тела матки) – самое распространенное онкогинекологическое заболевание у женщин. Сегодня подходы к его лечению также меняются благодаря персонализированной терапии.
До недавних пор считалось, что существует два типа рака эндометрия. Наиболее частый, первого типа, обычно возникает у полных пациентов, часто с сопутствующими диабетом и гипертонией. Второй – серозный, более агрессивный, не связанный с избытком эстрогенов. На основании клинической картины врачи принимали решение о необходимости дополнительного лечения после операции. Сегодня, благодаря лучшему пониманию биологии опухоли, мы знаем, что этих типов не два, а четыре. И для каждого из них предусмотрено определенное лечение. Чтобы определить, с каким типом рака эндометрия мы имеем дело, достаточно для начала провести иммуногистохимическое исследование.
Каждую опухоль эндометрия вне зависимости от стадии, мы тестируем на наличие определенных молекул, указывающих на благоприятный или менее благоприятный прогноз заболевания. Например, наличие мутации гена P53 говорит о менее благоприятном прогнозе. В этом случае мы рекомендуем не только наблюдение, но и дополнительное лечение с помощью химио-или лучевой терапии.
Некоторые раки матки, так же, как и некоторые раки яичников и молочной железы, имеют в своей основе генетический синдром – синдром Линча. Если мы находим проявления синдрома Линча в опухоли, мы направляем пациентов на полноценное генетическое тестирование. Это важно, потому что рак матки – не единственное заболевание, к которому предрасположены носители мутаций, вызывающих синдром Линча. В частности, у них повышен риск рака толстой кишки в молодом возрасте.
Часто первым возникает рак матки, через какое-то время развивается рак толстой кишки.
Поэтому носителям синдрома Линча рекомендуют начинать скрининг на рак кишки не в 45-50, а гораздо раньше — с 30 лет и делать колоноскопию раз в 6 или 12 месяцев, чтобы не пропустить развитие заболевания.
Выявление синдром Линча у пациентки с раком матки может повлиять и на лечение.
При поздних стадиях пациентам с синдромом Линча мы назначаем специфическую иммунотерапию препаратом пемпролизумаб, что позволяет улучшить прогнозы пациентов.
Генетическое профилирование опухоли – это колоссальный прорыв, который позволил нам подойти к полностью персонализированной терапии в онкологии, основанной не только на диагнозе, но и на понимании биологии опухоли. Для пациентов — это возможность получить точное узкоспециализированное лечение, дающее лучшие результаты, а в случае наследственных раков — возможность защитить будущие поколения от опасных заболеваний.
Этиология и встречаемость наследственного неполипозного рака кишечника. По крайней мере, у 50% индивидуумов в западных популяциях к 70 годам развиваются колоректальные опухоли, и приблизительно у 10% из них, в конечном счете, развивается колоректальный рак.
Наследственный неполипозный рак кишечника (ННРК) (MIM №120435) — генетически разнородный аутосомно-доминантный синдром предрасположенности к раку, часто вызывается мутациями в генах репарации неспаренных оснований ДНК. Наследственный неполипозный рак кишечника (ННРК) встречается с частотой 2-5 на 1000, что составляет приблизительно 3-8% колоректального рака.
При большинстве колоректальных опухолей, включая САП, кариотип опухоли прогрессивно становится все более анеуплоидным. Приблизительно 13-15% колоректальных опухолей не имеет такой хромосомной нестабильности, но имеет инсерцию или делецию в повторяющихся последовательностях (микросателлитная нестабильность). Микросателлитную нестабильность обнаруживают в 85-90% опухолей при наследственном неполипозном раке кишечника.
В соответствии с этим наблюдением, приблизительно 70% семей наследственным неполипозным раком кишечника с карциномами, имеющими микросателлитную нестабильность, наследуют мутации в одном из шести генов репарации неспаренных оснований ДНК: MSH2, MSH6, MLH1, MLH3, PMS1 или PMS2.
Репарация ДНК в неспаренных основаниях уменьшает ошибки репликации в 1000 раз. Ошибки синтеза ДНК вызывают неправильное спаривание нитей и деформируют двойную спираль ДНК. Комплекс белков репарации организует разные ферменты для восстановления повреждений. Используя вырезание длинных участков, этот комплекс удаляет ошибочный фрагмент вновь синтезированной нити ДНК и затем вновь синтезирует его.
Чтобы вызывать микросателлитную нестабильность, должны потерять свою функцию оба аллеля гена репарации ДНК. Высокая частота соматической утраты функции второго аллеля приводит к тому, что наследственный неполипозный рак кишечника наследуется как аутосомно-доминантная болезнь приблизительно с 80% пенетрантностью. Соматическая утрата функции может происходить за счет потери гетерозиготности, внутригенных мутаций или гиперметилирования.
При наследственном неполипозном раке кишечника количество мутантных микросателлитных локусов нарастает по мере перехода из аденомы в карциному. Инактивация генов, содержащих микросателлитные последовательности, может играть ключевую роль в развитии рака. Например, микросателлитная нестабильность порождает мутации типа сдвига рамки в гене рецептора фактора роста II (TGFBR2).
Мутации в гене TGFBR2 приводят к утрате экспрессии белка TGF(3RII, и, поскольку система TGFP тормозит рост эпителиальных клеток толстого кишечника, переходу к неуправляемому росту. В поддержание концепции о роли гена TGFBR2 при наследственном неполипозном раке кишечника описана одна семья без мутаций в генах репарации ДНК, но с наследуемой мутацией в гене TGFBR2. Мутации гена TGFBR2 встречаются на ранних этапах наследственного неполипозного рака кишечника и могут содействовать росту аденом.
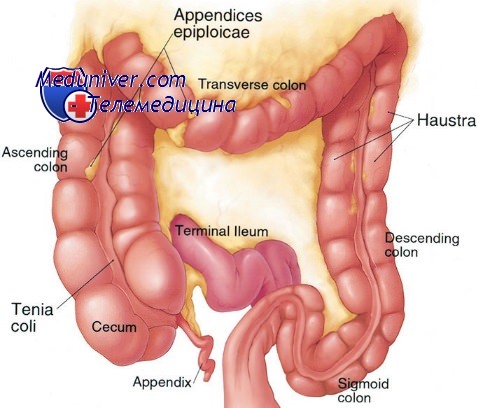
Хотя у больных ННРК число полипов аналогично общей популяции, они развиваются в более молодом возрасте. Средний возраст установки диагноза колоректальной аденокарциномы меньше 50 лет, т.е. на 10-15 лет раньше, чем в общей популяции. Больные наследственным неполипозным раком кишечника (ННРК) и известной унаследованной мутацией имеют 80% риск развития колоректальной опухоли в течение всей жизни.
От 60 до 70% аденом и карцином при наследственном неполипозном раке кишечника (ННРК) развивается между селезеночным углом и илеоцекальным соединением, в то время как большинство спорадических колоректальных опухолей (а также опухоли при САП) развиваются в нисходящем отделе толстой кишки и сигмовидной кишке. Карциномы при ННРК реже имеют хромосомную нестабильность и ведут себя менее активно, чем спорадический рак кишечника; спорадические опухоли и карциномы при САП часто могут быть анеуплоидными и более энергичными.
По этой причине больные наследственным неполипозным раком кишечника (ННРК) имеют лучший прогноз (с учетом стадии и возраста), чем больные с САП или колоректальными опухолями с хромосомной нестабильностью.
Помимо колоректального рака, при наследственном неполипозном раке кишечника (ННРК) возможны и другие опухоли, включая рак желудка, тонкого кишечника, поджелудочной железы, почек, эндометрия и яичников; опухоли легкого и молочной железы с наследственным неполипозным раком кишечника (ННРК) не связаны. Пациенты с наследственным неполипозным раком кишечника (ННРК) и известной унаследованной мутацией в течение жизни имеют более 90% риска развития колоректального рака или одной из таких опухолей.
Особенности фенотипических проявлений наследственного неполипозного рака кишечника:
• Возраст начала: средний
• Колоректальный рак
• Многочисленные первичные опухоли
Диагноз наследственного неполипозного рака кишечника (ННРК) устанавливают на основе семейного анамнеза; пациенты не имеют различий в симптоматике. Минимальные критерии, позволяющие предположить наследственный неполипозный рак кишечника (ННРК) как причину случая колоректального рака или другой опухоли, — наличие наследственного неполипозного рака кишечника (ННРК) у трех членов семьи, по крайней мере, два из которых — первой степени родства, не менее чем в двух поколениях, причем развитие колоректальной опухоли, по крайней мере, у одного из больных должно произойти до 50 лет.
У пациентов без семейного анамнеза, но с рано появившимся колорек-тальным раком показан ДНК-анализ клеток опухоли, позволяющий обнаружить микросателлитную нестабильность. Для диагностики применяют также иммуно-гистохимическое выявление белков MLH1 и MSH2. Раннее распознавание наследственного неполипозного рака кишечника (ННРК) необходимо для эффективного вмешательства; колоноскопический контроль проксимальных отделов толстой кишки, начатый в возрасте 25 лет, увеличивает ожидаемый срок жизни на 13,5 года, а профилактическое хирургическое удаление кишечника в возрасте 25 лет увеличивает ожидаемый срок жизни на 15,6 года.
Биопсия эндометрия и абдоминальное УЗИ у женщин группы риска не показали эффективности в предупреждении рака матки, встречающегося при этом заболевании. В семьях с известными унаследованными мутациями идентификация мутаций в генах репарации ДНК помогает сфокусировать внимание на конкретных членах семьи, но если мутация неизвестна, это не отрицает потребности в частых осмотрах.
Эмпирический общепопуляционный риск развития колоректального рака — 5-6%. Этот риск заметно изменяется в зависимости от семейного анамнеза. Относительный риск для пациентов, имеющих родственников первой степени с колоректальным раком, выше популя-ционного в 1,7 раза; он возрастает в 2,75 раза, если коло-ректальный рак наблюдали у двух и более родственников первой степени родства. Если опухоль у такого родственника развилась до 44 лет, относительный риск возрастает более чем в 5 раз.
Обратите внимание, что пациент с унаследованной мутацией генов репарации неспаренных оснований ДНК имеет 50% риск родить ребенка, несущего ту же мутацию. Все дети, получившие такую мутацию, имеют приблизительно 90% риск развития опухолей в течение жизни, принимая пенетрантность наследственного неполипозного рака кишечника (ННРК) за 80%, плюс фоновый общепопуляционный риск опухолей кишечника и других опухолей, связанных с наследственным неполипозным раком кишечника (ННРК) (желудка, тонкой кишки, поджелудочной железы, почек, эндометрия, яичников).
Пренатальная диагностика очень спорная и не входит в стандартные рекомендации, но теоретически возможна, если известна наследуемая мутация у родителя. Из-за неполной пенетрантности и варьирующей экспрессивности тяжесть и возраст появления рака кишечника и других опухолей предсказать невозможно.
Пример наследственного неполипозного рака кишечника. П.П., 40-летняя женщина, бухгалтер, мать троих детей, направлена в клинику онкогенетики лечащим врачом для консультации относительно ее семейного анамнеза опухолей. У ее отца, брата, племянника, племянницы, дяди по отцу и бабушки по отцу развился колоректальный рак.
В анамнезе у пациентки не было терапевтических или хирургических проблем. Данные медицинского осмотра оказались нормальными. Генетик объяснил женщине, что ее семейный анамнез напоминает наследственный неполипозный рак кишечника, и наиболее эффективный способ определить генетическую причину рака в ее семье — молекулярный анализ живого больного члена семьи.
После обсуждения с племянницей, единственной выжившей из больных членов семьи, женщина и племянница вернулись в клинику для обследования. Анализ архивного образца ткани опухоли, удаленной из кишечника, выявил микросателлитную нестабильность; последующее секвенирование ДНК из образца крови, полученного от племянницы, обнаружило наследуемую мутацию в гене MLH1. Сама пациентка не имела данной мутации; в связи с этим генетик заключил, что риск для нее самой и ее детей по развитию рака кишечника равен общепопуляционному.
Однако оказалось, что у ее здорового брата мутация есть, и ему рекомендован постоянный ежегодный колоноскопический контроль.
Читайте также:

