Радиоактивные лекарства от рака

У пациентов с неоперабельным гепатоцеллюлярным раком печени появился шанс на хирургическое удаление злокачественной опухоли и, как следствие, на излечение. В Медицинском радиологическом научном центре им. А.Ф. Цыба, филиале НМИЦ радиологии Минздрава РФ прошел первый этап нового для России метода лечения — радиоэмболизации печени. Он признан самым эффективным при этом заболевании и позволяет значительно увеличить продолжительность жизни пациентов по сравнению с теми, кто получил традиционную терапию. В мире радиоэмболизация входит в стандарт лечения, но у нас этот метод до сих пор не внедрен.
Основной метод лечения этого вида рака — радикальная операция. Но проблема в том, что только 20% от общего числа таких пациентов могут быть излечены хирургическим способом. Для всех остальных (у кого опухоль больше 5 см) приходится применять менее эффективные методы лечения, и продолжительность жизни в таком случае составляет 6–18 месяцев.

На сегодня в распоряжении врачей помимо хирургического метода есть еще пять способов лечения, среди которых системная химиотерапия, радиочастотная деструкция и дистанционная лучевая терапия. Все они имеют определенные противопоказания.
Суть радиоэмболизации в том, что в сосуды опухоли вводят радиофармпрепарат Иттрий 90, являющийся источником бета-излучения. Он блокирует кровоснабжение опухоли и разрушает ее изнутри. Такая операция высокоэффективна и малотравматична, а окружающие здоровые ткани практически не страдают.
— С помощью радиоэмболизации при лечении рака печени 2–3-й стадии чаще получается добиться стабилизации процесса и уменьшить объем опухолевой ткани. Это позволяет увеличить продолжительность жизни пациента, понизить стадию заболевания. После возможны традиционная операция и излечение, — сказал Валерий Кучеров. — Метастатические поражения печени тоже достаточно успешно лечатся с помощью радиоэмболизации. А их дают 70–75% всех онкологических заболеваний, ведь печень — это самый уязвимый при раке орган человека.
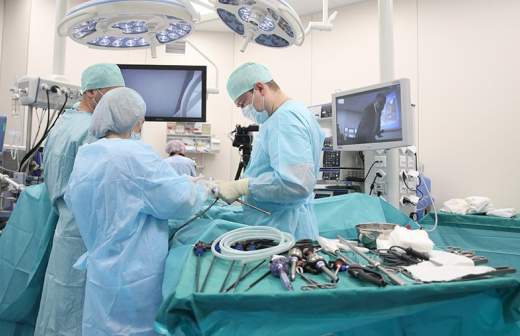
В России до сих пор радиоэмболизация печени, как стандарт лечения гепатоцеллюлярного рака, не выполнялась по нескольким причинам. Необходимые для нее микроисточники радиоактивного излучения (микросферы) производятся в Канаде и Австралии, а короткий период полураспада препарата осложняет их доставку. К тому же стоимость импортных микросфер очень высока. Кроме того, медучреждениям нужна специальная лицензия на такие операции и высококвалифицированный персонал.
Процедура радиоэмболизации состоит из двух частей. Сначала проводится диагностическая операция. Во время нее пациенту вместо микросфер с радионуклидами Иттрия-90 вводится технеций. При этом оценивается состояние печени и проводится проверка структуры сосудов. Операция позволяет определить, подходит ли пациент для радиоэмболизации, нет ли опасности повредить здоровые ткани или другие органы.
15 марта в МРНЦ им. А.Ф. Цыба провели именно такую подготовительную операцию в форме мастер-класса. На него пригласили ведущих хирургов центра, а также заведующего отделением интервенционной радиологии Anadolu Medical Center In Affilation with Johns Hopkins Medicine (Турция) доктора Ахмета Мурата Докдока. По его словам, процедура радиоэмболизации была одобрена комиссией FDA в 1999 году.
Доктор медицинских наук Мурат Дёкдёк

Второй этап операции — собственно введение микросферы с Иттрием 90 — проведут точно таким же образом, как и первый, через две недели.


Наш эксперт – заведующий отделением радиохирургического лечения открытыми радионуклидами Медицинского радиологического научного центра им. А. Ф. Цыба, доктор медицинских наук Валерий Крылов.
Жертвы моды


Стрельба по мишеням
Впрочем, несмотря на опасность радиации для здоровья, врачи не утратили интереса к её применению. Ведь если радиация способна убивать клетки, то, значит, она может воздействовать и на опухоль. Однако долгое время оставался открытым вопрос: как справиться с опухолью, но уберечь пациента от вреда, который причиняет радиация? Со временем ответ был найден – нужно доставить радиоактивные элементы непосредственно к опухоли и тем самым снизить воздействие радиации на весь организм.
Первые эксперименты начались ещё в 40‑е годы прошлого века. Тогда радиоактивные изотопы йода стали применять для лечения метастазов рака щитовидной железы. Этот метод и сейчас является не просто эффективным, а во многих случаях и безальтернативным.
Его суть состоит в том, что клетки щитовидной железы избирательно поглощают йод. Это относится как к здоровым клеткам, так и поражённым раком. Задача состоит в том, что надо обмануть клетки опухоли. Сначала следует хирургическим путём удалить щитовидную железу вместе с опухолью и поражёнными регионарными лимфоузлами. Затем нужно создать в организме дефицит гормонов щитовидной железы и йода. Дело в том, что клетки щитовидной железы нуждаются в йоде, чтобы вырабатывать гормоны. Клетки дифференцированного рака щитовидной железы тоже активно поглощают йод. И для уничтожения опухолевых клеток в организм пациента вводят не просто йод, а его радиоактивную форму. Поскольку клетки опухоли не способны отличить обычный йод от радиоактивного, они поглощают ядовитый элемент и гибнут. При этом, в каком бы органе ни оказались метастазы, радиоактивный йод отыщет и уничтожит опухолевую клетку. Для организма в целом такое лечение достаточно безопасно, поскольку в клетки, которые не относятся к щитовидной железе и не занимаются строительством соответствующих гормонов, йод не попадает. Получается, что при помощи радионуклидной терапии ведётся не огонь по большим площадям, а прицельная стрельба по мишеням.

Найти и уничтожить
Позже радионуклидную терапию стали применять и при лечении других видов рака. Например, при костных метастазах при раке предстательной железы. Дело в том, что опухоли простаты приводят к появлению костных метастазов в 90% случаев. А это страшные боли, резкое снижение качества жизни, а в конечном итоге и сокращение продолжительности самой жизни.
Изотоп радия благодаря химическому сходству с кальцием встраивается в костную ткань в метастазах и, воздействуя на них, повреждает как опухолевые клетки, так и клетки, вызывающие разрушение костной ткани. Это позволяет не только уменьшать боль, но и подавлять рост метастазов.
На сегодняшний день лечение костных метастазов изотопами радия считается одним из самых безопасных. Радий очень избирательно воздействует на опухолевую ткань благодаря своему мощному альфа-излучению. При этом практически не повреждается костный мозг, поскольку длина пробега альфа-частиц такова, что они не достигают костного мозга.
Препараты вводятся в организм внутривенно. Лечение может выполняться в амбулаторных условиях.

Ядерная терапия — одна из форм лучевой терапии, использующая пучки высокоэнергетических протонов, нейтронов или β-активных ионов для лечения рака.
Виды и методы ядерной терапии в онкологии
В настоящее время существует несколько видов ядерной терапии.
- Протонная терапия рака.
- Нейтронно-изотопная терапия.
- Терапия тяжелыми ионами.
- SIRS-терапия.
Основные методы ядерной терапии, используемые в клиниках за рубежом, — это протонная терапия, терапия тяжелыми ионами и SIRS-терапия.
Протонная терапия

Пучок протонов ускоряется с помощью циклотрона или синхротрона. Конечная энергия пучка возникающих частиц определяет глубину проникновения и, следовательно, местоположение максимальной энергии воздействия. Поскольку пучок легко отклонять с помощью электромагнитов в поперечном направлении, можно использовать метод растрового сканирования, то есть быстро перемещать луч по области мишени. А за счет того, что энергия пучка и, следовательно, глубина проникновения изменяются, весь объем мишени может быть покрыт в трех измерениях, обеспечивая облучение, точно соответствующее форме опухоли. Это одно из главных преимуществ данного метода по сравнению с обычной лучевой терапией.
В отличие от рентгеновских или гамма лучей, максимальная доза облучения протонами создается на строго определенном расстоянии от источника излучения. И после этого максимума излучение полностью иссякает.
Благодаря этому можно добиваться максимального воздействия именно в зоне опухоли, никак не затрагивая здоровые ткани, находящиеся за ней по ходу действия излучения.

- Минимальное воздействие на здоровые ткани.
- Снижение вероятности того, что облучение вызовет новый рак (вторичная опухоль).
- Максимально сильное воздействие на опухоль.
- Более широкий спектр показаний для применения.
Подтверждена эффективность протонной терапии при глиобластоме, раке прямой кишки и простаты.
Протонная терапия особенно показана для лечения:
- рака у детей;
- ряда редких видов рака у взрослых, для которых нет таргетного или иммунологического лечения, таких как опухоли у основания черепа, вблизи позвоночника или вблизи зрительного нерва.

Несмотря на то, что протонная терапия — самый безопасный метод терапии в онкологии, без определенных побочных эффектов и тут не обходится.
Все последствия метода можно разделить на два вида.
- Эффекты, связанные с воздействием протонов на здоровые ткани, расположенные перед опухолью по ходу пучка протонов — воспаление кожи, выпадение волос, зуд, онемение и высыпания в месте воздействия пучка.
- Эффекты, обусловленные разрушением опухоли, — общая интоксикация, повышение температуры, повышенная утомляемость, аллергические реакции.
Цена сеанса протонной терапии исчисляется тысячами (а порой и десятками тысяч) евро. Однако нередко это вполне оправдано, учитывая ее эффективность, а иногда и безальтернативность. Нюанс в том, что цена в разных центрах, где можно сделать протонную терапию, может отличаться очень сильно, и нужно очень внимательно отнестись к выбору конкретной клиники.

Терапия тяжелыми ионами
Углерод-ионная терапия использует более массивные частицы, чем протоны или нейтроны. Углеродно-ионная радиотерапия привлекает все большее внимание ученых, поскольку улучшаются технологические возможности, а клинические исследования демонстрируют ее преимущества лечения многих видов рака, таких как рак предстательной железы, глиобластома, саркомы костей и мягких тканей, местно-рецидивирующий рак прямой кишки.
Метод также имеет явные преимущества для лечения иным образом трудно поддающихся лечению гипоксических и радиоустойчивых форм рака.
К середине 2017 года более 15 000 пациентов прошли лечение по всему миру в 8 операционных центрах. В настоящее время действуют пять установок для лучевой терапии тяжелыми ионами (из них 2 в Европе), и существуют планы строительства еще нескольких установок в ближайшем будущем.
Все методы лечения тяжелыми частицами (протонами, ионными пучками) демонстрируют определенный максимум воздействия в определенной точке организма. Поэтому они обеспечивают максимальную летальную дозу в опухоли или рядом с ней. Это сводит к минимуму вредное излучение окружающих нормальных тканей.
Ионы углерода тяжелее протонов и, таким образом, обеспечивают более высокую относительную биологическую эффективность (ОБЭ). Их воздействие на клетки опухоли получается и более сильным, и более точным, что позволяет уничтожать максимальное количество атипичных клеток.

SIRS-терапия (СЭР-сферы)
SIR-сфера Y-90 — это полимерное искусственное медицинское микроустройство, используемое в селективной внутренней лучевой терапии для лечения неоперабельных опухолей печени.
Использование внешнего облучения для лечения опухолей печени ограничено высокой чувствительностью здоровой ткани печени к облучению. Селективная внутренняя лучевая терапия с использованием SIR-Spheres дает возможность доступа к лучевой терапии при неоперабельных первичных и вторичных опухолях печени, обеспечивая защиту здоровым клеткам.
Полимерные микросферы СЭР-сферы представляют собой наноимплантат одноразового использования. Они содержат изотоп иттрий-90 и имеют средний диаметр 32,5 микрон.
Иттрий-90 — высокоэнергетический бета-излучающий изотоп без первичной гамма-эмиссии. Максимальная энергия бета-частиц составляет 2,27 МэВ со средним значением 0,93 МэВ. Максимальный диапазон выбросов в ткани составляет 11 мм со средним значением 2,5 мм. Период полувыведения составляет 64,1 часа.
Эти свойства полимерных микросфер SIR-Spheres обуславливают то, что микросферы оседают преимущественно в микроциркуляторном русле, окружающем опухоль, максимизируя противоопухолевые лечебные эффекты и сводя к минимуму воздействие на здоровые клетки печени.
Ядерная терапия с использованием SIR-Spheres:
- удлиняет межрецидивные промежутки;
- повышает общую выживаемость;
- потенциально уменьшает размер опухоли перед операцией;
- смягчает симптомы заболевания.
СЭР-сферы можно комбинировать с современной химиотерапией или вводить в виде монотерапии. Также этот метод может быть использован в качестве альтернативы местной химиотерапии.
Узнайте больше о возможностях ядерной терапии. Напишите нам или закажите обратный звонок, мы предоставим вам всю необходимую информацию.
Новое лекарство успешно убивает рак и к тому же снижает риск развития устойчивости раковых клеток к лечению. Исследователи говорят о перспективности новинки, успешно прошедшей доклинические испытания.

Ученые уверены в перспективности новинки, успешно прошедшей доклинические испытания.
Лекарство-новинка решает сразу две проблемы
На сайте Женевского университета в Швейцарии сообщили о разработке многообещающего метода лечения рака, которое решает сразу две серьёзные проблемы терапии заболевания: резистентность клеток рака к препаратам и тяжёлые побочные эффекты химиотерапии. Новое лекарство получило название "С2".
Разработанный препарат, по сути, является сочетанием нескольких уже известных противораковых лекарств, используемых для химиотерапии, но в малых дозировках. Комбинация препаратов воздействует конкретно на раковые клетки, не трогая здоровые, что значительно снижает риск тяжёлых побочных эффектов химиотерапии, от которых страдает столько пациентов: тошнота, высокая температура, проблемы с пищеварением, боли, выпадение волос, анемия и прочие.
Принцип действия препарата
Принцип действия С2 строится на выявлении клеток с лишними центросомами, или клеточными центрами. У обычных клеток имеется две центросомы, для клеток опухоли же характерно наличие дополнительных центросом. Именно на них и нацелен разработанный швейцарцами препарат. По словам исследователей, С2 блокирует группы лишних центросом в раковых клетках, тем самым убивая всю клетку. Здоровые же клетки атаке не подвергаются. При этом лекарство значительно снижает риск развития устойчивости опухоли к лечению, давая надежду на то, что рецидива болезни не случится.
Четыре компонента, которые наиболее эффективны в борьбе с опухолью
Пытаясь найти подходящее эффективное сочетание препаратов, швейцарские учёные протестировали более двух сотен разнообразных комбинаций противоопухолевых лекарств. В результате было выявлено четыре компонента, отличавшихся наибольшей эффективностью в борьбе с опухолью. Эти вещества и стали основой разработанного препарата. В итоге в С2 вошли: CI-994, тубацин, дазатиниб и эрлотиниб.
При том, что в настоящий момент на рынке лекарств уже есть препарат, действующий примерно по тому же принципу, что и С2, авторы исследования утверждают, что новинка будет гораздо эффективнее. Дело в том, что имеющийся на рынке "Паклитаксел", действие которого тоже направлено на атаку лишних центросом в клетках рака, обладает наибольшей эффективностью только в очень больших дозировках, а приём данного средства сопряжён с тяжёлыми побочными эффектами для пациента. С2 же, основанный на комбинации низкодозированных препаратов, подобные эффекты убирает.
С2 уничтожает в двадцать раз больше опухолевых клеток
Разработанное лекарство уже прошло стадию доклинических испытаний и было протестировано на различных клеточных культурах. Эксперименты показали, что С2 уничтожает в двадцать раз больше опухолевых клеток, чем другие препараты, не трогая здоровые клетки.
Учёные предсказывают, что со временем С2 заменит на рынке "Паклитаксел" и поспособствует большей выживаемости и увеличит продолжительность жизни пациентов, однако этого ещё нужно дождаться. Новинке ещё как минимум предстоят клинические испытания и множество других тестов.
Встройте "Правду.Ру" в свой информационный поток, если хотите получать оперативные комментарии и новости:
Подпишитесь на наш канал в Яндекс.Дзен или в Яндекс.Чат
Добавьте "Правду.Ру" в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.
Эффект радиоизотопного лечения основывается на местном радиоактивном излучения препарата. Облучение воздействует на раковые клетки, разрушая их.

При изотопной терапии (радиоизотопное лечение, лечение изотопами, радионуклидное лечение, молекулярная лучевая терапия), пациенту внутривенно или перорально вводится радиоактивный препарат, который с помощью обмена веществ переносится к пораженному органу или ткани. В течение определенного времени препарат местно облучает пораженный участок. Планирование лечения пациента всегда является индивидуальным процессом, для которого необходимо наличие профессиональных знаний из различных специализированных областей.
Изотопная терапия становится всё более распространённой формой лечения различных онкологических заболеваний. Причиной этому стало то, что в настоящий момент разрабатывается всё большее количество радиофармпрепаратов, которые могут эффективно применяться в лечении рака. Например, при лечении лимфом используются радиоактивно маркированные антитела, т.е. контрастное вещество уничтожает раковую ткань с помощью излучения и выработки антител.
При всех видах радиоизотопного лечения необходимо проведение ОФЭКТ сканирования (однофотонно-эмиссионная компьютерная томография) и ПЭТ-КТ сканирования (позитронно-эмиссионная компьютерная томография). Данные исследования позволяют отследить накопление радиоактивного вещества в тканях, а также определить необходимую дозу препарата и спрогнозировать его эффективность. При лечении в ткань опухоли направляется достаточная доза облучения, контролируемая с помощью сканирования. В некоторых случаях для получения нужной дозы облучения необходимо проведение нескольких сеансов терапии.
Радионуклидное лечение нейроэндокринных опухолей
Редкие нейроэндокринные опухоли можно лечить с помощью короткого излучения, переносящегося к тканям с помощью пептидов. На сегодняшний день в странах Северной Европы при лечении нейроэндокринных опухолей рекомендуется радиоизотопная терапия. Совсем недавно радиоизотопное лечение стало использоваться при лечении рака поджелудочной железы, рака печени и рака предстательной железы.
Радионуклидное лечение метастазов в костной ткани
С помощью радиоактивных фармпрепаратов возможно лечение болевого синдрома при распространенном метастазировании рака в костную ткань. При таком лечении радиофармпрепарат воздействует на участки около метастазов (в этих участках происходит повышенный обменом веществ).
– Бета-излучатель Sm-153 (Самарий). Воздействие основано на возросшем метаболизме фосфора в метастазе скелета. Препарат воздействует на клетки метастатического очага и окружающие его нервные окончания, одновременно подавляя болевой синдром.
– Альфа-излучатель (Ra-223). Альфа-излучение воздействует на костную ткань, пораженную метастазами, при этом нанося минимальный вред окружающим здоровым тканям. Лечение направленно на уменьшение болевого синдрома, повышение прочности костной ткани и продление жизни пациента в целом. Специалисты Дократес имеют опыт лечения Ra-223 при метастазированном в скелет раке предстательной железы. Клиника принимала участие в клинических исследованиях препарата.
Радионуклидное лечение других видов рака
С начала 2000-х годов различные формы радиоизотопной терапии используются, в частности, при лечении неходжкинской лимфомы. Во время терапии облучение при помощи радиоактивно маркированных антител разрушает раковые клетки.
При раке щитовидной железы самым распространённым радиоизотопным лечением является лечение радиоактивным йодом (I-131). В процессе лечения метастазы накапливают радиойод, и под воздействием облучения уменьшаются/уничтожаются.
Радиоизотопная терапия может проводиться при некоторых редких видах опухолей (например, феохромоцитомы, нейробластомы) и гематологических заболеваний (например, лейкемии), но такое лечение проведено весьма ограниченному количеству пациентов. Большинство из этих видов лечения требует сотрудничества врачей из различных сфер здравоохранения, а само лечение может быть проведено лишь в нескольких медицинских центрах мира.
Специалисты клиники Дократес имеют необходимые опыт и знания проведения радионуклидного лечения. В лечении принимает участие команда квалифицированных специалистов: врач радиоизотопной терапии, радиолог, онколог, мед. физик и пр. Лечение проводится под руководством Главного врача радиоизотопного отделения клиники, д.м.н., профессора Калеви Кайремо.
Пациентка с нейроэндокринной опухолью, прошедшая лечение в клинике Дократес
Подробнее

В мае этого года врачи онкологической клиники Дократес приняли участие в престижной конференции Американского общества клинической онкологии (ASCO), чтобы услышать.

Актуальная информация о безопасности пациентов в период коронавируса (COVID-19)

Я хочу приехать на лечение. Принимаете ли вы новых пациентов? Да, клиника Дократес работает в штатном режиме. Несмотря на пандемию.
За последние годы человечество шагнуло далеко вперед в вопросах диагностики и лечения раковых заболеваний. Как мы знаем на сегодня, раковые.
- Прием онколога в течение нескольких дней, индивидуальный план лечения
- Узкая специализация в онкологии
- Новейшие технологии и опытные специалисты
- Второе мнение специалиста: экспертное мнение онколога по плану лечения
- Обслуживание на русском языке
Запись на прием
Свяжитесь с нами
пн-пт 8.00-16.00 (GMT +2)

Онкологическая клиника Дократес
Saukonpaadenranta 2, 00180 Helsinki
FI-00180 Helsinki
Call центр: +358 10 773 2050
- Главная
- Наши специалисты
- Типы рака
- Рак предстательной железы
- Pак молочной железы
- Рак легких
- Рак кишечника
- Рак кожи
- Рак поджелудочной железы
- Лимфома Ходжкина
- Menu Item
- Лейкемия
- Миелома
- Рак щитовидной железы
- Скрининг на рак щитовидной железы
- Лечение тиреотоксикоза
- Лечение радиойодом
- Рак желудка
- Рак желчного пузыря и желчевыводящих путей
- Саркома костей и мягких тканей
- Рак мочевого пузыря и мочевыводящих путей
- Рак печени
- Рак пищевода
- Показать больше
- Истории наших пациентов
- Актуально
- Новому пациенту
- Лечение рака в Дократес
- Сканирование и диагностирование рака
- Методы лечения рака
- Центр восстановления здоровья
- Клинические исследования
- Проживание
- Услуга Privacy Plus
- Стоимость лечения
- Удаленная оплата
- Уровень удовлетворенности пациентов
- Дистанционные приемы в Онкологической клинике Дократес
- Контакты
- Миссия и ценности
- Вакансии
- Часто задаваемые вопросы
Мы используем cookies для сбора личной информации, с целью улучшить его содержание, улучшить качество обслуживания и маркетинга. Пожалуйста, примите или отклоните использование файлов cookie для сбора личной информации.
Десятки не предназначенных для лечения онкологических заболеваний лекарств способны убивать раковые клетки — к такому выводу пришли ученые из Массачусетского технологического института и Гарварда, протестировав тысячи лекарственных соединений на сотнях раковых клеток. Исследователи проверили действие примерно 4518 лекарств на 578 человеческих раковых клеток и выяснили, что примерно 50 из этих лекарств имеют противоопухолевую активность. Эти препараты использовались для лечения диабета, воспалительных процессов, алкоголизма и даже артрита у собак.
Александр Мелерзанов, декан факультета биологической и медицинской физики МФТИ:
Перепрофилирование лекарственных средств — это актуальное направление в современной медицине. По сути это поиск новых показаний для известных лекарств, что гораздо дешевле, чем создание новых. Например, лекарство для коррекции уровня глюкозы в крови — метформин — исследуется как потенциальный геропротектор (средство, влияющее на продолжительность жизни).
Каждая опухоль состоит из множества различных мутирующих клеток и, соответственно, на некоторые штаммы клеток могут влиять лекарства, не предназначенные изначально для терапии при этой нозологии. Данные о составе опухоли получаются при помощи молекулярно-генетического исследования биопсийного материала с последующим анализом с помощью биоинформатики. Затем из библиотеки существующих лекарств находится вещество с доказанным влиянием именно на данную опухоль. Это один из подходов в персонализированной медицине — прецизионная онкология.
Таким образом, учитывая, что опухоль гетерогенна, вполне возможно, что на некоторые из них действуют различные лекарства. При этом необходимо отметить, что многие лекарства обладают широким спектром действия и не всегда только тем, которое мы от них ожидаем. Некоторые лекарства широкого спектра могут иметь воздействие на опухоль, однако значительно более слабое по сравнению с лекарствами, которые специально разработаны для терапии онкологических заболеваний. Возможно, они действуют мягче, но по факту они не обладают достаточным воздействием для полного уничтожения опухоли. А так как главная задача онколога — уничтожение опухоли, приходится, к сожалению, мириться с выраженными побочными эффектами действующих лекарств.
Есть три группы лекарств, которые обладают антираковыми свойствами. Первая — классические терапевтические препараты, которые обладают общим цитоксическим и цитостатическим эффектом, то есть травят все клетки организма, но раковые клетки в силу своих особенностей гибнут раньше. Эта группа химиотерапевтических препаратов разделяется на подгруппы в зависимости от способа действия: есть лекарства, которые повреждают ДНК или препятствуют синтезу нуклеотидов, есть лекарства, которые угнетают клеточную активность и препятствуют делению клеток, и др. Вторая группа — это лекарства целевой терапии. Они воздействуют на определенные клеточные механизмы, которые, в идеале, характерны только для раковых клеток и отсутствуют в здоровых. Среди таких механизмов можно назвать WNT-сигнальный каскад, который мы изучаем в моей лаборатории. Он активен в определенных раковых клетках и выключен в большинстве здоровых. Если лекарство целевым образом подавляет активность этого каскада, то мы убиваем WNT-зависимые раковые клетки. Третья группа препаратов — иммунотерапевтические, которые влияют на взаимодействие раковых клеток с иммунной системой, с тем, чтобы последняя эффективнее распознавала и уничтожала раковые клетки.
В целом нельзя утверждать, что у репозиционированных лекарств побочные эффекты меньше, чем у специализированных противораковых препаратов. Однако репозиционированные лекарства имеют ряд преимуществ. Их дозировки, побочные эффекты и сочетания с другими препаратами уже во многом известны. В этом смысле они на шаг впереди по сравнению с новыми веществами, которые разрабатываются конкретно против рака. Многие из этих новых веществ не станут лекарствами как раз потому, что будут обладать недопустимыми токсическими эффектами.
Если сравнивать, например, антибиотик против проказы клофазимин, который может применяться при лечении трижды негативного рака молочной железы, и целевой антираковый препарат вантиктумаб, нельзя сказать, что побочные эффекты клофазимина меньше.
Здесь нет общего правила. Мишенью для большинства лекарств выступают клеточные белки. У нас есть ограниченное количество конфигураций, в которые сворачивается белковая цепочка. Любая химическая структура, обладающая лекарственным свойством (фармакофор), которая связывается с белковой мишенью в нашем организме, с высокой вероятностью свяжется с некоторой другой белковой мишенью с подобной структурой в нашем же организме, то есть наступит побочный эффект. Не всегда этот побочный эффект вреден и ограничивает применение препарата. Иногда этот эффект положительный, и мы получаем дополнительную терапевтическую пользу: эта вторая белковая мишень может отсутствовать в здоровых клетках и присутствовать в раковых. Такая вероятность не равна нулю для любого фармакофора.
Марина Секачева, директор Института персонализированной медицины Сеченовского университета:
Сегодня у ученых появилась возможность работать с большими массивами данных, ставить серийные эксперименты. Это нашло свое отражение в обсуждаемой работе коллег. Многие лекарственные препараты обладают так называемыми побочными эффектами, то есть эффектами, которые связаны с их механизмом действия, но не были целью их изобретения. Классическим примером является виагра, которая изначально тестировалась как сердечно-сосудистое средство, а свое распространение получила по совсем другому показанию. Если говорить о противоопухолевой активности, здесь поле для расширения показаний еще больше. В развитии опухолевой клетки может быть изменен практически любой сигнальный путь и мишень. И именно этим интересна такая работа. Противоопухолевая активность неонкологических препаратов оказалась связана с новыми механизмами, которые еще мало изучены. Конечно, это путь для поиска новых препаратов с абсолютно отличным механизмом действия.
Читайте также:


