Рабдомиосаркома гистологическая классификация опухолей
VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА РАДБОМИОСАРКОМ У ДЕТЕЙ
Д.М. Коновалов 1,2 , А.С. Тертычный 1,2 , А.Г. Талалаев 1,2
1 Российский государственный медицинский университет
2 НИИ детской гематологии МЗ РФ
Опухоли мягких тканей составляют, по данным различных национальных регистров, от 7% до 23% всех злокачественных новообразований у детей. Международная гистологическая классификация опухолей мягких тканей содержит описания более чем 150 различных нозологических форм опухолей мягких тканей. По данным Германского регистра детских опухолей 45% всех злокачественных опухолей мягких тканей у детей приходятся на различные гистологические типы рабдомиосаркомы.
По нашим данным, у плодов и детей до 6-ти месяцев жизни рабдомиосаркома составляет 29,4% от всех злокачественных опухолей мягких тканей в данной возрастной группе.
Морфологическая диагностика опухолей мягких тканей нередко вызывает затруднения из-за многообразия вариантов строения и значительного морфологического сходства опухолей различного гистогенеза. Данное обстоятельство определяется филогенетическим сходством происхождения опухолей мягких тканей: они развиваются из производных всех трех зародышевых листков, однако, наиболее часто - из мезенхимы, которая сама по себе является неоднородной. С другой стороны, часть опухолей мягких тканей с признаками той или иной терминальной дифференцировки имеют единый гистогенез, но под действием случайных соматических мутаций, эпигенетических механизмов или измененного микроокружения дифференцируются не однонаправленно.
Суммарным результатом вышеизложенного являются выраженная гетерогенность строения опухолей мягких тканей и их морфологическое сходство одновременно.
Вместе с тем в большинстве отдельных нозологических форм злокачественных опухолей мягких тканей наблюдается относительная устойчивость формальных диагностических морфологических признаков, лежащих в основе их классификации и дифференциальной диагностики, а также позволяющих определять особенности биологического поведения и прогноз клинического течения каждого конкретного образования.
Злокачественные опухоли с признаками поперечно-полосатой мышечной дифференцировки являются структурно значимыми в аспекте терапевтических клинических программ. Учитывая важность прогностических различий, наибольший акцент в последние годы сделан на более точных и воспроизводимых дифференциально-диагностических критериях эмбрионального и альвеолярного вариантов рабдомиосаркомы. Обоснованность и целесообразность данного разграничения получена, в основном, на основании результатов цитогенетических и молекулярно-биологических исследований и подтверждена длительными клиническими наблюдениями. Морфологические признаки, позволяющие проводить данное разграничение, базируются на морфологии клеточных элементов опухоли и особенностях тканевых структур.
Эмбриональная рабдомиосаркома. Примитивная злокачественная опухоль мягких тканей, которая проявляет фенотипические и биологические признаки эмбриональных скелетных мышц. Эмбриональная рабдомиосаркома обычно наблюдается у детей младше 15 лет, только в 17% случаев – у больных старше этого возраста. Большая часть (46%) встречается у детей младше 5 лет, 5% - у детей до 1 года и редко – как врожденная. Гистологическое строение эмбриональной рабдомиосаркомы в целом характеризуется миксоидным характером стромы и веретеноклеточным составом. Клеточные элементы опухоли имеют вытянутую веретеновидную или звездчатую форму, неравномерно распределены среди стромального компонента. В зависимости от выраженности ядерного полиморфизма, формы и размеров клеток, количества митозов выделяют собственно веретеноклеточный и анапластический варианты эмбриональной рабдомиосаркомы. Рабдомиосаркомы, возникающие в слизистых оболочках полых органов, выделяются в отдельный вариант – ботриоидную рабдомиосаркому, которая имеет характерную макроскопическую картину в виде гроздей винограда и характеризуется преобладанием миксоидной веретеноклеточной ткани с группировкой клеточных элементов опухоли непосредственно под собственной пластинкой слизистой оболочки с формированием “камбиального слоя”.
Каждый из гистологических подтипов эмбриональной рабдомиосаркомы в соответствии с особенностями гистологического строения необходимо отличать от опухолей иного гистогенеза или иной дифференцировки. В большинстве случаев речь идет о лейомиосаркоме, монофазных синовиальных саркомах, шванномах, фибросаркомах и, в ряде случаев, о злокачественных фиброзных гистиоцитомах. Дифференциальная диагностика внутри группы веретеноклеточных опухолей на гистологическом уровне представляет значительные затруднения и чревата высокой вероятностью часто повторяющихся однотипных ошибок.
Альвеолярная рабдомиосаркома. Примитивная злокачественная круглоклеточная опухоль, которая по морфологии клеточных элементов напоминает лимфому и демонстрирует частичную поперечно-полосатую мышечную дифференцировку. Выделяют три основных гистологических варианта альвеолярной рабдомиосаркомы – типичную, солидную и смешанную альвеолярно-эмбриональная рабдомиосаркома.
Общая гистологическая характеристика альвеолярной рабдомиосаркомы, в отличие от эмбриональной, при условии сохранения признаков поперечно-полосатой дифференцировки, определяется иным, фиброзным характером стромы, образующей альвеолярные и псевдоальвеолярные структуры, выстланные опухолевыми клетками. По соотношению стромального и клеточного компонентов в альвеолярной рабдомиосаркоме выделены типичный и солидный варианты. Клеточные элементы, составляющие гистологический субстрат альвеолярной рабдомиосаркомы, имеют преимущественно округлую форму с вариабельным ядерно-цитоплазматическим соотношением. Среди этих клеток часто определяются клеточные элементы с резко гиперхромными ядрами, признаками повреждения ядра, кариорексиса. Могут встречаться многоядерные клетки, клетки с эпителиоидной дифференцировкой, однако, большинство клеток опухоли не имеют признаков какой-либо дифференцировки.
Гистологический тип рабдомиосаркомы с сочетанием наиболее специфичных признаков альвеолярной и эмбриональной рабдомиосаркомы принято относить к смешанному, альвеолярно-эмбриональному варианту альвеолярной рабдомиосаркомы.
Альвеолярный вариант рабдомиосаркомы необходимо дифференцировать с лимфомами, группой мелко-круглоклеточных опухолей, саркомой Юинга, десмопластической мелко-круглоклеточной опухолью и, иногда - с герминоклеточными опухолями. Как и в случае с эмбриональным вариантом рабдомиосаркомы, дифференциальный диагноз на уровне гистологического исследования весьма сложен.
Отдельно описываемый вариант плеоморфной рабдомиосаркомы встречается крайне редко и описан только у взрослых. По гистологической картине этот вариант не отличается от других плеоморфных сарком, и его отношение к группе рабдомиосарком может быть установлено только с использованием специальных методов исследования. Следует отметить, что выделение различных вариантов рабдомиосаркомы возможно только на гистологическом уровне, так как иные характеристики (антигенный состав и генетические особенности) в большинстве случаев имеют групповую принадлежность и, следовательно, являются общими для всех вариантов рабдомиосарком. Выявление же молекулярно-биологических аномалий, к сожалению, не всегда доступно.
Несмотря на всю сложность и относительность гистологической субклассификации, определение гистологического типа рабдомиосаркомы является обязательной и клинически значимой характеристикой. Прогноз клинического течения определяется стадией, гистологической характеристикой, возрастом больного и локализацией образования.
Гистологическая классификация опухолей мягких тканей предполагает определение антигенного набора клеточных элементов опухоли. На основании данных иммуногистохимических исследований разработаны критерии, позволяющие установить гистогенез или терминальную дифференцировку опухоли. Эти критерии лежат в основе дифференциальной диагностики большинства групп опухолей, включая опухоли мягких тканей. Злокачественные опухоли поперечно-полосатой мышечной ткани характеризуются экспрессией широкого спектра мышечно-специфических иммунологических маркеров. При этом последовательность экспрессии и набор экспрессируемых антигенов коррелирует со степенью дифференцировки клеточных элементов так, как это происходит в эмбриогенезе. Наименее дифференцированные клетки экспрессируют только виментин. Об увеличении степени дифференцировки может свидетельствовать появление экспрессии десмина и мышечно-специфического актина. Дифференцированные клетки характеризуются позитивным связыванием с антителами к миоглобину, миозину и рецепторам креатин киназы М. Для определения мышечной дифференцировки могут быть использованы антитела к титину, дистрофину и рецепторам ацетилхолин эстеразы.
Следует помнить, что мышечные маркеры десмин и мышечно-специфический актин определяются на мышечной ткани вне зависимости от направления ее дифференцировки, т.е. в клетках с общим мышечным фенотипом, включая гладкие мышцы, сердце, миофибробласты, миоэпителиальные клетки, перициты и отдельные мезотелиальные клетки.
Антитела к MyoD1 и миогенину (Myf4) являются высокоспецифичными в отношении рабдомиосаркомы, так как соответствующие антигенные детерминанты появляются в результате приобретения специфических генетических аномалий, и на сегодняшний день считаются стандартом для постановки диагноза. Однако следует заметить, что только ядерная экспрессия может считаться специфичной, в отличие от широко встречаемой неспецифической цитоплазматической экспрессии.
Наряду с экспрессией мышечных антигенов в части рабдомиосарком сохраняется абберантная экспрессия родственных маркеров, таких как S-100 протеин, нейрон-специфическая енолаза, синаптофизин, хромогранин А, NB84.
Таким образом, постановка диагноза рабдомиосаркомы требует тщательной гистологической и иммуногистохимической оценки патологических изменений, сравнительного анализа полученных данных с учетом особенностей гистологического строения и иммунофенотипа опухолей иного гистогенеза. Только комплексный морфологический подход с учетом возраста и локализации, а также тесное взаимодействие с врачами клинической службы может обеспечить адекватный результат.
Рабдомиосаркома (злокачественная рабдомиома, миосаркома, рабдомиобластома) встречается относительно редко (10—12% злокачественных опухолей мягких тканей). Может развиваться вне связи с мышечной тканью (в забрюшинной клетчатке, средостении, на лице и шее, в носоглотке, по ходу мочеполового тракта, в женских половых органах), но чаще локализуется в зоне расположения мышц (в нижних, реже в верхних конечностях, мышцах, туловище). Возраст и пол значения не имеют. Опухоль обладает высокой степенью злокачественности. Указывают на резкое ускорение роста опухоли после биопсии. Метастазированне обильное, иногда начинается после удаления опухоли, без рецидива. Рецидивы часты.
Макроскопически опухоль представляет собой узел в толще мышц, диаметром до 20 см и более. Микроскопически характерен полиморфизм структуры, обусловленный тем, что опухолевые клетки по своему строению напоминают зародышевые мышечные клетки на разных фазах эмбриогенеза, регенерационные миобласты, возникающие при гибели мышечных волокон, и отличаются значительной катаплазией. Это создает большие трудности при попытке их классифицировать. Различают эмбриональную, альвеолярную, плеоморфиую и смешанную формы рабдомиосарком.
В 1946 г А. Р. Stout впервые выделил плеоморфный тип рабдомиосаркомы; G. D. Stoble и Н. W. Dargeon — эмбриональный в 1950 г.; в 1952 г К. Mostofi и М. Morse, F. Farinacci et al (1956) — ботриондный подтип, в 1956 г. J. S. Riopelle, J. P. Theriault и R. S. Horn, H. F. Enterline в 1958 г — альвеолярный тип рабдомиосаркомы
Несколько десятилетий назад рабдомиосаркому считали самой частой опухолью, составляющей до 25% всех сарком. Одной из самых многочисленных форм признавалась плеоморфная рабдомиосаркома. В настоящее время значительную часть опухолей, первоначально диагностированных как плеоморфные рабдомиосаркомы, относят к злокачественным фиброзным гистиоцитомам. По данным многих авторов, рабдомиосаркома составляет до 75% всех глубокорасположенных сарком конечностей и туловища. Другие относят ее к числу относительно редких злокачественных опухолей. В зависимости от гистологического варианта строения опухоль резко отличается по локализации, течению и возрасту больных.
У детей рабдомиосаркома является одной из самых распространенных злокачественных опухолей, уступая только нефробластоме и нейробластоме.
При изучении больших серий наблюдений выявляется 2 возрастных пика поражения — около 4 лет и около 18 лет. Ранний пик связан с поражением области головы, шеи и мочеполового тракта, поздний — с поражением мужского мочеполового тракта и мышц нижней части тела, особенно нижних конечностей. При всех локализациях опухоли, исключая ротоносоглотку, наблюдается преимущественное поражение лиц мужского полз. Случаев рабдомиосаркомы, индуцированных ионизирующим излучением, химикатами или вирусами, не описано. Связь с нейрофиброматозом позволяет предполагать, что 8 некоторых случаях в возникновении рабдомиосаркомы играют роль генетические нарушения. В других случаях опухоль бывает врожденной.
Клиническая симптоматика рабдомиосаркомы неспецифична. При поражении области головы и шеи, особенно носоглотки и орбиты, опухоль может распространяться на твердую мозговую оболочку и сопровождаться менингеальными явлениями, что отмечают примерно у 1/3 этих больных.
Самым частым вариантом является эмбриональная рабдомиосаркома, составляющая около 60% всех наблюдений. Этот вариант может встретиться в любом месте, но преобладающей является область головы и шеи, орбита и мочеполовой тракт.
Эмбриональная рабдомиосаркома образована преимущественно мелкими, вытянутыми клетками разнообразной формы — от круглых до звездчатых или тонких вытянутых, биполярных формирующих переплетающиеся пучки или массу типа синцитиальной, располагающимися в миксоматозном основном веществе. Важное диагностическое значение имеют вытянутые клетки с эозинофильной цитоплазмой, имеющие лентообразный или полосовидный вид и иногда поперечную исчерченность в цитоплазме.
Ботриоидный подтип эмбриональной рабдомиосаркомы составляет около 6—7% всех рабдомиосарком и отличается наклонностью поражать прежде всего мочеполовой тракт, область головы и шен, реже — желчный пузырь и др. Опухоль может иметь вид полипа, напоминающего кисть винограда.
Характерной морфологической особенностью, отличающей ботриондный подтип эмбриональной рабдомиосаркомы, является наличие так называемого камбиального пласта разнонаправленных пучков и скоплений компактно расположенных опухолевых клеток непосредственно под эпителием слизистой оболочки. В остальном этот подтип неотличим от обычного эмбрионального варианта. У женщин чаще поражается вагина, у мужчин — мочевой пузырь, паратестикулярная область. Эта опухоль может также локализоваться в назо-отофарингеальной области.
Эмбриональную рабдомиосаркому следует отличать от многих доброкачественных и злокачественных опухолей — от миксомы, миксоидной липосаркомы, иммунобластной лимфомы, низкодиффереицированного рака. При этом следует иметь в виду пол, возраст, локализацию опухоли; помогает также электронно-микроскопическое и иммуиоморфологическое исследования.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Рабдомиосаркома - злокачественная опухоль, происходящая из скелетной (поперечно-полосатой) мышцы.
Код по МКБ-10
- C48. Злокачественное новообразование забрюшиииого пространства и брюшины.
- C49. Злокачественное новообразование других типов соединительной и мягких тканей.
Код по МКБ-10
Эпидемиология
На долю рабдомиосаркомы приходится около половины всех случаев мягкотканых сарком у детей. Она составляет 10% всей онкологической патологии детского возраста. В заболеваемости этой опухолью выделяют два возрастных пика - в 1-7 и 15-20 лет. Первый совпадает с периодом манифестации врождённых злокачественных новообразований детского возраста - нейробластомы и нефробластомы, второй - с типичным возрастом диагностики злокачественных опухолей костей.

[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Рабдомиосаркома и наследственные синдромы
Примерно в трети случаев рабдомиосаркома сочетается с различными пороками развития: мочеполового тракта (8%). ЦНС (8%), пищеварительной системы (5%), сердечно-сосудистой системы (4%). В 4% случаев выявляют добавочную селезёнку, в 1% - гемигипертрофию. Рабдомиосаркому можно встретить при синдромах, предусматривающих предрасположенность к развитию злокачественных новообразований - Беквита-Вндеманиа, Ли-Фраумени (определяет высокую частоту развития злокачественных опухолей у членов семьи: связан с мутацией гена р53). Рекликгхаузена. Рубинстайна-Тейби (сочетание карликовости и олигофрении с гипертелоризмом. асимметрией лица, клювовидным носом, аномальным прикусом, гилерметропией. астигматизмом. характерным укорочением и утолщением больших пальцев кистей и стоп, а также часто и с другими аномалиями скелета и внутренних органов).
Симптомы рабдомиосаркомы
Рабдомиосаркома может локализоваться в любой области тела, в том числе в местах отсутствия скелетной мускулатуры (например, мочевой пузырь, желчевыводящие пути). Для этого новообразования характерно лимфогенное и гематогенное (в лёгкие, кости, костный мозг) метастазирование.
Локализации рабдомиосаркомы в области головы и шеи и в мочеполовом тракте чаще выявляют у детей в возрасте до 10 лет, в то время как для подростков характерны новообразования конечностей, туловища и паратестикулярные рабдомиосаркомы.
Классификация рабдомиосаркомы
Гистологическое строение и гистологическая кламмификация
Рабдомиосаркома развивается в поперечно-полосатой мышечной ткани, а также в таких гладкомышечных анатомических образованиях, как мочевой пузырь, влагалище, простата, семенной канатик. Источником роста рабдомиосаркомы становится не зрелая скелетная мускулатура, а незрелая мезенхимальная ткань, её предшественница. Условия для возникновения рабдомиосаркомы возникают, например, в зоне мочепузырного треугольника в результате смешения в этой области меэодермальных и эктодермальных тканей или в области головы и шеи, где возникают нарушения в развитии дериватов жаберных дуг. Выделяют несколько гистологических типов рабдомиосаркомы.
При рабдомиосаркомах выявляют также такие хромосомные аномалии, как 5q+: 9q+: 16p+: 12p+: del(l): и гипердиплоидия с множественными копиями 2,6.8. 12,13.18,20,21. При этом прогноз при диплоидных опухолях хуже по сравнению с гипердиплоидными.

[11], [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23]
При рабдомиосаркоме и других саркомах мягких тканей на дооперационном этапе применяют стадирование по системе TNM (табл. 66-20).
В TNM-классифнкации выделение категорий ТЗ и Т4 не предусмотрено. Наличие более чем одного новообразования рассматривают как первичную опухоль и её отдалённые метастазы. В современных протоколах лечения мягкотканных сарком для их стадирования на этапе после радикальной операции или биопсии используют классификацию IRS (Intergroup Rhabdomyosarcoma Study) и послеоперационное рТ-стадирование

[24], [25], [26], [27], [28], [29], [30], [31]
Диагностика рабдомиосаркомы
Симптомы рабдомиосаркомы и других сарком мягких тканей в наибольшей степени зависит от их локализации.
- При расположении новообразования в конечностях характерно наличие пальпируемого опухолевого образования, вызывающего дефигурацию конечности и нарушающего её функции. Образование обычно довольно плотное, его пальпация не вызывает заметной болезненности.
- При локализации новообразования в забрюшинном пространстве возникают боли в животе, его увеличение и асимметрия, симптомы сдавления кишечника и мочевыводящих путей.
- В случае локализации новообразования в области туловища, головы, шеи новообразование можно выявить при физикальном осмотре: дефигурация поражённой части тела, ограничение движений в этой области. При этом рабдомиосаркома шеи способна сочетаться с огрубением голоса и дисфагией, новообразования носоглотки - с локальной болью, носовыми кровотечениями, дисфагией, опухоли параназальных синусов с локальными болью и отёком, синуситами, односторонними выделениями и кровотечениями из носовых ходов, рабдомиосаркома среднего уха - с хроническим отитом с гнойными и геморрагическими выделениями, наличием полипондных масс в наружном слуховом ходе, периферическим параличом лицевого нерва, рабдомиосаркома орбиты - с птозом, косоглазием, снижением остроты зрения.
- Новообразования параменингеальных локализаций сопровождаются параличом лицевых нервов, менингеальными знаками, дыхательной недостаточностью вследствие инвазии опухоли в ствол мозга.
- Новообразования малого таза сопровождаются обструкцией кишечника и мочеполового тракта. При опухолях мочевого тракта отмечают нарушение пассажа мочи, вплоть до её острой задержки; над лоном можно пропальпировать плотное образование. При новообразованиях мочевого пузыря и простаты в части случаев возникает макрогематурия. Для опухолей влагалища и матки характерны влагалищные кровотечения, наличие во влагалище гроздевидных опухолевых масс. При новообразованиях придатка яичка отмечают его увеличение и болезненность. Лабораторные и инструментальные ис еле дои ни а
В основе диагностики сарком мягких тканей лежит морфологическая верификация диагноза. Однако до её проведения необходима оценка первичного очага опухоли и локализаций возможных метастазов. При диагностике первичного опухолевого очага в диагностический план включают исследования, применимые при данной локализации рабдомиосаркомы: рентгенографию, УЗИ, РКТ и МРТ, экскреторную урографию, иистографию и т.д. Диагностику возможных метастазов выполняют по стандартному плану, исходя из характерных для сарком мягких тканей локализаций метастазов. Выполняют рентгенографию и РКТ грудной клетки, радиоизотопное исследование скелета, исследование миелограммы. УЗИ регионарных лимфатических узлов.

[32], [33], [34], [35]
- Полное физикальное обследование с оценкой местного статуса
- Клинический анализ крови
- Клинический анализ мочи
- Биохимический анализ крови (электролиты, общий белок, печеночные пробы, креатинкн, мочевина, лактатдегидрогеназа, щелочная фосфатам, фосфорно-кальцмвый обмен)
- Коагулограмма
- УЗИ области поражения
- Рентгенография органов грудной полости в пяти проекциях (прямой, двух боковых, двух косых)
- УЗИ органов брюшной полости и забрюшкнного пространства
- Костномозговая пункция из двух точек
- Сцинтиграфия (РИД) костной системы
- ЭКГ
- ЭхоКГ
- Завершающий этап - биопсия (или полное удаление) для верификации гастологичесото диагноза. Целесообразно сделать отпечатки с биоптата для цитологического исследования

[36], [37], [38], [39], [40], [41], [42], [43]
- При подозрении на метастазы в легкие
- РКТ органов грудной полости
- При подозрении на вовлечение в процесс костных структур - рентгенография костей данной анатомической области в двух проекциях (прямой и боковой с захватом выше- и нижерасположенных суставов
- При выявленных метастазах в другие кости по данным
- РИД-прицельная рентгенография пораженных очагов или РКТ указанных областей
- При подозрении на метастазы в головной мозг - ЭхоЭГ и РКТ головного мозга
- УЗИ регионарных лимфатических узлов при подозрении на их метастатическое поражение
- Реносцинтиграфия при выявленных нарушениях функций почек
- При локализации рабдомиосаркомы в мягких тканях конечности - МРТ пораженной конечности
- Ультразвуковое цветное дуплексное ангиосканирование сосудов поражённой конечности
- Ангиография конечности (по показаниям)
- При локализации в мочевом пузыре:
- цистоскопии с возможной биопсией;
- экскреторная урография;
- урофлоуметрия
- При параменингеальиых локализациях:
- ЛОР-осмотр;
- офтальмологический осмотр;
- цитологическое исследование ликвора;
- РКТ/МРТ головного мозга

[44], [45], [46], [47], [48], [49], [50]
К кому обратиться?
Лечение рабдомиосаркомы
Лечение рабдомиосаркомы комплексное. Оно включает химиотерапию, радикальную операцию и лучевую терапию. Современные программы химиотерапии предусматривают использование таких цитостатиков, как алхилирующие агенты (ифосфамид, циклофосфамид), винкаалкалоиды (винкристин), антранилиновые антибиотики (доксорубицнн), актиномицин-Д, ингибиторы топоизокеразы (этопозид), препараты платины (карбоплатин).
Хирургическое лечение рабдомиосаркомы следует проводить, руководствуясь общим принципом хирургической радикальности. При изначально нерезектабельных новообразованиях первым этапом следует проводить биопсию. Это позволяет впоследствии избежать повторного местного роста опухоли из её макро- или микроскопических остатков, что особенно актуально при локализациях в голове, шее, орбите. В части случаев даже после эффективной полихимиотерапии рабдомиосаркома может оставаться нерезектабельной (новообразования носоглотки, параменингеальные локализации). В этом случае хирургическое лечение не показано, местный контроль осуществляют средствами консервативной химиолучевой терапии.
При локализации опухоли в мягких тканях конечностей возможны значительный объём поражения и вовлечение сосудисто-нервного пучка в новообразование. В подобных случаях, несмотря на отсутствие признаков распространения злокачественного процесса на костные структуры, единственно радикальной оказывается органоуносящая операция. Операции с сохранением конечности проводят либо после сокращения размеров опухоли в результате химиотерапии, либо инициально при небольших новообразованиях, имеющих при УЗИ и РКТ\МРТ чёткие границы.
В случае изолированного поражения рабдомиосаркомой дна мочевого пузыря (другие отделы от опухоли свободны) при хорошем ответе на химиотерапию возможна резекция стенки мочевого пузыря. В большинстве случаев мочевой пузырь бывает поражен либо тотально, либо рабдомиосаркома локализуется в области мочепузырного треугольника, поэтому возникает необходимость экстирпации мочевого пузыря с последующей хирургической реконструкцией путей оттока мочи. Оптимальной тактикой одномоментного хирургического лечения в онкопедиатрической практике следует считать уретеросигмостомию. в противоположность как уретерокутанеостомии, так и одномоментному формированию сложных артифициальных мочевых резервуаров из различных отделов кишечной трубки. На фоне химиотерапии в первом случае велик риск восходящей уроинфекции с развитием двустороннего пиелонефрита, а во втором - несостоятельности сформированного резервуара вследствие сниженной на фоне действия цитостатических агентов регенерационной способности тканей. Как альтернатива возможна тактика с первоначальной уретерокутанеостомией и последующим (через несколько месяцев после окончания химиолучевого лечения) этапом формирования артифициального мочевого резервуара.
Паратестикулярные новообразования удаляют вместе с яичком и семенным канатиком из пахового доступа (орхофуникулэктомия). При рабдомиосаркоме матки показана её экстирпация, при опухоли влагалища - удаление влагалища. При новообразованиях, поражающих оба эти органа, матку и влагалище удаляют единым блоком с опухолью.
Лёгочные метастазы при их резектабельности подлежат хирургическому удалению. Костные метастазы в связи с их фатальностью для прогноза удалять не следует.
Лучевую терапию при рабдомиосаркоме проводят в соответствии с критериями, определёнными конкретной программой лечения. Доза облучения зависит от локализации или метастазов.
Высокодозную химиотерапию с трансплантацией костного мозга назначают пациентам с рабдомиосаркомами из группы высокого риска: при IV стадии.
Гистология. Оригинальная классификация гистологических вариантов рабдомиосарком у детей, описанная в 1958 году, объединяет опухоли из определенных типов клеток, такие как эмбриональные, альвеолярные, ботриоидные и полиморфно-клеточные. Исследование гистологии опухолей в IRS добавило в эту классификацию примитивные мелкоклеточные саркомы I и II и неопределенные недифференцированные формы.
К благоприятным типам относятся эмбриональные, включая ботриоидный вариант, внекостная саркома Юинга и недифференцированные или смешанные типы опухолей. Гистологически неблагоприятными считаются альвеолярная и анапластическая или мономорфная круглоклеточная опухоли (табл. 70-4). Гистологический характер опухоли, определяемый при постановке диагноза, учитывается в современных лечебных программах и определяет модификации методов лечения, в частности интенсивность терапии.
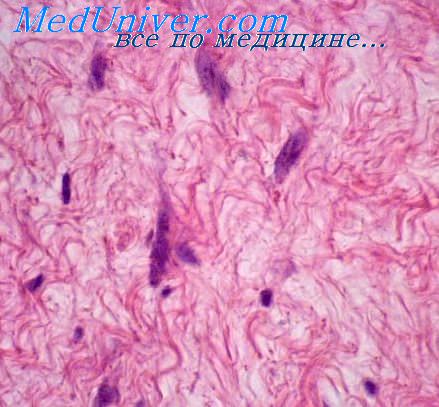
Эмбриональные опухоли. Эмбрионально-клеточные опухоли состоят из небольших, округлых, веретенообразных миобластов. Данный тип клеток обычно встречается в мочеполовом тракте, а также в области головы и шеи. Это наиболее частый тип клеток, наблюдающийся у детей с рабдомиосаркомой (рис. 70-5).
Более 60% случаев, по нашим данным, относится к эмбриональным опухолям. Небольшие округлые клетки иногда трудно дифференцировать с лимфоцитами, нейробластами и с внекостной саркомой Юинга, особенно при исследовании замороженных срезов. Дети с эмбриональными опухолями имеют наилучший прогноз. Ботриоидный вариант эмбриональной рабдомиосаркомы отмечается при субмукозной локализации.
Затем эти опухоли растут в просвет органа и выглядят при макроскопическом исследовании в виде полипоидных масс, напоминающих гроздья винограда. Ботриоидные опухоли встречаются в мочевом пузыре, влагалище, матке, носоглотке, а также иногда в общем желчном протоке и на промежности. На ботриоидные опухоли приходится 5—6% всех рабдомиосарком у детей. Прогноз при этом очень благоприятный.
Опухоли, гистологически неблагоприятные. Неблагоприятные формы включают в себя альвеолярные, анапластические и мономорфные круглоклеточные опухоли. На альвеолярную рабдомиосаркому приходится 20% всех случаев рабдомиосаркомы у детей. Этот тип растет в виде тяжей с гроздьями небольших круглых опухолевых клеток с обильной эозинофильной цитоплазмой.
Рабдомиобласты имеют поперечную исчерченность (40%) и иногда образуют синтициальные многоядерные гигантские клетки. Однако наличие поперечной исчерченности — совсем не обязательное условие для постановки диагноза. У детей с альвеолярно-клеточными опухолями наблюдается хромосомная транслокация между хромосомами 2 и 13. Наиболее частая локализация — конечности, туловище и перианальная область. Однако альвеолярные опухоли наблюдаются также в зонах, характерных для первичной локализации рабдомиосарком.
У пациентов с альвеолярными опухолями отмечаются наихудший прогноз, высокий процент вовлечения региональных лимфоузлов, рецидивов опухоли, поражения костного мозга и отдаленных метастазов. Анапластический тип характеризуется наличием гиперхроматических и полиморфных ядер с увеличенными причудливыми митотическими фигурами. Мономорфные круглоклеточные опухоли представляют собой поражение с очень однородными круглыми ядрами с выступающими краями.
Лечение в последующем (IRS-II и III) более низкими дозами (от 4000 до 5500 сГр в зависимости от возраста — менее или более 6 лет; лишь некоторые пациенты получали меньше 4000 сГр) привело к увеличению частоты локальных и региональных рецидивов (более, чем в 30% случаев в группах II и III и более 40% в группе IV), особенно если размеры первичной опухоли были значительными (>5,0 см). Исключение составляли дети, в том числе и грудные, с поражением I группы, у которых опухоль была полностью резецирована. У этих пациентов отмечалась высокая выживаемость при лечении двумя химиопрепаратами (актиномицин D и винкристин), лучевая терапия при этом не требовалась.
Однако в тяжелых случаях (группы II и IV) лучевая терапия является очень важным компонентом лечения, особенно при такой локализации, которая не позволяет произвести локальную обширную резекцию опухоли. При правильном применении лучевая терапия способствует снижению частоты локальных рецидивов в зоне расположения первичной опухоли. Пациенты лечились методом гиперфракционного облучения с применением дважды в день (с промежутком между сеансами в 6—8 часов) дозы 110 сГр на протяжении 5 дней в неделю.
Теоретическим преимуществом гиперфракционного метода является возможность применения соответствующей дозы (5800 сГр) таким образом, что в результате лечения уничтожается опухоль, но сохраняются интактными нормальные ткани. Цель подобной тактики — повысить процент излечения локальных и региональных опухолей на 10—15%, в то же время уменьшив риск нежелательных поздних эффектов, связанных с облучением.
При некоторых локализациях может потребоваться еще более существенное уменьшение дозы облучения (например, при облучении легких — 1800 сГр, живота—3000 сГр). Изменение схемы и дозы облучения порой необходимо и в тех случаях, когда применяются радиопотенциирующие химиотерапевтические препараты, такие как актиномицин D и адриамицин.
В лечении пациентов с мягкотканными саркомами иногда применяется брахитерапия с различной степенью успеха. Применение интерстициальных датчиков (beads или rods) во влагалище, мочевом пузыре и других местах (например, скелетные мышцы) обеспечивает высокую выживаемость в некоторых случаях, особенно при очень больших опухолях, с хорошим локальным эффектом в зоне первичной опухоли.
Брахитерапия обладает следующими достоинствами: (1) при данной дозе облучения увеличивается биологический эффект; (2) непосредственно визуализируется ложе опухоли; (3) больше возможностей для сохранения интактными окружающих тканей; (4) возможно осуществить короткое по продолжительности облучение и (5) метод может быть применен в качестве дополнения к обычному наружному облучению. Главный недостаток брахитерапии — повышенная частота раневых осложнений.
Читайте также:

