Пуповинная кровь и лимфома
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
Высокодозная химиотерапия с последующей аллогенной трансплантацией гемопоэтических стволовых клеток (ГСК) является наиболее эффективным методом лечения у взрослых онкогематологических больных с высоким риском, однако, только треть из них имеет родственных доноров. Одним из альтернативных источников аллогенных ГСК в настоящее время стали клетки пуповинной крови. Использование клеток пуповинной крови применимо для лечения взрослых больных с резистентными формами высокоагрессивных лимфом, которым уже была выполнена аутогенная трансплантация периферических стволовых кроветворных клеток, в случае отсутствия потенциального подходящего по HLA донора.
Введение
Высокодозная химиотерапия с последующей аллогенной трансплантацией гемопоэтических стволовых клеток (ГСК) в настоящее время признана наиболее эффективным методом лечения у взрослых онкогематологических больных с высоким риском, однако только треть из них имеет доступных родственных доноров. Клетки пуповинной крови стали альтернативным источником аллогенных ГСК после успешно проведенной трансплантации клеток пуповинной крови (ТКПК) у ребенка с анемией Фанкони [1] . С тех пор во всем мире проведено более 20 000 ТКПК. В связи с тем, что появляются новые подтверждения преимущества неродственной ТКПК по сравнению с клетками костного мозга (КМ), с каждым годом увеличивается общее количество банкированных замороженных образцов, чье количество в настоящее время составляет около 600 тыс. [2] . Многие исследователи также отмечают, что пролиферативная способность ГСК пуповинной крови превосходит пролиферативную способность клеток КМ или ПК взрослых [3] . Так, 100 мл пуповинной крови содержат 1/10 числа ядросодержащих клеток (ЯСК) и клеток-предшественников (СD34+), имеющихся в 1000 мл КМ, но в связи с интенсивной пролиферацией после трансфузии, стволовые клетки такого образца ПК могут воссоздать всю кроветворную систему [4] .
Недостатком ПК является ограниченность объема одного образца, а следовательно и количества ГСК, которые можно выделить из него. Как правило, этого количества будет недостаточно для проведения ТГСК у взрослых (среднее количество клеток – 0,5– 1,0×10 7 , среднее количество CD34+ – 2,0×10 6 ). По данным научной литературы, необходимое количество для трансплантации ядросодержащих клеток в эксфузате ПК должно составлять 3,7×10 7 на кг массы тела рецепиента, а достаточным количеством CD34+ считается от 3,3×10 5 /кг [9] . В настоящее время необходимое количество ГСК для успешного восстановления гемопоэза достигается путем трансплантации двух частично-родственных образцов ПК [10] . А также представляется теоретически возможным экспансия прогениторных клеток ПК и ГСК ex vivo [11 – 17] . Еще одним способом трансплантации клеток ПК является трансфузия непосредственно в костный мозг, что позволяет значительно уменьшить потери клеток, происходящие при внутривенном введении, и связанные с диссеминацией по всему организму их значительной части [18] . Другой перспективной методикой, позволяющей добиться быстрого восстановления числа нейтрофилов и лучшего энграфтмента является совместная пересадка частично HLA совпадающих стволовых клеток ПК после их Т-клеточной деплеции. В последнее время стали появляться сообщения о методиках, предусматривающих совместную с мультипотентными мезенхимальными стволовыми клетками (ММСК) костного мозга трансфузию, что обеспечивает улучшение энграфтмента трансплантата.
Применение ТКПК при неходжкинских лимфомах
Первые сообщения о неродственной ТКПК с применением немиелоаблативных режимов кондиционирования при неходжкинских лимфомах появились в 2005 г. [29] . В исследование были включены 20 пациентов (медиана возраста составила 46,5 лет) подвергшихся немиелоаблативному режиму кондиционирования, включающим в себя флударабин 125 мг/м 2 , мелфалан 80 мг/м 2 и тотальное облучение тела в дозе 4 Гр с последующей неродственной ТКПК. 17 из 20 пациентов имели высокоагрессивные формы НХЛ (диффузная В-клеточная крупноклеточная лимфома). 95% пациентов имело III/IV стадию заболевания и IPI выше 2, у 75% констатирована резистентность к проводимой ХТ, 30% из них уже была проведена ауто-ТПСКК. Среднее число введенных клеток составило 2,75×10 7 /кг (2,3– 3,4×10 7 /кг). Медиана времени после наблюдения составила 334,5 дней. Выживаемость без прогрессии (ВБП) и общая выживаемость (ОВ) составила 50% в течение года, что превосходит все применяемые до этого методы лечения (при использовании режимов высокодозной химиотерапии медиана ВБП в течении 1 года и 5-летняя ОВ колеблется в пределах 12–39% и 33 – 53%, соответственно (режимы BEAC, DHAP, SWOG, DexaBEAM [30–32] , при применении ауто-ТГСК 3-летняя ОВ – 36% [33] (рис. 1). Представленные данные позволяют применять ТКПК с немиелоаблативным режимом кондиционирования у больных НХЛ с высоким риском, резистентностью к проводимой химиотерапии и в случае отсутствия родственного донора ГСК.
Второе значимое исследование в области применения ТКПК при НХЛ было проведено группой ученых США в рамках ASBMT (American Society for Blood and Marrow Transplantation). В это исследование было включено 65 пациентов с гистологически верифицированным диагнозом: фолликулярная лимфома – ФЛ (n=11), хронический лимфолейкоз – ХЛЛ (n=9), мантийноклеточная лимфома – МКЛ (n=8), диффузная В-клеточная крупноклеточная лимфома – ДВКЛ (n=11), анапластическая Т-клеточная лимфома (n=2), периферическая Т-клеточная лимфома (n=1), лимфома Ходжкина (n=23). Медиана возраста составила 46 лет. Всем больным до этого уже были проведены три курса полихимиотерапии или ауто-ТПСКК. У 100% больных был определен высокий риск раннего прогрессирования заболевания. ТКПК проводилась после одного режима кондиционирования, включающего в себя циклофосфан 50 мг/кг в день -6, флударабин 40 мг/м 2 с -6 по -2 день и тотальное облучение тела (ТОТ) в дозе 200 сГр на фоне иммуносупрессии циклоспорином. Среднее количество введенных ЯСК составило 3,3×10 7 / кг. Среднее количество CD34+ клеток – 4,4×10 5 / кг. Медиана времени наблюдения 23 мес. Общая 3-летняя ВБП составила 49%. Текущая ВБП при ФЛ/ХЛЛ – 68%, при ДВКЛ/МКЛ – 47%, 3-летняя ОВ – 55%, при ФЛ/ХЛЛ – 69%, при ДВКЛ/МКЛ – 54%. (3-летняя ОВ при ауто-ТГСК у больных с резистентными формами ФЛ/ХЛЛ – 56%, ДВКЛ – 36%, МКЛ – 69% [33] ). Основываясь на этих данных можно заключить, что ТКПК с предварительным немиелоаблативным режимом кондиционирования является эффективным методом лечения больных НХЛ, с продвинутыми стадиями и не имеющих доноров сиблингов [34] .
Группа ученых EBMT (European Group for Blood and Marrow Transplantation) в 2009 г. представила результаты неродственной ТКПК у взрослых больных с лимфопролиферативными заболеваниями. В исследование было включено 104 пациента (медиана возраста 41,5 лет), которые подверглись неродственной ТКПК. Больные страдали следующими заболеваниями: НХЛ – 61, лимфомой Ходжкина – 29, ХЛЛ – 14. 87% больных имели поздние стадии заболевания и у 60% из них ауто-ТГСК оказалась неэффективной. 64% больным перед трансплантацией проводили немиелоаблативный режим кондиционирования, а 46% подвергли ТОТ. Медиана наблюдения составила 18 мес. ВБП составила 40% в течении одного года, при сохранении химиочувствительности опухоли (49% против 34%), при комбинации кондиционирования с ТОТ (60% против 23%), при более высоком содержании в эксфузате ЯСК (49% против 21%). Базируясь на этих данных можно сделать вывод о том, что ТКПК у больных с поздними (продвинутыми) стадиями НХЛ является эффективным методом лечения. Большое значение при проведении ТКПК имеют сохранение химиочувствительности опухоли, включение в режимы кондиционирования ТОТ и количество ЯСК в образце трансплантата. [35] .
К сожалению, в настоящее время не проводится клинических испытаний ТКПК именно при НХЛ. Подавляющее большинство испытаний включает в себя большое количество различных по морфологии, происхождению и клиническим проявлениям различных онкогематологических нозологий, что затрудняет трактовку получаемых данных и формулировку выводов. Для оценки преимущества клеток ПК перед другими традиционными методами лечения необходима инициация отдельных клинических испытаний с включением пациентов, страдающих только неходжкинскими лимфомами.
Перспективы дальнейших исследований
На данный момент ТКПК при онкогематологических заболеваниях применяется в основном при острых лейкозах у детей. Использование данного метода трансплантации у взрослых пока не получило широкого распространения, но количество сообщений о них в научной литературе с каждым годом неуклонно увеличивается [36–42] . До настоящего времени, основными причинами ограничения применения ТКПК остаются: высокая частота развития острой (20–50%) и хронической РТПХ (5–30%), а лечение самой реакции приводит к присоединению последующей инфекции, что значительно увеличивает количество летальных исходов после ТКПК. Применение СК ПК у взрослых пациентов ограничено небольшим объемом образца крови, а значит и недостаточным количеством клеток для человека массой больше 40 кг [43] . Результатом этого является более медленное приживление трансплантата, кратко- и долговременные риски инфекционных осложнений. Первые попытки осуществить увеличение количества клеток, прежде всего ГСК, привели к неизбежному наращиванию количества более дифференцированных клеток в культуре. Следовательно, экспансия ex vivo не улучшала эффективность приживления, так как увеличивался уровень апоптоза пересаженных клеток и снижался уровень заселения костного мозга [44] . Будущее такого направления, как увеличение количества недифференцированных гемопоэтических предшественников, лежит в области выделения этих клеток на основании их функциональной активности, а не на основании их поверхностного иммунофенотипа, что, кроме того, подразумевает учет влияния цитокинов стромы на формирование и работу ниши ГСК [43] .
Наиболее перспективные направления применения ТКПК представлены в таблице. Представленные в таблице пути применения ПК в настоящий момент находятся на различных этапах доклинических и клинических исследований и говорить о преимуществе того или другого метода применения пока рано. Однако количество сообщений в зарубежной литературе о трансплантации клеток ПК в клинической практике при различных заболеваниях в настоящий момент достигает порядка 800 (рис. 3). В сравнении с прошлым десятилетием эта цифра увеличилась в десятки раз, что указывает на очевидность эффективности применения ТКПК и перспективу применения этого метода лечения при различных ранее не курабельных заболеваниях.
Заключение
Таким образом, следует заключить, что по предварительным данным ТКПК может быть применена у больных с резистентными формами НХЛ, которым уже была выполнена аутотрансплантация и не имеющих потенциального подходящего по HLA донора.
Лимфома Ходжкина (лимфогранулематоз) относится к группе злокачественных заболеваний, при которых у большинства больных (детей и взрослых) удается добиться полного излечения с помощью современных программ химио- и лучевой терапии. Наибольшие сложности составляет лечение группы больных с первичной резистентностью (5—10 %) и рецидивами заболевания, особенно ранними (в пределах года с момента достижения ремиссии). Рецидивы наблюдаются у 10—15 % больных лимфомой Ходжкина, из которых приблизительно у половины удается достичь состояния повторной ремиссии даже при использовании резервных схем цитостатической терапии.
В настоящее время стандартом в лечении взрослых больных лимфомой Ходжкина является комбинированная химио- и лучевая терапия. С помощью современных протоколов около 95 % больных с I—II стадией и 70—80 % с III—IV стадией лимфомы Ходжкина могут быть излечены.
В целом эффективность терапии при лимфоме Ходжкина зависит от стадии болезни в момент постановки диагноза и IPI. К неблагоприятным факторам относятся возраст больного 45 лет и старше, мужской пол, IV стадия, содержание гемоглобина менее 105 г/л, альбумина менее 4 г/л, лимфоцитов менее 0,6 • 109/л, количество лейкоцитов в момент постановки диагноза 15- 109/л или более. Другими прогностическими факторами, имеющими значение, являются индекс Карновского, невозможность достижения ПР при использовании стандартных доз химиотерапии. До сих пор не установлено статистически достоверного влияния гистологического варианта лимфомы Ходжкина на отделенные результаты лечения.
С увеличением длительности жизни больных с лимфомой Ходжкина возрастает значение адекватности доз при проведении цитостатической и лучевой терапии, поскольку вероятность развития вторичных опухолей, наиболее часто возникающих в областях рядом с местом лучевого воздействия, зависит от интенсивности цитостатической и лучевой нагрузки. Проблемой отдаленного периода может быть развитие сердечной и легочной недостаточности.
Таким образом, высокодозная цитостатическая терапия с последующей трансплантации гемопоэтических стволовых клеток представляется оправданной только при следующих вариантах течения лимфомы Ходжкина: наличии прогностически неблагоприятных значений IPI, отсутствии ремиссии при проведении стандартной химиотерапии, развитии рецидива лимфомы Ходжкина или первичной резистентности. В подобных случаях терапия иногда бывает безуспешной и не зависящей от дозы применяемых препаратов.
К прогностически неблагоприятным вариантам течения лимфомы Ходжкина относятся III—IV стадии заболевания.
До последнего времени основным вариантом трансплантации гемопоэтических стволовых клеток, используемым у больных с лимфомой Ходжкина, являлась ауто-трансплантации гемопоэтических стволовых клеток (преимущественно ауто-ТПСКК).
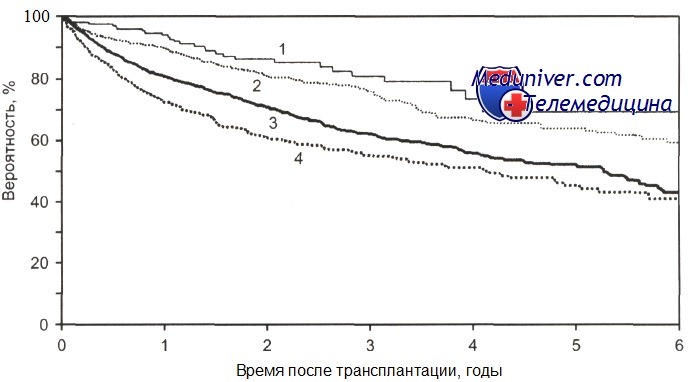
Общая выживаемость после ауто-ТГСК больных с лимфомой Ходжкина в зависимости от стадии болезни.
1-ПР1 (n = 184); 2-ПР2+ (n = 734); 3 - рецидив (n = 1806); 4 — ремиссия не достигнута (n = 632); р = 0,0001.
Проведение ауто-трансплантации гемопоэтических стволовых клеток больным лимфомой Ходжкина I—II стадии возможно только при наличии признаков рецидива, особенно раннего, или первичной резистентности заболевания.
У части больных использование высокодозной химиотерапии с трансплантацией гемопоэтических стволовых клеток ограничено быстрой прогрессией заболевания, возрастом, низким индексом Кар-новского, а также невозможностью получения ауто-логичного трансплантата вследствие значительного снижения клеточности КМ и изменения функционального состояния гемопоэтических стволовых клеток после многочисленных курсов химиотерапии. Наиболее часто это связано с тем, что значительному большинству больных с лимфомой Ходжкина ранее проводилась лучевая терапия, что затрудняет получение аутотрансплантата из костного мозга (КМ). В связи с этим трансплантация гемопоэтических стволовых клеток, выделенных из крови (ауто-ТПСКК), стала при лимфоме Ходжкина методом выбора.
| Автор | Количество больных | Результаты |
| Sweetenham J. et al. | 290 | 30 % 5-летняя БРВ, 34 % 5-летняя ОВ |
| Chopra R. et al. | 46 | 33 % 5-летняя БРВ |
| Reece D. et al. | 30 | 42 % 5-летняя БРВ, 60 % 5-летняя ОВ |
| Yahalom J. et al. | 28 | 33 % 5-летняя БРВ |
| Moreau P. et al. | 28 | 31 % 3-летняя БСВ, 50 % 5-летняя ОВ |
| Gianni A. et al. | 7 | 31 % 6-летняя БРВ, 42 % 6-летняя ОВ |
Наряду с указанным установлено отрицательное влияние следующих прогностических факторов на общую выживаемость больных с лимфомой Ходжкина при ауто-трансплантации гемопоэтических стволовых клеток: наличие В-симптомов, признаки экстранодального поражения, длительность полной ремиссии менее 1 года, низкий индекс Карновского (менее 80 %), отсутствие химиочувствительности и эффекта от двух-трех предшествующих курсов химиотерапии.
По данным CIBMTR, у больных лимфомой Ходжкина без учета стадии заболевания 3-летняя общая выживаемость после ауто-трансплантации гемопоэтических стволовых клеток в ПР1 была 81 %, во второй и последующих ремиссиях —76 %, при рецидиве — 63 %, при первичной резистентности — 55 %.
Факт рецидива отрицательно влияет на общую и безрецидивную выживаемость больных лимфомой Ходжкина. Несмотря на это, по данным различных исследований, у пациентов с рецидивом лимфомы Ходжкина 5-летняя общая выживаемость после ауто-трансплантации гемопоэтических стволовых клеток колеблется в пределах 65—85 % и зависит от интенсивности примененной перед ауто-трансплантации гемопоэтических стволовых клеток химиотерапии. Сохранение химочувстви-тельности опухоли имеет принципиальное значение. В случае отсутствия химиочувствительности лимфомы Ходжкина 5-летняя общая выживаемость после ауто-трансплантации гемопоэтических стволовых клеток составила 26,1 %, при сохранении химиочувствительности — 73,7 %.
| Автор | Количество больных | рецидив менее чем через 12 мес | рецидив более чем через 12 мес |
| Chopra R. et al. | 52 | 41 % | 57 % |
| Bierman P. et al. | 85 | 32% | 47% |
| Reece D. et al. | 58 | 48 % | 85 % |
Эффективность ауто-трансплантации гемопоэтических стволовых клеток при лимфоме Ходжкина исследовали многократно. Изучено прогностическое значение многих факторов. Так, установлено, что отдаленные результаты зависят от стадии болезни и места рецидива в момент проведения трансплантации. При выполнении ауто-трансплантации гемопоэтических стволовых клеток в первом рецидиве 10-летняя безрецидивная выживаемость составила 60 %, при рецидиве в первично-вовлеченной области — 38 %, при IIIВ—IV стадии лимфомы Ходжкина —21 %. По данным другого исследования, при первично-резистентном варианте лимфомы Ходжкина 10-летняя общая выживаемость и безрецидивная выживаемость после ауто-ТГСК составили 55 и 36 % соответственно. Общие результаты ауто-трансплантации гемопоэтических стволовых клеток при неблагоприятных вариантах течения лимфомы Ходжкина представлены в таблицах
Наиболее часто при лимфоме Ходжкина используются режимы кондиционирования: CBV (цикло-фосфан, BCNU, этопозид) и BEAM (BCNU, этопо-зид, цитозар, мелфалан), возможно применение VIP (этопозид, ифосфамид, цисплатин). При режиме кондиционирования CBV 5-летняя общая выживаемость больных с первичной рефрактерностью или рецидивом лимфомы Ходжкина достигает 67 %, при использовании BEAM она составляет 47—70 %.
Таким образом, показанием к трансплантации гемопоэтических стволовых клеток у больных лимфомой Ходжкина являются прогностически неблагоприятные варианты течения болезни. Эффективность трансплантации гемопоэтических стволовых клеток при лимфоме Ходжкина колеблется в среднем от 25 до 80 %, что зависит от индекса IPJ, стадии болезни, места рецидива и сохранения химиочувствительности опухоли.

Лечение рака крови стволовыми клетками в Германии, при разрушении больного костного мозга, может быть последним шансом для некоторых пациентов с лимфомой и лейкемией.
В нашем костном мозге постоянно образуются универсальные единицы — стволовые клетки предшественники, способные трансформироваться в любые другие клетки крови.
При таких заболеваниях, как лейкемия или лимфома, напрямую поражены эти клеточные ростки.
Для излечения таких больных немецкие онкологи применяют сложное многоступенчатое лечение — так называемую трансплантацию стволовых клеток крови (Transplantation von Blutstammzellen).
Стоимость такого лечения составляет десятки тысяч евро, потому что пациентам потребуются большие количества дорогостоящих препаратов, специальные условия пребывания после кондиционирования, услуги лаборатории и др.
В некоторых случаях стволовые клетки получают у самого пациента. Но зачастую это невозможно, поэтому врачам приходится искать подходящего донора костного мозга.
Биология стволовых клеток крови: предшественники всего
Зрелые клетки крови имеют ограниченный срок службы. Стволовые клетки постоянно обеспечивают пополнение этой многомиллиардной армии маленьких помощников. Каждый день костный мозг заменяет несколько миллиардов эритроцитов, лейкоцитов, тромбоцитов.
Показания к трансплантации стволовых клеток крови в Германии
Несмотря на техническую сложность, риск и высокую стоимость, эта процедура является жизненно необходимой для тяжелобольных людей с онкогематологическими патологиями.
Ниже перечислены диагнозы, для которых немецкими органами здравоохранения одобрена трансплантация стволовых клеток крови:
• Анемия Фанкони
• Бета-талассемия майор
• Врожденные и приобретенные иммунодефициты (например, SCID)
• Истинная полицитемия
• Лимфома Ходжкина
• Миелодиспластический синдром (MDS)
• Неходжкинская лимфома
• Острая лимфобластная лейкемия
• Острая миелоидная лейкемия
• Пароксизмальная ночная гемоглобинурия
• Первичный миелофиброз
• Плазмоцитома (множественная миелома)
• Серповидноклеточная анемия
• Хроническая лимфобластная лейкемия
• Хроническая миелоидная лейкемия
Более подробную информацию можно запросить у Немецкой ассоциации трансплантации костного мозга и крови (Die Arbeitsgemeinschaft für Knochenmark- und Blutstammzelltransplantation).
Последствия химиотерапии и лучевой терапии рака
При лечении рака цитостатиками или лучевой терапией в первую очередь погибают клетки, которые быстро размножаются. С одной стороны, это злокачественные клетки, ради которых была назначена терапия. С другой стороны, это костный мозг пациента.
Насколько серьезен этот побочный эффект?
Все зависит от дозы и продолжительности токсического воздействия. При лучевой терапии последствия зависят от того, попадает ли костный мозг (перечисленные выше кости) под облучение. К счастью, подавляющее большинство пациентов быстро восстанавливаются после кратковременного подавления костного мозга. Обычно врачи наблюдают транзиторную анемию, лейкопению и тромбоцитопению, которые полностью обратимы.
Ведущие клиники Германии используют специальные щадящие протоколы лечения рака, которые минимизируют негативное воздействие терапии на костный мозг больных. Однако терапия гематологического рака требуют высоких доз цитостатиков. Если стандартные методы не останавливают болезнь, разрушение костного мозга и трансплантация стволовых клеток остается единственным шансом.
Самая опасная часть — уничтожение костного мозга. После кондиционирования организм остается один на один с многочисленными угрозами. Кровотечения, инфекции от случайного контакта — все это может в считанные дни убить ослабленного пациента. Вот почему человек должен находиться в специально оборудованной палате под непрерывным наблюдением врачей. Все контакты с посторонними ограничиваются. Важно как можно скорее ввести новые стволовые клетки. В зависимости от заболевания, врачи используют предварительно собранные собственные клетки или донорские.
Центры трансплантации стволовых клеток крови в Германии
Несколько десятков онкогематологических клиник и отделений известных больниц по всей территории Германии готовы предложить эту сложную и ответственную процедуру своим пациентам, в том числе медицинским туристам.
Наиболее известные немецкие клинические центры:
Подробная информация о клиниках доступна в Центральном реестре доноров костного мозга Германии (Zentrales Knochenmarkspender-Register für die Bundesrepublik Deutschland, ZKRD).
Возможные источники стволовых клеток для лечения рака крови
Технически, стволовые клетки крови нужно передать прямо костному мозгу, месту их образования. Другим вариантом является особая форма переливания крови, перед которым врачи заставляют стволовые клетки мигрировать из костного мозга в кровь донора специальными лекарственными средствами.
В первом случае речь идет о трансплантации костного мозга (Knochenmarktransplantation), во втором — о трансплантации периферических стволовых клеток (Stammzelltransplantation). Немецкие больницы практикуют оба метода лечения рака, однако второй вариант является менее стрессовым для донора (не требуется болезненная экстракция костного мозга).
Исследования показывают: гемопоэз у доноров периферических клеток восстанавливается быстрее, чем у доноров костного мозга. Но выбор конкретного метода зависит от ситуации.
Пуповинная кровь: еще один источник стволовых клеток?
В немецких онкологических центрах пуповинная кровь новорожденных как источник стволовых клеток имеет относительно небольшое значение из-за ее дефицита. Она действительно содержит много ценного биологического материала. В отличие от взрослой донорской крови или костного мозга, клетки новорожденного не подвергались возрастным изменениям. С биологической точки зрения, они идеальны.
Донорская пуповинная кровь лучше переносится реципиентами, но количество материала, как правило, недостаточное. В результате реципиенту потребуется больше времени, чтобы полностью восстановиться после лечения рака.
Часто задаваемые вопросы о лечении
Трансплантация клеток или же органов от другого человека называется аллогенной. Если пациент предлагает собственный костный мозг или периферические клетки крови во время ремиссии болезни, такая процедура носит название аутологичной. Выбор метода зависит не только от желания пациента: немецкие врачи учитывают множество объективных клинических факторов, в том числе тип рака, состояние здоровья, доступность близкородственного донора и многое другое.
Аутогенная пуповинная кровь доступна только в том случае, если у вас при рождении брали кровь материала на хранение. Таким образом, почти все такие трансплантации аллогенные, то есть они требуют подходящего донора из банка.

В зависимости от клинической ситуации, предварительно назначают дополнительные лекарства для подавления раковых клеток или облегчения побочных эффектов.
Поиск донора обычно начинается с ближайших родственников пациента. Однако не все больные, которым требуется трансплантация аллогенных (донорских) стволовых клеток крови, находят подходящего донора в семейном кругу. Национальные и международные (европейские) базы данных позволяют им найти не родственного донора. Благодаря развитой системе донорства немецкие клиники в большинстве случаев могут своевременно найти необходимый трансплантат. Сегодня в этой стране каждый здоровый взрослый человек в возрасте от 18 до 55 лет имеет право пожертвовать клетки.
Критерии исключения — некоторые хронические заболевания. Современные технологии диагностики и оценки качества биологического материала гарантируют безопасность любых тканей, взятых из немецких банков. С каждым годом трансплантация стволовых клеток крови становится все более надежным и доступным лечением лейкемии и лимфомы.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
Мы с тобой одной крови



Чудо после рождения
— Янина Ивановна, расскажите, как получают пуповинную кровь?
— Пуповина соединяет эмбрион, а потом и плод с плацентой. В этом временном органе есть одна вена и две артерии. Вена — тот сосуд, по которому кислород и питательные вещества поступают от матери к ребенку. По рекомендации ВОЗ через минуту после рождения пуповина пережимается. Считается, что за это время кровь из вены успеет вернуться к новорожденному. Но пока отток крови к ребенку не произошел полностью, мы можем успеть ее собрать. Поэтому, чтобы сохранить пуповинную кровь, пережатие пуповины нужно произвести буквально спустя 30 секунд после появления малыша на свет.
— В интернете можно найти статьи, в которых пишут о том, что процедура вредит новорожденному. Насколько это соответствует действительности?

— В чем заключаются целительные свойства пуповинной крови?
— Впервые пуповинная кровь была использована в 1988 году, так как накануне ученые обнаружили, что в ней содержится большое количество стволовых клеток. Трансплантация прошла успешно. И это событие открыло эру использования пуповинной крови как еще одного источника гемопоэтических стволовых клеток.
— Каковы преимущества стволовых клеток пуповинной крови по сравнению со стволовыми клетками, получаемыми из других источников — костного мозга и периферической крови?
— Для трансплантации пуповинной крови необходимо меньше локусов совместимости, чем для трансплантации костного мозга. Пуповинная кровь с большей вероятностью подойдет родственникам при необходимой пересадке. Стволовые клетки пуповинной крови моложе. Их способность размножаться и дифференцироваться в нужные организму клетки значительно мощнее. Кроме того, они вызывают меньшую реакцию трансплантат против хозяина.
Надежный банковский депозит
— Для лечения каких патологий используют пуповинную кровь?
— В основном она используется для лечения заболеваний, связанных с системой крови и иммунной системой, а также генетических заболеваний обмена веществ. Среди них лейкозы, лимфомы, анемии, тромбоцитопении, иммунодефициты, наследственные патологии, опухоли костного мозга и другие. А также при неврологических расстройствах и аутоиммунных заболеваниях.
— Известно, что с помощью одной дозы можно спасти только ребенка до десяти лет. Тогда в чем смысл сохранять ее дольше?
— Считается, что замороженная доза может обеспечить лечение ребенка массой тела до 30 килограммов. И только 12—13 процентов от хранимых образцов могут пригодиться для пациента весом 70—80 килограммов. Но стволовые клетки пуповинной крови можно нарастить. Мы используем один из отработанных методов приумножения клеток. Эти технологии постоянно совершенствуются.
— В нашей стране есть два частных банка пуповинной крови. А публичного банка пуповинной крови у нас нет. Как же оказывают помощь белорусским пациентам, пуповинную кровь которых не сохранили?
— Только у 30 процентов пациентов, которым нужна трансплантация стволовых клеток, есть полностью совместимый родственный донор. В мире было сделано более 40 000 трансплантаций пуповинной крови из публичных банков и 2000 из частных. Публичный банк создает государство или меценат. Содержание публичного банка требует много средств. Он формируется из доз крови, от которых отказались роженицы. При этом сами они в последующем не могут воспользоваться своей дозой. Если мы нашли в каком-то публичном банке кровь для нашего пациента, государство ее оплачивает и проводится трансплантация. У нас есть возможность сохранять пуповинную кровь только в персонифицированном банке, единицы которого могут использовать только те, кто платит за хранение.
— Кого может спасти пуповинная кровь из частного банка?
— Считается, что она подходит не только самому ребенку, но и его родственникам первой линии. К 70 годам вероятность онкологического заболевания возрастает. И если до 10 лет одна трансплантация этих клеток проводится в соотношении один случай на 1660 человек, то в 70 лет — одна трансплантация приходится на 271 человека. То есть с годами возрастает вероятность использования пуповинной крови как самим донором, так и его родителями, братьями и сестрами. Благодаря совершенствованию методов приумножения стволовых клеток пуповинной крови шансы их использования увеличиваются. Официально нашему банку 10 лет. Мы рекомендуем всем родителям наших пациентов сохранять пуповинную кровь при рождении последующих детей. Для них услуга бесплатная. Кроме того, следует это делать, если в семье есть братья и сестры с заболеванием, которое потенциально можно вылечить трансплантацией пуповинной крови. Сегодня в нашем банке хранится около 400 единиц. Обработка пуповинной крови и первый год стоит около 650 долларов. В других странах — от 2000. А в последующем клиент платит около 20 долларов в год.
Спасли жизнь уже дважды
— Как долго может содержаться пуповинная кровь в банке, не теряя при этом своих свойств?

— Гуляет миф о том, что стволовые клетки пуповинной крови могут спровоцировать онкозаболевания.
— Нет, эти клетки не вызывают развития опухолей. Они безопасны.
— Довелось ли за десять лет, что существует банк, размораживать кровь?
— Да, дважды. У нас был пациент с миелодиспластическим синдромом и пациентка с апластической анемией. Их родители родили вторых деток, пуповинная кровь которых и спасла им жизнь.
Читайте также:

