Простата тур рак гистология
Хирургическое удаление новообразования является одним из наиболее эффективных методов лечения рака предстательной железы (простаты). В статье пойдет речь о том, что собой представляет операция ТУР простаты, в чем ее особенности при раке, какие бывают осложнения и как ускорить восстановительный период.
Необходимо помнить, что ТУР предстательной железы не входит в число радикальных операций. Этот метод оперативного лечения направлен не на устранение опухоли и лечение онкологии, а на симптоматическое лечение, улучшающее качество жизни пациентов с болезненными проявлениями.

ТУР простаты: особенности и показания
Трансуретральная резекция простаты при онкозаболеваниях представляет собой малоинвазивное оперативное вмешательство, направленное на удаление пораженной части железы.
Этот метод хирургического лечения применяется при ранних стадиях местнораспространенного рака. Следует учитывать, что, в отличие от радикальной простатэктомии, операция является не методом лечения онкологии. Ее цель заключается в ослаблении болезненных симптомов, вызванных нарушениями мочеиспускания, в частности, устранении острой задержки мочи, вызванной сдавливанием новообразованием уретрального канала.
Показаниями к ТУР простаты являются:
- острая задержка мочи, вызванная развитием злокачественного процесса;
- выраженная гематурия (наличие крови в моче);
- болезненность при мочеиспускании;
- выявление доброкачественной опухоли или онкообразования;
- инфекционные воспаления уретры.
Трансуретральная резекция предстательной железы противопоказана в случае наличия новообразований большого размера, пациентам преклонного возраста с выраженными нарушениями свертываемости крови. Кроме того, процедура не проводится при воспалительных заболеваниях мочевыводящих путей (в этом случае операцию откладывают до стабилизации состояния пациента).
ТУР простаты: разновидности операции
Различают следующие две разновидности трансуретральной резекции:
- монополярная ТУР — электрическая петля разогревается током, пропущенным через ткани пациента, до температуры, позволяющей произвести резекцию новообразования и прижечь поврежденные кровеносные сосуды;
- биполярная ТУР — два электрода расположены на одном конце петли, формирование между ними тока дает возможность проводить операции пациентам с наличием сердечно-сосудистых заболеваний.
ТУР простаты: подготовка
Еще одним безусловным достоинством трансуретральной резекции предстательной железы является отсутствие необходимости в специальной подготовке к операции.
Перед оперативным вмешательством пациенту следует пройти следующие исследования:
- общий и биохимический анализы крови и мочи;
- рентгенография органов грудной клетки;
- ЭКГ;
- осмотр терапевта и анестезиолога.
Последний раз принимать пищу разрешается вечером накануне операции, в день процедуры следует воздерживаться и от питья. Для очистки кишечника утром в день операции пациенту делают клизму, а перед процедурой сбривают волосы в области паха и промежности.
Трансуретральная резекция простаты: ход операции
Операция проводится под общим внутривенным или эпидуральным (спинальным) наркозом. Продолжительность процедуры — около 1 часа.
В уретральный канал пациента вводится специальный, оснащенный видеокамерой, прибор — резектоскоп. Он продвигается по уретре к предстательной железе, после чего производится иссечение новообразования электропетлей. В ходе операции мочевой пузырь постоянно промывается физиологическим раствором, что значительно улучшает видимость. При онкопатологиях железы (в отличие от аденомы) отсутствуют или плохо выражены четкие границы резекции. Иссечение опухоли проходит под дополнительным контролем введенного в прямую кишку пациента пальца хирурга-онкоуролога. После резекции новообразования прижигаются кровеносные сосуды для прекращения кровотечения, а в мочевой пузырь устанавливается дренаж.
ТУР простаты: послеоперационный период
В первые несколько недель после резекции у пациента наблюдается гематурия. Кровотечение развивается вследствие отслоения кровяных сгустков, сформировавшихся при прижигании кровеносных сосудов.
Катетер, который устанавливается в мочевом пузыре в ходе операции, используется для постоянного промывания органа. Продолжительность промывания различается в зависимости от выраженности кровотечения.
Практически всегда в послеоперационный период пациент ощущает дискомфорт, болезненность, ощущения рези и жжения в процессе мочеиспускания, жалуется на частые позывы. Эти болезненные симптомы являются проявлениями воспалительного процесса, для снятия которого проводится антибиотикотерапия.
Для ускорения восстановления в первые после операции дни следует соблюдать такие правила:
- малые порции воды можно начинать пить уже через два-три часа после оперативного вмешательства;
- принимать пищу разрешается на следующий день;
- воздерживаться от физических нагрузок;
- не допускать переохлаждения;
- не употреблять алкогольные напитки.
Осложнения после ТУР простаты
- Нарушения мочеиспускания (болезненность, ощущение рези и жжения).
- Гематурия.
- Цистит, пиелонефрит.
- Послеоперационный простатит.
- Стриктура (сужение) уретры.
- Недержание мочи.
- Ретроградная эякуляция — нарушения выброса спермы во время эякуляции (сперма не выводится через уретральный канал, а направляется в мочевой пузырь). Безопасное состояние, проявляющееся помутнением мочи после сексуального контакта. Встречается у каждого пятого пациента после ТУР.
- ТУР-синдром — всасывание в кровеносное русло жидкости, которая в ходе операции использовалась для промывания. Развивающееся в результате разрушение эритроцитов и нарушение электролитного баланса крови может быть опасным для пациентов с сопутствующими сердечно-сосудистыми заболеваниями. ТУР-синдром встречается достаточно редко, однако для его предупреждения применяется именно биполярная ТУР простаты.
ТУР простаты: преимущества и недостатки
Операция обладает рядом преимуществ:
- минимальное количество и выраженность послеоперационных осложнений;
- отсутствие шрамов и рубцов;
- быстрый восстановительный период.
Основной недостаток операции заключается в сложности визуального определения границ резекции вследствие распространения злокачественного процесса.
ТУР простаты: диета

После проведения операции пациенту необходимо придерживаться определенных правил и режима питания. Причем желательно делать это не только первые недели после вмешательства, но и на протяжении дальнейшей жизни.
Диета после ТУР простаты основывается на следующих принципах:
- питаться нужно дробно (мелкими порциями, не реже 5 раз в день);
- мясные продукты должны составлять не более трети всего рациона;
- из меню следует исключить жирные, копченые, жареные и соленые блюда;
- запрещается употреблять продукты, в состав которых входят ароматизаторы, красители, консерванты, эмульгаторы.
В состав ежедневного рациона включаются:
- нежирные сорта мяса (говядина, свинина, кролик, птица);
- рыба (палтус, лосось, сардины, семга, сельдь) и морепродукты (мидии, креветки);
- овощи (капуста, картофель, свекла, морковь, кабачки);
- бобовые (фасоль, чечевица);
- сухофрукты (изюм, курага, инжир, чернослив).
- чеснок, хрен, горчица (постепенное введение в рацион разрешается не ранее пятого дня после операции).
Из напитков, кроме негазированной питьевой воды, разрешаются соки-фреш (овощные, фруктовые), компоты, некрепкий зеленый чай. Также полезны приготовленные дома йогурт и простокваша, кисломолочные коктейли с добавлением фруктов и ягод.

- English
- Русский







































Главное меню
- Редакционная коллегия
- Редакционный совет журнала
- Архив
- База авторов
- Порядок рецензирования статей
- Информация для авторов
- Информация для рекламодателей
- Издательский дом
- Политика редакции
- Обратная связь
Главное меню
- Редакционная коллегия
- Редакционный совет журнала
- Архив
- База авторов
- Порядок рецензирования статей
- Информация для авторов
- Информация для рекламодателей
- Издательский дом
- Политика редакции
- Обратная связь
В настоящее время золотым стандартом диагностики рака предстательной железы (РПЖ) является гистологическая оценка биоптатов, полученных при трансректальной тонкоигольной мультифокальной биопсии предстательной железы (ПЖ) под контролем ультразвукового исследования [1,2,3]. Биоптаты ПЖ являются одним из самых сложных материалов для гистологической оценки. Морфологическая идентификация минимального фокуса аденокарциномы представляет значительную сложность в связи с необходимостью дифференциальной диагностики микрофокуса аденокарциномы с большим количеством доброкачественных состояний.
В настоящее время широко распространена биопсия из 10-14 точек [4,5]. В ряде случаев при наличии в анамнезе пациента простатической интраэпителиальной неоплазии или атипической мелкоацинарной пролиферации выполняется сатурационная биопсия ПЖ. Несмотря на то, что накоплен немалый опыт выполнения биопсии ПЖ в некоторых учреждениях биоптаты из левой и правой долей погружаются в два, отдельно маркированных, контейнера. Соответственно, при работе с гистологическим материалом в лаборатории биоптаты из одной доли помещаются в один блок и, таким образом, на микропрепарате оказывается несколько (от 3 и больше) фрагментов ткани ПЖ. Множество столбиков в одной кассете приводит к неравномерной заливке парафином биопсийного столбика и может вызвать потерю значительного количества материала для гистологического исследования и к большому количеству артефактов. Европейской и Американской ассоциациями патологов рекомендовано размещение на микропрепарате не более одного столбика ткани. Это не только позволяет сохранить длину биоптата и свести к минимуму количество артефактов, но и помогает спланировать постановку игл при брахи- и (или) криотерапии, решить вопрос об объеме предстоящей операции или спланировать ход повторных биопсий с прицельным забором большего количества фрагментов 7.
Следующим этапом работы с биопсийным материалом является макроскопическое описание столбиков тканей с последующим формированием патологоанатомического заключения. В мире приняты следующие диагнозы для оценки биоптатов ПЖ [6,7]:
- Аденокарцинома предстательной железы;
- Фокус, подозрительный в отношении аденокарциномы предстательной железы (атипическая мелко-ацинарная пролиферация);
- Простатическая интраэпители-альная неоплазия высокой степени;
- Нет данных за злокачественное образование.
В большинстве случаев злокачественные новообразования ПЖ представляют собой ацинарную аденокарциному. При формировании патологоанатомического заключения описывается длина каждого биоптата и процент протяженности опухоли в каждом из биоптатов; степень дифферен-цировки опухоли по системе градации Глисона; общее количество биоптатов с аденокарциномой; локализация опухоли, согласно схеме, предоставленной урологами; наличие опухоли в пери-простатической жировой ткани; наличие периневральной инвазии.
Протяженность опухолевой ткани в биоптатах подсчитывается в процентах. Расчет заключается в делении общей протяженности пораженной ткани биоптата на общую длину биоптата за исключением длины перипростатической ткани.
В биоптат ПЖ может попасть перипростатическая ткань и ткань семенных пузырьков, что позволяет патологу диагностировать экстрапрос-тическую инвазию и инвазию в семенные пузырьки.
Степень дифференцировки аденокарциномы ПЖ производится согласно шкале Глисона. Основным принципом данной шкалы является просмотр биоптатов под малым увеличением (объективы 4х-10х) с преимущественной оценкой тканевой атипии 14. За редким исключением РПЖ имеет неоднородную структуру [12,13,16,17]. Поэтому для того, чтобы подсчитать показатель Глисона при исследовании ткани ПЖ после биопсии суммируют две наиболее высоких градации, с указанием их процентного соотношения. Полученное число баллов служит важным прогностическим критерием, позволяющим предположить более быстрое прогрессирование заболевания, метастази-рование и снижение выживаемости.
Классификация Глисона остается стандартным подходом в гистологической градации аденокарциномы предстательной железы. Изменения, внесенные в классификацию Глисона в 2004 году, так же учтены и в классификации 2016 года. Существенным дополнением классификации 2016 года явилась рекомендация указывать процент 4 балла в случае суммы баллов 7, а так же введены так называемые прогностические группы.
В 2014 году, международное общество уропатологов (ISUP) модифицировало классификацию Глисона. Основные выводы следующие:
- решетчатые (крибриформные) структуры должны быть отнесены к баллу 4;
- железы с гломеруляциями должны быть отнесены к баллу 4;
- оценка муцинозной аденокарциномы ПЖ должна быть основана на ее основном характере роста.
В прошлом в некоторых случаях крибриформная аденокарцинома была оценена как балл 3, в соответствии с классификацией ВОЗ 2004 года редкие решетчатые железы могли быть оценены как балл 3. Однако последние данные показали, что крибриформная аденокарцинома является независимым фактором прогноза биохимического рецидива после радикальной простатэктомии (РПЭ), метастазирования после РПЭ и раковоспецифической выживаемости 20. Поэтому все крибриформные структуры принято относить к 4 баллу. Еще одним изменением в классификации ВОЗ 2004 года является то, что плохо сформированные железы относятся к баллу 4. В настоящее время балл 4 включает: решетчатые железы, сливающие железы, плохо сформированные железы, железы с гломеруляциями. В рекомендациях 2016 года требуется указывать процент балла 4 при сумме баллов 7 в патологических ответах биопсии ПЖ и в патологических заключениях после РПЭ, в рекомендациях ВОЗ 2004 года, патологические заключения, указывающие балл 4/5, не часто встречались в клинической практике. Указание процента 4 балла может иметь решающее значение в планировании дальнейшего лечения. Так, например, некоторым пациентам с суммой баллов 3+4=7, при низком проценте 4 балла, может быть предложено активное наблюдение. Множество данных, позволяет предположить, что указание процента аденокарциномы таких высоких грейдов как 4 и 5, является важным прогностическим показателем. Однако, метод, который необходимо использовать для определения процентного соотношения, не уточняется.
Недавно был разработан перечень прогностических групп. На конгрессе международного общества уропатологов в 2014 году состоялся консенсус с участием широкого круга патологов и клиницистов, на котором была предложен новый взгляд на использование шкалы Глисона, подразумевающий создание прогностических групп от 1 до 5 на основании суммы баллов градации Глисона и прогноза для пациента:
Группа 1: Сумма баллов, согласно градации Глисона 3+3=6;
Группа 2: Сумма баллов, согласно градации Глисона 3+4=7;
Группа 3: Сумма баллов, согласно градации Глисона 4+3=7;
Группа 4: Сумма баллов, согласно градации Глисона 4+4=8, 3+5=8, 5+3=8;
Группа 5: Сумма баллов, согласно градации Глисона 9-10.
Есть несколько оснований для создания групп: сумма баллов 2 и 5 не используется или используется крайне редко, баллы шкалы Глисона были сформированы достаточно давно с использованием других механизмов, определяющих факторы прогноза. Кроме того, группа 1 обозначает для клинициста и пациента, что сумма баллов 6 является минимально возможной из 6 групп, а не указывает на некую среднюю сумму баллов от 1 до 10. Данное положение является критическим и информирует все заинтересованные стороны, о том, что аденокарцинома ПЖ балл 1 имеет благоприятный прогноз. Таким образом, пациенты из группы 1 с учетом клинических данных (уровень ПСА сыворотки крови, клиническая стадия заболевания, количество опухоли в ткани всех биоптатов ткани ПЖ) могут быть кандидатами на активное наблюдение. Прогностическая значимость пяти групп была подтверждена в крупном исследовании с участием множества институтов. Было исследовано более 20 000 случаев РПЭ, более 16 000 случаев тонкоигольных биопсий ПЖ и более 5000 биопсий с последующей лучевой терапией [21]. Интересно так же, что существуют геномные корреляции в поддержку формирования данной групповой оценки прогноза заболевания [22]. В связи с чем, согласно рекомендациям ВОЗ 2016 г., прогностический балл в патологоанатомическом ответе необходимо указывать наряду с общепринятой градацией по шкале Глисона с учетом ее изменений в 2014 году.
ВЫВОДЫ
1. При выявлении атипической мелкоацинарной пролиферации рекомендовано выполнение повторной биопсии.
2. Сумма баллов по системе градации Глисона 2-4 всегда является заниженной и некорректной. Под этим диагнозом может скрываться аденокарцинома с суммой баллов 6 или аденоз (атипическая аденоматозная гиперплазия). Сумма баллов 5, практически всегда является заниженной и будет выше после радикальной простатэктомии.
3. При нескольких позитивных биоптатах, содержащих различные степени дифференцировки по системе градации Глисона, суммируются две наиболее высокие градации.
4. Средняя длина столбика ПЖ на микропрепарате должна составлять не менее 1 см.
5. Частота диагностики атипической мелкоацинарной пролиферации не должна превышать 5%.
6. Рекомендовано выполнять забор биопсийных столбиков согласно карте биопсии ПЖ, когда каждый биопсийный столбик погружается в отдельный маркированный контейнер.
7. Рекомендовано размещать на одном микропрепарате не более одного столбика ткани.
8. В патологоанатомическом ответе необходимо указывать прогностический балл наряду с общепринятой градацией по шкале Глисона с учетом ее изменений в 2014 году.
Работа выполнена при поддержке РНФ, соглашение № 14-15-01120.
ЛИТЕРАТУРА
1. Rogatsch H, Moser P, Volgger H. Diagnostic effect of an improved preembedding method of prostate needle biopsy specimens. Hum Pathol 2000; 31(9):1102-1107.
2. Delahunt B, Nacey JN. Broadsheet number 45: thin core biopsyof prostate. Pathol 1998; 30:247-256.
3. Ohori M, Kattan M, Scardinio PT. Radical Prostatectomy for carcinoma of the prostate. Mod Pathol 2004; 17(3):349-359.
4. Srigley JR, Jones B, Kapusta L. The effect of specimen submission protocols on the detection rate of histologic abnormalities in sextant prostate biopsies (abstract). Mod Pathol 2001; 14:123.
5. Lane RB, Lane CG, Mangold KA. Needle biopsy of prostate. What constitutes adequate histologic sampling? Arch Pathol Lab Med 1998; 122:833-835.
6. Murthy WM, Ramsey J, Soloway MS. A better nuclear fixative for diagnostic bladder and prostate biopsies. J Urol Pathol 1993; 1:79-87.
7. Boccon-Gibod L, van der Kwast TH, Montironi R, Boccon-Gibod L, Bono A. Handling and reporting of prostate biopsies. Eur Urol 2004; 46(2):177-181.
8. Reyes AJ, Humphrey PA. Diagnostic effect of complete histologic sampling of prostate needle biopsy specimens. Am J Clin Pathol 1998; 109:416-422.
9. Kao J, Upton M, Zhang P, Rosen S. Individual prostate biopsy core (Bc) embedding facilitates maximal tissue representation. J Urol 2002; 168(2):496-499.
10. Brat DJ, Wills ML, Lecksell KL, Epstein JI. How often are diagnostic feartures missed less extensive sampling of prostate needle biopsy specimens? Am J Surg Pathol 1999; 23:257-262.
11. Humphrey P. A. Prostate pathology. Chicago. 2007, 556 p.
12. Coard KS, Freeman VL. Gleason grading of prostate cancer: : level of concordance between pathologists at the University Hospital of the West Indies. Am J Clin Pathol 2004; 122:373-376.
13. Gleason DF. Histologic grading of prostate cancer: a perspective. Hum Pathol 1992; 23:273-279.
14. Cangiano TG, Litwin MS, Naitoh J, Dorey F, deKernion JB. Intraoperative frozen section monitoring of nerve sparing radical retropubic prostatectomy. J Urol 1999; 162(3 Pt 1):655-658.
15. Epstein JI. Pathologic assessment of the surgical specimen. Urol Clin North Am 2001; 28(3):567-594.
16. Humphrey PA. Gleason grading and prognostic factors in carcinoma of the prostate. Mod Pathol 2004; 17:292-306.
17. Gleason DF, Mellinger GT. Prediction of prognosis for prostatic adenocarcinoma by combined histological grading and clinical staging. J Urol 1974; 111 (1):59-64.
18. Kir G, Sarbay BC, Giimiij E, Topal CS. The association of the cribriform pattern with outcome for prostatic adenocarcinomas. Pathol Res Pract 2014;210(10):640-644. doi: 10.1016/j.prp.2014.06.002
19. Dong F, Yang P, Wang C, Wu S, Xiao Y, McDougal WS, et al. Architectural heterogeneity and cribriform pattern predict adverse clinical outcome for Gleason grade 4 prostatic adenocarcinoma. Am J Surg Pathol 2013; 37(12):1855-1861. doi: 10.1097/PAS.0b013e3182a02169.
20. Kweldam CF, Wildhagen MF, Steyerberg EW, Bangma CH, van der Kwast TH, van Leen-ders GJ. Cribriform growth is highly predictive for postoperative metastasis and disease-specific death in Gleason score 7 prostate cancer. Mod Pathol 2015; 28(3):457-464. doi: 10.1038/mod-pathol.2014.116.
21. Epstein JI, Zelefsky MJ, Sjoberg DD, Nelson JB, Egevad L, Magi-Galluzzi C, et al. A contemporary prostate cancer grading system: a validated alternative to the Gleason score. Eur Urol 2016; 69(3):428-435. doi: 10.1016/j.eururo.2015.06.046
22. Rubin MA, Girelli G, Demichelis F. Genomic correlates to the newly proposed grading prognostic groups for prostate cancer. Eur Urol 2016;69(4):557-560. doi: 10.1016/ j.eururo.2015.10.040.
Работа выполнена при поддержке РНФ, соглашение № 14-15-01120.
г. Краснодар, ул. 40 лет Победы, 108
Пн.-Суб.: с 08:00 до 20:00
Вс.: с 09:00 до 17:00
г. Краснодар, ул. Яна Полуяна, 51
Пн.-Суб.: с 08:00 до 20:00
- О клинике
- Отзывы
- Партнеры
- Вакансии
- Акции
- Лицензии
- Научные работы
- Отделения
- Наши врачи
- Полезное
- Новости
- Статьи
- Прайс-лист
- Вопрос-ответ
- Глоссарий
- Политика конфиденциальности
- Политика обработки персональных данных
- Правовая информация
- Новости
- Прайс
- Контакты
ТУР: трансуретральная резекция аденомы простаты

19 лет опыта


273.016 пациентов

ТУР. Трансуретральная резекция аденомы простаты
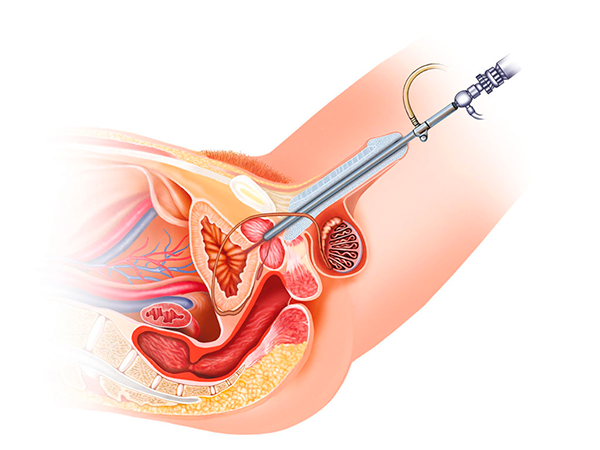
Если вам или близкому человеку поставлен диагноз аденома простаты и рекомендовано оперативное лечение, то, вероятно, вы испытываете беспокойство и хотите узнать больше о предстоящей операции. В этой статье мы доступно и подробно расскажем, что это за операция, в чем преимущества такого вида лечения, а также расскажем о сроках послеоперационного восстановления.
Прежде всего главное: во время операции ТУР удаляется не простата, а только опухоль (аденома), а сам орган остается. Операция проводится эндоскопически с помощью резектоскопа. Резектоскоп – это специальный инструмент, который вводится через уретру (мочеиспускательный канал). Преимущества операции в том, что она проводится без разрезов, через естественные отверстия. В процессе операции осуществляются тонкие срезы ткани с помощью резектоскопа.
Если пациенту противопоказан эпидуральный вид обезболивания, применяется эндотрехеальный наркоз. Вид наркоза выбирает врач-анестезиолог.
В начале операционное поле будет обработано антисептиком. Затем хирург вводит резектоскоп в канал и осматривает мочевой пузырь. После этого резектоскоп располагается в простатическом отделе уретры, где будут выполняться срезы. Цель операции – удалить опухоль. После удаления срезы опухоли отправляются на гистологическое исследование.
После операции в мочевой пузырь будет установлен катетер на 2-3 дня. Обычно первые сутки пациент проводит в палате реанимации. После того как состояние нормализуется, пациента переводят в обычную палату. После операции вам будет проведена антибактериальная и противовоспалительная терапия.
- Никаких разрезов;
- Максимально быстрый и легкий восстановительный период;
- Быстрый процесс восстановления мочеиспускания: мочевой пузырь не вскрывается и его целостность не нарушается;
- Вы сможете вернуться домой через 4-5 суток (зависит от индивидуального состояния пациента. Только врач решит, когда вас можно выписывать).
Запишитесь на прием прямо сейчас, заполнив онлайн-форму на нашем сайте.
Читайте также:

