Прогестерон при раке шейки матки
Харьковский национальный медицинский университет, ассистент кафедры патоморфологии, зав. каф. – А.Ф. Яковцова
РОЛЬ уровня ЭСТРОГЕНОв и прогестерона В ВОЗНИКНОВЕНИИ ПЛОСКОКЛЕТОЧНЫХ ИНТРАЭПИТЕЛИАЛЬНЫХ ПОРАЖЕНИЙ И РАКА ШЕЙКИ МАТКИ
Плоскоклеточные интраэпителиальные поражения шейки матки (ПИПШМ) (син. цервикальная интраэпителиальная неоплазия – cervical intraepithelial neoplasia – CIN ), включающие в свое понятие диспластические изменения различных степеней тяжести и преинвазивную (интраэпителиальную) карциному (карциному in situ ), предшествуют развитию инвазивного рака и наблюдаются у женщин различного возраста.
Целью нашей работы явилось изучение роли уровня эстрогенов и прогестерона в возникновении ПИПШМ и рака шейки матки (ШМ).
При анализе распределения пациенток с ПИПШМ и инвазивным плоскоклеточным раком по возрасту в нашем исследовании выявлено, что пик заболеваемости приходится на возраст 50-59 лет и 40-49 лет соответственно. Это группы, где наиболее часто встречаются полипы шейки матки и еще достаточно велико количество эндоцервикозов, а также наиболее часто встречаются пролиферативные процессы миометрия и эндометрия, что косвенно указывает на гормональные изменения в организме женщин, обусловленными периодами климакса и менопаузы. В литературе имеются сведения о том, что пролиферативная активность эпителия экзоцервикса определяется уровнем эстрогеновых гормонов в организме, подобная чувствительность эпителиальных клеток связана с наличием специализированных ядерных рецепторов к эстрогенам в ядрах базального и парабазального слоев. При высоком уровне эстрогенов в крови эти клетки могут проявлять митотическую активность. И о том, что локальные изменения в экзоцервиксе проходят на фоне гормональных нарушений в гипоталамо-гипофизарно-яичниковой системе свидетельствует высокий процент выявленных в нашем исследовании пролиферативных процессов миометрия и эндометрия (железистой гиперплазии и полипов эндометрия, фибромиом матки).
Однако в литературе имеются противоречивые сведения о содержании эстрогенов при пролиферативных процессах. По мнению ряда исследователей, значение имеет не столько количество выделяемых эстрогенов, сколько нарушение их экскреции и метаболического превращения, а также нарушение качественного соотношения между фракциями эстрогенов.
В связи с тем, что обмен женских половых гормонов представляет собой тонкий, сложный и весьма уязвимый процесс, существует большое количество факторов, которые, несмотря на их кажущуюся безобидность, могут вызывать достаточно серьезные нарушения в обмене женских половых гормонов. Метаболизм эстрогенов нарушается при сочетании неблагоприятных факторов внешней среды и генетической предрасположенности к ним. Среди генетических факторов, которые приводят к высокой восприимчивости к нарушению метаболизма эстрогенов, можно выделить полиморфизм генов, кодирующих ферменты фаз детоксикации. Среди неблагоприятных факторов внешней среды можно отметить следующие: курение; прием гормональных контрацептивов или женских половых гормонов с лечебной целью; различные токсические соединения; гормоны в продуктах питания; ожирение (способствует накоплению женских половых гормонов в организме, т.к. жировая клетчатка содержит большое количество фермента ароматазы – CYP19, который превращает мужские половые гормоны, образующиеся в надпочечниках, в эстрогены); заболевания желудочно-кишечного тракта; стрессы; дефицит нутриентов (многие витамины и минералы являются кофакторами ферментов, которые принимают участие в процессах превращения женских половых гормонов в организме); малоподвижный образ жизни (физические нагрузки стимулируют 2-гидроксилирование и детоксикацию эстрогенов).
Если неблагоприятные факторы внешней среды воздействуют на организм женщины длительное время, то рано или поздно организм начнет давать сбои, и могут появиться первые жалобы: болезненные и обильные менструации, боли в груди, связанные с менструацией, появление уплотнений в молочной железе, внезапные колебания веса, колебания настроения. Однако эти симптомы неспецифичны. Чрезмерное количество эстрогенов стимулирует пролиферацию эпителиальных и стромальных клеток матки, молочной железы. А это, в свою очередь, может привести к развитию эндометриоза, фиброзно-кистозной мастопатии, фибромиом матки и полипов эндометрия. Состояние гиперэстрогенемии также способствует внедрению папилломавирусной инфекции в ШМ и развитию дисплазии. Это обусловлено прежде всего тем, что эстрогены обладают антиапоптотическим действием по отношению к эпителиальным клеткам ШМ, причем этот эффект не связан с их митогенным действием. Кроме того, эстрогены стимулируют экспрессию Е6-онкогена вируса папилломы человека (ВПЧ) 16, который в свою очередь связывается с геном супрессии опухоли р53 и способствует ослаблению его экспрессии. Еще одно негативное действие эстрогенов на развитие дисплазий проявляется в том, что, с одной стороны, они стимулируют экспрессию двух вирусных генов Е6 и Е7, вызывающих онкогенную активность, а с другой – ингибируют иммунологическое разрешение при начальных повреждениях слизистой оболочки ШМ вирусом папилломы человека путем снижения экспрессии антигенов главного комплекса гистосовместимости I и II классов.
Литературные данные также сообщают, что количество эстрогеновых рецепторов в эпителиальных клетках с явлениями неоплазии снижена, при этом экспрессия вирусных антигенов (ВПЧ) повышается. По мнению авторов, снижение экспрессии рецепторов к эстрогенам в инфицированных ВПЧ эпителиальных клетках способствует прогрессии неопластических перерождений эпителия ШМ. При этом, несмотря на уменьшение количества рецепторов по мере нарастания неопластических изменений в этих клетках, увеличивается эстрогеннезависимая пролиферативная активность. Тем не менее, гиперэстрогенемию следует рассматривать как один из факторов, способствующих формированию опухолевых поражений ШМ.
Прогестерон является одним из наиболее существенных регуляторов действия эстрогенов. Прогестерон снижает множество эстрадиол-индуцируемых эффектов в матке, таких как повышение синтеза белка, РНК, ДНК, образование рецепторов прогестерона. Прогестерон ингибирует рост и пролиферацию клеток матки и приводит к необратимым последствиям в дифференцировке, и к существенным изменениям функциональных возможностей клеток матки. Наиболее очевидно, что многие антиэстрогенные эффекты прогестерона обусловлены его выраженной способностью снижать количество рецепторов эстрогенов во всех структурах матки, способствовать нарушению взаимодействия эстрогенов с рецепторами в цитозоле, увеличивать количество факторов, связывающих эстрогеновые рецепторы и тем самым снижать количество связанных с хроматином рецепторов эстрогенов. Скорее всего, влияние прогестерона на эффекты эстрогенов следует рассматривать не как антиэстрогенный эффект, а как собственное специфическое действие, которое во многом противоположно действию эстрогенов. Однако, прогестерон оказывает не только тормозящее влияние на все эффекты эстрогенов в матке, но и некоторые потенцирует, а на какие-то – не влияет. Отмечено, что прогестерон не ингибирует эстрадиол-индуцируемый синтез трансформирующего фактора роста b, который способен тормозить пролиферативные процессы. Сказанное выше свидетельствует о влиянии на неопластические процессы как высоких (потенцирующих действие эстрогенов), так и низких (неингибирующих) уровней содержания этого гормона.
Таким образом, определение уровня содержания эстрогенов и прогестерона, особенно у женщин возрастных категорий, относящихся к группе риска, являются важной диагностической мерой в выявлении ПИПШМ и рака ШМ.
Ю.С. Сидоренко, Э.Л. Шурыгина, А.М. Тютюнова
Успехи в изучении патогенеза рака матки как гормонозависимой опухоли одновременно с появлением высокоактивных синтетических стероидов дали основание к широкому внедрению гормонотерапии в комплексном лечении этого заболевания (Шуваева Н.И. и соавт., 1981; Бохман Я.В. и соавт., 1981а). Из гормональных препаратов с этой целью чаще всего применяется прогестерон и его аналоги.
В основе противоопухолевого действия прогестерона лежит его физиологическое влияние на ткань матки и способность опухоли матки отвечать на действие прогестерона теми же морфологическими реакциями, которые наблюдаются в нормальных тканях этого органа при физиологическом действии эндогенного прогестерона в секреторной фазе менструального цикла. Прогестерон при раке тела матки, согласно мнению большинства исследований, снижает пролиферативную активность опухоли и повышает ее структурно-функциональную дифференцировку, стимулирует активную секрецию. В дальнейшем происходит секреторное истощение, наступают дегенеративно-атрофические изменения, которые оканчиваются отторжением опухоли или ее отдельных участков (Бохман Я.В. и соавт., 1983).
Несмотря на свою многолетнюю историю, эндокринная терапия рака тела матки содержит еще много неясных и противоречивых вопросов. Наряду с положительными клиническими результатами гормонотерапия рака тела матки дает значительную частоту рецидивов заболевания, нередко развивается гормональная резистентность опухоли или гормональная коррекция носит временный характер.
Большинство исследователей считают, что положительные клинические результаты наблюдаются только у тех больных, в опухолях которых первоначальный уровень рецепторов прогестерона был достаточно высоким. Если уровень рецепторов прогестерона низок, эффект лечения отсутствует. Одним из путей преодоления резистентности рака эндометрия к прогестеронотерапии является повышение эстрогенного фона в организме у больных в постменопаузе перед началом прогестеронотерапии. Показано, что введение прогестагенов снижает концентрацию цитоплазматических и ядерных рецепторов эстрогенов особенно в миометрии (Grilli С., 1978).
В вопросе о механизме действия прогестинов при лечении рака матки и первичности их влияния мнения исследователей нередко противоречивы. По мнению некоторых авторов, прогестины оказывают на опухоль в основном местное действие, вызывая в ней деструктивные изменения (Бохман Я.В. и соавт., 19816). Другие авторы (Вольстных Л.В., 1984) механизм действия прогестерона связывают с центральным влиянием через гипоталамо-гипофизарную систему с последующим опосредованным эффектом на опухоль.
Целью нашего исследования явилось выяснение эффективности прогестинотерапии при лечении больных раком тела матки с позиций клинического течения заболевания и местного воздействия 17-ОПК на первичный очаг, а также воздействие его на состояние гормонального баланса в целом с учетом изменений в гипоталамо-надпочечниковой и гипофизарно-гонадной системах при нестандартном – эндолифатическом – пути введения 17-оксипрогестерон-капроната.
Под наблюдением находилось 55 больных раком тела матки. Большинство из них (50 человек), имели нулевую стадию, у 10 женщин диагностирована III стадия, у 5 – IV стадия.
17-ОПК вводили в эндолимфатические сосуды нижних конечностей по методике, разработанной в институте.
У всех больных диагноз был подтвержден гистологическим исследованием соскобов слизистой оболочки полости матки. В дополнение к гистологическому заключению диагноз рака эндометрия у больных был подтвержден цитологическим исследованием эндометриальных аспиратов, рентгеноконтрастной гистероцервикографией, которые определялись в процессе лечения. Эндокринно-метаболические нарушения установлены при клиническом и лабораторном исследовании у следующего числа больных: разная степень ожирения – 55%, клинический сахарный диабет – 15%, гипертоническая болезнь – 30%. 25% больных относились к репродуктивному периоду, 75% к менопаузальному.
Оценка противоопухолевого эффекта 17-ОПК в клиническом проявлении рака матки основывалась на динамическом изучении жалоб больной, общего состояния, гинекологического статуса, переносимости гормональной терапии.
Ведущим клиническим симптомом в диагностике рака матки у большинства наших пациентов явились атипические кровянистые выделения, однократно или многократно возникающие у женщин репродуктивного возраста или многократные необильные кровянистые выделения в постменопаузальном периоде. Поэтому по частоте проявления этого симптома в процессе лечения 17-ОПК мы судили о выраженности противоопухолевого эффекта гормонотерапии.
В анамнезе у большинства больных отмечены нарушения в репродуктивном гомеостазе: эндокринная форма бесплодия, рецидивирующие гиперпластические процессы, симптомы гиперэстрогении в постменопаузе.
До проведения гормонотерапии у большинства больных определяли эстрогенный фон путем подсчета кариопикнотического индекса и числового индекса созревания влагалищных мазков. У всех больных изучались стероидные гормоны андрогенного, эстрогенного, прогестинового и глюкокортикоидного ряда в моче, а также тройные гормоны гипофиза в крови.
Эффективность применяемой гормонотерапии оценивали путем сопоставления данных биопсии эндометрия до начала и цитологических исследований аспиратов эндометрия в процессе лечения или морфологического исследования удаленного во время операции препарата. Принималось во внимание повышение дифференцировки опухоли, появление секреции, снижение митотической активности, деструктивные изменения.
Взятие крови и сбор суточной мочи для исследования содержания гормонов осуществляли до начала гормонотерапии и после ее завершения.
Лечение рака тела матки с помощью прогестерона у молодых пациенток назначалась как самостоятельное лечебное воздействие.
Перед лечением на боли жаловались 70% больных, кровянистые выделения из половых путей наблюдались у 82,5%, кровотечение у 60%.
После эндолимфатической гестагенотерапии боли уменьшились у 80%, у 76% прекратились кровянистые выделения. Исследование мазков-аспиратов из полости матки проводилось до лечения и после получения курсовой дозы. У 80% больных в результате лечения отмечена регрессия клеток опухоли. Полученные нами данные свидетельствуют о том, что изменения опухолевых клеток могут служить контролем эффективности лечения и дают возможность судить о чувствительности опухоли к гормонотерапии. Это подтверждалось признаками появления в опухоли секреции, некротических очагов, дифференцировки.
При выраженном эффекте в железах отмечались значительные секреторные превращения железистого эпителия с обильным слизеобразованием. Эпителий располагался в один слой, ядра клеток становились полиморфными. При частичном эффекте ткань опухоли после гормонотерапии состояла из железистых структур. В эпителии имелись признаки дистрофии: вакуолизация цитоплазмы и ядра.
Что касается гормональных изменений, происходящих под влиянием эндолимфатического введения 17-ОПК, то они напоминают те, которые описаны при введении прогестиновых препаратов внутримышечно. Это относится прежде всего к динамике тройных гормонов гипофиза. Под влиянием эндолимфатического введения 17-ОПК статистически достоверно снизился уровень ЛГ, сдвинулось соотношение между двумя гонадотропинами в пользу ФСГ. Эндолимфатическая прогестинотерапия сопровождалась существенными изменениями в экскреции стероидных гормонов, среди которых прежде всего на себя обращает внимание повышение уровня прегнандиола. Экскреция данного стероида увеличилась вдвое в сравнении с исходной (таблица).

Наблюдаемое повышение уровня эскреции прегнандиола произошло в основном за счет увеличения эндогенной секреции прогестерона, и определяемый прегнандиол скорее всего явился продуктом Метаболизма эндогенного прогестерона. Согласно результатам работы Н.Д. Тронько (1982) синтетические прогестины, в том числе 17-ОПК, не входят в состав выделяемого с мочой прегнандиола в основном из-за отсутствия расщепления эфира.
Одновременно с увеличением количества прегнандиола под влиянием эндолимфатической 17-ОПК-терапии наблюдалось явное возрастание суммы эстрогенных гормонов, за счет эстро- на (Э1), эстрадиола (Э2). Количество эстриола (Э3) оставалось прежним.
Среди изменений других стероидов следует отметить наблюдаемый сдвиг в соотношении 11-дезоксигенированных 17-КС и 11-оксигенированных в сторону увеличения уровня первых. Из 11-дезоксигенированных форм наибольший вклад в сдвиг соотношения отдельных представителей группы 17-КС внесла фракция этиохоланолона.
Не исключено, что наблюдаемое увеличение уровня эстрогенов в этот период усиливает действие ОПК на опухолевую ткань путем повышения в ней прогестиновых рецепторов и уменьшения эстрогенрецепторных комплексов, которые длительное время задерживаются в ядре клеток матки в неактивном виде.
Нам кажется очень важным тот факт, что повышение экскреции эстрогенов у обследуемых больных было непродолжительным: через 20 дней после прогестерон-капроната количество женских половых гормонов снова устанавливалось в пределах исходных величин.
Данные проведенной работы свидетельствуют о том, что наиболее эффективной эндолимфатическая прогестино-терапия была при карциноме у молодых женщин – 90% излеченных без операции.
Наши данные полностью подтверждают результаты работ Я.В. Бохмана (1984) о том, что 17-оксипрогестеронотерапия более эффективна у лиц, принадлежащих к I патогенетическому варианту.
С учетом полученных результатов можно думать, что разработка вопросов эндолимфатической прогестинотерапии больных предраком и раком тела матки заслуживает пристального внимания и дальнейшего внедрения, поскольку у молодых сохраняет репродуктивную систему и ее функции, а у пожилых – нередко позволяет избежать риска хирургического вмещательства, в комплексной терапии – увеличивает ее эффективность.
Рак матки – очень распространенная патология среди женщин. Для лечения заболевания используются различные методы. Одним из самых безопасных для организма считается гормонотерапия при раке.
- Можно ли применять гормонотерапию при лечении рака матки?
- В каких случаях врач может назначить гормонотерапию при лечении рака матки?
- Как проводится гормонотерапия?
- Как правильно подобрать гормональные препараты?
- Основные препараты, используемые для лечения рака матки
Можно ли применять гормонотерапию при лечении рака матки?
Гормональные препараты часто используются при лечении рака матки и других органов репродуктивной системы. С их помощью можно законсервировать опухоль, но при этом на организм не будет нанесено негативное воздействие. Кроме того, с помощью гормонов можно уменьшить размер опухоли, за счет чего она станет более операбельной.
Гормональные средства практически не имеют побочных действий. Обычно их назначают в форме таблеток, которые можно принимать на протяжении длительного периода времени.
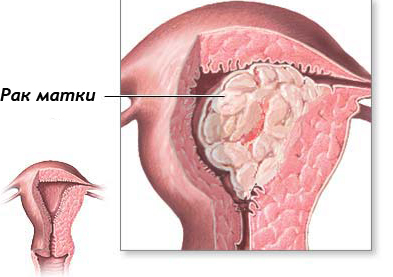
В каких случаях врач может назначить гормонотерапию при лечении рака матки?
Терапия гормонами может быть назначена лечащим врачом в нескольких основных случаях:
- Если опухоль небольшая, гормоны могут стать альтернативой хирургическому вмешательству. Конечно, она не может рассосаться сама собой, но при правильном лечении ее рост приостановится. Иногда удается добиться уменьшения новообразования. Поэтому оно не будет беспокоить женщину. Такой способ лечения подходит только в случае доброкачественности образования. В таком случае пациентке необходимо регулярно проходить обследование у гинеколога, чтобы следить за состоянием опухоли (не увеличивается ли она в размерах, нет ли в ней злокачественных клеток).
- Перед операцией, чтобы уменьшить размер опухоли. За счет этого врачу будет проще ее оперировать. К тому же, если размер новообразования больше 2 см, требуется полное удаление матки. При помощи гормональной терапии можно добиться уменьшения диаметра опухоли, поэтому при операции детородные органы будут сохранены. Более того, некоторые новообразования увеличиваются очень сильно и проникают в мышечный слой матки. Такие опухоли считаются неоперабельными, поэтому единственный способ их лечения – гормонотерапия. Если со временем новообразование уменьшится до оптимального размера, его оперируют.
- Показана гормонотерапия и после операции на половые органы женщины. Она необходима для поддержания оптимального гормонального уровня в организме. Ведь в послеоперационный период матки необходим период восстановления, поэтому продуцирование некоторых гормонов замедляется.
Обязательно назначается лечение гормональными препаратами после полного удаления матки и ее придатков, что также является одним из способов лечения рака. Это называется заместительная гормональная терапия. Препараты замещают гормоны, которые должны были продуцироваться яичниками. ЗГТ требуется не только после операции, а на протяжении всей жизни женщины для поддержания гормонального уровня.
Как проводится гормонотерапия?
При раке матки лечение гормонами обычно совмещается с радиотерапией. За счет облучения новообразование перестанет расти, а гормоны будут еще больше усиливать этот эффект. Как правило, для лечения опухоли используется прогестерон. Он представляет собой женский половой гормон, который считается очень действенным для уничтожения новообразования.
Ведь опухоль развивается за счет воздействия на нее эстрогена – еще одного полового гормона. Для подавления его действия используется Тамоксифен, содержащий прогестерон. Такой препарат замедляет прогрессирование опухоли.
А в период восстановления после операции требуется ЗГТ. В таком случае подразумевается прием сразу нескольких гормонов (эстрогены, гестагены и другие). Начало терапии – не ранее 2-3 месяцев после хирургического вмешательства.
Необходимо учитывать, что гормональная терапия имеет целый ряд противопоказаний. Она не подходит женщинам с:
- серьезными патологиями почек и печени;
- высокой предрасположенностью к тромбообразованию;
- болезнями ЖКТ.
Кстати, гормональные препараты выпускаются не только в форме таблеток, но и в виде гелей. В таком случае мазь необходимо нанести на кожу, затем она впитается и попадет в общий кровоток. Такой препарат не окажет негативного воздействия на ЖКТ.
Как правильно подобрать гормональные препараты?
Обычно в лечении рака матки используется Тамоксифен. Это безопасный для организма препарат. Его преимущество в том, что после терапии снижается вероятность рецидива патологии – повторного возникновения опухоли. Кроме того, для лечения могут быть применены ароматазы, которые блокируют выработку эстрогенов. Схема лечения может заключаться в следующем:
- прием Тамоксифена на протяжении 5 лет;
- применение только ароматазы в течение 5 лет;
- употребление 2-3 года Тамоксифена, а затем 2-3 года – ароматазы;
- прием Тамоксифена длительностью 5 лет, после чего лечение ароматазой 2-3 года.
Подбор используемых гормональных средств обязательно осуществляет лечащий врач. В процессе этого он обращает внимание на несколько критериев: стадия развития патологического процесса, применение дополнительных средств терапии, присутствие в атипичных клетках HER-2.
Основные препараты, используемые для лечения рака матки
Выше уже рассматривалось, какие гормональные препараты применяются для лечения ракового процесса. За счет их использования замедляется или полностью прекращается рост новообразования. Рассмотрим подробнее особенности каждого вещества:
- Тамоксифен. Это самое распространенное средство, используемое с целью подавления действия эстрогена. Препарат используется как до наступления менопаузы у женщин, так и после нее. Кроме того, он может быть включен в терапию до хирургического вмешательства или после его проведения. Препарат выпускается в форме таблеток. Терапия им может быть длительной – до 5 лет.
- Ароматаза. Средство применяется с целью замедления продуцирования эстрогена у женщин климатерического периода. Выделяют 2 ингибитора ароматазы – Аримидекс, Фемара и Аромазин. Каждый из них может быть использован в процессе лечения рака матки любой стадии. Нельзя принимать препарат дольше 5 лет. При очень длительном использовании может появиться хрупкость костей. Поэтому при лечении ингибиторами ароматазы необходимо регулярно проходить рентген. Дополнительно можно принимать биофосфонаты, которые укрепляют костную ткань.
- Фаслодекс. Это единственный препарат, действие которого направлено на уничтожение эстрогеновых рецепторов на поверхности всех клеток в организме. Использование средства рекомендовано для женщин периода постменопаузы, хотя оно подходит и для лечения женщин 35-40 лет. Обычно назначается Фаслодекс в тех случаях, если другие гормональные средства оказываются неэффективными при лечении рака. К тому же, его можно сочетать и с другими препаратами.
Кроме того, врач может посоветовать пациентке воздействие на яичники, за счет чего снизится выработка гормона в организме. Притом это воздействие может быть выполнено как хирургическим путем, так и при помощи медицинских препаратов.
Например, Золадекс воздействует на гипофиз и яичники, за счет чего подавляется выработка гормонов, отвечающих за продуцирование эстрогенов. Если применение медикаментов неэффективно, прибегают к более кардинальному методу – овариоэктомии. В этом случае проводится либо облучение яичников, либо полное их удаление. Однако из-за этого у женщины может наступить ранняя менопауза, из-за чего она начнет преждевременно стареть. Естественно, после такой операции пациентка не сможет стать матерью.
Большинство гормональных средств вызывают побочные действия для организма. В частности, они могут вызвать чрезмерную сухость на слизистых оболочках – влагалища, рта, носа. Кроме того, под их влиянием усиливается потоотделение у женщины, возможно покраснение половых губ. Нередко появляются выделения из влагалища – мажущие слизистые и с примесями крови. Некоторые препараты вызывают суставную боль, ломоту, в результате чего ухудшается общее самочувствие пациентки.
В большинстве случаев эти побочные действия проходят самостоятельно. Однако если они приносят женщине дискомфорт, необходимо срочно пройти обследование у гинеколога. Доктор поможет сгладить проявление побочных эффектов.
Несмотря на то что смертность от рака эндометрия (РЭ) ниже, чем при злокачественных опухолях шейки матки и яичников, она все же остается высокой, особенно если принять во внимание подавляющее число больных с первично диагностированной I стадией. Некоторые рецидивы, например, в культе влагалища можно успешно лечить с помощью хирургического вмешательства, ЛТ или комбинированным методом.
Прогноз для многих больных благоприятный, и они живут достаточно долго. К сожалению, во многих случаях рецидивы возникают за пределами верхней части влагалища и поэтому не подлежат ни хирургическому лечению, ни ЛТ. У некоторых пациенток ЛТ имеет ограниченное значение, особенно если ее применяли как этап первичного лечения. Следовательно, для многих пациенток с рецидивом рака эндометрия (РЭ) терапией выбора остается гормональная или химиотерапия.
Прогестины назначают в качестве адъювантной терапии, направленной на профилактику рецидива заболевания. В рамках рандомизированного исследования Lewis и соавт. при раке эндометрия (РЭ) применяли медроксипрогестерона ацетат (МПА) или плацебо в послеоперационный период. В обеих группах 4-летняя выживаемость была одинаковой.
Kauppila и соавт., описав более 1100 больных раком эндометрия (РЭ), получавших адъювантную терапию прогестинами в течение 2 лет после операции и ЛТ, обнаружили, что рецидивы возникали даже при высокодифференцированных аденокарциномах I стадии; по их мнению, профилактическое применение прогестинов у этих пациенток было неэффективным.
В проспективном исследовании DePalo и соавт. не обнаружили разницы в выживаемости 363 больных раком эндометрия (РЭ) I стадии, получавших МПА в течение 12 мес, и 383 пациенток с той же стадией, которые не получали этот препарат. По данным британского исследования, в котором 429 пациенток с I и II стадиями рака эндометрия (РЭ) были рандомизированы для послеоперационной терапии МПА или наблюдения, разницы в показателях выживаемости через 5 лет выявлено не было.

Прогестины применяют более 30 лет; чувствительность рецидивных опухолей рака эндометрия (РЭ) к этим гормонам доказана. Имеющиеся данные свидетельствуют о том, что приблизительно 1/3 всех больных с рецидивами рака эндометрия (РЭ) реагирует на гормональную терапию, причем частота ответов при высокодифференцированных аденокарциномах значительно выше, чем при умеренно и низкодифференцированных.
Эксперты GOG назначали МПА по 50 мг 3 раза в сутки 420 больным с выраженными стадиями или рецидивами рака эндометрия (РЭ). Из 219 пациенток с объективно измеряемыми опухолями было всего 17 (8%) с полным ответом на терапию и 13 (6 %) — с частичным. Более чем у 1/2 пациенток заболевание оставалось стабильным, а у 1/3 — прогрессировало. Медиана выживаемости составила 10,5 мес.
При высокодифференцированных аденокарциномах частота ответов на терапию прогестинами выше, чем при низкодифференцированных. GOG в рамках рандомизированного клинического исследования III фазы провела сравнительную оценку эффективности МПА в дозе 1000 и 200 мг/сут у 300 пациенток. Различий между показателями ответа на лечение и выживаемостью между двумя терапевтическими группами не отмечено. Lentz сообщил о другом клиническом исследовании GOG, в котором больным с распространенным или рецидивным раком эндометрия (РЭ) назначали высокие дозы (800 мг/сут) мегестрола ацетата.
Из 58 пациенток прореагировали на лечение 13 (24%); у 6 (11 %) пациенток ответ был частичным, причем в 4 случаях он длился более 18 мес. и наблюдался при умеренно и высокодифференцированных аденокарциномах.
Позднее стали определять специфические ЭР и ПР в клетках злокачественных опухолей матки. Нет сомнений в наличии этих рецепторов, но их концентрация варьирует в различных опухолях. В высокодифференцированных опухолях по сравнению с низкодифференцированными содержится больше как ЭР, так и ПР.
В небольшой группе пациенток было установлено, что примерно в 1/3 рецидивных опухолей содержались ЭР и ПР. Следовательно, рецепторный статус опухоли может коррелировать с клиническими данными чувствительности к прогестерону у больных с рецидивным раком эндометрия (РЭ). Предварительные результаты весьма убедительно свидетельствуют об этом.
Очевидно, что для подтверждения этих данных необходимо получить дополнительную информацию; во всяком случае, перспективы в этом направлении весьма обнадеживающие. Если подтвердится прямая корреляция, то анализ рецепторного статуса опухоли позволит подбирать ту или иную схему гормональной или химиотерапии при рецидивах рака эндометрия (РЭ). Если результат анализа на наличие ЭР и ПР положительный, то у пациентки хорошие шансы на достижение ремиссии при лечении прогестинами, даже если у нее низкодифференцированная опухоль.
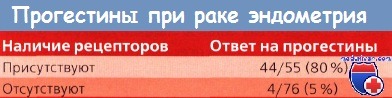
С другой стороны, при отрицательных результатах ответ на терапию прогестинами может оказаться настолько низким, что проведение XT сэкономит время и будет более эффективным. Kauppila, анализируя данные 5 исследований, описанных в литературе, подсчитал, что 89% опухолей с ПР проявили чувствительность к гормональной терапии по сравнению с чувствительностью всего лишь 17 % у опухолей, не содержащих эти рецепторы. По данным GOG, 4 (40%) из 10 опухолей, имеющих ЭР и ПР, реагировали на проводившуюся терапию прогестинами по сравнению с 5 (12%) из 41 опухоли без ПР.
Терапию прогестинами можно проводить несколькими способами. Мы предпочитаем использовать МПА (Депо-Провера) по 400 мг в/м с недельным интервалом. Другие рекомендуемые прогестины: пероральный МПА (Провера) 150 мг/сут и мегестрола ацетат (Мегейс) 160 мг/сут. Если достигнут объективный ответ, терапию прогестинами продолжают неопределенно долго. При прогрессировании заболевания прогестины отменяют и назначают XT.
Читайте также:

