При взаимодействии железа с хлором образуется хлорид железа iii
Реакция взаимодействия железа с хлором.










Уравнение реакции взаимодействия железа с хлором:
Железо взаимодействует с хлором. Реакция взаимодействия железа с хлором представляет собой сгорание железа в атмосфере хлора.
2Fe + 3Cl2 → 2FeCl3 (t = 200-300 °C).
Реакция железа с хлором протекает при условии: при предварительном нагревании железа до температуры 200-300 °C.
В результате реакции происходит образование хлорида железа (III).
В ходе реакции железа с хлором при стандартных условиях выделяется тепловая энергия (теплота) 798,8 кДж .
Термохимическое уравнение этой реакции имеет следующий вид:
2Fe + 3Cl2 = 2FeCl3 + 798,8 кДж; ΔH = -399,4 кДж/моль.
Таким образом, реакция железа с хлором носит экзотермический характер.










- ← Реакция цинка с серой
- Реакция цинка с водой →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 893)
- Экономика Второй индустриализации России (101 448)
- Программа искусственного интеллекта ЭЛИС (22 642)
- Метан, получение, свойства, химические реакции (15 899)
- Мотор-колесо Дуюнова (15 113)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 468)
- Природный газ, свойства, химический состав, добыча и применение (13 936)
- Крахмал, свойства, получение и применение (13 512)
- Прямоугольный треугольник, свойства, признаки и формулы (13 061)
- Целлюлоза, свойства, получение и применение (11 912)
- Пропилен (пропен), получение, свойства, химические реакции (11 652)
- Этилен (этен), получение, свойства, химические реакции (11 171)
- Бутан, получение, свойства, химические реакции (9 847)
- Оксид алюминия, свойства, получение, химические реакции (9 364)
- Оксид железа (III), свойства, получение, химические реакции (9 140)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.

Хлорид железа (III), хлорное железо, также - трихлорид железа. FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Содержание
- 1 Физические свойства
- 2 Методы получения
- 3 Химические свойства
- 4 Применение
- 5 Безопасность
Физические свойства

Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6H2O — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц:
- Также трихлорид получается при окислении хлором хлорида железа (II):
- Также существует достаточно интересный метод окисления оксидом серы (IV):
- Другим способом получения трихлорида железа (FeCl3) является взаимодействие
оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O + Q↑ 
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
- При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
- реагирует с иодоводородом:
Применение
Безопасность
Хлорид железа (III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.

Свойства железа и его соединений
Железо — химический элемент восьмой группы, четвёртого периода, следовательно, строение его атома можно изобразить схемой:
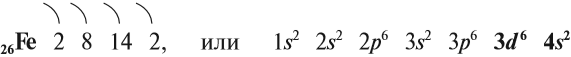
Железо — очень распространённый элемент периодической системы. Среди химических элементов, которые входят в состав Земной коры, оно занимает четвёртое место. В центре Земли имеется массивное железно-никелевое ядро, которое обеспечивает естественный магнетизм Земли.
Хотя атом железа в соединениях может проявлять степени окисления +2, +3, +6, в природе встречаются соединения преимущественно трёхвалентного железа:
- Fe2O3 — гематит (красный железняк);
- Fe2O3 · FeO — магнитный железняк;
- Fe2O3 · Н2О — бурый железняк.
Железо — серебристо-белый пластичный металл. Это металл средней активности, тем не менее оно может реагировать с активными неметаллами (галогены, кислород, сера, углерод), кислотами, а при особых условиях — с водой. При этом если реакция происходит с сильным окислителем, то образуется соединение трёхвалентного железа. Впрочем, если в результате реакции образуется соединение двухвалентного железа, то на воздухе это соединение быстро окисляется до трёхвалентного состояния. Например, с сильным окислителем хлором образуется хлорид Fe (III):
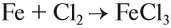
А при взаимодействии с соляной кислотой, атом хлора которой может проявлять только восстановительные свойства, образуется хлорид железа (II).
Задание 11.1. Составить уравнение реакции взаимодействия железа с серой, водой, соляной кислотой, разбавленной азотной кислотой.
Соли железа (II) и (III) имеют разную окраску: растворы соединений железа (II) бесцветные, а растворы железа (III) — окрашены в жёлтый цвет.
При взаимодействии с щелочами из растворов солей железа можно получить его гидроксиды. Они так сильно отличаются друг от друга по цвету, что эту реакцию можно считать качественной на соединения железа с разной степенью окисления. Так, из солей Fe (II) выделяется белый (в инертной атмосфере) осадок, который на воздухе мгновенно зеленеет:
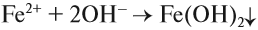
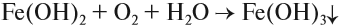
Наиболее чувствительной качественной реакцией на Fe 3+ является реакция с роданидом калия:
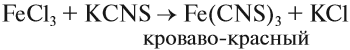
Оксид и гидроксид железа (II) проявляют основные свойства, т. е. реагируют с кислотами, но не реагируют со щелочами. В отличие от них, оксид и гидроксид железа (III) проявляют слабые амфотерные свойства. Это означает, что при обычных условиях эти вещества реагируют с кислотами и не реагируют со щелочами, но при сплавлении они со щелочами реагируют:
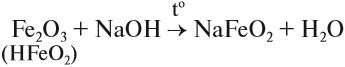
Кроме того, они растворяются в горячих, концентрированных растворах щелочей.
Таким образом, на примере свойств соединений железа ещё раз убеждаемся в справедливости закономерности: при возрастании степени окисления атома металла усиливаются и кислотные, и окислительные свойства соединений.
Задание 11.2. Составьте уравнение реакции гидролиза хлорида железа (III).

Получение железа (чугуна и стали)
Производство чугуна основано на восстановительных свойствах углерода. Чугун образуется в домнах, куда загружают смесь кокса и железной руды. В результате горения кокса образуется необходимое для реакции тепло и сильный восстановитель — угарный газ:
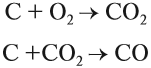
Впрочем, и кокс является прекрасным восстановителем:
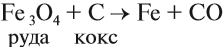
Угарный газ является основным восстановителем доменного процесса, поскольку ввиду газообразного состояния имеет высокую реакционную способность, способен проникать в любую точку домны. Кроме того, он не образует цементита. Эти реакции восстановления происходят при температуре 450…700 °C:
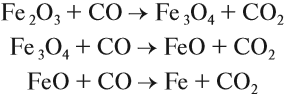
Полученный углекислый газ, реагируя с избытком кокса, вновь превращается в угарный газ:
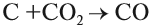
и процесс продолжается. Он происходит в верхней части домны. Выделяющееся в твёрдом виде железо опускается в нижнюю часть домны, контактирует с коксом, начинает плавиться, так как температура в этой части печи превышает 1300 °C. Кокс, образуя сплав с железом (чугун), понижает температуру плавления железа на 400°; одновременно с этим часть железа образует цементит:
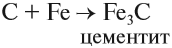
Для предохранения расплавленного железа от окисления в исходную смесь добавляют флюсы. Это известняк, который является поставщиком углекислого газа и, всплывая на поверхность, образует защитную плёнку.
Полученный чугун содержит до 4,5 % углерода, он используется для получения стали. Цель переработки — удаление примесей углерода, фосфора, серы. Готовая сталь должна содержать 0,3…2 % углерода. Кроме того, в сталь вводят различные добавки, которые изменяют её свойства. Так, нержавеющая сталь содержит около 12 % хрома.
Сталь является основным сплавом машиностроения, но легко ржавеет, так как подвергается коррозии (см. урок 8.4).

Выводы
Железо — главный металл нашей цивилизации. Станки, различные машины и механизмы, строительные конструкции, мосты, трубы — всё состоит из железа, точнее, стали или чугуна. Это достаточно активный металл, поэтому легко образует различные соединения, в которых чаще всего проявляет валентность III. Такие соединения имеют обычно красно-коричневую окраску (ржавчина).
Мерцающие, слегка зеленоватые листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на жлезные опилки газообразным хлором. При этом, в отличии от действия соляной кислоты, образуется соль трёхвалентного железа:
- Также трихлорид получается при окислении хлором хлорида железа(II):
- Также существет достаточно интересный метод окисления оксидом серы(IV):
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления, начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комлексные соли тетрахлорожелезной кислоты:
- При нагревании до 350°C с оксидом железа(III) образуется оксохлорид железа:
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окислет металлическую медь, переводя её в растворимые хлориды:
Применение
- Хлорид железа(III) применятеся для травлении печатных плат.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
См. также
- Хлорид железа(II)
Wikimedia Foundation . 2010 .
- Котельня-Боярская
- Оффенбург
Хлорид железа(III) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(III) … Википедия
хлорид железа(III) — трёххлористое железо, хлористое железо(III) … Cловарь химических синонимов I
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Хлорид гексаамминхрома(III) — Общие Систематическое наименование Хлорид гексаамминхрома(III) Традиционные названия гексамминхромихлорид Химическая формула [Сr(NH3)6]Cl3 Физические свойства … Википедия
Хлорид золота (III) — трихлорид золота AuCl3. Внешний вид красные моноклинные кристаллы. Молярная масса 303,33 г/моль. В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом… … Википедия
Хлорид хрома (III) — Хлорид хрома(III) CrCl3. Свойства Фиолетовые кристаллы; плотность 2,76 г/см3; tпл 1152°С. При 600°С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+). Получение В… … Википедия
Хлорид золота(III) — У этого термина существуют и другие значения, см. Хлорид золота. Хлорид золота(III) … Википедия
Хлорид железа(II,III) — Общие Систематическое наименование Хлорид железа(II,III) Традиционные названия Хлористое железо Химическая формула Fe3Cl8 Физические свойства … Википедия
Хлорид железа (II) — Хлорид железа(II) (хлористое железо) FeCl2 соль. Содержание 1 Свойства 2 Получение 3 Применение 4 См. также // … Википедия
Хлорид железа(II) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(II) … Википедия
Задание №1
Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением тепла и света. Составьте уравнения четырех описанных реакций.
при взаимодействии как солей соляной кислоты, так и самой кислоты с нитратом серебра образуется АgCl – нерастворимое в воде и кислотах творожистое вещество белого цвета (уравнение 1); эта реакция является качественной на хлорид-ион.
Фильтрат-раствор, прошедший через фильтр, который задерживает нерастворимые вещества. Взаимодействие растворимых солей с растворами щелочей-способ получения нерастворимых оснований (уравнение 2)
Fe(OH)3 – нерастворимое вещество бурого цвета, амфотерный гидроксид, разлагается при нагревании на оксид металла и воду (уравнение 3).
Восстановление металлов из их оксидов с помощью алюминияпромышленный способ получения многих металлов (алюмотермия); реакция экзотермическая, сопровождается выделением тепла, света и плавлением реакционной массы (уравнение 4)
Продукты разложения хлорида аммония последовательно пропустили через нагретую трубку, содержащую оксид меди(II), а затем через склянку с оксидом фосфора(V). Составьте уравнения четырёх описанных реакций.
Соли аммония и кислот, для которых нехарактерны окислительные свойства (NH4Cl, (NH4)2CO3), при нагревании разлагаются на аммиак NH3 и кислоту (уравнение 1)
Оксид меди (II) – основный оксид, кислоты реагируют с основными оксидами с образованием солей (уравнение2)
Аммиак, в котором азот находится в низшей степени окисления N –3 , проявляет восстановительные свойства и восстанавливает среднеактивные и малоактивные металлы из их оксидов (уравнение 3)
При взаимодействии P2O5 с водой, в зависимости от соотношения реагентов и температуры, могут образовываться фосфорные кислоты (H4P2O7, HPO3, H3PO4) (уравнение 4); азот с P2O5 не реагирует
Газ, выделившийся при взаимодействии хлороводородной кислоты с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой.
Составьте уравнения четырёх описанных реакций.
Взаимодействие соляной кислоты с перманганатом калия является способом получения хлора (уравнение 1)
Железо взаимодействует с сильными окислителями с образованием соединений железа в степени окисления +3 (уравнение 2)
Железо в степени окисления +3 проявляет свойства окислителя, поэтому может взаимодействовать с восстановителем (сульфид натрия восстановитель, так как содержит серу в степени окисления S –2 ), образуя соединения двухвалентного железа (уравнение 3)
Горячая азотная кислота окисляет серу до высшей степени окисления +6 (до H2SO4), азот при этом восстанавливается до N +4 (до NO2) (уравнение 4)
При сжигании на воздухе простого вещества жёлтого цвета образуется газ с резким запахом. Этот газ выделяется также при обжиге некоторого минерала, содержащего железо, на воздухе. При действии разбавленной серной кислоты на вещество, состоящее из этих же элементов, что и минерал, но в другом соотношении, выделяется газ с запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуется исходное простое вещество. Составьте уравнения четырёх описанных реакций.
Простое вещество желтого цвета, горящее на воздухе с выделением газа с резким запахом, – сера (уравнение 1)
Вещества, содержащие железо и серу: минерал пирит FeS2 и сульфид железа (II) (уравнения 2 и 3)
При взаимодействии оксида серы (IV) и сероводорода первый проявляет свойства окислителя, второй-восстановителя) и образуется простое вещество-сера (уравнение4)
После кратковременного нагревания неизвестного порошкообразного вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зелёный, выделением газа и искр. Твердый остаток смешали с едким калии нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зелёного цвета, который растворяется в избытке кислоты. Составьте уравнения четырёх описанных реакций.
Решение:
Вещество оранжевого цвета, которое разлагается с изменением цвета на зелёный, – бихромат аммония (NH4)2Cr2O7 (уравнение 1)
Cr2O3 – вещество зелёного цвета, – амфотерный оксид и будет реагировать с безводной щелочью с образованием соли (уравнение 2)
В воде, в присутствии небольшого количества кислоты, KCrO2 будет гидролизоваться с образованием нерастворимого амфотерного гидроксида хрома(III) (уравнеие 3)
Амфотерный гидроксид хрома (III) растворяется в избытке кислоты с образованием Cr +3 , имеющий зелёный цвет (уравнение 4).
Хлорид железа(III), хлорное железо, также - трихлорид железа. FeCl3 — средняя соль трёхвалентного железа и соляной кислоты, слабое амфотерное соединение.
Содержание
- 1 Физические свойства
- 2 Методы получения
- 3 Химические свойства
- 4 Применение
- 5 Безопасность
- 6 См. также
- 7 Примечания
Физические свойства [ | ]

Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения [ | ]
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку [1] газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц [2] :

- Также трихлорид получается при окислении хлором хлорида железа(II):

- Также существует метод окисления оксидом серы(IV):

- Другим способом получения трихлорида железа (FeCl3) является взаимодействие оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:

Химические свойства [ | ]
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:

- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:

- При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:

- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:

F e C l 3 + C u C l → F e C l 2 + C u C l 2 <\displaystyle <\mathsf

- реагирует с иодоводородом:

Применение [ | ]
Безопасность [ | ]
Хлорид железа(III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.
Читайте также:

