При множественной миеломе какие тромбоциты
Онкозаболевания представляют серьезную угрозу, особенно те виды опухолей, которые имеют высокие показатели заболеваемости у населения. К таким патологиям относится и миеломная болезнь. В медицинской практике существуют другие названия, среди которых миеломатоз, ретикулоплазмоцитоз, генерализованная плазмоцитома.
Эту патологию относят к гемобластозам (рак крови) во время течения которых происходит увеличение концентрации плазмоцитов, вырабатывающих большое количество парапротеинов (патологических белков). Обычно онкопатология диагностируется у пожилых афроамериканцев.
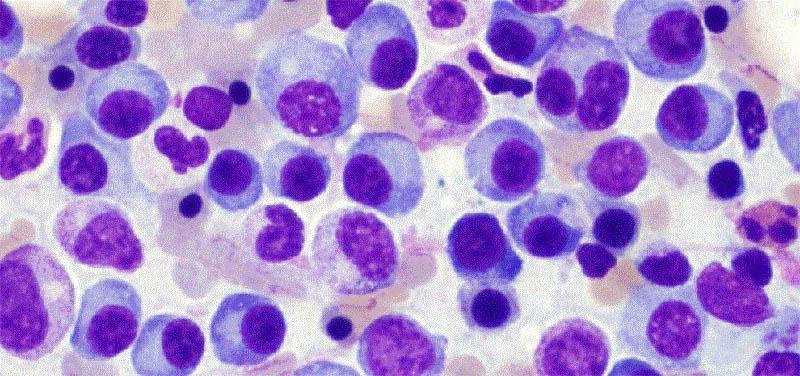
Что такое миеломная болезнь
Эта патология именуется как плазмоцитома или множественная миелома. Онкопатологию относят к хроническим миелобластным лейкозам с невысоким показателем злокачественности. Изначально, B-лимфоцит достигает уровня плазмоциты и обретает способность вырабатывать антитела против инфекций. В нормальном состоянии плазмоциты регулируют в организме иммуноглобулины, защищающие организм от проникновения и распространения вирусов. Патологические клетки не в состоянии обеспечивать защиту организма, что обусловлено внезапным снижением синтеза и стремительным разрушением здоровых антител. Под влиянием определенных факторов у больного начинают формироваться клетки, которые постоянно делятся и мутируют. Во время этого образуется большое количество плазмобластов и плазмоцитов в костном мозгу. Они синтезируют в больших объемах белки иммуноглобулина в крови, имеющие неправильное строение. Такие белковые соединения не утрачивают защитную способность, но всё больше скапливаются в костномозговых структурах.
Онкопатология обычно развивается медленно, разрушая костные структуры, но иногда может распространяться на лимфатические ткани, почки и селезенку. После образования миеломы до возникновения признаков болезни может пройти несколько десятилетий. При диагнозе множественная миелома, без адекватного лечения болезнь может привести к летальному исходу на протяжении двух лет.
Причины заболевания
Досконально изучить причины появления миеломной болезни ученым не удалось, но уже установлены факторы, способные спровоцировать развитие онкологического процесса:
- престарелый возраст,
- хронические заболевания крови,
- частые инфекционные заболевания,
- нефропатия (инфекции мочеполовой системы),
- длительное ионизирующее излучение,
- проживание в плохой экологической среде,
- работа, подразумевающая регулярный контакт с токсинами и химикатами,
- наследственность и генетическая предрасположенность к онкопроцессам,
- наличие вредных привычек, в частности курение и пристрастие к спиртным напиткам,
- регулярные стрессы и эмоциональные всплески.

Главным провоцирующим фактором считается нарушение B-лимфоцитов в плазмоциты во время трансформации по организму. Из-за такого сбоя начинает стремительно увеличивается число аномальных плазмоцитов, образующих миеломные клетки внутри костей. По мере течения болезни патологические клетки замещают нормальные, из-за чего постепенно кровь начинает плохо сворачиваться, а иммунитет ухудшаться.
Разновидности
Исходя из того, какой вид парапротеинов вырабатывают атипичные плазмоциты, миелома крови классифицируется на:
- A-миелома — диагностируется в 25% случаев,
- G-миелома — наиболее распространенная разновидность, выявляемая у 50% пациентов,
- M-миелома — встречается не более чем в 6% случаев патологии,
- E-миелома — данный вид болезни диагностируется у двух пациентов из ста,
- D-миелома — на данную разновидность приходится около 3% больных,
- Миелома Бенс-Джонса — на этот вид болезни приходится до двадцати процентов случаев,
- Несекретирующая опухоль — встречается крайне редко, не чаще чем у 1% пациентов.
Миеломы костного мозга G, A, M, E, и D продуцируют неправильные клетки иммунного глобулина типов IgG, IgA, IgE, IgD. Миелома Бенс-Джонса именуется так из-за выделения белка Бенс-Джонса. По большей части это теоретическое распределение миелом. На практике чаще используются классификации по локализации плазмоцитарных клеток и по их строению, а также особенностям опухоли. Исходя из количества затронутых патологией костей либо органов, выделяют одиночные и множественные миеломы.
Данный вид патологии характеризуется возникновением только одного очага, который способен формироваться в определенном лимфоузле или кости, где есть костный мозг. Часто локализуется в бедренных костях, однако может поражать позвоночник и другие трубчатые кости.
При появлении множественной формы опухолевые очаги появляются в нескольких костях. Поражению одинаково часто подвергается позвоночный ствол, черепные кости, ребра, лопатки и т.д. Кроме костей болезнь способна распространяться на селезенку и лимфоузлы.
Главным отличием такой онкопатологии является отсутствие ограниченных точек роста новообразований. Плазматические клетки стремительно делятся и расходятся по всем костям в теле. Внутри кости расположение плазмоцитов не ограничивается одним очагом, патологические клетки заполняют всю площадь костного мозга.
Болезнь отличается одновременным развитием опухолевых очагов со стремительным развитием плазмоцитов, а еще глобальной деформацией костномозговой структуры. Плазмоциты занимают только определенные участки, а остальные патологические изменения возникают из-за воздействия новообразования. При данной болезни плазмоциты могут находиться внутри костной ткани, поражать селезенку или лимфатические узлы.
Болезнь имеет черты как множественной, так и единичной миеломы. Диффузно-очаговая форма делится на несколько видов:
- плазмоцитарной,
- плазмобластной,
- полиморфноклеточной,
- мелкоклеточной.
Каждый подвид болезни отличается своими особенностями течения.
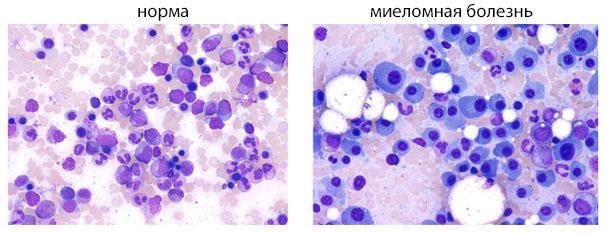
При такой онкопатологии появляется большое количество B-лимфоцитов в очагах роста новообразования, активно продуцирующих парапротеины. Развитие такой миеломы проходит медленно и зачастую вызывает трудности во время терапии. Иногда активная выработка парапротеинов становится причиной поражения важных для жизни органов и систем, которые нечувствительны к терапии.
При наличии злокачественной болезни в кости преобладают плазмобласты, которые синтезируют малое количество парапротеинов, но слишком быстро делятся и размножаются. При своевременном выявлении болезни она хорошо поддается терапии.
Эти виды миелом отличаются наличием в патологических очагах плазмоцитов, находящихся на разных стадиях созревания. Такие миеломы самые агрессивные, ведь очень быстро развиваются и вызывают дисфункцию многих отделов организма.
Стадии заболевания
Тяжесть онкопатологии зависит от этапа, на котором находится заболевание.
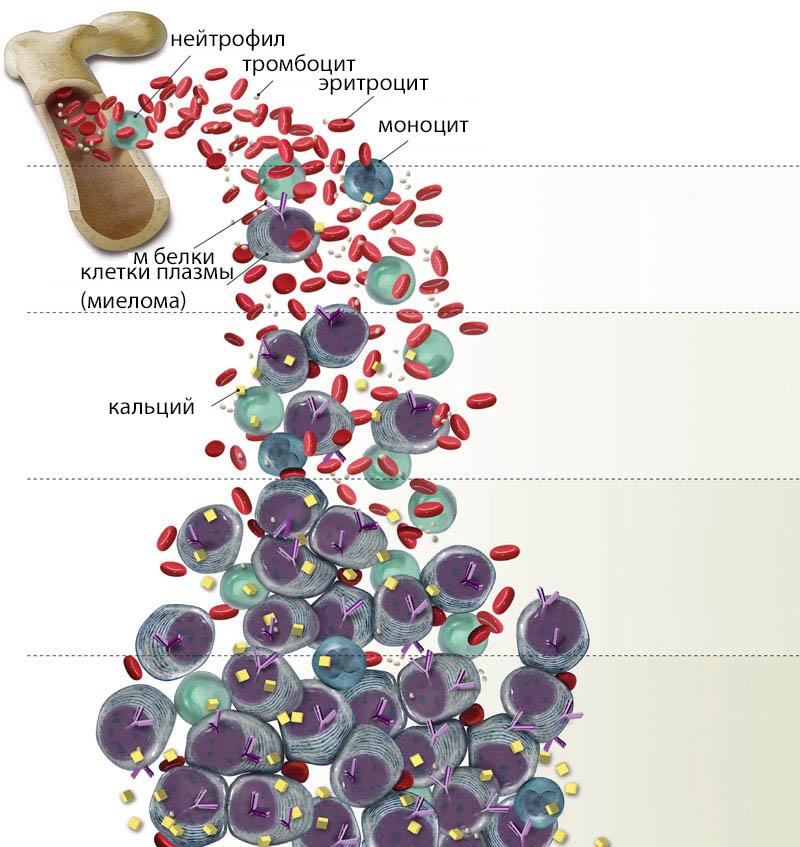
Стадий множественной миеломы всего существует три:
- При первой стадии общая масса опухолевого процесса не достигает одного килограмма, гемоглобин в крови равняется 100 г/л или выше. Данная стадия не вызывает симптомов, поэтому болезнь на этом этапе течения обнаруживают крайне редко.
- Вторая — вес опухолевой массы увеличивается до 1,2 кг. Возникают клинические проявления в виде понижения в организме железа, избытка кальция, почечной недостаточности и болевого синдрома.
- Третья — данная стадия характеризуется увеличением опухолевой массы свыше 1,2 кг и значительным изменением костномозговой структуры. Уровень гемоглобина опускается до 85 г/л, кальций падает до 12 мг/100 мл. Течение множественной миеломы 3 степени обычно заканчивается смертью больного. Основной причиной является инфаркт или почечная недостаточность.
Успех лечения в первую очередь зависит от фазы развития болезни, поэтому рекомендуется регулярно проходить полное медицинское обследование.
Симптомы болезни
При наличии миеломы в первую очередь происходит поражение костей и почек, из-за чего возникают нарушения в кроветворной системе. Симптомы миеломы зависят от стадии ее развития, а также степени поражения. Так как развитие болезни занимает очень много времени, бессимптомное ее течение может продолжаться около пятнадцати лет. В это время больной даже не будет подозревать о наличии серьезной патологии. Выявить миелому возможно посредством лабораторных исследований для профилактического обследования или лечения другой патологии.
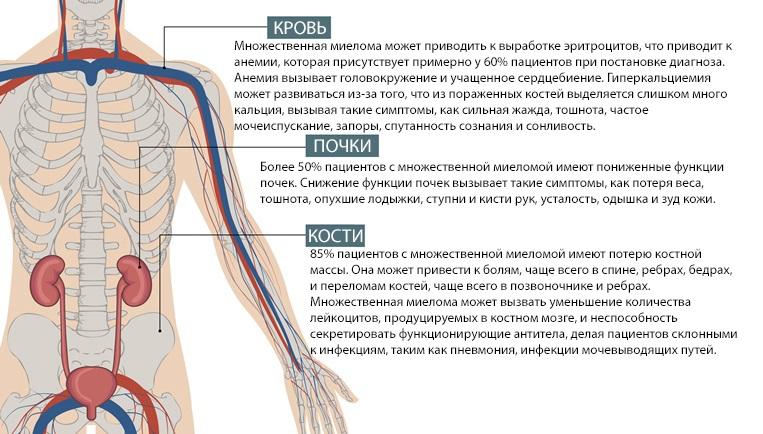
Симптомами миеломной болезни служат такие проявления:
- частые головокружения,
- развивается анемия,
- наличие болей,
- астения,
- стремительное уменьшение веса больного,
- постоянные ОРВИ и ОРЗ.
При появлении этих признаков миеломной болезни, стоит сразу отправиться за консультацией специалиста и пройти дополнительное обследование, для распознания патологии.
При обильном распространении множественной миеломы у пациентов очень часто наблюдается наличие таких синдромов:
Еще при развитии болезни поражается ЦНС и начинается гиперкальциемия, это только осложняет течение болезни. Когда патология переходит на заключающую стадию, клиническая симптоматика значительно усиливается. В некоторых случаях на четвертой стадии развивается острый лейкоз.
Диагностика
Если возникают подозрения на наличие миеломной болезни, диагностику проводит опытный врач в условиях стационара. В основном к врачу приходят пациенты, у которых анализ крови показал значительное повышение СОЭ, что характерно для миеломы. Во время постановки диагноза больным назначаются определенные лабораторные исследования, которые позволяют распознать болезнь еще на этапе ее формирования. Сначала врач проводит осмотр больного, а также уточняет период возникновения первых клинических признаков болезни, затем назначает анализы.
При миеломе диагностика проводится с помощью следующих исследований:
- общеклинический анализ мочи и крови (определяется повышение белка в моче),
- биохимический анализ крови,
- миелограмма,
- спиральная компьютерная томография,
- рентген костей,
- метод иммуноэлектрофореза.

Курс терапии назначается врачом только после проведения всех диагностических исследований.
Общие принципы терапии
Лечение миеломы не предусматривает применения радикальных методов, так как основной задачей курса терапии является продление и улучшение качества жизни. Вылечить полностью миелому невозможно. Однако в борьбе с опухолевым поражением можно затормозить его развитие и вызвать ремиссию.
После точного диагностирования миеломной болезни, лечение проводится с использованием паллиативных методов, позволяющих затормозить рост новообразования и ослабить признаки. К паллиативным способам лечения миеломы относится химическая терапия, облучение и подбор правильного питания. Проводить лечение народными средствами в домашних условиях не рекомендуется.
Применение химиотерапии — самый результативный метод борьбы с миеломой. Во время проведения курса лечения может использоваться как один препарат (монохимиотерапия), так и несколько медикаментозных средств (полихимиотерапия).
При назначении полихимиотерапии могут использоваться следующие препараты:
- Циклофаосфамид,
- Мелфан,
- Леналидомид,
- Дексаметазон.

Препараты принимают внутрь или внутривенно с помощью внутримышечных инъекций. Когда назначают курс химиотерапии, лечение может проводиться по одной из нескольких схем:
- Схема MP — прием препаратов мелфалан и преднизолон в таблетированном виде.
- Схема M2 — введение внутривенных инъекций винкристина, циклофосфамида и BCNU. Вместе с этим на протяжении двух недель необходимо принимать таблетки преднизолона и мелфалана.
- Схема VAD — терапия проводится в 3 сеанса. Во время первого сеанса лечение проводится лекарствами доксирубицин и винкристин. Во время следующих сеансов необходимо принимать таблетки дексаметазона.
- Схема VBMCP — назначается больным, возраст которых младше 50 лет. В первый день терапии пациентам внутривенно вводят винкристин, циклофосфамид и кармустин. Затем на протяжении недели необходимо пить мелфалан и преднизолон. Через полтора месяца им вновь вводят инъекцию кармустина.
При любой схеме лечения, прием препаратов осуществляется только под строгим наблюдением специалистов.

После лечения химиопрепаратами стойкая ремиссия наблюдается у 40% пациентов.
Применение лучевой терапии назначается обычно при солитарных и крупноочаговых опухолях, когда лечение химиопрепаратами бессильно. В таком случае удается затормозить развитие злокачественного образования и ослабить клинические проявления болезни.
Если облучение и применение химических препаратов не дали эффекта, пациентам проводят пересадку костного мозга. Примерно у 40% пациентов трансплантация стволовых клеток помогает достичь стойкой ремиссии болезни.
Этот способ лечения множественной миеломы предполагает прием назначенных лекарств. Их действие направлено на купирование болей, корректировку концентрации кальция в крови. Препараты нормализуют свертываемость крови и стабилизируют работу почек.
Иногда еще возможно проведение операции по удалению одиночного очага миеломы, над которым потом проводится цитологическое исследование. Если наблюдается тяжелое течение болезни, пациентам может быть назначено применение морфина, бупренорфина и других наркотических препаратов.

Во время лечения болезни обязательно нужно придерживаться правильного питания. Диету при миеломной болезни назначает лечащий специалист. В рационе следует ограничить употребление продуктов с большим содержанием белка. Больному нужно есть меньше мясных блюд, яиц, бобовых и орехов.
Прогноз и профилактика
Обычно при множественной миеломе прогноз неблагоприятный. Почти у всех пациентов удается достичь ремиссии на два или три года, в лучшем случае этот период можно увеличить еще на два года. Без адекватного лечения миеломы, продолжительность жизни пациентов составляет не более двух лет. Полное выздоровление возможно только в случае солитарной формы онкопатологии.
Специфических способов для профилактики образования миеломной опухоли нет. Людям, попадающим в зону риска заболеваемости, рекомендуется регулярно проходить профилактический осмотр, для своевременного обнаружения патологии. Стоит тщательно следить за своим здоровьем, вести активный образ жизни и избавиться от вредных привычек.
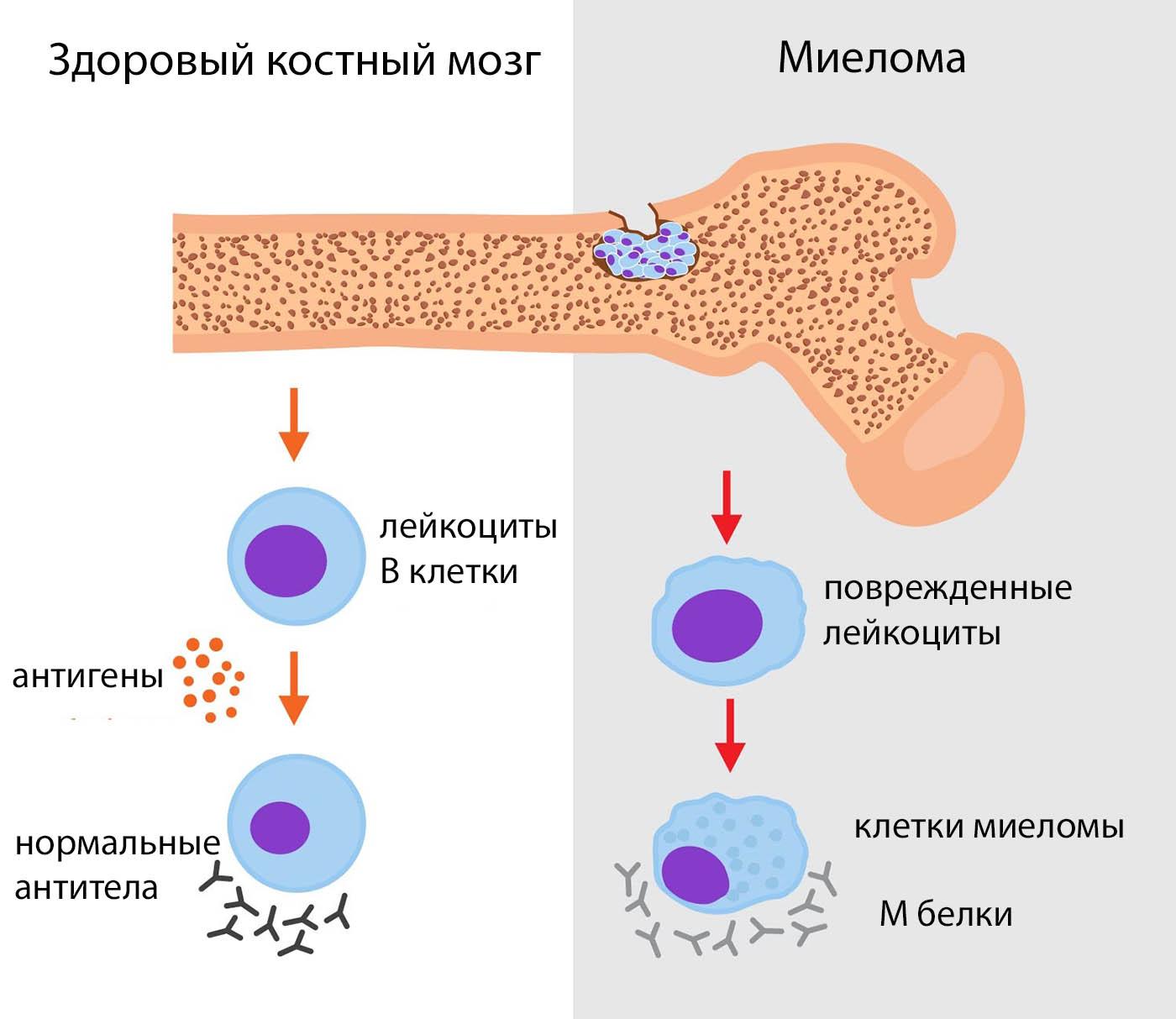
Множественная миелома – это злокачественное заболевание крови, при котором образуется избыточное количество дефектных плазмоцитов (одного из видов лейкоцитов), что приводит к повреждению костного мозга, костей, почек, к нарушению работы иммунной системы.
Поврежденные плазмоциты могут образовывать опухоли, которые обычно располагаются в костях. Если опухоль одна, то ее называют единичная плазмоцитома. В случае если опухолей несколько, речь идет о множественной миеломе.
Миелома – достаточно редкое заболевание, которым чаще страдают люди старше 60 лет. Пациенты моложе 40 лет встречаются крайне редко. Эта болезнь неизлечима, однако современные методы лечения позволяют приостановить развитие процесса на несколько лет. Прогноз заболевания во многом зависит от стадии, на которой начато лечение.
Болезнь Рустицкого, миелома, миеломатоз, ретикулоплазмоцитоз, генерализованная плазмоцитома, болезнь Рустицкого – Калера.
Plasma cell myeloma, Kahler's disease, myeloma.
Проявления миеломы зависят от активности процесса, и на начальной стадии заболевания могут полностью отсутствовать. Признаки миеломы неспецифичны, то есть такие же симптомы могут быть вызваны другим заболеванием, поэтому точную причину их появления может установить только врач. Основными симптомами являются:
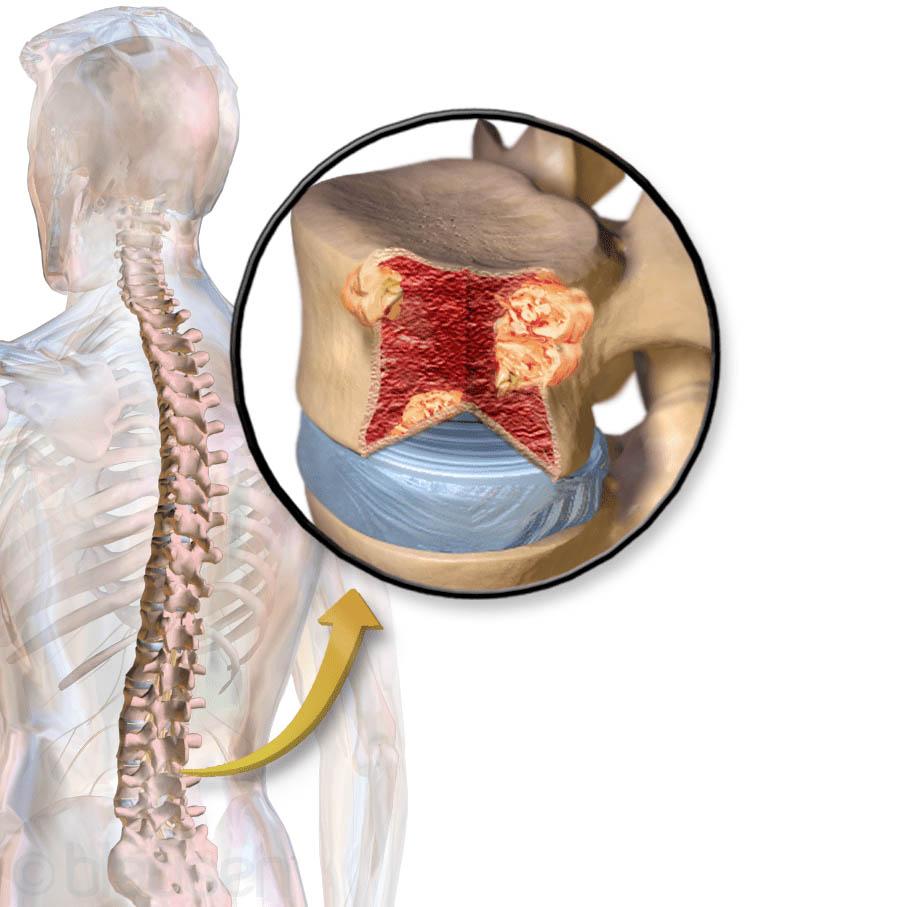
- боли в костях, чаще в ребрах, позвонках,
- частые переломы,
- частые инфекционные заболевания,
- слабость, недомогание,
- жажда,
- запоры,
- учащенное мочеиспускание,
- увеличение или уменьшение объема мочи,
- онемение, боли в конечностях.
Общая информация о заболевании
Несмотря на то что основные проявления заболевания связаны с повреждением костей, миеломная болезнь – разновидность рака крови. В основе болезни лежит повреждение плазмоцитов, разновидности лейкоцитов. Они, как и все остальные клетки крови, образуются в костном мозге из стволовых клеток. Этот процесс заключается в ряде последовательных, запрограммированных на уровне ДНК клетки делений, в результате которых сначала формируются лимфоидные стволовые клетки, а затем В-лимфоциты. В-лимфоциты являются клетками иммунитета, то есть осуществляют борьбу с чужеродными для организма вирусами и бактериями. Окончательное созревание В-лимфоцитов происходит вне костного мозга – в лимфатических узлах, селезенке, тимусе. Для этого необходим антиген – белок чужеродного микроорганизма. При контакте с антигеном В-лимфоцит превращается в плазмоцит и начинает секретировать антитела – специфические белки, которые разрушают чужеродные клетки. Каждый плазмоцит секретирует определенный вид антител, направленных на борьбу с конкретным микроорганизмом. В норме у человека образуется необходимое, строго контролируемое количество плазмоцитов.
При миеломной болезни повреждается ДНК плазмоцитов. В организме накапливается избыточное количество бесполезных, измененных плазмоцитов, которых еще называют миелоцитами. Эти клетки накапливаются в костях, образуя опухоли и разрушая кости, а также вырабатывают дефектные – моноклональные белки, или белки Бенс-Джонса. Эти белки не способны бороться с чужеродными клетками, как нормальные антитела, и выводятся из организма почками. Разрушение костей приводит к повышению уровня кальция в крови, что проявляется жаждой, запорами, тошнотой. Повышенное количество кальция и белка вызывает повреждение почек. Происходит угнетение нормального кроветворения и, как следствие, уменьшается количество эритроцитов и нормальных лейкоцитов. В итоге развивается анемия и снижается устойчивость организма к инфекциям.
Точная причина патологических изменений в плазмоцитах неизвестна, однако существуют факторы, повышающие вероятность миеломной болезни.
Кто в группе риска?
- Люди старше 60 лет.
- Страдающие ожирением.
- Подвергавшиеся облучению.
- Работающие с инсектицидами, пестицидами, продуктами нефтепереработки и другими токсическими веществами.
- ВИЧ-инфицированные.
- Пациенты с аутоиммунными заболеваниями, например ревматоидным артритом, системной красной волчанкой.
- Пациенты с моноклональной гаммопатией (это группа заболеваний, при которых в организме вырабатываются аномальные антитела).
- Люди, у родственников которых была миеломная болезнь.
Часто миеломная болезнь определяется еще до проявления симптомов, в ходе стандартного профилактического обследования. Заподозрить заболевание на начальной стадии позволяют изменения в результатах лабораторных анализов. Дальнейшее обследование зависит от проявлений болезни.
- Общий анализ крови (без лейкоцитарной формулы и СОЭ). При миеломной болезни уровень лейкоцитов чаще всего снижен. Также могут быть понижены концентрации эритроцитов, тромбоцитов и гемоглобина.
- Определяется протеинурия, то есть выделение с мочой белка Бенс-Джонса.
- Общий белок сыворотки. Его уровень повышается за счет большого количества моноклональных белков.
- Альбумин сыворотки. Альбумин – это белок, который синтезируется в печени и отвечает за перенос различных веществ, например билирубина, жирных кислот, некоторых гормонов. Уровень альбумина бывает снижен даже при высоком общем белке, так как белок повышен именно из-за патологических компонентов – моноклональных белков, которые по структуре отличаются от альбумина.
- Креатинин в сыворотке. Является побочным продуктом обмена веществ, который выводится почками. При миеломной болезни может быть повышен вследствие повреждения почек.
- Кальций в сыворотке. Уровень кальция повышается из-за разрушения костей.
Другие методы исследования
- Электрофорез белков мочи и крови. Метод необходим для выявления моноклональных белков и белков Бенс-Джонса. Основан на том, что разные виды белков, помещенных на специальную бумагу, гель или мембрану, под действием постоянного электрического поля движутся с разной скоростью.
- Биопсия костного мозга – взятие образца костного мозга из грудины или костей таза с помощью тонкой иглы. Проводится после предварительного обезболивания. Затем под микроскопом обнаруживают изменения в структуре костного мозга. Процедура необходима для выявления плазмоцитов в костном мозге.
- Рентгенография, компьютерная томография и магнитно-резонансная томография. Эти методы позволяют сделать снимки костей, на которых определяются четко очерченные, округлой или овальной формы участки разрушения костей, а также патологические переломы.
- Позитронно-эмиссионная томография. В организм вводят дезоксифлюороглюкозу – препарат, помеченный радионуклидом, который поглощается клетками опухоли. Затем с помощью позитронной камеры исследуют участки накопления этого вещества. Дезоксифлюороглюкоза находится в организме очень короткое время, большая часть ее распадается уже во время исследования, что позволяет уменьшить лучевую нагрузку на пациента. Информативность метода заключается в том, что можно оценить не только внешние характеристики опухоли, как при КТ или МРТ, но и активность обмена веществ в тканях опухоли.
Лечение зависит от стадии заболевания, вида миеломы, общего состояния пациента. На начальной стадии, до появления внешних признаков и при медленном прогрессировании болезни лечение может быть отложено. Однако пациент должен регулярно проходить обследование для контроля за развитием болезни. При первых симптомах следует начинать лечение.
- Химиотерапия – использование специальных препаратов, которые разрушают злокачественные клетки или препятствуют их делению.
- Иммунотерапия. При терапии множественной миеломы используют препараты, активизирующие иммунную систему. Структура этих препаратов идентична веществам, которые вырабатываются лейкоцитами и участвуют в борьбе с инфекциями, раковыми клетками. Чаще всего используют синтетический альфа-интерферон – специфический белок, идентичный по строению интерферону человека и обладающий противовирусной активностью.
- Лучевая терапия – разрушение злокачественных клеток с помощью ионизирующего излучения.
- Трансплантация стволовых клеток. У пациента с миеломной болезнью или подходящего донора забирают часть стволовых клеток с помощью специального аппарата, после чего их замораживают. Затем пациент подвергается химиотерапии или лучевой терапии, которые разрушают большинство клеток костного мозга, как больных, так и здоровых. После этого пациенту пересаживают его собственные или донорские стволовые клетки. Трансплантация стволовых клеток не излечивает пациента, но увеличивает продолжительность его жизни.
- Симптоматическая терапия – терапия, направленная на конкретные симптомы. Например, антибиотики при инфекции и введение эритропоэтина (вещества, стимулирующего деление эритроцитов) при анемии.
Специфической профилактики миеломной болезни нет.
Рекомендуемые анализы
- Общий анализ крови
- Общий анализ мочи с микроскопией осадка
- Кальций в сыворотке
- Креатинин в сыворотке
- Белок общий в сыворотке
- Альбумин в сыворотке
- Цитологическое исследование пунктатов, соскобов других органов и тканей
Множественная миелома (миеломная болезнь)
Множественная миелома, миеломная болезнь, multiple myeloma.
Хотя у ряда лиц симптомы миеломы впервые обнаруживаются после 50 лет, средний возраст больных во время выявления болезни равен 66 годам, и только 2% пациентов моложе 40 лет. Миеломная болезнь развивается из иммунологического состояния, определяемого как моноклональная гаммапатия неизвестного значения (MGUS-англ. или МГНЗ) . Это состояние, по американской статистике, может быть выявлено у 2-4% населения старше 50 лет. Поскольку моноклональная гаммапатия не вызывает каких-либо жалоб, то определяется лишь как случайная лабораторная находка и является предраковым состоянием. Переход от моноклональной гаммапатии неизвестного значения к миеломной болезни за год отмечается у одного из 100 лиц, пораженных МГНЗ. Такая трансформация обычно наблюдается через промежуточную стадию тлеющей миеломы (smoldering multipe myelona- SMM), при которой риск прогрессии увеличивается в 10 раз т.е. до 10% в год. На фоне тлеющей миеломы отмечается резкое увеличение содержания парапротеина в крови, достигающего уровня развернутой миеломы.
Классификация множественной миеломы 2014 года
В 2014 году Международная рабочая группа по миеломной болезни обновила диагностические критерии различных форм этого заболевания. Основная ревизия состояла в добавлении трех специфических биомаркеров: количество клональных плазматических клеток в костном мозге ≥60%, соотношение свободных легких цепей в сыворотке ≥100 и более одного локального поражения на МРТ, — к существующим маркерам поражения конечных органов (гиперкальциемия, почечная недостаточность, анемия или поражение костей). Ранее, поражение конечных органов трактовались как акроним CRAB — calcium, renal disease, anemia, bone lesions.
Обновленные критерии позволяют обеспечить раннюю диагностику и назначение лечения до развития поражения конечных органов. Как следует из критериев, диагноз миеломной болезни требует 10% и более плазматических клеток при исследовании костного мозга или наличия плазмацитомы, доказанной биопсией, плюс одно или более нарушений, обусловленных заболеванием.
Диагностические критерии Международной рабочей группы для миеломной болезни и связанных клеточных нарушений (2014)
- Моноклональная гаммопатия неизвестного значения – МГНЗ (MGUS): моноклональный парапротеин (не-IgM) 0.25 mmol/L или выше, чем верхний лимит нормального для соответствующей лаборатории значения или >2.75 mmol/L;
- Почечная недостаточность: клиренс креатинина 177 μmol/L;
- Анемия: значение гемоглобина >20 г/л ниже нижнего предела нормального в лаборатории или значение гемоглобина 5% и низкое насыщение трансферрина типичны для дефицита железа.является проявлением миеломной болезни примерно у 75% больных. В этих случаях уровень анемии умеренный. Но у 10% больных с Hb 2 , обнаруживается у 20% больных миеломой на этапе диагноза и примерно у половины больных в ходе миеломной болезни. Причины поражения почек комплексные и включают дегидратацию, гиперкальциемию, инфекции, воздействие нефротоксических лекарств, в частности, прием больших доз НПВС для купирования болевого синдрома.
Наличие легких цепей в моче при миеломной болени может вызвать нарушение функции почек, известное как вторичный синдром Фанкони. Он обусловлен недостаточностью реабсорбционной способности проксимальных канальцев, что проявляется глюкозурией, аминоацидурией, гипофосфатемией и гипоурикемией.
В интерстиции развивается процесс воспаления с итоговым тубуло-интерстициальным фиброзом, приводящим к почечной недостаточности. Более того, невыведенные почками моноклональные легкие цепи могут откладываться в почках, сердце, печени, тонком кишечнике, нервных стволах, приводя к развитию первичного амилоидоза (AL-амилоида) или болезни отложения легких цепей (light-chain deposition disease — LCDD англ, БОЛЦ). Для диагностки почечной недостаточности требуется определение креатинина, мочевины, натрия и калия, кальция и оценка СКФ по формуле MDRD или CKD-EPI. Также рекомендуется измерение общего белка, электрофорез и иммунофиксация в образцах 24-часовой мочи. У больных с неселективной протеинурией или селективной альбуминурией требуется исключить наличие амилоидоза или MIDD , для чего показана биопсия почки или подкожного жира с окраской на конго-рот. У больных с протеинурией свободных легких цепей (белка Бенс-Джонса) биопсия жира не обязательна, поскольку в этом случае диагноз миеломного повреждения почек не вызывает сомнений и требует планирования терпии основного заболевания.
Свободные легкие цепи имеют высокую чувствительность и специфичность по сравнению с электрофорезом белков в моче. Больные с почечной недостаточностью при ММ имеют повышенное каппа/лямбда отношение даже при отсутствии доказательств моноклональной гаммапатии. Причина состоит в нарушении выделения легких цепей. У здоровых людей очищение крови от легких цепей осуществляется почками. Каппа цепи являются мономерными и быстрее покидают кровь сравнительно с лямбда цепями, что доказывается каппа/лямбда отношением в среднем 0.6 у лиц без поражения почек. У больных с почечной недостаточностью основной системой очищения становится ретикуло-эндотелиальная система, полупериод жизни каппа цепей из-за этого удлиняется. Отношение каппа/лямбда оказывается при почечной недостаточности равным в среднем 1.8. Свободные легкие цепи имеют высокую чувствительность и специфичность, и больные с почечной недостаточностью имеют повышенное каппа/лямбда отношение вследствие нарушения клиренса каппа и лямбда цепей.
Инфекционные осложнения при множественной миеломе.
При миеломной болезни возрастает частота бактериальных и вирусных инфекций в 7-10 раз по сравнению с популяционным контролем. Гемофильная палочка, пневмонический стрептококк, кишечная палочка, грам-отрицательные бактерии и вирусы (грипп и герпес зостер) являются наиболее частыми виновниками инфекции у больных миеломной болезнью.
Повышенная чувствительность больных к инфекционным заболеваниям является результатом двух основных обстоятельств. Во-первых, влиянием самого заболевания, во-вторых, пожилым возрастом и побочным действием проводимой терапии. Лимфоцитопения, гипогаммаглобулинемия, нейтропения вследствие инфильтрации миеломными клетками костного мозга и под влиянием проводимой химиотерапии обуславливают повышенную чувствительность к инфекции. Связанная с болезнью недостаточность врожденного иммунитета вовлекает разные части иммуной системы и включает дисфункцию В-клеток, а также функциональные отклонения со стороны дендритных клеток, Т- клеток и натуральных киллеров (NK). Нарушения функции почек и легких, слизистой ЖКТ, мультиорганные нарушения, вызванные отложением легких цепей иммуноглобулинов, также увеличивают риск инфекционных заболеваний. Наконец, миеломная болезнь поражает приемуществено пожилых лиц с коморбидными возрастными заболевниями и малоподвижным образозм жизни, исходно предрасположенных к инфекциям.
Иммуномодуляторы и глюкокортикоиды являются частью лечения наиболее тяжелых вариантов заболевания. При имеющихся инфекционных контактах, наличии нейтропении и гипогаммаглобулинемии и подавленном клеточном иммунитете терапия иммуномодуляторами требует профилактического назначения антибиотиков.
Гиперкальциемия
Симптомы гиперкальциемии неспецифичны и зависят как от абсолютных значений, так и от сроков прироста кальция. Умеренная гиперкальциемия (кальций сыворотки 3–3.5 mmol/л), которая развивалась месяцами, может переноситься незаметно с минимальными жалобами , в то время как как подобная гиперкальциемия, возникшая за недельный период, приводит к ярким симптомам. Тяжелая гиперкальциемия ( кальций более 3.5 mmol/л) почти всегда приводит к клиническим проявлениям. Больные жалуются на отсутствие аппетита и запоры. При этом общее недомогаение и мышечная слабость может прогрессировать до летаргии, спутанности и комы. Кардиоваскулярные проявления включают укорочение QT интервала и аритмии. Почечная дисфункция представляется другим важным проявлением гиперкальциемии. Пациенты часто отмечают полиурию как следствие пониженной концентрационной способности почек в условиях гиперкальциемии. Появление камней в почках наблюдается только при длительной гиперкальциемии. Острая почечная недостаточность в результате прямой вазоконстрикции и натриурезом-вызываемого сокращения объема крови относится к наиболее тяжелым проявлениям поражения почек при гиперкальциемии. Причиной гиперкальциемии является повышенная активность остеокластов при пониженной активности остеобластов и лизис костной ткани при миеломной болезни. Активация остеокластов, разрушающих структуру костей, вызывается цитокинами, секретируемыми миеломными клетками, в частности , интерлейкином-1. Не случайно степень гиперкальциемии зависит от общей массы накопившихся миеломных клеток, так что наиболее тяжелая гиперкальциемия обнаруживается у больных с широко распространенной болезнью.
Признаки гиперкальциемии зависят от уровня кальция и быстроты его повышения, что создает необходимость в ускоренном обследовании. Большинство причин гиперкальциемии на практике обусловлено повышенным уровнем паратгормона и его производных (гуморальная форма), а в 20 % — с инфильтрацией костного мозга клетками опухолей (инфильтративная форма). Множественная миелома с легкими цепями в крови является самой частой причиной среди заболеваний крови. Число больных с гиперкальциемий из-за наличия опухоли в 2-3 раза выше, чем из-за первичного гиперпаратиреоза.
Для миеломной болезни с гиперкальциемией характерен низкий уровень паратгормона, фосфор в норме. При гуморальной форме гиперкальциемии обнаруживается повышенный уровень паратгормона, низкий уровень фосфора.
Тромбофилии
Риск венозных тромбозов обусловлен целым рядом причин, а миеломная болезнь его значительно увеличивает. К факторам риска тромбозов относятся пожилой возраст,, ограничение подвижности из-за болей, частые инфекции, дегидратация, почечная недостаточность, ожирение, сахарный диабет и другие коморбидные заболевания.
Среди проявлений наиболее опасна тромбоэмболия легких, которая может оказаться фатальной.
Частота примерно тромбоэмболии при миеломе оценивается в 5-8/100 больных.
Это связано с тем что миелома сопровождается повышенной вязкостью крови, угнетением выработки естественных антикоагулянтов и гиперкоагуляцией крови, спровоцированной инфекциями, с повышенным уровнем фактора Виллебранда, фибриногена и фактора VIII, пониженным уровнем протеина S и.т.д.). Проведение курса лекарственной терапии, в том числе назначение эритропоэтинов, также может сыграть роль триггера венозных тромбоэмболий. Поэтому в первые месяцы терапии рекомендуется дополнять традиционную терапию миеломы аспирином или антикоагулянтной терапией.
Скрининг предрасположенности к тромбозам и венозной тромбоэмболии при миеломной болезни, наряду со стандартным коагулогическим обследованием, должен включать исследование вязкости крови.
Прогнозировование и факторы риска при миеломе
Выделено три уровня этого онкомаркера, которые связаны с длительной выживаемостью пациентов. Это позволяет определить несколько стадий заболевния.
- бета-2-микроглобулин менее 3,5 мг/л и альбумин более 35 г/л, средняя выживаемость 62 месяца,
- промежуточная между 1 и 3 стадиями, средняя выживаемость 44 месяца.
- стадия бета 2-микроглобулин более 5.5 мг/л, средняя выживаемость 29 мес.
Однако, в настоящее время использование новых препаратов значительно изменило прогноз естественного течения заболевания. Тем не менее, международная система была протестирована для новейшей терапии и подтвердила свою надежность. Так 5-летняя выживаемость больных в стадии I, II и III составила 66%, 45% и 18% соответственно.
В Международной системе не оказалось места для таких ценнных прогностических показателей как число тромбоцитов, уровень лактатдегидрогеназы и свободных легких цепей в крови.
Число тромбоцитов в крови коррелирует с вытеснением костного мозга и имеет предсказательное значение выше, чем у альбумина. Содержание лактатдегидрогеназы (ЛДГ) коррелирует с общей массой миеломных клеток, недостаточным ответом на терапию и укорочением выживаемости. У больных с уровнем свободных легких цепей в крови свыше 4,75 г/л чаще выявляется почечная недостаточность, высокой процент миеломных клеток в пунктате костного мозга, высокие значения бета-2-микроглобулина и лактатдегдрогеназы, чаще обнаруживается болезнь отложения легких цепей и стадия III по Международной системе. Однако представленных доказательств оказалось недостаточно, чтобы включить эти три критерия в Международную систему. Но они были представлены в системе Дьюри-Саймона (1975), значение которой не оспаривается до сих пор.
Повышенный уровень сывороточного бета 2-микроглобулина, повышенный уровень лактатдегидрогеназы и низкий уровень сывороточного альбумина относятся к неблагоприятным признакам прогноза при миеломной болезни. Хотя уровень бета2- микроглобулина увеличивается при почечной недостаточности, однако существует значительная корреляция между объемом опухолевой ткани и концентрацией этого биомаркера в крови. Исключение составляют лишь случаи, когда миеломная болезнь развивается уже на фоне имеющейся почечной недостаточности.
Перспективным методом оценки прогноза заболевания является генетическое исследование опухоль-ассоциированных генов. Цитогенетическое выявление транслокаций в отличие от трисомии относится к неблагоприятным прогностическим признакам. Метод флюоресцентной гибридизации in situ (FISH) позволил упростить выявление хромосомных аберраций в миеломных клетках, что предлагается исследователями клинико Мэйо (США) использовать для выбора индивидуальной лечебной тактики, исходя из прогноза для больного на основании учета выявленных аббераций. Генетические исследования хромосомных аномалий и мутаций при миеломе являются перспективными методами для лабораторной оценке прогноза и устойчивости к терапии при миеломе. Однако для их оценки требуются большие сроки и число пролеченных больных, чтобы определить способность новых средств терапии преодолеть цитогенетические показатели высокого риска при миеломной болезни.
Читайте также:

