Поражение сердца при лимфомах
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Представлены данные по эпидемиологии поражений сердца при онкогематологических заболеваниях, в частности, при лимфомах, их клиническим проявлениям, современным возможностям диагностики и лечения. В качестве иллюстрации представлен клинический случай успешной полихимиотерапии больного лимфомой с поражением сердца, одним из проявлений которого являлось нарушение ритма и проводимости.
к.м.н., доцент кафедры госпитальной терапии №1 Первого МГМУ им. И.М. Сеченова
д.м.н., профессор той же кафедры, научный руководитель отделения гематологии Клиники госпитальной терапии им. А.А. Остроумова
зав. отделением гематологии Клиники госпитальной терапии им. А.А. Остроумова
врач-гематолог того же отделения
студентка 5 курса лечебного факультета Первого МГМУ им. И.М. Сеченова
к.м.н., доцент кафедры госпитальной терапии №1 Первого МГМУ им. И.М. Сеченова
1. Hoffmeier A, Sindermann JR, Scheld HH, Martens S. Cardiac tumors-diagnosis and surgical treatment. Dtsch Arztebl Int 2014;111(12):205-11.
2. O’Mahony D, Piekarz RL, Bandettini WP, et al. Cardiac involvement with lymphoma: A review of the literature. Clin Lymphoma Myeloma 2008; 8(4): 249-52.
3. Alvarez J, Vivancos R, de Mora M, et al. Primary cardiac lymphoma: presentation of a case and review of the literature. Rev Esp Cardiol 1997; 50: 444-7.
4. Doronin V.A., Morozova N.V., Gradoboev M.I., et al. Primary cardiac diffuse large cell B-cell lymphoma: Case report and review of literature. Klinicheskaya Onkogematologiya 2009; 2(4): 358-61. In Russian (Доронин В.А., Морозова Н.В., Градобоев М.И., и др. Первичная диффузная в-крупноклеточная лимфома сердца. Клиническое наблюдение и обзор литературы. Клиническая Онкогематология 2009; 2(4): 358-61).
5. Rahbar K., Seifarth H., Schäfers M, et al. Differentitation of malignant and benign cardiac tumors using 18F-FDG PET/CT. J Nucl Med 2012;53:856-63.
6. Bertheart J. Carney complex (CNC). Orphanet J Rare Dis 2006;1:21.
7. Mariscalco G., Bruno VD., Borsani P., et al. Papillary fibroelastoma: insight to a primary cardiac valve tumor: L Card Surg 2010; 25: 198-205.
8. Patel J., Melly L., Sheppard M.N. Primary cardiac lymphoma: B-and T-cell cases at a specialist UK centre. Ann Oncol 2010;21(5):1041-5.
9. Petrich A., Cho SI, Billett H. Primary Cardiac Lymphoma. An Analysis of Presentation, Treatment, and Outcome Patterns. Cancer 2011;117:581-9.
10. Ikeda H, Nakamura S, Nishimaki H, et al. Primary lymphoma of the heart: case report and literature review. Pathol Int 2004; 54: 187-95.
11. Anghel G, Zoli V, Petti N, et al. Primary cardiac lymphoma: report of 2 cases occurring in immunocompetent subjects. Leuk Lymphoma 2004: 45; 781-8.
12. Ceresoli GL, Ferreri AJ, Bucci E, et al. Primary cardiac lymphoma in immunocompetent patients: diagnostic and therapeutic management. Cancer 1997: 80; 1497-506.
13. Sato H, Takahashi M. Non-Hodgkin's malignant lymphoma of the bone with intracavitary cardiac involvement. Intern Med 1993;32(6):502-7.
14. Cho SW, Kang YJ, Kim TH, et al. Primary cardiac lymphoma presenting with atrioventricular block. Korean Circ J 2010; 40:94-8.
15. Kaderli AA, Baran I, Aydin O, et al. Diffuse involvement of the heart and great vessels in primary cardiac lymphoma. Eur J Echocardiogr 2010;11(1):74-6.
16. Danbauch SS, Okpapi JU, Maisaka MM, Ibrahim A. Ventricular tachycardiain a patient with lymphocytic (non Hodgkin’s) lymphoma. Cent Afr J Med 1995;41:169-71.
17. Miyashita T, Miyazawa I, Kawaguchi T, et al. A case of primary cardiac B cell lymphoma associated with ventricular tachycardia, successfully treated with systemic chemotherapy and radiotherapy: a longterm survival case. Jpn Circ J 2000;64:135-8.
18. Tanaka Y, Yamabe H, Yamasaki H, et al. A case of reversible ventricular tachycardia and complete atrioventricular block associated with primary cardiac B-cell lymphoma. Pacing Clin Electrophysiol 2009; 32: 816-9.
19. Rosenberg SA, Diamond HD, Jaslowitz B, Craver LF. Lymphosarcoma: review of 1269 cases. Medicine 1961; 40: 31.
20. Kober G, Magedanz A, Mohrs O, et al. Non-invasive diagnosis of a pedunculated left ventricular hemangioma: tumor classification and evaluation of relevant literature. Clin Res Cardiol 2007; 96: 227-31.
21. Schwab J, Haack G, Sinss D, et al. Diagnosis of left ventricular myxoma with cardiac magnetic resonance imaging. Clin Res Cardiol 2007; 96:189-90.
22. Majano-Lainez RA. Cardiac tumors: a current clinical and pathological perspective. Crit Rev Oncog 1997;8:293-303.
23. Meng Q, Lai H, Lima J, et al. Echocardiographic and pathologic characteristics of primary cardiac tumors: a study of 149 cases. Int J Cardiol 2002;84:69-75.
24. Faganello G, Belham M, Thaman R, et al. A case of primary cardiac lymphoma: analysis of the role of echocardiography in early diagnosis. Echocardiography 2007; 24:889-92.
25. Hoffmann U, Globits S, Schima W, et al. Usefulness of magnetic resonance imaging of cardiac and paracardiac masses. Am J Cardiol 2003;92:890-5.
26. Wang ZJ, Reddy GP, Gotway MB, et al. CT and MR imaging of pericardial disease. Radiographics 2003; 23:S167-80.
27. Nguyen JD, Carrasquillo JA, Little RF, et al. Fluorodeoxyglucose positron emission tomography in the presence of cardiac metastases. Clin Nucl Med 2003;28:979-80.
28. Romer W, Garbrecht M, Fuchs C, et al. Images in cardiovascular medicine. Metabolic imaging identifies non-Hodgkin's lymphoma infiltrating heart. Circulation 1998;97:2577-8.
29. Israel O, Keidar Z., Bar-Shalom R. Positron emission tomography in the evaluation of lymphoma. Semin Nucl Med 2004; 3: 166-79.
30. Collins C.D. PET in lymphoma. Cancer Imaging 2006; 6: S63-70.
31. Seam P., Juweid M.E., Cheson B.D. The role of FDG-PET scans in patients with lymphoma. Blood 2007;110:3507-16.
32. Abramowitz Y, Hiller N, Perlman G, et al. The diagnosis of primary cardiac lymphoma by right heart catheterization and biopsy using fluoroscopic and transthoracic echocardiographic guidance. Int J Cardiol 2007;118:e39-40.
33. Chim CS, Chan AC, Kwong YL, et al. Primary cardiac lymphoma. Am J Hematol 1997;54:79-83.
34. Kang SM, Rim SJ, Chang HJ, et al. Primary cardiac lymphoma diagnosed by transvenous biopsy under transesophageal echocardiographic guidance and treated with systemic chemotherapy. Echocardiography 2003;20:101-3.
35. Jurkovich D, de Marchena E, Bilsker M, et al. Primary cardiac lymphoma diagnosed by percutaneous intracardiac biopsy with combined fluoroscopic and transesophageal echocardiographic imaging. Catheter Cardiovasc Interv 2000;50:226-33.
36. Yeh ET, Tong AT, Lenihan DJ, et al. Cardiovascular complications of cancer therapy: diagnosis, pathogenesis, and management. Circulation 2004;109(25):3122-31.
37. Curigliano G, Cardinale D, Suter T, et al. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncol 2012;23 Suppl 7:vii155-66.
38. Sayed-Ahmed MM, Shouman SA, Rezk BM, Propionyl-L-carnitine as potential protective agent against adriamycin-induced impairment of fatty acid beta-oxidation in isolated heart mitochondria. Pharmacol Res 2000;41(2):143-50.
39. Silber JH, Cnaan A, Clark BJ, Enalapril to prevent cardiac function decline in long-term survivors of pediatric cancer exposed to anthracyclines. J Clin Oncol 2004;22(5):820-8.
40. Ganz WI1, Sridhar KS, Ganz SS, Review of tests for monitoring doxorubicin-induced cardiomyopathy. Oncology 1996;53(6):461-70.
41. Nakamae H, Tsumura K, Terada Y, Notable effects of angiotensin II receptor blocker, valsartan, on acute cardiotoxic changes after standard chemotherapy with cyclophosphamide, doxorubicin, vincristine, and prednisolone. Cancer 2005;104(11):2492-8.
42. Bosch X, Esteve J, Sitges M, et al. Prevention of chemotherapy-induced left ventricular dysfunction with enalapril and carvedilol: rationale and design of the OVERCOME trial. J Card Fail 2011;17(8): 643-8.
43. Kalay N, Basar E, Ozdogru I, Protective effects of carvedilol against anthracycline-induced cardiomyopathy. J Am Coll Cardiol 2006;48(11):2258-62.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Первичные лимфомы сердца — это редкие новообразования, которые составляют от 1,3 до 2% всех первичных опухолей сердца. Лимфомы могут развиваться у пациентов как с нормальным, так и с ослабленным иммунитетом, но чаще встречаются у последних.
В настоящее время увеличилось число сообщений о первичных лимфомах сердца, особенно ассоциированных с ВИЧ. После трансплантации различных органов может развиваться посттрансплантационная лимфопролиферативная болезнь (ПТЛБ), которая может привести к развитию первичной лимфомы сердца. В этом случае причинами служат длительная иммуносупрессия и вирус Epstein-Barr. При лимфомах, ассоциированных с ВИЧ и ПТЛВ, обычно есть и внесердечные поражения, изолированное поражение сердца встречается редко.
Наиболее частые клинические проявления первичных лимфом сердца — боли в груди, ХСН, перикардиальный выпот, сердцебиение и аритмии. У некоторых больных могут отмечаться общие симптомы. Менее распространенными проявлениями первичных лимфом сердца являются тампонада сердца, легочная и системная эмболии, синдром ВПВ и внезапная смерть.
В анализах крови в 16-23% случаев отмечается повышение уровня лактатдегидрогеназы, в 20% — повышение СОЭ. Изменения на ЭКГ неспецифичны, нередко обнаруживаются признаки АВ-блокады и наджелудочковых аритмий.
Рентгенография грудной клетки обычно в диагностике не помогает, а ЭхоКГ, особенно ЧПЭхоКГ, дает хорошую визуализацию лимфом сердца. Для выявления границ опухоли предпочтительнее КТ и МРТ, причем МРТ обладает наиболее высокой чувствительностью в диагностике первичных лимфом сердца. Однако признаки первичных лимфом сердца, выявляемые с помощью КТ и МРТ, неспецифичны, и для подтверждения диагноза необходимо гистологическое исследование.
Цитологическое исследование перикардиального выпота подтверждает диагноз в 60% случаев. Чреспищеводная, трансвенозная под контролем ЭхоКГ и чрескожная внутрисердечная биопсии позволяют получить образцы тканей для уточнения диагноза, однако в некоторых случаях (при невозможности использования данных методов) биопсию можно выполнить путем медиастиноскопии или торакотомии.
В 69-72% случаев первичные лимфомы сердца поражают его правые отделы. Одиночные поражения наблюдаются в 66% случаев, множественные — в 34%. Перикардиальный выпот встречается в 49% случаев, а в некоторых случаях может быть единственным проявлением заболевания. Средний размер первичных лимфом сердца составляет 7 см и может варьировать от 3 до 12 см.
Гистологически 80% первичных лимфом сердца, обнаруживаемых у иммунокомиетентных лиц, состоят из больших клеток В-клеточных лимфом, в некоторых случаях также встречаются клетки мелкоклеточных лимфом, лимфом Burkitt и Т-клеточных лимфом. У больных с ослабленным иммунитетом наиболее часто встречаются мелкоклеточные лимфомы с пересеченными ядрами и иммунобластные лимфомы. В постановке диагноза и определении специфического подтипа лимфомы могут помочь потоковая цитометрия и иммуногистохимическое исследование.
Первичные лимфомы сердца по агрессивности идентичны лимфомам других локализаций. Все лимфомы чувствительны к химиотерапии. Раннее ее начало с применением антрациклина и лучевой терапии (или без нее) — основа лечения первичных лимфом сердца, которое позволяет в большинстве случаев обойтись без радикального хирургического вмешательства. В последние годы успешное применение ритуксимаба, моноклональных антител к CD20, в комбинации с обычной химиотерапией дало надежду на увеличение выживаемости больных.
Однако в целом прогноз при первичных лимфомах сердца остается неблагоприятным даже на фоне проводимого лечения, учитывая агрессивную природу заболевания: 60% больных умирают в течение 2 мес после установления диагноза.
Прогноз у пациентов с ПТЛБ сердца существенно лучше, но во всех случаях в качестве начального лечения рекомендуется уменьшение иммуносупрессивной терапии.
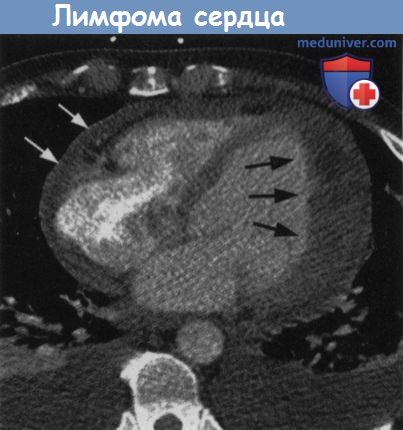
Начальная кардиальная пимфома у пациента с желудочковой аритмией.
Неоднородное утолщение боковой стенки левого желудочка (черные стрелки) из-за проникающего роста лимфомы.
Перикардиальный выпот (белые стрелки) и билатеральный плевральный выпот.

Что это такое – лимфома? Это онкологическая болезнь лимфоидной ткани. Отличительной чертой этого заболевания считается повышение лимфоидных узлов, разрушение разных внутренних органов, в которых замечается существенное накапливание лимфоцитов с опухолевыми клетками. Белая клетка крови (лимфоцит) – основной элемент иммунной системы организма. В МКБ-10 лимфома числится под кодом С 85.
Причины
Точные причины возникновения лимфом у детей на данный момент полностью не изучены. Появлению болезни предрасполагают патологии в лимфоцитах. Клетки могут поразить не только лимфоузлы, но и другие внутренние органы. Но врачи выделяют некоторые причины лимфомы Ходжкина у детей, прогноз при которой не очень благоприятный:
- заражение гепатитом;
- ВИЧ-инфекция;
- злокачественные изменения В-лимфоцитов;
- аутоиммунные заболевания (красная волчанка, ревматоидный артрит) ;
- радиоактивное излучение не только на ребенка, но и на женщину при беременности;
- использование иммуносупрессивной терапии;
- снижение иммунитета;
- наличие лейкоза у родителей или других родственников;
- поражение инфекционными болезнями и вирусом герпеса;
- влияние канцерогенов;
- химиотерапевтическое лечение, лучевая терапия;
- генетическая и этническая предрасположенность (синдром Клайнфельтера и Дауна) ;
- лимфоидное истощение;
- персистенция некоторых вирусов – Эпштейна-Барра, Луи-Бара, Вискотта-Олдрича, Т-лимфоцитарного.

Если химиотерапевтическое лечение использовалось для устранения других опухолей у детей, отмечается повышение риска развития лимфомы, поскольку препараты такого типа очень токсичны и могут повреждать генетический аппарат как раковых клеток, так и здоровых.
Как проявляется лимфома?
Как отмечают онкологи, до 3-летнего возраста лимфома возникает крайне редко, однако с возрастом риск ее развития увеличивается. Поэтому если в семье имеются или имелись ранее злокачественные онкопатологии, необходимо предельно внимательно следить за здоровьем ребенка, регулярно проходить обследования, которые не дадут упустить момент начала развития заболевания. Чаще всего в детском возрасте развивается лимфома Ходжкина, которая имеет благоприятные прогнозы, нежели лимфома неходжкинского типа. В целом на сегодняшний день влияние причин на возникновение лимфом активно изучается.
Симптомы
Раннее выявление симптомов лимфомы у детей значительно увеличивает шансы на благоприятный прогноз и эффективность проводимой терапии. Как правило, симптомы выявляются при диспансеризации по поводу других заболеваний, но при этом очень важная роль отводится родителям, которые должны внимательно следить за изменением физического состояния и поведения детей.
Основным симптомом лимфомы у детей является увеличение одного или сразу нескольких лимфоузлов. Увеличение размеров чаще всего наблюдается на лимфоузлах, расположенных в области шеи, в ключичной и затылочной частях, в подмышечных впадинах, в паховой области, а также в скрытых лимфоузлах (в области таза, живота, позвоночника). Следует отметить, что увеличение лимфоузлов происходит безболезненно и не доставляет ребенку неприятных ощущений, поэтому задача родителей – не пропустить эти физиологические изменения на теле малыша.
В случае, когда увеличенные лимфоузлы начинают надавливать на органы, расположенные рядом с ними, возникают сопутствующие симптомы:
- одышка или кашель может свидетельствовать об увеличении лимфоузла в области трахеи или легких;
- боль в животе, расстройство пищеварения может быть следствием увеличения скрытых лимфоузлов в области живота;
- при попадании клеток лимфы в печень или селезенку эти органы становятся увеличенными.

Наличие лимфомы у ребенка также сопровождается некоторыми общими симптомами, которые характерны для целого ряда заболеваний. Эти симптомы должны быть обязательно учтены при составлении общего анамнеза. К ним относятся:
- Ребенок быстро устает – на начальной стадии появляется после активных действий, но чем дальше развивается заболевание, тем более пассивным становиться ребенок? и время активности сокращается.
- Повышенная сонливость, апатия.
- Ребенок сильно потеет ночью, в комплексе со снижением веса и повышенной температурой.
- Выраженный кожный зуд без видимых причин.
Нельзя точно сказать, как долго развивается лимфома у детей. У одних симптоматика проявляется через три недели, у других – через четыре месяца.
В наше время существует немало разновидностей лимфом, но не так давно их делили на болезнь Ходжкина и неходжкинскую лимфому, однако такое противопоставление данного заболевания не полностью отображает суть лимфомы и не позволяет определить наиболее эффективную тактику терапии и ее прогноз.
Неходжкинские лимфомы разделяли на новообразования, которые имеют высокую и низкую степень злокачественности. В каждой группе было выделено несколько типов лимфом, учитывая морфологические характеристики клеток опухолей. Эту классификацию приняли, но на данный момент эта система устарела, так как неходжкинская лимфома имеет около 16 подтипов.
Лимфома Ходжкина
Что это такое – лимфома Ходжкина? По сути, данная разновидность лимфомы не является лимфомой как таковой, поскольку новообразование состоит из моноцитарных и макрофагальных клеток, а не из лимфоцитов. Так, болезнь рассматривается отдельно от неходжкинских лимфом, но это все же является злокачественным образованием, возникающем в ткани лимфоузлов.
Неходжкинская лимфома
Это обширное понятие, поэтому для подтверждения диагноза необходимо уточнить причину ее образования, а также уровень злокачественности. Лимфоидная ткань имеет лимфоциты двух групп: В-лимфоциты и Т-лимфоциты. Последние нужны для иммунитета клеток, которые способствуют инактивации чужеродных частиц. Для образования специфических белков, которые связываются с грибком, вирусом и бактериями, обезвреживают их, есть В-лимфоциты. Эти клетки группируются в фолликулах, в которых периферия преимущественно Т-клеточная, а центр – В-лимфоцитарный. Если условия будут соответствующие, может происходить неадекватное распространение клеток конкретной зоны, что определяет вид новообразования.
Зрелоклеточные лимфомы
Это сравнительно доброкачественные лимфомы, которые возникают из вызревших лимфоцитов, отличаясь практически бессимптомным протеканием. Единственным и наиболее верным симптомом лимфомы называют чрезмерное увеличение лимфоузлов. Некоторая часть зрелоклеточных лимфом на протяжении определенного времени переходит в лимфосаркому.
Лимфома Беркитта
Данная разновидность лимфомы обладает высоким уровнем злокачественности, она распространяется в кровь, внутренние органы и костный мозг, за границы лимфатической системы. Болезнь начинается постепенно и внезапно, на что влияет локализация опухоли.
Крупноклеточная диффузная лимформа
Данная разновидность лимфомы отличается высокой агрессивностью. Первичный очаг в большинстве случаев располагается экстрадонтально или в лимфоузлах. Отдельно стоит отметить первичную В-крупноклеточную лимфому средостения, которая возникает в тимусе, постепенно прорастая в средостение.

Диагностика
При проведении процедур диагностики лимфомы у детей первоначально внимательно проводится врачебный наружный осмотр обратившегося пациента. После этого для подтверждения диагноза ребенок должен сдать следующие необходимые анализы:
- кровь;
- сделать УЗИ или рентген.
Помимо этого, чтобы подтвердить наличие лимфомы, в обязательном порядке нужно провести несколько взаимосвязанных важных исследований, благодаря которым появится возможность с точностью определить, какой вариант заболевания присутствует и на какой стадии он сейчас находится. Врачи, проводя анализ тканей пациента, используют биопсический метод. Чтобы провести его именно по такому методу, берется больной лифоузел и внимательно изучается специалистом под микроскопом.
Для определения стадии имеющейся болезни, помимо тех способов, которые были перечислены выше, можно использовать магнитно-резонансную томографию, двухфотонную эмиссионную томографию, провести компьютерную томографию или же сделать сцитинграфию скелета. Чтобы получить как можно больше информации об опухоли на костном мозге и определить, какое имеется количество пораженных клеток, на самых критических стадиях болезни, переходят к трепанобиопсии.

До начала проведения необходимой лечебной терапии нудно обследовать сердце ребенка, сделав ему кардиограмму или заменить ее на ультразвуковое исследование сердца, а также для большей эффективности можно провести и обе процедуры одновременно. Помимо этого, возможно потребуется провести диагностику на наличие отклонений организма в обмене веществ.
Все перечисленные методы диагностики могут применяться не в каждом из случаев. Какое именно исследование или комплекс исследований назначить больному, определить может только лечащий врач.
Лечение
Если у ребенка имеется врачебно подтвержденная лимфома, его нужно срочно положить в онкологическое отделение больницы, а также может подойти и гематологическое отделение.
В наибольшем количестве случаев для лечения используется химическая терапия. В этом случае малыша лечат при помощи цитостатика, ориентированного на приостановку разделения клеток или же их полного устранения (клеток, где обнаружена опухоль). Использование лишь одного способа будет недостаточно для ликвидации всех пораженных клеток, вследствие этого доктора разработали комбинацию цитостатиков, по-другому еще их называют полихимической терапией. Данный способ считается самым лучшим ввиду своей максимальной эффективности.
После проведения процедур химической терапии в некоторых случаях используется также облучение – лучевая терапия. Если химическая и радиальная терапия не дают желаемых результатов или болезнь повторилась, переходят на химиотерапию с высокими дозами. Нехорошим фактором в таком виде терапии считается ее плохое воздействие на кровь костного мозга. Вследствие этого важно делать пересадку стволовых клеток – нередко прибегают к аутологичной пересадке костного мозга.
Исцеление заболевания Ходжкина с доминированием лимфоцитов
На первоначальных стадиях заболевания убирают один зараженный лимфоузел (если отсутствуют другие пораженные), в случае, если после этого не возникнут какие-либо осложнения. Где-то больше половины больных в этих случаях вылечиваются, не прибегая к радиальной и химической терапии. Им нужно обязательно проходить систематический осмотр для постоянного слежения за их состоянием. Называют этот процесс стратегией выжидательного исследования. При возникновении признаков лимфомы проведение такой стратегии заканчивается.

Направление химиотерапии
При традиционной болезни Ходжкина делается несколько химиотерапевтических блоков. Численность циклов, их длительность и напряженность первоначально опираются на то, какая у ребенка стадия заболевания, и зависят от того, какую терапевтическую группу применяют для лечения больного. Любой блок терапии длится не более двух месяцев. В любой из курсов лечения включаются следующие вещества:
В промежутках между терапией необходимо делать двухнедельный интервал. В среднем курс лечения лимфомы длится не менее двух и не более шести месяцев, в случаях, если не были обнаружены повторы заболевания.
Лучевая терапия
В настоящее время проктологи рекомендуют для половины пациентов делать лучевую терапию болезни следом за химической. После наблюдений за тем, как организм пациента откликается на проведение химиотерапии, ставится вопрос о возможности проведения лучевой терапии.

В случае, если были проведены два блока химической терапии ПЭТ, появились улучшения, то необходимость в проведении данной терапии отпадает (это относится к любой форме заболевания). Положительная реакция на такой способ лечения означает сокращение лимфомы на половину, и, исходя из этого, в ее остатках отсутствуют активные клетки опухоли.
Чаще всего терапию с использованием лучей применяют по истечении двух недель после завершения химической терапии. В среднем выдается доза облучения, равная двадцати греям. При сокращении объема лимфомы впоследствии проведения первых двух блоков химической терапии приблизительно на 75 % лучевая доза возрастает до тридцати греев.
Дабы не разрушить здоровые клетки, находящиеся рядом с опухолью, необходимый объем выдается не за один раз, а за несколько процедур. Лечить пораженный участок нужно маленькими порциями. Продолжительность радиальной терапии в среднем длится две или три недели. Выходные дни даются организму для отдыха и восстановления от процедуры.
Прокалывания при болезни Ходжкина
Лечение лимфомы у детей в государственных клиниках Москвы возможно, но не принесет такого результата, как за границей. В Германии для детей, пораженных лимфомой, для лечения используют исключительно программы, носящие название исследования оптимизации терапии. Представляют собой они общепринятые больничные изучения, ставящие перед собой задачу лечения пациентов по прогрессивным программам и в то же время увеличения эффекта, получаемого от терапии.

Шансы на выздоровление
Благодаря современным и точным способам диагностики и стандартным проколам активной терапии, шансы на выздоровление и полного излечения опухоли очень высоки. Перед тем как переходить к лечению, всех пациентов разделяют по различным терапевтическим группам, для каждой из них предусматриваются свои методы лечения. Согласно проводимым исследованиям, болезнь нередко дает повтор, но и в последующих случаях ее получается благополучно вылечить.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Введение. Лимфома миокарда — одна из самых редких локализаций среди всех лимфопролиферативных заболеваний. Несмотря на отсутствие на сегодняшний день общепринятых рекомендаций по лечению первичных или вторичных лимфом миокарда, химиотерапия проводится согласно клиническим рекомендациям по лечению лимфопролиферативных заболеваний, что в ряде случаев приводит к успешному результату.
Материалы и методы. В статье представлен клинический пример диагностики и лечения 65-летней женщины с диагнозом: Неходжкинская лимфома ст. II BE гр. II с поражением миокарда, лимфатических узлов шеи, лимфоузлов средостения, правой небной миндалины. Пациенту была выполнена успешная химиотерапия в режиме R-СЕОР в 6 курсов.
Результаты и обсуждение. После 2-го курса химиотерапии в полости правого предсердия лоцировалась эхопозитивная структура, фиксированная к МПП размерами 2,8 х 2,0 см. Фракция выброса 61 %. Эффект: регрессия более 50 %. Через 4 месяца после завершения лечения фракция выброса 63 %, регрессия более 80 %, частичный ответ.
Заключение. Достоверная постановка диагноза лимфомы с поражением миокарда основывается на результатах гистологического и ИГХ-исследования. В настоящее время предпочтение отдается менее инвазивным методикам, одной из которых является биопсия под контролем чреспищеводной Эхо-КГ. Как и прочие лимфопролиферативные заболевания, лимфома с поражением миокарда является химиочувствительной опухолью и хорошо поддается лечению. В каждом случае вопрос тактики лечения должен решаться индивидуально, принимая во внимание соматический статус пациента, объем и степень распространения опухоли, ее морфологический тип, а также возможность оказания адекватной специализированной помощи.
Сакаева Дина Дамировна — доктор медицинских наук, заместитель главнго врача по лекарственной терапии.
450054, Уфа, пр-т Октября, 73/1, тел.: 8 (347) 237-23-09
Раевская Татьяна Владимировна — врач-онколог, тел.: 8 987 489 77 89
450054, Уфа, пр-т Октября, 73/1
Валиахметова Чулпан Хусаеновна — кандидат медицинских наук, заведующий онкологическим отделением противоопухолевой лекарственной терапии.
450054, Уфа, пр-т Октября, 73/1,тел.: 8 (347) 237-23-09
Исхакова Алсу Инзеровна — врач-онколог.
450054, Уфа, пр-т Октября, 73/1, тел.: 8 (347) 237-23-09
1. Гадаев И.Ю., Ершов В.И., Бочкарникова О.В., Соколова И.Я., Буданова Д.А., Котова Е.С. и др. Поражение сердца при лимфомах. Обзор литературы и описание случая клинического течения В-крупноклеточной лимфомы. Рациональная фармакотерапия в кардиологии. 2015;11(6):610-7.
2. Hoffmeier A., Sindermann J.R., Scheld H.H., Martens S. Cardiac tumors-diagnosis and surgical treatment. Dtsch Arztebl Int. 2014;111(12):205-11. DOI: 10.3238/arztebl.2014.0205
3. Jonavicius K., Salcius K., Meskauskas R., Valeviciene N., Tarutis V, Sirvydis V. Primary cardiac lymphoma: two cases and a review of literature. J Cardiothorac Surg. 2015;10:138. DOI: 10.1186/s13019-015-0348-0
4. Farris G.R., Andrikopoulou E., De La Cuesta A.V, Seghatol-Eslami E, Scarabelli T.M. Cardiac lymphoma presenting as subacute progressive dyspnea: a case report and review of the literature on the pathophysiology and imaging of intracardiac tumors. CASE (Phila). 2017;1(1):6-10. DOI: 10.1016/j.case.2016.11.004
5. Parato V.M., Muscente E, Scarano M. Primary cardiac lymphoma: a case report. G Ital Cardiol (Rome). 2017;18(1):11—3. DOI: 10.1714/2628.27022
6. Nijjar P.S., Masri S.C., Tamene A., Kassahun H., Liao K., Valeti U. Benefits and limitations of multimodality imaging in the diagnosis of a primary cardiac lymphoma. Tex Heart Inst J. 2014;41(6):657-9. DOI: 10.14503/THIJ-13-3595
7. Ito I., Nakaoka Y., Kubokawa S.I., Sugane H., Kusume T., Matsuda H., et al. Primary cardiac lymphoma: a lesson learned from an unsuccessful experience. Intern Med. 2018;57(24):3569-74. DOI: 10.2169/internalmedicine.0594-17
8. Perna G.P, Gini G., Brambatti M., Battistoni I., Marini M., Angelini L., et al. Primary cardiac lymphoma in an immunocompetent young adult: outcome with chemotherapy. G Ital Cardiol (Rome). 2017;18(1):7-10. DOI: 10.1714/2628.27021
9. Aimanan K., Kumar K.S., Mohd Arif M.N., Noor Zuraini M., Ramdzan M.J., Hamdan L. Rare intracardiac tumor: primary cardiac lymphoma presenting as atypical angina. Case Rep Med. 2016;2016:4125295. DOI: 10.1155/2016/4125295
10. Chemello D., Raupp-da-Rosa P, Telo G., Clausell N. Ventricular tachycardia associated with non-Hodgkin’s lymphoma. Arq Bras Cardiol. 2011;97(6):e132-4. PMID: 22262151.
11. Al-Mehisen R., Al-Mohaissen M., Yousef H. Cardiac involvement in disseminated diffuse large B-cell lymphoma, successful management with chemotherapy dose reduction guided by cardiac imaging: A case report and review of literature. World J Clin Cases. 2019;7(2):191-202. DOI: 10.12998/wjcc.v7.i2.191
12. Yamada T., Siric F., Reddy V.V.B., Neal Kay G. B-cell lymphoma of the pericardium presenting with ventricular tachycardia with a successful catheter ablation. HeartRhythm Case Rep. 2016;2(5):384-7. DOI: 10.1016/j.hrcr.2016.05.002
13. Salerni S., Barison A., Masci P.G., Aquaro G.D. Rare presentation of asymptomatic pericardial effusion: hemangioma of the atrioventricular groove in cardiac magnetic resonance imaging. Circulation. 2014;130(3):e15-7. DOI: 10.1161/CIRCULATIONAHA.113.007804
14. Abad C., Novoa J., Delgado A., Alons A. Myxoma of the left ventricle. Tex Heart Inst J. 2014;41(4):395-400. DOI: 10.14503/THIJ-13-3281
15. Diao W.J., Shi C., Liu G., Liu X.G., Li H.H., Meng J.J., et al. The diagnosis and treatment of cardiac lymphangioma: A case report and literature review. Medicine (Baltimore). 2019;98(2):e14000. DOI: 10.1097/MD.0000000000014000
16. Wang J.G., Wang B., Hu Y., Liu J.H., Liu B., Liu H., et al. Clinicopatho-logic features and outcomes of primary cardiac tumors: a 16-year-experience with 212 patients at a Chinese medical center. Cardiovasc Pathol. 2018;33:45-54. DOI: 10.1016/j.carpath.2018.01.003
17. Yi J.E., Yoon H.J., O J.H., Youn H.J. Cardiac and pericardial 18F-FDG uptake on oncologic PET/CT: comparison with echocardiographic findings. J Cardiovasc Imaging. 2018;26(2):93-102. DOI: 10.4250/jcvi.2018.26.e10
18. Carras S., Berger F., Chalabreysse L., Callet-Bauchut E., Cordier J.F., Salles G., et al. Primary cardiac lymphoma: diagnosis, treatment and outcome in a modern series. Hematol Oncol. 2017;35(4):510-9. DOI: 10.1002/hon.2301
19. Hishikari K., Kuwahara T., Kimura S., Hikita H., Takahashi A., Isobe M. Reversible atrial fibrillation with bradycardia associated with primary cardiac B-cell lymphoma. Intern Med. 2016;55(6):635-8. DOI: 10.2169/internalmedicine.55.5851
20. Menter T., Ballova V., Caspar C., Wolff T., Kasenda B., Singer G., et al. ALK-negative anaplastic large cell lymphoma arising in the thrombus of an aortic prosthesis preceded by clonally related lymphomatoid papulosis. Virchows Arch. 2019 Jan 26. DOI: 10.1007/s00428-019-02531-x
21. Quintana R.A., Yeh Y.C., Llanos-Chea F. Occult cardiac angiosarcoma presenting as cardiac tamponade. Am J Med Sci. 2017;354(2):216. DOI: 10.1016/j.amjms.2017.01.009
22. Chaturvedi A., Gange C., Sahin H., Chaturvedi A. Incremental value of magnetic resonance imaging in further characterizing hypodense mediastinal and paracardiac lesions identified on computed tomography. J Clin Imaging Sci. 2018;8:10. DOI: 10.4103/jcis.JCIS_63_17
23. Bogaert J., Francone M. Pericardial disease: value of CT and MR imaging. Radiology. 2013;267(2):340-56. DOI: 10.1148/radiol.13121059
24. Wright C.L., Maly J.J., Zhang J., Knopp M.V. Advancing precision nuclear medicine and molecular imaging for lymphoma. PET Clin. 2017;12(1):63-82. DOI: 0.1016/j.cpet.2016.08.005
25. Gallamini A., Borra A. Role of PET in lymphoma. Curr Treat Options Oncol. 2014;15(2):248-61. DOI: 10.1007/s11864-014-0278-4
26. Kim H.J., Lee R., Choi H., Paeng J.C., Cheon G.J., Lee D.S., et al. Application of Quantitative Indexes of FDG PET to Treatment Response Evaluation in Indolent Lymphoma. Nucl Med Mol Imaging. 2018;52(5):342-9. DOI: 10.1007/s13139-018-0543-8
27. Goedel A., Hoellein A., Rischpler C., Gotze K. B-lymphoblastic lymphoma: a heartening diagnosis. Eur Heart J Cardiovasc Imaging. 2015;16(1):116. DOI: 10.1093/ehjci/jeu177
28. Katagiri S., Akahane D., Suguro T., Furuya N., Fujimoto H., Saito T., et al. Cardiac biopsy with intracardiac echocardiographic guidance for successful diagnosis of cardiac lymphoma. Clin Case Rep. 2018;6(9):1681-3. DOI: 10.1002/ccr3.1699
29. Nascimento A.F., Winters G.L., Pincus G.S. Primary cardiac lymphoma: clinical, histologic, immunophenotypic features of 5 cases of a rare disorders. Am. J. Surg. Pathol. 2007;31(9):1344-50. DOI: 10.1097/PAS.0b013e3180317341

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:

