Помощь детям с лимфомой
Лечение крупноклеточной неходжкинской лимфомы у детей. В 1960-е годы прогноз острого лимфобластного лейкоза у детей стал существенно улучшаться. Это связано с применением более интенсивных методов лекарственной терапии и профилактического лечения ЦНС.
Однако детские лимфомы все еще входят в число крайне тяжелых заболеваний: 85% заболевших детей умирает в течение первого года после постановки диагноза и лишь 10-15% достигают 5-летней выживаемости.
Многие современные схемы интенсивной терапии основаны на схеме LSA2L2, предложенной Воллнером в 1971 г. При лечении по этой схеме 5-летняя выживаемость составляет 70-80%, и лишь у нескольких детей по истечении этого срока отмечались рецидивы. Схема лечения включает три этапа.
1. Первичное интенсивное лечение циклофосфамидом, винкристином, доксорубицином, преднизолоном и метотрексатом (интратекально).
2. Укрепляющее лечение антиметаболитами — цитозинарабинозидом, тиогуанином и аспарагиназой.
3. Поддерживающее лечение в течение 1 года с последовательной сменой пар препаратов.
Результаты лечения представлены на рисунке ниже. Большая выживаемость отмечается для больных со стадиями заболевания I и II.
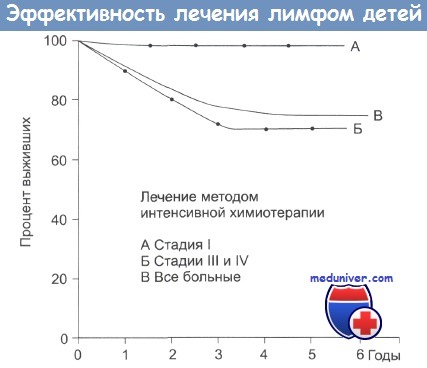
При рандомизированных клинических испытаниях Children's Cancer Study Group в США детей с НХЛ во всех стадиях заболевания лечили по схеме LSA2L2 и с использованием менее интенсивного режима по схеме СОМР (циклофосфамид, винкристин, метотрексат и преднизолон). При этом было показано, что схема СОМР несколько менее эффективна.
Остальные схемы основаны на методике лечения острых лейкозов с применением высоких доз циклофосфамида, разработанной в Германии. Они обладают такой же эффективностью, как и LSA2L2. При локализованной форме болезни двухлетняя безболезненная выживаемость оказывается выше (81%), чем при генерализованной ее форме (46%). Для больных с делокализованной формой лимфобластного заболевания схема LSA2L2 дает лучшие результаты, чем СОМР.
Детская лимфобластная лимфома обычно поражает средостение. Это характерно для многих случаев Т-клеточной лимфомы. Невластные заболевания носят более локализованный характер и поражают брюшную область. В рандомизированных клинических испытаниях на больных с неплохим прогнозом (стадии I и II) было показано, что из схемы лечения можно исключить лучевую терапию, и при лечении препаратами в умеренной дозе в сочетании с назначением метотрексата (интратекально) 4-летняя выживаемость больных составляла 90%.
Снижение доз препаратов и исключение лучевой терапии благоприятно сказываются на последующем состоянии детей. При назначении менее интенсивных режимов лечения без снижения выживаемости можно избежать развития у детей таких последствий, как замедление роста костей, развитие костных раков и лейкозов, а также бесплодия.
Для опухолей, клетки которых экспрессируют антиген CD30, оптимальные режимы лечения пока не разработаны, и обычно детей лечат по схеме СМОР или LSA2L2.
В качестве профилактического лечения ЦНС в некоторых схемах предусмотрено облучение головы. При лечении по схеме LSA2L2 с назначением только метотрексата (интратекально) рецидивы поражения ЦНС составляют около 16%. Количество рецидивов снижается, если наряду с лекарственным лечением проводят облучение головы. Риск поражения ЦНС у больных в стадии I, а также после удаления опухоли в брюшной полости, снижается.
Лечение мелкоклеточной лимфомы нерасщепленных клеток (включая лимфому Беркитта)
Схема лечения для этих лимфом отличается от принятой для лимфобластной лимфомы тем, что используются большие дозы алкилирующих агентов. Лечение не продолжается дольше 10 недель, но является очень интенсивным. При первичном лечении лучевая терапия не используется. Почти у всех детей наблюдается полная ремиссия заболевания, однако у 50% отмечаются рецидивы.
При наступлении рецидива со стороны ЦНС лечение еще возможно, однако сейчас большинство схем терапии предусматривает профилактическое лечение ЦНС.
Дети, которые прожили 2 года, считаются вылечившимися. Двухгодичная безболезненная выживаемость больных на разных стадиях заболевания составляет: для I и II стадий 80%; для III — 65%, и для IV — 40%. У больных в стадии III перед началом лечения желательно удалить большую часть опухоли. Если удалено 90% опухоли, то результат лечения оказывается таким же, как у больных со стадией I заболевания. Для больных в стадии IV разработаны более интенсивные методы лечения.
Проходит испытания метод химиотерапии высокими дозами лекарств, совместно с введением аутологичных стволовых клеток. Также в рецептуру включают новые препараты, например ифосфамид и этопозид.

Что это такое – лимфома? Это онкологическая болезнь лимфоидной ткани. Отличительной чертой этого заболевания считается повышение лимфоидных узлов, разрушение разных внутренних органов, в которых замечается существенное накапливание лимфоцитов с опухолевыми клетками. Белая клетка крови (лимфоцит) – основной элемент иммунной системы организма. В МКБ-10 лимфома числится под кодом С 85.
Причины
Точные причины возникновения лимфом у детей на данный момент полностью не изучены. Появлению болезни предрасполагают патологии в лимфоцитах. Клетки могут поразить не только лимфоузлы, но и другие внутренние органы. Но врачи выделяют некоторые причины лимфомы Ходжкина у детей, прогноз при которой не очень благоприятный:
- заражение гепатитом;
- ВИЧ-инфекция;
- злокачественные изменения В-лимфоцитов;
- аутоиммунные заболевания (красная волчанка, ревматоидный артрит) ;
- радиоактивное излучение не только на ребенка, но и на женщину при беременности;
- использование иммуносупрессивной терапии;
- снижение иммунитета;
- наличие лейкоза у родителей или других родственников;
- поражение инфекционными болезнями и вирусом герпеса;
- влияние канцерогенов;
- химиотерапевтическое лечение, лучевая терапия;
- генетическая и этническая предрасположенность (синдром Клайнфельтера и Дауна) ;
- лимфоидное истощение;
- персистенция некоторых вирусов – Эпштейна-Барра, Луи-Бара, Вискотта-Олдрича, Т-лимфоцитарного.

Если химиотерапевтическое лечение использовалось для устранения других опухолей у детей, отмечается повышение риска развития лимфомы, поскольку препараты такого типа очень токсичны и могут повреждать генетический аппарат как раковых клеток, так и здоровых.
Как проявляется лимфома?
Как отмечают онкологи, до 3-летнего возраста лимфома возникает крайне редко, однако с возрастом риск ее развития увеличивается. Поэтому если в семье имеются или имелись ранее злокачественные онкопатологии, необходимо предельно внимательно следить за здоровьем ребенка, регулярно проходить обследования, которые не дадут упустить момент начала развития заболевания. Чаще всего в детском возрасте развивается лимфома Ходжкина, которая имеет благоприятные прогнозы, нежели лимфома неходжкинского типа. В целом на сегодняшний день влияние причин на возникновение лимфом активно изучается.
Симптомы
Раннее выявление симптомов лимфомы у детей значительно увеличивает шансы на благоприятный прогноз и эффективность проводимой терапии. Как правило, симптомы выявляются при диспансеризации по поводу других заболеваний, но при этом очень важная роль отводится родителям, которые должны внимательно следить за изменением физического состояния и поведения детей.
Основным симптомом лимфомы у детей является увеличение одного или сразу нескольких лимфоузлов. Увеличение размеров чаще всего наблюдается на лимфоузлах, расположенных в области шеи, в ключичной и затылочной частях, в подмышечных впадинах, в паховой области, а также в скрытых лимфоузлах (в области таза, живота, позвоночника). Следует отметить, что увеличение лимфоузлов происходит безболезненно и не доставляет ребенку неприятных ощущений, поэтому задача родителей – не пропустить эти физиологические изменения на теле малыша.
В случае, когда увеличенные лимфоузлы начинают надавливать на органы, расположенные рядом с ними, возникают сопутствующие симптомы:
- одышка или кашель может свидетельствовать об увеличении лимфоузла в области трахеи или легких;
- боль в животе, расстройство пищеварения может быть следствием увеличения скрытых лимфоузлов в области живота;
- при попадании клеток лимфы в печень или селезенку эти органы становятся увеличенными.

Наличие лимфомы у ребенка также сопровождается некоторыми общими симптомами, которые характерны для целого ряда заболеваний. Эти симптомы должны быть обязательно учтены при составлении общего анамнеза. К ним относятся:
- Ребенок быстро устает – на начальной стадии появляется после активных действий, но чем дальше развивается заболевание, тем более пассивным становиться ребенок? и время активности сокращается.
- Повышенная сонливость, апатия.
- Ребенок сильно потеет ночью, в комплексе со снижением веса и повышенной температурой.
- Выраженный кожный зуд без видимых причин.
Нельзя точно сказать, как долго развивается лимфома у детей. У одних симптоматика проявляется через три недели, у других – через четыре месяца.
В наше время существует немало разновидностей лимфом, но не так давно их делили на болезнь Ходжкина и неходжкинскую лимфому, однако такое противопоставление данного заболевания не полностью отображает суть лимфомы и не позволяет определить наиболее эффективную тактику терапии и ее прогноз.
Неходжкинские лимфомы разделяли на новообразования, которые имеют высокую и низкую степень злокачественности. В каждой группе было выделено несколько типов лимфом, учитывая морфологические характеристики клеток опухолей. Эту классификацию приняли, но на данный момент эта система устарела, так как неходжкинская лимфома имеет около 16 подтипов.
Лимфома Ходжкина
Что это такое – лимфома Ходжкина? По сути, данная разновидность лимфомы не является лимфомой как таковой, поскольку новообразование состоит из моноцитарных и макрофагальных клеток, а не из лимфоцитов. Так, болезнь рассматривается отдельно от неходжкинских лимфом, но это все же является злокачественным образованием, возникающем в ткани лимфоузлов.
Неходжкинская лимфома
Это обширное понятие, поэтому для подтверждения диагноза необходимо уточнить причину ее образования, а также уровень злокачественности. Лимфоидная ткань имеет лимфоциты двух групп: В-лимфоциты и Т-лимфоциты. Последние нужны для иммунитета клеток, которые способствуют инактивации чужеродных частиц. Для образования специфических белков, которые связываются с грибком, вирусом и бактериями, обезвреживают их, есть В-лимфоциты. Эти клетки группируются в фолликулах, в которых периферия преимущественно Т-клеточная, а центр – В-лимфоцитарный. Если условия будут соответствующие, может происходить неадекватное распространение клеток конкретной зоны, что определяет вид новообразования.
Зрелоклеточные лимфомы
Это сравнительно доброкачественные лимфомы, которые возникают из вызревших лимфоцитов, отличаясь практически бессимптомным протеканием. Единственным и наиболее верным симптомом лимфомы называют чрезмерное увеличение лимфоузлов. Некоторая часть зрелоклеточных лимфом на протяжении определенного времени переходит в лимфосаркому.
Лимфома Беркитта
Данная разновидность лимфомы обладает высоким уровнем злокачественности, она распространяется в кровь, внутренние органы и костный мозг, за границы лимфатической системы. Болезнь начинается постепенно и внезапно, на что влияет локализация опухоли.
Крупноклеточная диффузная лимформа
Данная разновидность лимфомы отличается высокой агрессивностью. Первичный очаг в большинстве случаев располагается экстрадонтально или в лимфоузлах. Отдельно стоит отметить первичную В-крупноклеточную лимфому средостения, которая возникает в тимусе, постепенно прорастая в средостение.

Диагностика
При проведении процедур диагностики лимфомы у детей первоначально внимательно проводится врачебный наружный осмотр обратившегося пациента. После этого для подтверждения диагноза ребенок должен сдать следующие необходимые анализы:
- кровь;
- сделать УЗИ или рентген.
Помимо этого, чтобы подтвердить наличие лимфомы, в обязательном порядке нужно провести несколько взаимосвязанных важных исследований, благодаря которым появится возможность с точностью определить, какой вариант заболевания присутствует и на какой стадии он сейчас находится. Врачи, проводя анализ тканей пациента, используют биопсический метод. Чтобы провести его именно по такому методу, берется больной лифоузел и внимательно изучается специалистом под микроскопом.
Для определения стадии имеющейся болезни, помимо тех способов, которые были перечислены выше, можно использовать магнитно-резонансную томографию, двухфотонную эмиссионную томографию, провести компьютерную томографию или же сделать сцитинграфию скелета. Чтобы получить как можно больше информации об опухоли на костном мозге и определить, какое имеется количество пораженных клеток, на самых критических стадиях болезни, переходят к трепанобиопсии.

До начала проведения необходимой лечебной терапии нудно обследовать сердце ребенка, сделав ему кардиограмму или заменить ее на ультразвуковое исследование сердца, а также для большей эффективности можно провести и обе процедуры одновременно. Помимо этого, возможно потребуется провести диагностику на наличие отклонений организма в обмене веществ.
Все перечисленные методы диагностики могут применяться не в каждом из случаев. Какое именно исследование или комплекс исследований назначить больному, определить может только лечащий врач.
Лечение
Если у ребенка имеется врачебно подтвержденная лимфома, его нужно срочно положить в онкологическое отделение больницы, а также может подойти и гематологическое отделение.
В наибольшем количестве случаев для лечения используется химическая терапия. В этом случае малыша лечат при помощи цитостатика, ориентированного на приостановку разделения клеток или же их полного устранения (клеток, где обнаружена опухоль). Использование лишь одного способа будет недостаточно для ликвидации всех пораженных клеток, вследствие этого доктора разработали комбинацию цитостатиков, по-другому еще их называют полихимической терапией. Данный способ считается самым лучшим ввиду своей максимальной эффективности.
После проведения процедур химической терапии в некоторых случаях используется также облучение – лучевая терапия. Если химическая и радиальная терапия не дают желаемых результатов или болезнь повторилась, переходят на химиотерапию с высокими дозами. Нехорошим фактором в таком виде терапии считается ее плохое воздействие на кровь костного мозга. Вследствие этого важно делать пересадку стволовых клеток – нередко прибегают к аутологичной пересадке костного мозга.
Исцеление заболевания Ходжкина с доминированием лимфоцитов
На первоначальных стадиях заболевания убирают один зараженный лимфоузел (если отсутствуют другие пораженные), в случае, если после этого не возникнут какие-либо осложнения. Где-то больше половины больных в этих случаях вылечиваются, не прибегая к радиальной и химической терапии. Им нужно обязательно проходить систематический осмотр для постоянного слежения за их состоянием. Называют этот процесс стратегией выжидательного исследования. При возникновении признаков лимфомы проведение такой стратегии заканчивается.

Направление химиотерапии
При традиционной болезни Ходжкина делается несколько химиотерапевтических блоков. Численность циклов, их длительность и напряженность первоначально опираются на то, какая у ребенка стадия заболевания, и зависят от того, какую терапевтическую группу применяют для лечения больного. Любой блок терапии длится не более двух месяцев. В любой из курсов лечения включаются следующие вещества:
В промежутках между терапией необходимо делать двухнедельный интервал. В среднем курс лечения лимфомы длится не менее двух и не более шести месяцев, в случаях, если не были обнаружены повторы заболевания.
Лучевая терапия
В настоящее время проктологи рекомендуют для половины пациентов делать лучевую терапию болезни следом за химической. После наблюдений за тем, как организм пациента откликается на проведение химиотерапии, ставится вопрос о возможности проведения лучевой терапии.

В случае, если были проведены два блока химической терапии ПЭТ, появились улучшения, то необходимость в проведении данной терапии отпадает (это относится к любой форме заболевания). Положительная реакция на такой способ лечения означает сокращение лимфомы на половину, и, исходя из этого, в ее остатках отсутствуют активные клетки опухоли.
Чаще всего терапию с использованием лучей применяют по истечении двух недель после завершения химической терапии. В среднем выдается доза облучения, равная двадцати греям. При сокращении объема лимфомы впоследствии проведения первых двух блоков химической терапии приблизительно на 75 % лучевая доза возрастает до тридцати греев.
Дабы не разрушить здоровые клетки, находящиеся рядом с опухолью, необходимый объем выдается не за один раз, а за несколько процедур. Лечить пораженный участок нужно маленькими порциями. Продолжительность радиальной терапии в среднем длится две или три недели. Выходные дни даются организму для отдыха и восстановления от процедуры.
Прокалывания при болезни Ходжкина
Лечение лимфомы у детей в государственных клиниках Москвы возможно, но не принесет такого результата, как за границей. В Германии для детей, пораженных лимфомой, для лечения используют исключительно программы, носящие название исследования оптимизации терапии. Представляют собой они общепринятые больничные изучения, ставящие перед собой задачу лечения пациентов по прогрессивным программам и в то же время увеличения эффекта, получаемого от терапии.

Шансы на выздоровление
Благодаря современным и точным способам диагностики и стандартным проколам активной терапии, шансы на выздоровление и полного излечения опухоли очень высоки. Перед тем как переходить к лечению, всех пациентов разделяют по различным терапевтическим группам, для каждой из них предусматриваются свои методы лечения. Согласно проводимым исследованиям, болезнь нередко дает повтор, но и в последующих случаях ее получается благополучно вылечить.
Неходжкинские лимфомы (НХЛ) составляют 7-8% всех злокачественных опухолей у детей и наиболее часто диагностируются в возрасте 5-9 лет.
У детей до 1 года это заболевание встречается исключительно редко. НХЛ у детей существенно отличаются от лимфом взрослых.
Для неходжкинских лимфом детского возраста характерна высокая пролиферативная активность незрелых опухолевых клеток со склонностью к диффузному росту, ранней диссеминации, поражению костного мозга и центральной нервной системы (ЦНС).
Поэтому около 80% больных поступают в стационар с распространенным процессом. В результате интенсивных исследований за последние годы достигнуты существенные успехи в лечении НХЛ у детей.
Длительная безрецидивная выживаемость детей при использовании современных программ лечения варьирует от 70 до 90% в зависимости от стадии и клеточного типа опухоли.
Высокая митотическая активность клеток определяет высокую чувствительность неходжкинских лимфом к химиотерапии (XT), которая используется при всех случаях НХЛ.
Применяемые противоопухолевые препараты, их дозы и длительность лечения зависят от иммунного типа неходжкинских лимфом, стадии заболевания и характеристики прогноза, т. е. групп риска. Ограничено применение лучевой терапии в виде облучения ЦНС только случаями Т-клеточной НХЛ. Облучение нодальных поражений ни с профилактической целью, ни при наличии остаточной опухоли не проводится. При всех случаях детских неходжкинских лимфом обязательна профилактика нейролейкоза. Использование интенсивных программ лечения требует проведения сопроводительной терапии.
Одна из наиболее эффективных программ лечения данного заболевания — разработанный германо-австрийской группой онкопедиатров протокол для НХЛ (BFM-NHL) с учетом клеточной принадлежности опухоли (Т-, В- и крупноклеточные анапластиче-ские лимфомы), которая уточняется иммунофенотипированием.
Основная часть Т-клеточных (не-В-клеточных) лимфом локализуется в средостении, а В-клеточных — в брюшной полости и носоглотке.
При определении стадии заболевания чаще всего используют классификацию Анн-Арбор в модификации Мэрфи для неходжкинских лимфом у детей (1980).
Программа лечения лимфобластных (из предшественников Т- и В-клеток) и Т-клеточных лимфом идентична программе лечения острого лимфобластного лейкоза (ОЛЛ):
■ длительный непрерывный (в течение 2 лет) курс лечения;
■ использование в программе антрациклинов и L-аспарагиназы;
■ для профилактики ЦНС применяют эндолюмбальную химиотерапию и облучение головного мозга;
■ поддерживающая терапия проводится в течение 1,5 года;
■ различия в программе лечения зависят только от стадии заболевания и скорости достижения эффекта.
Программы лечения В-клеточных лимфом (лимфома/лейкоз Беркитта, диффузная В-крупноклеточная лимфома) отличаются следующим:
■ использование коротких курсов интенсифицированной XT, проводимых в жестко установленные сроки;
■ общая продолжительность лечения менее 0,5 года;
■ использование в программе метотрексата в высоких дозах (1-5 г/м2 на 1 введение) и фракционно циклофосфамида;
■ профилактика и лечение поражения ЦНС осуществляются эндолюмбальным введением химиопрепаратов (трех) без облучения головного мозга;
■ поддерживающая терапия не проводится;
■ тактика химиотерапии в отношении доз и длительности терапии зависит не только от стадии, но и от массы опухоли, определяемой полным удалением (резектабельностью) во время хирургического вмешательства, активностью сывороточной лактатдегидрогеназы (ЛДГ), исходным поражением ЦНС.
Для программ лечения крупноклеточных анапластических лимфом характерно:
■ использование для индукции ремиссии коротких курсов интенсифицированной XT, проводимой в жестко установленные сроки, как при В-клеточной лимфоме;
■ интенсивность и продолжительность химиотерапии зависят от стадии и резектабельности опухоли;
■ с учетом иммунофенотипических различий внутри группы крупноклеточных анапластических лимфом необходим дифференцированный подход к проведению поддерживающего лечения.
Степени риска при НХЛ у детей Лимфобластная и Т-клеточная лимфомы:
I (стандартная) группа риска — стадия.
II (средняя) группа риска — III-IV стадия.
III группа риска — остаточная опухоль более 30% от исходной массы, и/или более 5 % бластов в костном мозге, и/или сохранение бластов в спинномозговой жидкости на 33-й день лечения, или прогрессия опухоли.
В-клеточная лимфома:
I группа риска — I-II стадия; первичная опухоль макроскопически полностью удалена.
II группа риска — I-II стадия, первичная опухоль макроскопически не полностью удалена; III стадия, при показателях ЛДГ, не превышающих 500 ЕД/л.
III группа риска — III-IV стадия; показатели лактатдегидрогеназы, не превышающие 1000 ЕД/л, отсутствует поражение ЦНС.
IV группа риска — III-IV стадия; показатели лактатдегидрогеназы, превышающие 1000 ЕД/л, и/или имеется поражение ЦНС.
Опухолевые заболевания кроветворной и лимфоидной ткани у детей
Крупноклеточная анапластическая лимфома:
I группа риска — I-II стадия; первичная опухоль макроскопически полностью удалена
II группа риска — I-II стадия, первичная опухоль макроскопически не полностью удалена; III стадия.
III группа риска — IV стадия (поражение костного мозга и/или ЦНС); вне зависимости от стадии множественное поражение костей, и/или поражение кожи, и/или поражение легких, и/или крупноклеточная анапластическая лимфома (вторая опухоль), и/или лимфогистиоцитарная лимфома.
Лечение лимфобластной и Т-клеточной лимфом
Преднизолон — 60 мг/м2 внутрь в 1-28-й день с постепенной отменой с 29-го по 36-и день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 8, 15, 22 и 29-й дни.
Рубомицин — 30 мг/м2 в/в капельно 1-часовая инфузия в 8, 15, 22 и 29-й дни.
L-аспарагиназа — 5000 ЕД/м2 в/в капельно 1-часовая инфузия в 12, 15, 18, 21, 24, 27. 30 и 33-й дни.
Циклофосфамид — 1000 мг/м2 в/в капельно 1-часовая инфузия на фоне введения месны в 36-й и 64-й дни.
Цитозин-арабинозид — 75 мг/м2 в/в струйно в 38-41,45-48, 52-55 и 59-62-й дни.
6-меркаптопурин — 60 мг/м2 внутрь в 36-63-й день.
Метотрексат — 6-12 мг (в зависимости от возраста) эндолюмбально в 1, 12, 33, 45 и 59-й дни.
6-меркаптопурин — 25 мг/м2 внутрь в 1-56-й день.
Метотрексат — 5000 мг/м2 (для Т-клеточных лимфом) или 2000 мг/м2 (для лимфом из предшественников В-клеток) в/в капельно 24-часовая инфузия в 8, 22, 36 и 50-й дни (при невозможности применения указанной дозы используется 1000 мг/м2).
Фолинат кальция — 30 мг/м2 в/в в течение 42 ч, 15 мг/м2 в течение 48 и 52 ч от начала инфузий метотрексата (коррекция доз и кратности введения в зависимости от концентрации метотрексата в сыворотке крови).
Метотрексат — 6-12 мг эндолюмбально в 8, 22, 36 и 50-й дни.
Примечание: лечение при протоколе М начинается через 2 нед. после окончания лечения по протоколу I
Протокол I (см. выше)
Протокол М (см. выше)
Протокол II
Дексаметазон — 10 мг/м2 внутрь в 1-21-й день с дальнейшей постепенной отменой.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 8, 15, 22 и 29-й дни.
Доксорубицин — 30 мг/м2 в/в капельно 1-часовая инфузия в 8, 15, 22 и 29-й дни.
L-аспарагиназа — 10 000 ЕД/м2 в/в капельно 1-часовая инфузия в 8, 11, 15 и 18-й дни.
Циклофосфан — 1000 мг/м2 в/в капельно 1-часовая инфузия в 36-й день.
Цитозар — 75 мг/м2 в/в струйно в 38-41 -й и 45-48-й дни.
6-меркаптопурин — 60 мг/м2/сут внутрь в 36-49-й день.
Метотрексат — 6-12 мгэндолюмбально в 38-й и 45-й дни.
Лучевая терапия на головной мозг в суммарной очаговой дозе (СОД) 12 Гр с 43-го дня цикла.
Примечание: протокол М начинается через 2 нед после окончания протокола I, протокол II начинается через 2 нед после окончания протокола М.
Лечение по программе протокола ОЛЛ у детей из группы высокого риска, используя блоки интенсивной XT.
Поддерживающее лечение одинаково для всех групп риска:
6-меркаптопурин — 50 мг/м2 внутрь ежедневно до 104-й недели (24 мес).
Метотрексат — 20 мг/м2 в/м 1 раз в неделю до 104-й недели (24 мес).
Примечание: дозы химиопрепаратов корректируются в зависимости от количества лейкоцитов (см. лечение ОЛЛ)
Циторедуктивная фаза
Дексаметазон — 5-10 мг/м2 внутрь в 1-5-й день.
Циклофосфан — 200 мг/м2 в/в капельно 1-часовая инфузия в 1-2-й день.
Метотрексат 6-12 мг (в зависимости от возраста) + цитозар 16-30 мг + преднизолон 4-10 мгэндолюмбально в 1-й день.
Дексаметазон — 10 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Метотрексат — 1000 мг/м2 в/в капельно 24-часовая инфузия (назначение фолината
кальция — см. протокол М).
Ифосфамид — 800 мг/м2 в/в капельно 1-часовая инфузия в 1-5-й день (на фоне введения месны).
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 4-й и 5-й дни.
Цитозар — 150 мг/м2 в/в капельно 1-часовая инфузия, 4 введения с интервалом 12 ч в 4-й и 5-й дни.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально во 2-й день.
Дексаметазон — 10 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Метотрексат — 1000 мг/м2 в/в капельно 24-часовая инфузия в 1-й день (назначение
фолината кальция — см. протокол М).
Циклофосфан — 200 мг/м2 в/в струйно на фоне месны в 1-5-й день.
Доксорубицин — 25 мг/м2 в/в капельно 1-часовая инфузия в 4-й и 5-й дни.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально во 2-й день.
Примечание: программа лечения состоит из двух блоков (А + В), проводимых с интервалом 2 нед.
Проводится с использованием циторедуктивной фазы и 4 чередующихся блоков А и В, проводимых с интервалом 2 нед.
Программа лечения детей в III и IV группах риска
Дексаметазон — 10 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Метотрексат — 5000 мг/м2 в/в капельно (см. выше) в 1-й день.
Ифосфамид — 800 мг/м2 в/в капельно 1-часовая инфузия в 1-5-й день (на фоне введения месны).
Этопозид — 100 мг/м2 в/в капельно 1-часовая инфузия в 4-й и 5-й дни.
Цитозар — 150 мг/м2 в/в капельно 1-часовая инфузия, 4 введения с интервалом 1-2-й 4-й и 5-й дни.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально во 2-й день.
Дексаметазон — 10 мг/м2 внутрь в 1-5-й день.
Винкристин — 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Метотрексат — 5000 мг/м2 в/в капельно (см. выше) в 1-й день.
Доксорубицин — 25 мг/м2 в/в капельно 1-часовая инфузия в 4-й и 5-й дни.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально во 2-й день.
Дексаметазон — 20 мг/м2 внутрь в 1-5-й день.
Виндезин — 3 мг/м2 (максимально 6 мг), при отсутствии — винкристин 1,5 мг/м2 (максимально 2 мг) в/в струйно в 1-й день.
Цитозар — 3000 мг/м2 в/в капельно 3-часовая инфузия, 4 введения с интервалом 12 ч в 1-й и 2-й дни.
Этопозид — 100 мг/м2 в/в капельно 2-часовая инфузия, 5 введений с интервалом 12 ч в 3-5-й день.
Метотрексат + цитозар + преднизолон (см. выше) эндолюмбально в 5-й день.
Примечание: лечение проводится чередованием блоков АА, ВВ и СС с интервалом 2 нед , 5 блоков в III группе риска и 6 блоков в IV группе риска
Программа лечения детей с поражением ЦНС состоит из 6 чередующихся блоков AAz, BBz и CCz, отличающихся эндолюмбальным введением метотрексата и преднизолона (первое введение через 24 ч от начала в/в инфузий высоких доз метотрексата ежедневно во 2-5-й день в 1/4 разовых доз от вводимых в блоках АА и ВВ).
Через 24 ч от окончания эндолюмбального введения метотрексата и преднизолона в 6-й день эндолюмбально вводится цитозар в дозе 16-30 мг (в зависимости от возраста). При проведении блока CCz первое эндолюмбальное введение метотрексата и преднизолона осуществляется через 24 ч от последней инфузий высоких доз цитозара ежедневно в 3-6-й день в 1/4 разовых доз от вводимых в блоке СС. На 7-й день через 24 ч от эндолюмбального введения метотрексата и преднизолона вводится эндолюмбально цитозар в дозе 16-30 мг (в зависимости от возраста).
Ритуксимаб вводится в дозе 375 мг/м2 в/в капельно с использованием инфузоматаза 24 ч до начала каждого блока химиотерапии у детей с лимфомой Беркитта и диффузной В-крупноклеточной лимфомой в III и IV группах прогностического риска.
Лечение крупноклеточных анапластических лимфом
У детей I группы риска проводится циторедуктивная фаза и 3 чередующихся блока XT (а и б).
Во II группе риска проводится циторедуктивная фаза и 6 чередующихся блоков химиотерапии (а и б). Блоки а и б отличаются от блоков А и В дозой метотрексата — 500 вместо 1000 мг/м2.
В III группе риска после циторедуктивной фазы используют 6 чередующихся блоков АА, ВВ и СС.
При Т-клеточной крупноклеточной анапластической лимфоме (CD3+) используют блоки высокого риска (HR) программы ОЛЛ или Т-НХЛ, после окончания основного курса лечения проводится поддерживающая XT винбластином 6 мг/м2 в/в струйно каждые 3 нед. до 12 мес. от начала всей программы терапии.
Разработан комплекс мер, позволяющих уменьшить частоту и тяжесть побочных реакций и осложнений во время проведения лечения неходжкинских лимфом у детей.
В начале лечения главную опасность представляет синдром лизиса опухоли (СЛО) и развитие мочекислой нефропатии с острой почечной недостаточностью.
Главное условие предупреждения развития токсических реакций, вызванных СЛО, — массивная инфузионная терапия в дозе 3000 мл/м2 в сутки (125 мг/м2/ч), включая 1500 мл/м2/сут 5% глюкозы, 1320 мл/м2/сут 0,9% натрия хлорида, 180 мл/м2/сут 4% натрия гидрокарбоната. Диурез стимулируется введением лазикса. В профилактике мочекислой нефропатии важную роль играет назначение аллопуринола в дозе 300 мг/м2 в 3 приема в сутки (10 мг/кг) в первые 3-8 дней лечения.
В тяжелых случаях показаны гемодиализ и гемофильтрация.
Тромбоконцентрат переливается при угрозе повышенной кровоточивости или инфекционном осложнении при количестве тромбоцитов менее 25х10 9 /л. Эритроцитная масса переливается для поддержания гематокрита на уровне 30%, исключая случаи с инициальным гиперлейкоцитозом, когда трансфузия эритроцитной массы может резко повысить риск церебрального лейкостаза.
Инфекционные осложнения возможны на любом этапе лечения, однако наиболее опасны при развитии агранулоцитоза в периферической крови (с количеством гранулоцитов менее 500/мкл).
При развитии агранулоцитоза в периферической крови требуется изоляция ребенка и проведение соответствующей терапии с использованием колониестимулирующих факторов и антибактериальных препаратов.
Читайте также:

